INTRODUCCIÓN
Las técnicas de depuración extracorpórea, elemento distintivo de nuestra especialidad, permiten al nefrólogo participar en el tratamiento de múltiples patologías no estrictamente nefrológicas. Este es el caso de los pacientes con hepatopatía crónica. El nefrólogo interviene en varias situaciones que complican al paciente cirrótico en sus diversos estadios evolutivos como son el fracaso renal agudo (FRA) y la insuficiencia renal crónica (IRC) del enfermo hepatópata, con o sin trasplante hepático y cuyo manejo debemos conocer.
La aplicación de las técnicas de diálisis en esta población presenta ciertas particularidades que trataremos de exponer en el presente trabajo.
FRACASO RENAL AGUDO EN PACIENTES CON HEPATOPATÍA CRÓNICA
La presencia de FRA en un paciente cirrótico dificulta enormemente su manejo y ensombrece su pronóstico1,2. Se estima que hasta un 20 % de los pacientes hospitalizados por cirrosis descompensada se complican con FRA3 y un 10-30 % lo presentan al ingreso1. Aunque un paciente cirrótico puede presentar FRA de cualquier origen, las causas más frecuentes son: FRA prerrenal, necrosis tubular aguda (NTA) (isquémica o tóxica) y síndrome hepatorrenal (SHR; tipo 1 y tipo 2) como consecuencia de las alteraciones hemodinámicas presentes en la cirrosis avanzada (vasodilatación grave esplácnica y periférica, bajo gasto cardíaco y vasoconstricción renal). En estudios epidemiológicos se describe que la distribución del FRA en el paciente cirrótico es la siguiente: el FRA prerrenal el 40 %, la NTA un 40 % y el SHR un 20 % aproximadamente. El adecuado diagnóstico diferencial entre estas tres entidades es muy relevante, dado su diferente pronóstico4,5, manejo y tratamiento.
La primera dificultad que encontramos es la definición del FRA en la cirrosis. La creatinina, el marcador de función renal más utilizado, es un derivado de la creatina. Esta proteína es sintetizada en el hígado, almacenada en el músculo y eliminada por el riñón mediante filtración glomerular y secreción tubular. En el paciente hepatópata grave la síntesis hepática de la creatina disminuye a la mitad6. Por otro lado, los niveles elevados de bilirrubina interfieren en la determinación de creatinina mediante la reacción de Jaffe, resultando en niveles anormalmente bajos. Además, las cifras de urea pueden estar elevadas en ausencia de disminución del filtrado glomerular (por ejemplo, por hemorragia digestiva). En consecuencia, las fórmulas habituales para medir el filtrado glomerular, basadas en la creatinina, sobrestiman la función renal del paciente cirrótico. Por ello se han establecido criterios diagnósticos específicos para el FRA en esta población. Así pues, el FRA en el paciente cirrótico se define como incremento de al menos 0,3 mg/dl o de un 50 % sobre los niveles de creatinina basal o un descenso de la diuresis por debajo de 0,5 ml/kg/h durante más de 6 horas7. Se ha propuesto la medida de cistatina C sérica, frente a la creatinina sérica, como mejor marcador de la función renal en pacientes cirróticos8 y como factor predictivo independiente del desarrollo de SHR.
El SHR es una forma específica y grave de FRA en el cirrótico cuyos criterios diagnósticos fueron definidos por el Club de la Ascitis en 1993 y actualizados en 20079,10, y se recogen en la tabla 1. Se trata de un FRA funcional por intensa vasoconstricción, por tanto potencialmente reversible, que complica la evolución del paciente cirrótico descompensado con ascitis o con fallo hepático agudo. El diagnóstico diferencial se plantea principalmente con el FRA prerrenal. En el SHR, al contrario de lo que ocurre en el FRA prerrenal, la función renal no mejora tras la expansión de volumen.
La NTA es la causa más frecuente de FRA parenquimatoso en el paciente cirrótico, a menudo precipitada por hipotensión sostenida, contrastes iodados y fármacos nefrotóxicos. La diferenciación entre SHR y NTA es muy difícil, sobre todo la NTA isquémica si el paciente ha recibido tratamiento diurético, el cual modifica los índices urinarios. Se ha propuesto que la presencia de células epiteliales en el sedimento sugiere NTA, pero este es un dato inconsistente. El diagnóstico del SHR es, por tanto, un diagnóstico de exclusión de otras causas de FRA y requiere una minuciosa historia clínica.
El pronóstico del SHR es muy pobre y se estima una mortalidad cercana al 100 % en pocos días o semanas, especialmente en el SHR tipo 1, si no se reemplaza el hígado enfermo por uno sano mediante trasplante.
El tratamiento del SHR consiste sucesivamente en: tratamiento farmacológico (vasoconstrictores esplácnicos como la terlipresina junto a expansores plasmáticos: albúmina), implantación de derivaciones portosistémicas intrahepáticas a través de la vena yugular (TIPS: transjugular intrahepatic portosystemic shunt) y depuración con diálisis. La diálisis se indicará en el SHR cuando los anteriores tratamientos fracasen y no exista contraindicación para el trasplante hepático en los pacientes con hepatopatía crónica.
Las indicaciones para iniciar diálisis en un paciente cirrótico con FRA suelen ser las mismas que para el resto de los enfermos renales. Las causas más frecuentes son: sobrecarga de volumen, acidosis e hiperpotasemia refractaria al tratamiento médico. En el caso de la NTA, realizaremos diálisis, como es natural, hasta que se recupere la función renal. En el SHR la diálisis suele ser un tratamiento de mantenimiento hasta que se realice el trasplante hepático, en pacientes con indicación para ello. Aunque se han descrito casos de enfermos mantenidos con vida mediante diálisis durante más de 30 días hasta que fueron trasplantados11, el tratamiento con diálisis no parece afectar favorablemente al pronóstico del fallo hepático, solo es un tratamiento de soporte. Por último, la necesidad de diálisis pretrasplante condiciona negativamente la supervivencia del paciente con trasplante hepático12,13.
En el manejo del paciente cirrótico con FRA se han usado todas las técnicas de diálisis clásicas, como la diálisis peritoneal (en desuso), la hemodiálisis (HD) y la hemodiafiltración venovenosa continua, entre otras. No hay en la actualidad ningún estudio que demuestre la superioridad de una modalidad dialítica sobre otra en estos pacientes. En general, la HD convencional se prescribe a los pacientes que no están ingresados en una unidad de vigilancia intensiva (UVI), reservándose la hemodiafiltración para aquellos pacientes en UVI intubados y conectados a respiración artificial14.
La HD en estos pacientes presenta numerosas complicaciones, como son el agravamiento de la hipotensión, las complicaciones hemorrágicas (aunque suelen permitir diálisis sin o con mínima dosis de heparina) y las infecciones asociadas a catéteres. Por otro lado, la eficacia detoxificadora de las sustancias acumuladas en el fallo hepático mediante HD es deficiente, ya que la mayoría de estas sustancias están muy ligadas a proteínas, como la bilirrubina, ácidos biliares, fenoles, índoles, ácidos grasos de cadena corta y media, aminoácidos aromáticos, mercaptanos, etc. En este sentido, en los últimos años se han desarrollado varias modalidades de diálisis con albúmina para eliminar los metabolitos hepáticos que se creen responsables de la clínica de la insuficiencia hepática y van ligados a proteínas, así como los productos nitrogenados del SHR asociado. La diálisis con albúmina de un solo paso ha dejado de usarse, a pesar de su eficacia, por su elevado coste. Los sistemas de hemodiadsorción (combinan la HD convencional con la diálisis con albúmina, la cual se regenera mediante adsorción con columnas de carbón y resinas de intercambio iónico). Estas nuevas modalidades de tratamiento extracorpóreo se denominan MARS© (Molecular Adsorbent Recirculating System) y Prometheus©15,16.
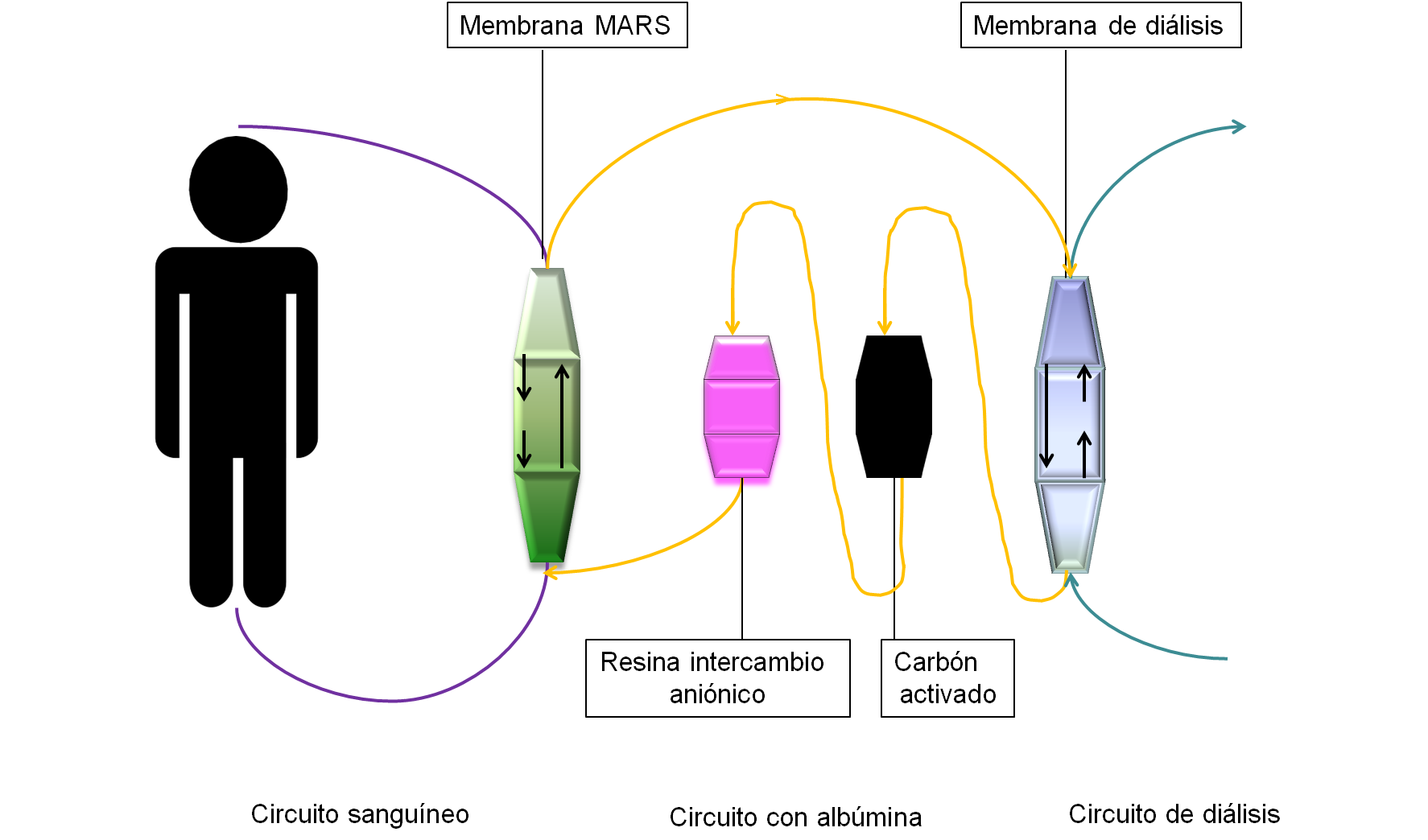
El MARS© consta de tres circuitos: a) sanguíneo con dializador MARS© de alta permeabilidad y tamaño de poro grande; b) albúmina exógena al 20 % y c) sistema de hemodiafiltración. En el circuito sanguíneo la sangre del paciente, cargada de sustancias hepatotóxicas, entra en contacto con la albúmina. Se producirá en esta primera fase el intercambio fundamentalmente de tóxicos ligados a proteínas junto al resto de las moléculas hidrosolubles. En el segundo circuito la albúmina cargada de productos tóxicos pasa por un circuito de diálisis (hemodiafiltración o HD convencional, esta en desuso). Estas membranas son de alta permeabilidad. En este paso se realiza el intercambio de sustancias de pequeño y mediano tamaño al enfrentarse al líquido de diálisis que circula a contracorriente. En el tercer circuito, la albúmina unida a sustancias tóxicas es regenerada a través de dos cartuchos (uno de carbón activado y otro de intercambio aniónico). La albúmina regenerada está disponible para volver a utilizarla (figura 1).
El MARS© es, pues, un tratamiento de soporte temporal que consigue mejorar las manifestaciones clínicas de la encefalopatía hepática y, en ocasiones, la recuperación de la función hepática y renal en pacientes con fallo hepático agudo fulminante o agudo sobre hepatopatía crónica en los pacientes con hepatopatía crónica avanzada candidatos a trasplante hepático.
El MARS© es una técnica segura con pocos efectos adversos y mejor tolerada que la HD convencional17. El principal inconveniente del MARS© es su alto coste, debido, entre otras causas, a las elevadas dosis de albúmina que consume. En los últimos años se han hecho numerosos estudios de coste-efectividad de esta técnica, cuyo resultado es que se trata de una técnica económicamente asumible en términos de supervivencia del paciente a la espera del trasplante hepático18,19.
A pesar de las ventajas mencionadas, no existe suficiente evidencia científica acerca de la superioridad del MARS©, en lo que respecta a la supervivencia del paciente, sobre el tratamiento convencional, como muestra un reciente metaanálisis al respecto20 y un amplio estudio multicéntrico realizado en Europa en el que hemos participado21.
El sistema Prometheus consta de dos circuitos: a) circuito extracorpóreo y b) circuito de plasma. Básicamente se trata de un módulo donde se realiza la filtración de la albúmina del paciente mediante una membrana de poro muy grande, seguida de dos columnas de adsorción, de intercambio iónico y resina neutra, respectivamente, que captarán las toxinas hepáticas. Posteriormente el plasma y la albúmina detoxificada vuelven al paciente tras pasar por una membrana de diálisis. Este sistema no requiere la administración de albúmina exógena y es bien tolerado. En la actualidad no está demostrada la superioridad del Prometheus sobre el MARS© ni a la inversa.
INSUFICIENCIA RENAL CRÓNICA EN PACIENTES CON HEPATOPATÍA CRÓNICA
La asociación entre la hepatopatía crónica y la glomerulonefritis, en concreto la nefropatía IgA y la membranoproliferativa asociada al virus C, es bien conocida. Aunque, de forma excepcional, la poliquistosis hepatorrenal puede conducir a fallo hepático y renal. Finalmente, los pacientes hepatópatas no están exentos de padecer enfermedades tan prevalentes como la diabetes o la uropatía obstructiva. Todas las anteriores son entidades que conducen a la IRC avanzada con requerimiento de diálisis.
A la hora de elegir la modalidad de diálisis en el paciente cirrótico con IRC debemos tener en cuenta varios aspectos. En general los pacientes hepatópatas, sobre todo en estado avanzado, presentan más hipotensión durante la sesión de HD, lo que podría precipitar episodios de encefalopatía hepática. Las alteraciones de la coagulación inherentes a la disfunción hepática obligan a ser muy meticulosos en la dosis y el tipo de anticoagulación que se prescriba en la HD. La diálisis peritoneal ofrece en este sentido ventajas sobre la HD, ya que no produce intolerancia hemodinámica ni necesita anticoagulación, tiene el valor añadido de ofrecer aporte de glucosa a un paciente desnutrido y la evacuación permanente de la ascitis. Además, la diálisis peritoneal, por su carácter domiciliario, evitaría la transmisión nosocomial de virus hepatotropos en las unidades de HD22,23. Por el contrario, la diálisis peritoneal tendría como inconveniente la dificultad de la realización en paciente con pérdida de la destreza manual (encefalopatía, hiponatremia, flapping, etc.), la mayor probabilidad teórica de peritonitis bacteriana y el empeoramiento del estado nutricional por las elevadas pérdidas proteicas en el dializado. Sin embargo, no hay estudios que demuestren la superioridad de una técnica dialítica sobre otra en estos pacientes24.
Si finalmente incluimos al paciente en HD crónica, evitaremos la colocación de catéter permanente por la elevada tasa de infecciones que conlleva.
El acceso peritoneal merece especial atención. En los pacientes con ascitis, la implantación del catéter servirá además para realizar una paracentesis inicial que acompañaremos de albúmina intravenosa para evitar la hipovolemia efectiva. En general, esperaremos, como en los no hepatópatas, un mes hasta usar el catéter, para evitar fugas pericatéter. Si es necesario iniciar la diálisis peritoneal a los pocos días de la implantación del catéter, se debe comenzar con volúmenes bajos y en decúbito realizando una «paracentesis controlada», que consiste en que el volumen de drenado sea 400-500 ml más de lo infundido, con lo que conseguiríamos una lenta disminución de la ascitis25. En la tabla 2 se resumen las recomendaciones referentes a la diálisis peritoneal en el paciente cirrótico.
Finalmente, es importante destacar que en el efluente peritoneal se han encontrado partículas víricas (virus B y C), por lo que hemos de instruir al paciente en un manejo adecuado del drenado peritoneal en domicilio.
DIÁLISIS EN EL POSTRASPLANTE HEPÁTICO
El posoperatorio del trasplante hepático es un período especialmente susceptible de complicarse con fallo renal y su incidencia se estima entre un 17-95 % según las series26,27. En general se trata de NTA. Los factores que precipitan el FRA postrasplante son múltiples y entre ellos se encuentran la hipotensión intraoperatoria, el sangrado intraoperatorio con necesidad de múltiples trasfusiones, las drogas anestésicas, el síndrome de reperfusión, el empleo prolongado de dopamina y niveles bajos de albúmina sérica pretrasplante28,29. No obstante, el uso de basiliximab en la inmunosupresión precoz del trasplante hepático y el retraso en la introducción de los anticalcineurínicos ha disminuido la incidencia de FRA en este contexto. La HD convencional y la hemodiafiltración venovenosa continua son las técnicas más utilizadas en el postrasplante inmediato y sus indicaciones son las habituales. Se prefiere la hemodiafiltración en los pacientes inestables hemodinámicamente o con edema cerebral. Para las urgencias (hiperpotasemia o edema agudo de pulmón) sigue siendo superior la HD aislada convencional. Hay que ser cauto con la anticoagulación para evitar la coagulación del circuito extracorpóreo en estos pacientes con plaquetopenia y disminución de la síntesis de los factores de anticoagulación.
La IRC es una complicación a largo plazo del trasplante hepático. La nefrotoxicidad por anticalcineurínicos, sobre todo la ciclosporina, la diabetes de novo, la hipertensión arterial, el virus C, el SHR pretrasplante, el retrasplante y la infección por el virus BK, han sido involucrados en la IRC postrasplante hepático30,31. Por último, la edad del receptor superior a 50 años parece ser uno de los factores más importantes en el desarrollo de IRC31,32.
A largo plazo hasta un 48 % de los trasplantados hepáticos pueden desarrollar IRC, pero este deterioro es muy lento, en 10-15 años, y entre el 3-18 % necesitarán diálisis crónica tras 10 años postrasplante31,33.
En la IRC sobrevenida al trasplante hepático estará indicada la diálisis crónica. Aunque no hay estudios al respecto, la HD es la técnica más indicada, ya que la diálisis peritoneal puede no ser viable en un abdomen previamente intervenido. Estos pacientes podrán ser valorados como candidatos a trasplante renal30.
CONCLUSIONES
El paciente con hepatopatía crónica es, con frecuencia, también un paciente renal. Ya que la afectación renal surge en cualquiera de los momentos evolutivos del paciente cirrótico, el nefrólogo debe estar al día de su manejo.
CONCEPTOS CLAVE
1. El paciente con hepatopatía crónica es, con frecuencia, también un paciente renal.
2. Los sistemas MARS® y Prometheus® son superiores a la HD en cuanto a detoxificación de sustancias hepáticas ligadas a proteínas.
3. La modalidad de diálisis más frecuentemente utilizada en los pacientes hepatópatas con IRC es la HD.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1.
12075_19115_45462_es_12075_tabla_1.pdf
Tabla 1.
12075_19115_45464_es_12075_tabla_2.pdf
Tabla 2. Recomendaciones de diálisis peritoneal en paciente cirrótico con ascitis