Sr. Director:
La amiloidosis secundaria (AA) es una causa poco frecuente de síndrome nefrótico en pacientes infectados por el virus de la inmunodeficiencia humana (VIH). Los casos referidos hasta la fecha son en pacientes con infección por el VIH y usuarios de drogas parenterales, apareciendo amiloidosis como consecuencia de la inflamación crónica producida por las múltiples infecciones de piel relacionadas con el uso de dichas drogas. Además de la inflamación cutánea por el uso de psicotrópicos parenterales, se producen trastornos inmunitarios que predisponen al depósito de amiloide debido a su reducida degradación. Específicamente, el déficit de interleuquina 2 (IL-2) ha sido descrito como uno de dichos trastornos. Reportamos el caso de una paciente con infección por VIH, antiguo usuario de drogas intravenosas que desarrolla fracaso renal agudo y síndrome nefrótico impuro secundarios a amiloidosis secundaria.
Hombre de 51 años, consumidor de 37 paquetes/año de tabaco, ocasional consumidor de cocaína y canabinoides, y antiguo adicto a la heroína intravenosa hasta hace 16 años; con infección por VIH conocida desde hace 25 años; recibe múltiples pautas de tratamiento retroviral por fallo y problemas de resistencia virológica, actualmente en tratamiento con maraviroc, raltegravir, darunavir y norvir, manteniendo desde hace un año cargas virales y un recuento de CD4 adecuados; infección por VHC diagnosticada en 2006, desestimándose, en ese momento, tratamiento por dificultades en su cumplimiento. Consulta por disnea, tos purulenta, fiebre de 40 ºC, distensión abdominal y malestar general de 10 días de evolución. En el momento del ingreso el paciente se hallaba en malas condiciones generales, normotenso, afebril, con bradicardia grave de 45 lpm. En la exploración física se evidenciaron palidez cutáneo-mucosa; edema blando, frío bimaleolar; prolongación del intervalo expiratorio con ruidos respiratorios disminuidos en tercios apicales de ambos hemitórax, crepitantes y roncus bilaterales; abdomen distendido, doloroso en forma difusa a la palpación profunda, con timpanismo a la percusión y ausencia de ruidos hidroaéreos.
En las exploraciones complementarias se observó anemia normocítica/normocrómica de 10,9 g/dl; leucocitosis de 11.700 x 10³/µl con neutrofilia y linfopenia (del 85 y del 8%, respectivamente). Valores elevados de urea y creatinina (293 y 9,53 mg/dl, respectivamente), hiperpotasemia de 7 mEq/l e hiponatremia de 125 mEq/l; acidosis metabólica. El sedimento urinario mostró un recuento de hematíes en 563 célulasl/μl, leucocitos en 103 células/μl, proteínas en 351 mg/dl y la FE Na+ fue del 2,6%. Las antigenurias para neumococo fueron positivas. En la radiografía de tórax se observaron imágenes radioopacas heterogéneas con broncograma aéreo en ápex de ambos campos pulmonares. La radiografía de abdomen mostraba dilatación colónica difusa, sin observarse niveles hidroaéreos. Una ecografía abdominal practicada urgentemente evidenciaba riñones de 15 cm (nefromegalia) con hiperecogenicidad cortical, índices de resistencia simétricos y ascitis libre. El ECG que evidenciaba ritmo nodal. Se realiza una tomografía computarizada (TC) de abdomen, observándose edema del tejido celular subcutáneo, derrame pleural bilateral, ascitis y engrosamiento mural de asas de intestino delgado, sin observarse oclusión, suboclusión ni hallazgos compatibles con isquemia; riñones globulosos con atenuación y retraso significativo de fases del medio contraste.
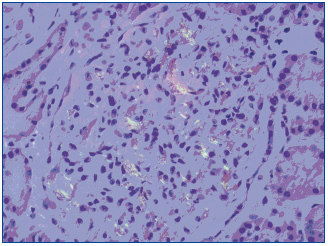
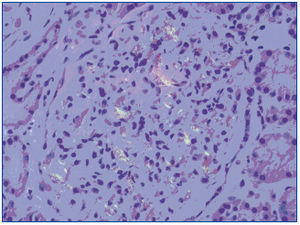
El paciente presenta evolución satisfactoria de la infección respiratoria (tras tratamiento antimicrobiano) y de la distensión abdominal. Sin embargo, persiste deterioro de función renal, manteniendo filtrados glomerulares alrededor de 18 ml/min. El estudio de orina recogida en 24 horas evidencia proteinuria de 22 g y persistencia de hematuria microscópica. Con el planteamiento de síndrome nefrótico impuro se realiza biopsia renal, observándose un total de 11 glomérulos, expansión mesangial global y difusa con formación de nódulos acelulares rojo Congo positivos, engrosamiento de membranas basales capilares, dilatación tubular con cilindros intratubulares densos y algunas células inflamatorias, y edema intersticial (figura 1). Prueba del permanganato positiva. La inmunohistoquímica sólo es positiva para amiloide AA.
No se identificaron patologías neoplásicas, infecciosas, autoinmunes o autoinflamatorias que explicasen la amiloidosis secundaria.
La relación entre el consumo subcutáneo y/o intravenoso de drogas, sobre todo heroína, y el desarrollo de amiloidosis secundaria es bien conocida desde hace más de 30 años1-3, sobre todo en pacientes que desarrollan infecciones cutáneas de repetición. Hasta la fecha, sólo existen dos casos en la literatura4,5 de pacientes infectados por este virus con amiloidosis, sin historia de consumo de drogas. A pesar de que la relación entre el VIH y la amiloidosis no queda clara, se ha observado que en estos pacientes, los niveles de proteína amiloide sérica A (SAA) se encuentran elevados6, lo que, en teoría, predispondría al desarrollo de amiloidosis. El mecanismo que explica el aumento de secreción de amiloide A es una reducción de los niveles de IL-27 debido a la infección por el VIH, lo que condiciona una disminución en la expresión del antagonista del receptor de IL-1 (IL-1Ra), lo que a su vez estimula la producción de factor de necrosis tumoral alfa (TNFα) e interleuquina 6 (IL-6) y la activación de NFκ-β que estimula la producción de SAA8.
En el caso presentado, dada la larga evolución de la infección por el VIH y el largo historial de consumo de drogas por vía parenteral, resulta imposible discernir la causa de la amiloidosis, que podría ser debida al consumo de drogas y las infecciones recurrentes, a la infección por el VIH o quizá a la suma de todo ello.
Figura 1. Depósitos mesangiales rojo Congo positivos.