La infección peritoneal es un problema frecuente que afecta negativamente a la supervivencia del paciente y de la técnica. El inicio rápido del tratamiento de la infección peritoneal reduce las complicaciones.
Se busca diseñar un índice multicomponente (MUL+DO) para el diagnóstico rápido y eficiente de infección peritoneal.
Con ese objetivo, se crea una cohorte de construcción con muestras de efluente peritoneal que se analizaron con tiras Multistix ® 10 SG Siemens para la detección de leucocitos. Después, se examinó cada muestra según el patrón oro: número de leucocitos, porcentaje de polimorfonucleares y cultivo microbiológico. Se construyó MUL+DO sumándole un punto a la escala cromática modificada MULTISTIX [0-1-2-3] si el paciente reporta dolor. MUL+DO toma valores de 0 a 4. Posteriormente, se creó una cohorte de validación del modelo. MUL+DO se aplicó a cada muestra, determinándose también leucocitos y porcentaje de polimorfonucleares.
La cohorte de construcción incluyó 134 muestras, 34 tenían infección (25,4% [17,6-33,1]). Las muestras con un valor MUL+DO >1, presentaron una sensibilidad y especificidad del 100%. La cohorte de validación incluyó 100 muestras con 16 infecciones (16% [8,3-23,7]).
En la cohorte de validación asumiendo como positiva una muestra con un valor MUL+DO > 1, se obtuvo una sensibilidad del 100% y una especificidad del 95,2%.
MUL+DO aplicado en la cohorte de construcción, mostró una separación perfecta de las poblaciones positiva y negativa. Todos los pacientes positivos presentaron una puntuación ≥2. En la cohorte de validación, el índice MUL+DO presentó una sensibilidad del 100% y una especificidad del 95,2%.
Peritoneal infection is a common problem that has a negative impact on the survival of patients and the technique. The early administration of peritoneal infection treatment reduces complications.
The goal of this study is to propose a multicomponent index (MUL+DO) for the quick and efficient diagnosis of peritoneal infection.
We selected a training cohort of peritoneal effluent samples which were analysed by Multistix ® 10 SG Siemens test strips for leukocyte detection. Then, each sample was examined according to the gold standard: number of leukocytes, polymorphonuclear percentage and microbiological culture. We constructed the MUL+DO index by adding one point to the MULTISTIX [0-1-2-3] modified chromatic scale if the patient reported pain. The MUL+DO index ranged from 0 to 4. A model validation cohort was then created. MUL+DO was applied to each sample and leukocytes and polymorphonuclear percentage were also assessed.
The training cohort ultimately included 134 samples, 34 of which with infection (25.4% [17.6-33.1]). Samples with a MUL+DO value greater than 1 presented a sensitivity and specificity of 100%. The validation cohort included 100 samples with 16 infections (16% [8.3-23.7]).
Assuming a sample with a MUL+DO value greater than 1 to be positive, we obtained a sensitivity of 100% and a specificity of 95.2%.
The MUL+DO index applied to the training cohort showed a perfect separation of the positive and negative populations. All positive patients presented a score ≥2. In the validation cohort, the MUL+DO reported a sensitivity of 100% and a specificity of 95.2%.
La repercusión de la peritonitis (IP) dentro de las unidades de diálisis peritoneal (DP) viene determinada por su influencia en la supervivencia del paciente a largo plazo (no por su tasa de letalidad directa1), su estrecha relación con el fracaso de la técnica2, así como con la pérdida de función renal residual3.
Aunque la incidencia de IP en DP ha disminuido en los últimos años, posiblemente gracias a los avances en la conectología, control de portadores nasales de Staphylococcus aureus4,5, mejora de las modalidades6, uso de soluciones más biocompatibles7–9 e innovaciones en los cuidados del orificio de salida10, la infección peritoneal, aún sigue siendo la complicación más frecuente en DP.
El diagnóstico de las peritonitis bacterianas «típicas», se basa en el líquido peritoneal efluente turbio, concretamente en un recuento celular de leucocitos (L) superior a 100 L/microlitro (L/μl) y más de 50% de polimorfonucleares (PMN) en la fórmula11.
En el caso de IP «atípicas», se requiere la presencia de al menos dos de las tres condiciones siguientes12:
- •
Clínica abdominal, principalmente dolor.
- •
Líquido efluente turbio, con el recuento celular y fórmula especificados anteriormente.
- •
Tinción de Gram o cultivo del líquido peritoneal: con demostración de presencia de microorganismos.
Un rápido inicio del tratamiento antibiótico, incluso sin esperar a la confirmación del diagnóstico, resulta fundamental para reducir las complicaciones de la IP11.
Las tiras reactivas, comúnmente utilizadas para el diagnóstico de infección urinaria, han demostrado una excelente validez diagnóstica (en términos de sensibilidad y especificidad) para el diagnóstico de la IP en la DP13–17, aunque sin llegar a una sensibilidad 100% y especificidad 100%.
El frecuente carácter multicomponente de las pruebas diagnósticas18 (en el sentido que, usualmente se debe atender a más de una característica) hizo que en este trabajo consideráramos la construcción de un modelo multicomponente (MUL+DO), para el diagnóstico de infección peritoneal.
MUL+DO está formado, por la utilización de tiras reactivas Multistix ® 10 SG Siemens, para la detección de leucocitos en líquido peritoneal efluente y el dolor autorreportado por el paciente. Con este objetivo, se utilizó una cohorte para la construcción del modelo (CCM), validándose, con otra cohorte (CVM), independiente de la primera. El modelo resultante debería ser útil en la práctica clínica, de manera que: fuera rápido, sencillo y válido.
Material y métodosPara la construcción del modelo MUL+DO, entre el 1 de enero y el 30 de junio de 2014, se recogió información sobre todas las muestras de efluente peritoneal obtenidas después de permanencias mínimas de 2 horas y volumen mínimo de infusión de 1.500 cc.
Las muestras fueron analizadas usando tiras reactivas Multistix ® 10 SG Siemens, el cuadrado que contiene el reactivo de esterasa leucocitaria fue instilado o sumergido en líquido peritoneal. Se anotaron los resultados de acuerdo con la escala cromática modificada que va del blanco al violeta de más intensidad (valor 0=0-15 L/μl, valor 1=16-70 L/μl, valor 2=71-125 L/μl y valor 3=126-500 L/μl). Se recogieron otras variables: edad, sexo, número de peritonitis anteriores, líquido turbio (no/sí/dudoso), dolor (autorreportado ¿tiene dolor abdominal? sí/no) y condición de diabético (sí/no).
Posteriormente, cada muestra, se evaluó de acuerdo con el patrón oro, recuento celular de L superior a 100 L/μl y más de 50% de PMN en la fórmula11. El efluente peritoneal, fue analizado mediante citología. Exactamente, el recuento celular de leucocitos y hematíes se llevó a cabo, en cámara Neubauer mejorada, el recuento diferencial (obtención de la fórmula) se efectuó por extensión y tinción con May-Grünwald-Giemsa. Se realizó también un cultivo microbiológico de cada muestra. Finalmente, se comprobó la concordancia entre el «gold estándar» y el primer análisis basado en las tiras reactivas.
La construcción del modelo multicomponente MUL+DO, se basó en la alta asociación entre las tiras reactivas Multistix y la IP. A los valores obtenidos en la escala cromática modificada (MULtistix [0-1-2-3]), se añade un punto si el paciente reportaba dolor (DOlor +1). Finalmente, la escala MUL+DO toma valores de 0 (menos riesgo) a 4 (más riesgo).
Entre el 1 de julio y el 31 de diciembre de 2014, para validar MUL+DO, se recogieron muestras con el mismo procedimiento y se recopiló idéntica información. Posteriormente, cada muestra se evaluó de acuerdo con el patrón oro de peritonitis «típica» (número de leucocitos y porcentaje de PMN), realizándose también un cultivo microbiológico.
Tanto en las muestras recogidas para CCM, como para CVM, se excluyeron aquellas procedentes de pacientes que hubieran recibido tratamiento antibiótico el mes anterior.
Este estudio contó con la aprobación del Comité Ético del Hospital Universitario Central de Asturias así como el consentimiento escrito informado de cada paciente.
Análisis estadísticoLa edad fue descrita mediante media ± desviación estándar. La igualdad entre medias fue contrastada mediante el test de Student-Welch. El resto de variables, todas categóricas, fueron descritas mediante frecuencias absolutas y relativas reportándose un intervalo de confianza al 95% para la incidencia de infección. La comparación de las mismas se realizó mediante el test exacto de la chi cuadrado. Se reporta la sensibilidad y la especificidad para Multistix y para la puntuación final. La capacidad diagnóstica se midió mediante el área bajo la curva Receiver Operating Characteristics (ROC). P-valores por debajo de 0,05 fueron considerados estadísticamente significativos. Los análisis estadísticos fueron realizados con el software de libre distribución R (www.r-project.org).
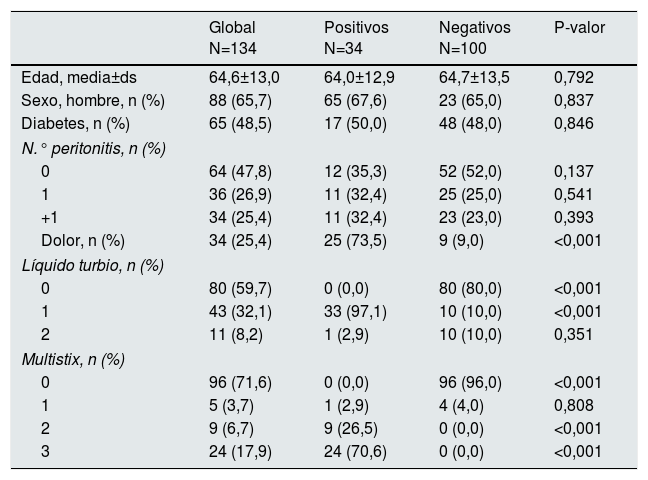
ResultadosLa CCM incluyó 134 muestras, 34 de ellas presentaron infección (25,4% [17,6-33,1]). La tabla 1 muestra la descripción de las poblaciones de positivos (con infección) y negativos (sin infección); la edad media fue de 64,6±13,0 siendo el 66% hombres. Las muestras positivas presentaron, de forma significativa, más dolor, más líquido turbio y más coloración en las tiras reactivas Multistix.
Descripción de las variables consideradas en la cohorte de construcción del modelo (CCM). Desviación estándar (ds). Número de peritonitis anteriores (N.° peritonitis). Líquido turbio no (0) sí (1) dudoso (2)
| Global N=134 | Positivos N=34 | Negativos N=100 | P-valor | |
|---|---|---|---|---|
| Edad, media±ds | 64,6±13,0 | 64,0±12,9 | 64,7±13,5 | 0,792 |
| Sexo, hombre, n (%) | 88 (65,7) | 65 (67,6) | 23 (65,0) | 0,837 |
| Diabetes, n (%) | 65 (48,5) | 17 (50,0) | 48 (48,0) | 0,846 |
| N.° peritonitis, n (%) | ||||
| 0 | 64 (47,8) | 12 (35,3) | 52 (52,0) | 0,137 |
| 1 | 36 (26,9) | 11 (32,4) | 25 (25,0) | 0,541 |
| +1 | 34 (25,4) | 11 (32,4) | 23 (23,0) | 0,393 |
| Dolor, n (%) | 34 (25,4) | 25 (73,5) | 9 (9,0) | <0,001 |
| Líquido turbio, n (%) | ||||
| 0 | 80 (59,7) | 0 (0,0) | 80 (80,0) | <0,001 |
| 1 | 43 (32,1) | 33 (97,1) | 10 (10,0) | <0,001 |
| 2 | 11 (8,2) | 1 (2,9) | 10 (10,0) | 0,351 |
| Multistix, n (%) | ||||
| 0 | 96 (71,6) | 0 (0,0) | 96 (96,0) | <0,001 |
| 1 | 5 (3,7) | 1 (2,9) | 4 (4,0) | 0,808 |
| 2 | 9 (6,7) | 9 (26,5) | 0 (0,0) | <0,001 |
| 3 | 24 (17,9) | 24 (70,6) | 0 (0,0) | <0,001 |
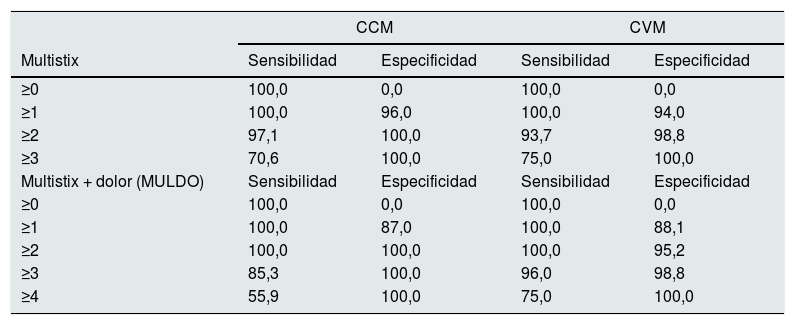
Los datos de sensibilidad y especificidad Multistix (0-3) y del modelo denominado MUL+DO (a la puntuación anterior se le añade un punto si el paciente reporta dolor, puntuación final de 0 a 4) se presentan en la tabla 2 (izquierda). Asumiendo como positiva (IP) una muestra con un valor MUL+DO superior a 1, se obtiene una sensibilidad y especificidad del 100%.
Sensibilidad y especificidad de las dos cohortes. Cohorte de construcción del modelo (CCM). Cohorte de validación del modelo (CVM)
| CCM | CVM | |||
|---|---|---|---|---|
| Multistix | Sensibilidad | Especificidad | Sensibilidad | Especificidad |
| ≥0 | 100,0 | 0,0 | 100,0 | 0,0 |
| ≥1 | 100,0 | 96,0 | 100,0 | 94,0 |
| ≥2 | 97,1 | 100,0 | 93,7 | 98,8 |
| ≥3 | 70,6 | 100,0 | 75,0 | 100,0 |
| Multistix + dolor (MULDO) | Sensibilidad | Especificidad | Sensibilidad | Especificidad |
| ≥0 | 100,0 | 0,0 | 100,0 | 0,0 |
| ≥1 | 100,0 | 87,0 | 100,0 | 88,1 |
| ≥2 | 100,0 | 100,0 | 100,0 | 95,2 |
| ≥3 | 85,3 | 100,0 | 96,0 | 98,8 |
| ≥4 | 55,9 | 100,0 | 75,0 | 100,0 |
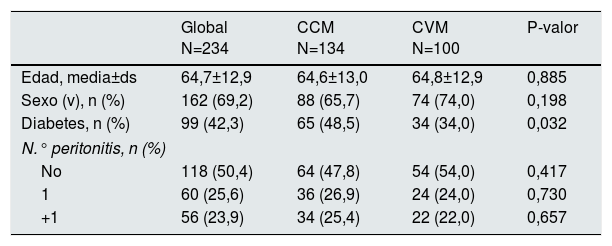
La CVM incluyó 100 muestras con 16 infecciones (16% [8,3-23,7]), las diferencias en la incidencia observadas en ambas cohortes no fueron estadísticamente significativas, (p=0,107). Ambas cohortes fueron similares observándose menor presencia de diabetes en la cohorte de validación (tabla 3). La tabla 2 (derecha) presenta la sensibilidad y la especificidad observadas en la cohorte de validación. Asumiendo como positiva una muestra con un valor de MUL+DO superior a 1, se obtuvo una sensibilidad del 100% y una especificidad del 95,2%.
Variables estudiadas en las dos poblaciones. Sexo varón (sexo [v])
| Global N=234 | CCM N=134 | CVM N=100 | P-valor | |
|---|---|---|---|---|
| Edad, media±ds | 64,7±12,9 | 64,6±13,0 | 64,8±12,9 | 0,885 |
| Sexo (v), n (%) | 162 (69,2) | 88 (65,7) | 74 (74,0) | 0,198 |
| Diabetes, n (%) | 99 (42,3) | 65 (48,5) | 34 (34,0) | 0,032 |
| N.° peritonitis, n (%) | ||||
| No | 118 (50,4) | 64 (47,8) | 54 (54,0) | 0,417 |
| 1 | 60 (25,6) | 36 (26,9) | 24 (24,0) | 0,730 |
| +1 | 56 (23,9) | 34 (25,4) | 22 (22,0) | 0,657 |
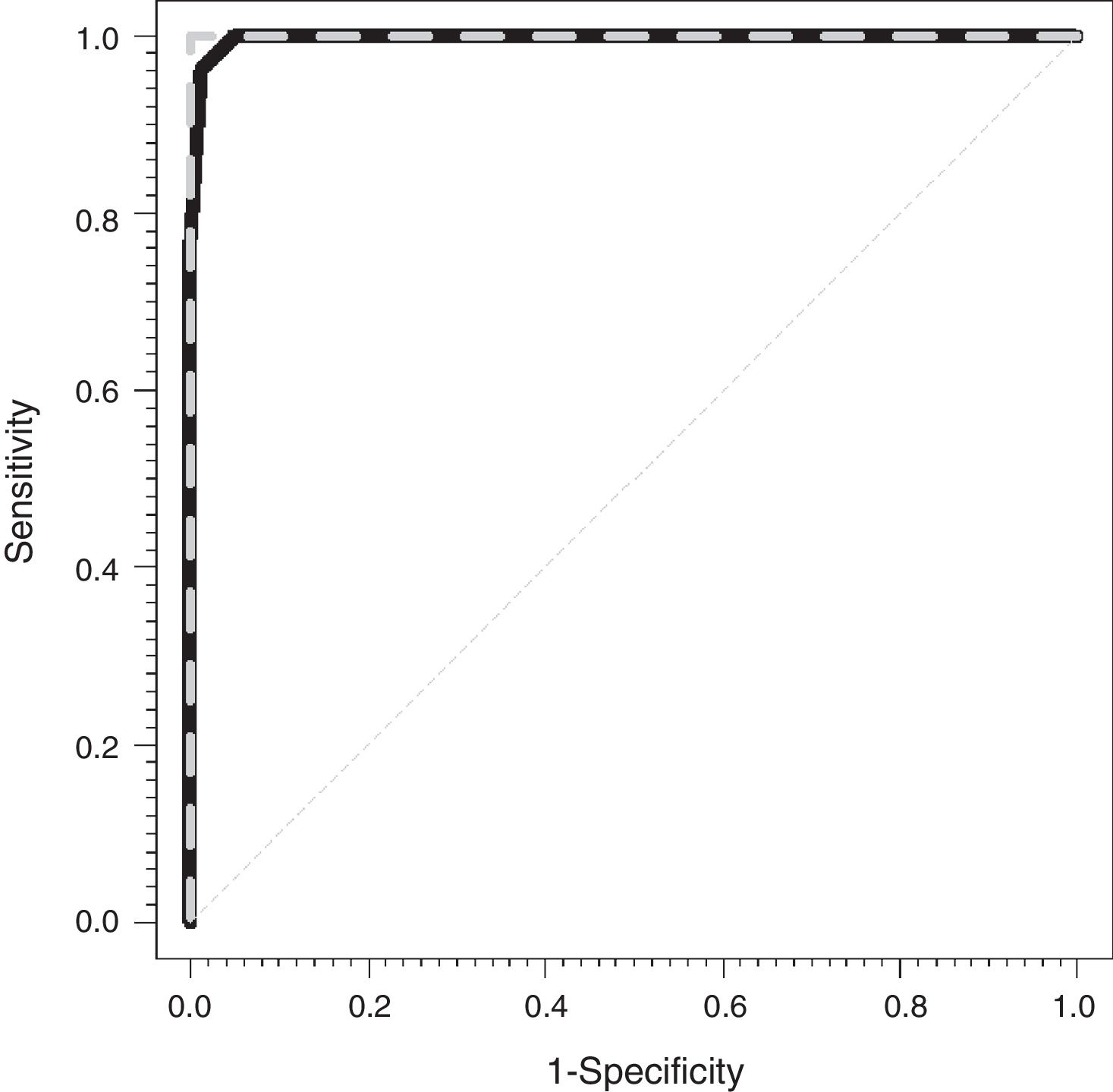
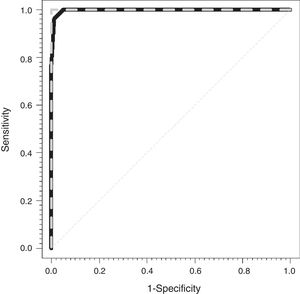
La figura 1 muestra las curvas ROC para la CCM (línea gris discontinua) y para la CVM (línea negra continua). Las áreas bajo la curva observadas fueron de 1 y 0,997 (0,991-1) para la CEM y la CVM, respectivamente.
DiscusiónLa aplicación del modelo multicomponente MUL+DO (Multixtis [0-1-2-3] + dolor [0-1]) sobre la cohorte de construcción, evidenció una separación perfecta de las poblaciones de positivos y negativos. Todos los positivos presentan una puntuación igual o superior a dos, mientras que todos los negativos tuvieron una puntuación igual o inferior a uno. La inclusión de la variable dolor, fácil y rápida de recoger y presente en 25 de 34 positivos y solo en 9 de 100 negativos, permite diagnosticar con mayor fiabilidad, la presencia de peritonitis.
Por supuesto, otras ponderaciones de las características finalmente incluidas podrían haber sido consideradas, sin embargo, dada la alta calidad del método propuesto y la sencillez de su cálculo, la elección final no incluye diferentes pesos.
En la cohorte de validación, el modelo MUL+DO presentó resultados muy buenos, aunque no perfectos como en el caso anterior. Todas las muestras positivas presentaron un valor mayor o igual a dos (sensibilidad del 100%) si bien, de los 84 individuos negativos incluidos en esta cohorte, tres tuvieron una puntuación de dos y uno presentó una puntuación de tres, resultando una especificidad de 95,2%. Se trata de un error asumible, teniendo en cuenta que en la práctica clínica diaria «la prueba diagnóstica perfecta no existe18,19.
El punto de corte fue establecido en un valor superior o igual a dos, basándonos en la curva ROC20 y de acuerdo a los postulados de Galem y Gambino21: «Se elige el punto de mayor sensibilidad, cuando se trata de enfermedades graves tratables y los resultados falsos positivos no supongan un traumatismo psicológico o económico para los individuos examinados».
La utilización de un modelo predictivo multicomponente tipo MUL+DO en el diagnóstico de peritonitis bacterianas espontáneas, en el campo de la hepatología, podría ser objeto de investigación, si bien los artículos consultados, muestran una validez (sensibilidad y especificidad22–25) controvertida, cuando se utilizan solo tiras reactivas para el diagnóstico de peritonitis bacterianas espontáneas.
A pesar de los buenos resultados obtenidos, se debe ser cauto en cuanto a la utilización de MUL+DO por el paciente; una mala conservación de las tiras Multistix ® 10 SG Siemens, mala interpretación de los resultados (pacientes con mala visión, en la tira aparecen otras determinaciones: glucosa, sangre…) etc., pueden debilitar la fiabilidad de la prueba26, haciendo que la validez y rendimiento clínico disminuyan.
En la práctica clínica, el desconocimiento de la fórmula leucocitaria puede dificultar el diagnóstico de peritonitis, poco frecuentes, con fórmulas «atípicas» donde existe predominio linfocitario o eosinofílico. MUL+DO es una prueba diagnóstica que sirve para determinar, en dos min, si el paciente tiene o no infección peritoneal. Esto, no exime, de que se envíen muestra de efluente peritoneal, para recuento y fórmula leucocitaria, así como para cultivo microbiológico, lo que permitirá al clínico, más tarde, saber el tipo de IP que tiene el paciente11,12.
Las diferencias entre las dos cohortes, no implica la existencia de ningún sesgo. La menor incidencia de IP en la CVM podría justificarse por la menor presencia de diabéticos27,28 o la posible variabilidad estacional de peritonitis29,30.
Aunque no es el objeto de este estudio, nos gustaría mostrar características inherentes a la prueba, que transmiten su factibilidad de aplicación18. Su sencillez condiciona su aceptabilidad (tanto por parte del paciente como del personal sanitario), permite ser utilizado por personal instruido en su manejo (cuidador, paciente), no necesariamente personal sanitario. Su coste, cada tira Multistix 10 SG ®, tiene un importe aproximado de 30 céntimos de euro. No precisa infraestructura (laboratorio), se puede realizar a pie de cama. Rapidez de resultados (2 min), permitiendo en su caso el inicio precoz del tratamiento una vez conocido el diagnóstico, unido a su validez (sensibilidad 100% y especificidad 95,2).
Teniendo en cuenta que tanto la CCM como la de CVM fueron recogidas en el mismo centro, una validación externa aportaría más evidencia científica.
Finalmente, concluimos que el índice MUL+DO es una prueba a) rápida (2 min), b) de bajo coste (30 céntimos de euro), c) y sencilla (no precisa infraestructura). La CCM, presentó una validez diagnóstica absoluta, tanto las muestras negativas como las positivas fueran perfectamente clasificadas (especificidad y sensibilidad 100%). Si bien, la validación del modelo, presentó peores resultados (sensibilidad 100% y especificidad 95,2%).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al laboratorio del Hospital Universitario Central de Asturias por su colaboración.
Al equipo de diálisis peritoneal del Hospital Universitario Central de Asturias, por su imprescindible participación en este estudio.
Al Dr. Gonzalo Solís Sánchez por sus acertadas rectificaciones y al Dr. Pedro Vidau por su entusiasmo en el proyecto y apoyo desinteresado.