El fallo inicial de ultrafiltración en diálisis peritoneal es un trastorno de base heterogénea, cuyo abordaje precisa una adecuada caracterización basada en la prueba de equilibrio peritoneal con solución hipertónica y en una correcta valoración clínica. En su forma más típica es un trastorno funcional, en ocasiones de base inflamatoria, mediado por una superficie capilar aumentada y una elevada tasa de reabsorción linfática, y reversible, al menos en parte, en la mayoría de los casos. No se debe confundir, en términos fisiopatológicos, clínicos o pronósticos, con el transporte rápido de solutos pequeños, aunque este sea una de sus causas principales. La preservación de la función renal residual y de la membrana peritoneal son objetivos especialmente importantes en estos pacientes, ya que facilitan el manejo y, potencialmente, la reversibilidad del trastorno. El consejo dietético, la potenciación de la diuresis y saluresis con diuréticos del asa, el uso de solución de poliglucosa y regímenes individualizados de diálisis peritoneal automatizada son las mejores herramientas para optimizar el control de volumen.
INTRODUCCIÓN
El control de volumen representa uno de los principales objetivos terapéuticos en los pacientes tratados con diálisis peritoneal (DP). La prevención de la hipervolemia se fundamenta tanto en la disciplina dietética como en una extracción eficaz del exceso de agua y sal a través de la diuresis y de la ultrafiltración (UF) por diálisis. A menudo se asume que esta complicación es un problema de aparición relativamente tardía, que se presenta una vez que la función renal residual (FRR) declina y, especialmente, en los pacientes que pierden la capacidad de UF1. Sin embargo, la tendencia a sobrecarga de volumen está presente desde fases muy iniciales de la terapia. Un estudio reciente2 ha mostrado que hasta un 56,5% de los pacientes presentan sobrehidratación de grado variable en el momento de iniciar DP.
La incapacidad para generar una UF adecuada en respuesta a los agentes osmóticos habituales en DP recibe el nombre de fallo o déficit de UF. En su forma más típica, esta complicación aparece después de una permanencia significativa (habitualmente a partir del tercer año) en DP, comprometiendo la supervivencia de pacientes y la técnica de diálisis. Sin embargo, en otros casos se observa una baja capacidad de UF desde el comienzo del tratamiento. El significado de esta forma inicial o incidente de fallo de UF es más controvertido. En la presente revisión se analiza este trastorno, prestando especial atención a los principios que deben guiar su manejo.
¿CÓMO SE ESTIMA LA CAPACIDAD DE ULTRAFILTRACIÓN?
Aunque la importancia de una UF adecuada fue percibida desde los primeros tiempos de la DP, el transporte de solutos pequeños centró la atención de los especialistas hasta finales de los años noventa del pasado siglo. La percepción común, y errónea, de que la capacidad de UF se podía inferir directamente como inversa del transporte de creatinina hizo que este segundo parámetro se utilizara como marcador rutinario del primero.
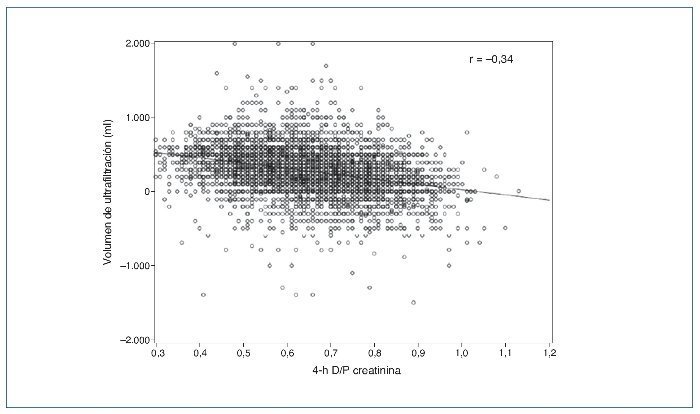
A lo largo de los años noventa, 2 factores pusieron de manifiesto la necesidad de estimar directamente la capacidad de UF en DP. En primer lugar, el modelo de transporte peritoneal de 3 poros3 permitió entender por qué el transporte de solutos pequeños y la UF muestran asociación, pero no son fenómenos acoplados y que, por tanto, uno no puede deducirse a partir del otro (fig. 1). En segundo lugar, el final de los noventa y, sobre todo, la primera década de este siglo contemplaron la acumulación de evidencia sobre el papel crucial de una UF adecuada en la prevención de la mortalidad cardiovascular en DP4-8.
Figura 1. Correlación entre transporte peritoneal de solutos pequeños (creatinina en este caso) y ultrafiltración durante una prueba de equilibrio peritoneal con solución de glucosa al 2,27/2,5%, en una muestra de 10.142 pacientes. Tomada de referencia 16.
Aunque la UF observada en entorno clínico proporciona una medida aproximada de la capacidad de UF de la membrana, este estimador depende de la pauta de prescripción. Por este motivo se hizo necesaria una estandarización de esta característica. La International Society of Peritoneal Dialysis (ISPD) fijó, de manera arbitraria, una UF de 400 ml a los 240 min en una prueba de equilibrio peritoneal (PEP) con glucosa al 3,86/4,25% como límite entre una capacidad de UF normal y reducida9. La importancia de este parámetro ha hecho que la PEP con solución de glucosa al 3,86/4,25% haya desplazado, de manera progresiva, a la clásica al 2,27/2,5%, como método de monitorización del funcionalismo peritoneal.
Sobre la base de lo expuesto, el diagnóstico de fallo de UF sería relativamente sencillo. Sin embargo, basarse en el resultado de una sola PEP para definir una cuestión tan importante puede ser engañoso, ya que esta prueba presenta una precisión y reproducibilidad limitadas10. En lo que respecta a la UF, su fiabilidad depende de una mecánica perfecta en 2 intercambios consecutivos de DP, una premisa que falla con cierta frecuencia. El hecho de que las soluciones tamponadas con bicarbonato generan una UF levemente inferior a las tamponadas con lactato11 acentúa la imprecisión de este criterio. Por tanto, la definición de fallo de UF debe ser mixta, basada en los resultados de la PEP al 3,86/4,25%, pero apoyada por la evidencia de una baja capacidad de UF en entorno clínico. La tendencia a hipervolemia refuerza el diagnóstico, aunque no es un elemento imprescindible, ya que la aparición de esta complicación depende también de la disciplina dietética, la FRR y una prescripción correcta de DP.
La valoración de la capacidad de UF de la membrana peritoneal puede ser especialmente problemática en las fases iniciales del tratamiento con DP. En primer lugar, la pauta de prescripción todavía no se ha estabilizado, por lo que los balances en entorno clínico son poco orientativos. Además, los problemas de drenaje, que son la fuente principal de errores en la valoración de la UF en una sola PEP, son más frecuentes al inicio de DP. Por último, las variaciones precoces en el funcionalismo peritoneal pueden desorientar al clínico poco experimentado. El transporte peritoneal de solutos pequeños tiende a aumentar, en grado variable, en los primeros días tras el inicio del tratamiento12-14, con un efecto menos predecible sobre la UF obtenida, un fenómeno cuyas causas están poco claras, aunque se ha atribuido a cambios en la volemia, efectos vasomotores de la glucosa sobre la vasculatura peritoneal (reclutamiento capilar y/o vasodilatación) o fenómenos inflamatorios locales generados por la bioincompatibilidad de las soluciones de DP. Aunque se intente contrarrestar este sesgo realizando la PEP basal en el segundo mes de tratamiento, la corrección puede ser incompleta, ya que la inestabilidad puede prolongarse en algunos pacientes.
¿QUÉ ES (Y QUÉ NO ES) FALLO INICIAL DE ULTRAFILTRACIÓN?
De lo expuesto anteriormente se deduce que debemos hablar de fallo inicial o incidente de UF en pacientes que presentan una UF a los 240 min < 400 ml en una PEP al 3,86/4,25% realizada tras, al menos, 4-6 semanas en DP, siempre que la prueba haya transcurrido sin contratiempos y los balances en entorno clínico sean coherentes con sus resultados. En sentido contrario, se puede afirmar que no es fallo inicial de UF:
• El que se manifiesta transcurrido un tiempo en diálisis (se suele admitir que el plazo de diagnóstico debe ser inferior a 6 meses tras el inicio de DP).
• El que aparece en peritoneos no “vírgenes” a DP, por ejemplo, en pacientes procedentes de trasplante renal que ya fueron tratados en su día con esta técnica.
• El que se diagnostica sin valoración estandarizada de la capacidad de UF, sino deduciéndola de una UF insuficiente en entorno clínico (que puede esconder una prescripción incorrecta) o de un transporte rápido de solutos pequeños, un error de concepto que ya se ha mencionado, y al que se volverá al hablar de la fisiopatología de esta complicación.
La PEP clásica al 2,27/2,5% permite la categorización del transporte peritoneal de agua15, pero tiene la desventaja de no estar estandarizada en sus resultados. Se considera que un balance hidrosalino neutro o positivo en esta prueba indica baja capacidad de UF16.
EPIDEMIOLOGÍA DEL FALLO INICIAL DE ULTRAFILTRACIÓN
La información sobre la incidencia del fallo inicial de UF en DP es escasa y controvertida. La causa principal puede ser la estandarización relativamente reciente de esta complicación. En un estudio sobre 410 pacientes, Fernández-Reyes et al17 identificaron un 6,6% de pacientes con déficit de UF al inicio de DP utilizando una metodología diagnóstica no estandarizada, pero sí bastante acorde con criterios vigentes. Otros estudios han detectado incidencias tan variables como el 20,3%18 o el 36,5%19. Las razones para tanta discordancia no están claras, pero el uso de soluciones tamponadas con bicarbonato para las PEP en los últimos estudios citados podría tener alguna influencia. En un amplio estudio sobre más de 10.000 pacientes incidentes en DP a los que se realizó una PEP al 2,27/2,5%, un 14,8% de los pacientes presentaron UF neutra o negativa durante la prueba16.
El perfil de riesgo para presentar fallo de UF al inicio de DP tampoco está bien definido. Se ha investigado más sobre los factores que predicen un transporte peritoneal rápido, pero, como ya hemos dicho, ambas complicaciones no son equivalentes. Entre los factores de riesgo más citados, destacan mayor edad20-22, sexo masculino20,23, raza20, diabetes y comorbilidad22 o hipoalbuminemia22-24. Algunos estudios han sido incapaces de identificar marcadores clínicos consistentes de esta complicación25. La relación entre el transporte peritoneal rápido y la existencia de un estado inflamatorio sistémico de fondo ha sido reconocida desde hace tiempo26,27 y, aunque tampoco es consistente28,29, se considera un factor importante en algunos pacientes, con un significado pronóstico potencialmente negativo30.
Existen pocos estudios que analicen el perfil epidemiológico específico del fallo incidente de UF. Diabetes16,25, mayor edad16, raza blanca16 y estado inflamatorio sistémico19 muestran asociación, aunque poco consistente, con esta complicación. En los últimos años se ha investigado activamente sobre la asociación de los trastornos de la membrana peritoneal con la presencia de varios polimorfismos genéticos, especialmente relacionados con citocinas y, más específicamente, con la interleucina 6 pero, nuevamente, los resultados son poco consistentes y los estudios se han centrado más en el transporte peritoneal de solutos pequeños que en la capacidad de UF31.
FISIOPATOLOGÍA DE LA BAJA CAPACIDAD DE ULTRAFILTRACIÓN INICIAL
El fallo adquirido de UF es un trastorno aparentemente homogéneo, de etiología y patogenia relativamente bien definidas, que asocia cambios estructurales típicos en la membrana, de comportamiento habitualmente progresivo y, en el mejor de los casos, solo parcialmente reversible32. El diagnóstico no suele ofrecer dudas, ya que se dispone del histórico del paciente, lo que reduce mucho el riesgo de falsos positivos. Además estamos, sin duda, ante un trastorno, ya que hay una lesión objetiva de la membrana con consecuencias clínicas evidentes, incluyendo la sobrecarga sostenida de volumen y el riesgo de progresión ulterior a peritonitis encapsulante, que conducen a mortalidad y fracaso de la técnica de DP.
Por el contrario, el fallo incidente de UF tiene un sustrato causal más heterogéneo (tabla 1), no asocia cambios estructurales específicos y es reversible (al menos parcialmente) en la mayoría de los casos. Además, es fácil errar en el diagnóstico, porque no se dispone de un sustrato comparativo previo y, a menudo, tiene escasa repercusión clínica, porque la FRR ayuda a mitigar sus efectos. En definitiva, en muchos casos constituye una circunstancia o un inconveniente, más que un verdadero problema clínico. Es por eso que, más que de fallo incidente de UF, quizá sería apropiado hablar de baja capacidad de UF al inicio de DP, dejando el término fallo para las formas adquiridas o persistentes.
La capacidad de UF mantiene una distribución esencialmente gaussiana25, en la que no existe un punto de corte de normalidad. El límite utilizado para la definición de fallo de UF9 es, pues, esencialmente arbitrario. El paciente incidente en DP con membrana peritoneal sana pero capacidad límite de UF puede fácilmente ser clasificado erróneamente. Además, algunos pacientes pueden ser objeto de una mala clasificación como consecuencia de una PEP defectuosa, por drenaje incompleto a los 240 min. Los pacientes con malfunción del catéter peritoneal son particularmente proclives a este problema. Por otra parte, una fuga de dializado puede manifestarse inicialmente como un problema de baja UF9. Por último, algunos pacientes presentan infección peritoneal precoz asociada a DP, incluso antes del inicio de diálisis. Una estimación del transporte peritoneal demasiado cercana al episodio puede conducir a un diagnóstico erróneo de fallo inicial de UF9. Todos estos problemas suelen quedar de manifiesto en un plazo de tiempo relativamente corto con ayuda de una correcta valoración clínica, pero pueden conducir transitoriamente a un diagnóstico erróneo de fallo de UF.
Un daño pretérito a la membrana peritoneal puede condicionar un fallo de UF desde el inicio del tratamiento con DP. Las causas no siempre son aparentes, pero no es difícil encontrar en estos pacientes antecedentes de resecciones intestinales, cirugías abdominales múltiples o complejas, peritonitis no asociadas a DP, pancreatitis, etc. Estos factores generan baja capacidad de UF por varios mecanismos, que incluyen una superficie peritoneal eficaz reducida, mala mecánica de la diálisis por adherencias o compartimentalización, o una esclerosis de la membrana, que genera un bajo transporte tanto de solutos como de agua, tradicionalmente conocido como fallo de membrana tipo 233.
En su forma más típica, el fallo de incidente de UF se ha asociado con un perfil fisiopatológico característico34, que incluye un transporte relativamente rápido de solutos pequeños y unas tasas elevadas de reabsorción linfática. El déficit de UF afecta tanto al transporte por poros pequeños como por ultraporos19. Característicamente, la permeabilidad hidráulica de la membrana y su parámetro dependiente, la conductancia osmótica a la glucosa, son similares a las de los pacientes sin fallo de UF, lo que apoya la noción de que la estructura de la membrana está relativamente indemne34. Por el contrario, los pacientes con fallo adquirido de UF tienden a presentar un transporte de pequeños solutos más rápido, la reabsorción linfática no parece alterada y, particularmente, muestran alteraciones sugestivas de una lesión estructural en la membrana, en consonancia con los resultados de las biopsias peritoneales y la evolución clínica34,35.
El transporte peritoneal rápido de solutos pequeños es la alteración más consistentemente observada en pacientes con baja capacidad inicial de UF32, aunque la correlación limitada entre este parámetro y la propia UF estandarizada (fig. 1) sugiere un impacto significativo de otros factores. En una muestra de nuestro centro de 198 PEP al 3,86/4,25% realizadas en el segundo mes en DP, los transportadores rápidos mostraban un riesgo de fallo de UF 2,8 veces mayor que los transportadores medios (intervalo de confianza del 95%, 1,3-5,6). Sin embargo, un 31,2% de los transportadores rápidos no presentaba fallo de UF, y el 60,7% de los fallos incidentes de UF se observaron en transportadores medios, que son mucho más prevalentes (datos no publicados). Por otra parte, las causas de un transporte rápido inherente de solutos pequeños podrían ser heterogéneas. Algunos pacientes podrían presentar una densidad capilar peritoneal alta previa a la DP, en unos casos sin significado patológico y, en otros, relacionada con estados inflamatorios sistémicos. Este último subgrupo, que se caracterizaría por su alta comorbilidad, hipoalbuminemia17 y malfunción de poros grandes (expresando disfunción endotelial y manifestándose por pérdidas proteicas peritoneales elevadas)29, sería el potencial responsable de la mortalidad asociada al transporte rápido observada en algunos estudios36. En otros pacientes, la superficie capilar aumentada vendría mediada por fenómenos de vasodilatación y/o reclutamiento capilar, como respuesta al contacto con las soluciones de diálisis. No están claros los mecanismos ni los mediadores de este fenómeno, aunque se asume una respuesta inflamatoria local a la bioincompatibilidad del dializado32.
Los mecanismos que conducen a una alta tasa de reabsorción linfática son aún menos conocidos, aunque el aumento de presión intraperitoneal inducido por la DP juega, con seguridad, algún papel37. No está claro que la reabsorción peritoneal sea por sí misma una causa significativa de fallo de UF (el llamado fallo de UF tipo 4)33, pero sí podría jugar un papel importante en asociación con otros factores. Además, este trastorno representa un problema significativo en el entorno clínico, ya que no mejora con la introducción de solución de poliglucosa.
EVOLUCIÓN DE LA BAJA CAPACIDAD DE ULTRAFILTRACIÓN INICIAL. FACTORES QUE INFLUYEN
El comportamiento medio de la membrana peritoneal en el primer año de tratamiento con DP todavía es objeto de cierta controversia, aunque parece producirse un descenso en el transporte de solutos pequeños en los primeros 6 a 12 meses, seguido de un aumento posterior21,38,39. Sin embargo, cuando se estratifica a los pacientes según su punto de partida, se pone de manifiesto un panorama de regresión a valores medios durante el primer año, en el que el transporte se acelera en los transportadores lentos y se hace más lento en los transportadores más rápidos de inicio39. Por otra parte, el transporte de agua mantiene una relativa estabilidad en el primer año en el conjunto de los pacientes18, y no parece producirse el aumento que sería de esperar tras el descenso en el transporte de solutos21. Sin embargo, la capacidad de UF sí podría aumentar en los transportadores más rápidos y, en general, en los pacientes con déficit de UF de inicio19,40. Resulta tentador atribuir este aumento al mayor descenso en el transporte de solutos pequeños, que se debería a una regulación a la baja de la respuesta inflamatoria inicial a las soluciones de diálisis, en esta subpoblación41. Seguramente esta sea la causa principal, pero otros factores podrían contribuir en grado variable. Así, a lo largo del primer año suelen resolverse, de una u otra manera, los problemas precoces de mal drenaje y fugas de dializado, y la observación clínica y la eventual repetición de la PEP basal permiten corregir algunos falsos positivos iniciales. Además, la actividad de acuaporinas podría aumentar durante este período en algunos pacientes, un fenómeno que se ha atribuido al contacto de la membrana con la glucosa del dializado42. El análisis evolutivo de las fracciones de transporte de agua en pacientes con baja capacidad inicial de UF muestra una tendencia sistemática al aumento del transporte de agua libre19, compatible con el efecto sumado de una menor superficie de poros pequeños y una mayor actividad de acuaporinas. En cambio, el efecto sobre la UF por poros pequeños es más inconsistente19.
En conjunto, la capacidad de UF tiende a mejorar a lo largo del primer año en la mayoría de los pacientes con baja capacidad de UF inicial. Como consecuencia, el fallo de UF, según definición estandarizada, revierte en una mayoría de casos, aunque existe desacuerdo sobre el porcentaje aproximado, que se situaría entre el 55 y el 85%19,40. No se han identificado rasgos demográficos ni clínicos que predigan la reversibilidad de la baja capacidad inicial de UF17,19. Tampoco el análisis de fracciones de UF en la PEP basal orienta en este sentido19. Evolutivamente, se ha indicado que el desarrollo de infecciones o una carga elevada de glucosa intraperitoneal durante el primer año podrían dificultar la recuperación17. En el mismo sentido, los pacientes tratados con icodextrina desde el inicio podrían tener más posibilidades de recuperación19. No hay datos que indiquen una evolución diferenciada en pacientes tratados con DP manual o automatizada24.
SIGNIFICADO PRONÓSTICO DE LA BAJA CAPACIDAD DE ULTRAFILTRACIÓN INICIAL
La reversibilidad del déficit inicial de UF sugiere un pronóstico benigno para este trastorno. Sin embargo, la asociación, observada en algunos estudios, entre transporte rápido y mayor mortalidad36 suscita algunas dudas sobre la cuestión. Los pacientes con un sustrato inflamatorio sistémico serían motivo de mayor preocupación entendiendo que, en estos casos, el déficit de UF sería un marcador de riesgo, más que su causa directa30. Aunque no se dispone de información fiable sobre el significado pronóstico específico del fallo incidente de UF, un estudio reciente sobre una amplia población, estudiada mediante PEP al 2,27/2,5%, ha mostrado que, a diferencia del transporte rápido de solutos pequeños, una capacidad de UF baja al inicio de DP no asocia mayores tasas de mortalidad o fallo de la técnica, aunque sí se observó una tendencia a mayores tasas de hospitalización en los primeros meses de seguimiento16. Estos resultados resaltan, una vez más, la necesidad de diferenciar transporte de solutos pequeños y capacidad de UF.
MANEJO DEL PACIENTE CON BAJA CAPACIDAD DE ULTRAFILTRACIÓN DESDE EL INICIO DE DIÁLISIS PERITONEAL
Aspectos generales
En la tabla 2 se presentan los aspectos fundamentales del manejo de los pacientes con baja capacidad de UF al inicio de DP. El primer paso es la confirmación del diagnóstico y la caracterización del problema. El estudio de los balances en entorno clínico y la propia pauta de prescripción permiten detectar incongruencias con los resultados de la PEP basal (criterio diagnóstico estandarizado). Si ocurre esto, puede estar indicada la repetición de la PEP utilizando variantes que permitan caracterizar el estado de la membrana y las fracciones de UF43. Aunque sería de gran interés conocer las tasas de reabsorción de fluido por vías linfática y capilar en estos pacientes, la estimación de estos parámetros es relativamente compleja, demanda el uso de marcadores específicos y su interpretación es controvertida, por lo que es poco aplicable al entorno clínico44,45.
Ante la evidencia de una baja UF debe considerarse la posibilidad de existencia de malfunción del catéter peritoneal o fugas no aparentes de dializado9. Una buena valoración clínica acompañada de un uso racional de pruebas de imagen permiten descartar estas complicaciones. Las pruebas de imagen abdominal pueden ser especialmente rentables en pacientes con déficit de UF y antecedentes de complicaciones abdominales o fallo de membrana tipo 2.
La valoración de las repercusiones clínicas de un déficit inicial de UF ayuda a planificar el manejo. La presencia de sobrehidratación indica medidas más agresivas. La ausencia de respuesta a la introducción de solución de poliglucosa sugiere mal drenaje, superficie reducida o esclerosis peritoneal (fallo de membrana tipo 2), o una tasa alta de reabsorción linfática.
Permitir la recuperación
Dada la potencial reversibilidad del trastorno, es esencial aplicar medidas que faciliten la recuperación de la membrana. La prevención de infecciones peritoneales y la reducción de la carga de glucosa peritoneal durante el primer año muestran una aparente asociación con la reversibilidad del trastorno39,40. La reducción de la carga de glucosa se consigue mediante un adecuado consejo dietético, el aprovechamiento de la FRR y el uso de soluciones libres de glucosa. Por otra parte, la evidencia clínica de un efecto beneficioso de las soluciones biocompatibles sobre la preservación de la membrana se limita casi exclusivamente a los resultados del ensayo balANZ46, pero existe un abrumador cuerpo de evidencia in vitro y ex vivo47 que avala la conveniencia de esta medida.
Balance hidrosalino
El mantenimiento de un adecuado balance hidrosalino es esencial en estos pacientes, que muestran signos de sobrehidratación desde el inicio de DP en un alto porcentaje de casos2. Para cumplir este objetivo es esencial la disciplina dietética. La preservación de la FRR y su uso para maximizar la diuresis y la saluresis también facilitan el manejo del problema. Los principios de preservación de la FRR son ya bien conocidos48. En este caso, además, la evidencia sobre el efecto beneficioso de las soluciones biocompatibles es más consistente49. Los diuréticos de asa maximizan diuresis y saluresis sin aparente efecto negativo sobre la FRR50.
Cuando las medidas anteriores son insuficientes, y especialmente en pacientes sin FRR, se hace especialmente necesario intensificar la UF. Dos medidas son especialmente útiles en este contexto. La introducción de soluciones de poliglucosa para el cambio largo tiene un efecto demostrado sobre el control de volumen51. Los beneficios de esta solución son máximos en transportadores rápidos52, pero más menores o nulos, si el problema es un fallo de membrana tipo 2 o una reabsorción linfática rápida. En este último caso, la reducción de la presión intraperitoneal (disminuyendo el volumen por intercambio) podría reportar algún beneficio53, pero la pérdida de carga osmótica que asocia esta medida podría resultar incluso contraproducente37,54.
La DP automatizada representa una opción atractiva en pacientes con déficit inicial de UF (tabla 3). Sin embargo, es preciso mantener algunas reservas. Se trata de una modalidad de mayor coste que la DP continua ambulatoria, implica el uso de dispositivos en individuos que, a menudo, se manejan con dosis muy bajas de DP, y algunos estudios sugieren que podría acelerar el declive de la FRR55,56. Además, la DP automatizada no es una opción en pacientes con esclerosis peritoneal, que suelen ser transportadores lentos, ni aporta nada si el problema es un catéter malfuncionante (de hecho, los problemas de drenaje son a menudo mayores en decúbito). Por otra parte, el estudio del grupo ANZ que mostraba mejor supervivencia en transportadores rápidos cuando son tratados con DP automática57 ha endosado esta estrategia. Sin embargo, un estudio más reciente16 ha mostrado que es el transporte rápido, pero no la capacidad de UF, el que podría asociar un mejor pronóstico con DP automática apoyando, una vez más, la noción de que ambos factores no son equivalentes. De lo anteriormente expuesto se deduce que la DP automática puede ser claramente ventajosa en pacientes con baja capacidad de UF solo si son transportadores rápidos, aunque los transportadores medios también pueden beneficiarse de la versatilidad de esta técnica.
En los pacientes con FRR deben programarse prescripciones poco agresivas, ya que las UF enérgicas no son necesarias, y la preservación de la membrana y de la FRR son especialmente importantes. El uso de soluciones de aminoácidos reduce la carga nocturna de glucosa. Los cambios deben ser cortos, pero teniendo en cuenta los tiempos de permanencia58. En general, programar permanencias inferiores a 60 min genera períodos largos de infusión y drenaje, y aumenta la carga de glucosa peritoneal sin mejorar (incluso puede empeorar) la eficiencia en términos de UF. Durante el día, un cambio largo con poliglucosa o un período seco total o parcial pueden resultar apropiados.
En los pacientes sin FRR se hacen precisas pautas más eficaces de UF, aunque el objetivo de preservación de la membrana sigue vigente. Dos tipos de estrategia pueden aumentar la eficacia de la UF en este contexto. Uno de ellos consiste en modular volúmenes y permanencias de los cambios nocturnos, la llamada DP adaptada59, que alterna cambios de mayor permanencia y volumen para mejorar la depuración, con otros de permanencia más corta y menor volumen, que intentan maximizar la UF. Una correcta utilización del período diurno ayuda también a mejorar la UF. Un cambio largo con icodextrina, asociado a un cambio suplementario corto, parece proporcionar tasas de UF y extracción de sodio óptimas60,61 y podría resultar más eficiente que las estrategias que buscan una UF intensiva nocturna62.
Aunque se han intentado algunas estrategias farmacológicas para mejorar la capacidad de UF, ninguna de ellas ha alcanzado la práctica clínica. Los intentos, ya veteranos, para reducir la reabsorción linfática con neostigmina63, fosfatidilcolina64 o betanecol65, han resultado una vía muerta en el plano clínico. Por otra parte, la estimulación de la actividad de acuaporinas con esteroides, acetazolamida u otras arilsulfonamidas ha ofrecido algunos resultados alentadores en estudios experimentales, pero necesita más pruebas de aplicabilidad clínica66.
En resumen, la baja capacidad de UF al inicio de DP tiene un trasfondo heterogéneo de naturaleza habitualmente funcional. Representa un problema clínico habitualmente benigno, lo que no disminuye la necesidad de medidas que faciliten su reversibilidad y permitan un adecuado control de volumen en los pacientes afectados.
Conflictos de interés
MPF y ARC han realizado labores remuneradas de consultoría, y recibido soporte económico para desplazamientos a congresos médicos por parte de Baxter Renal® y Fresenius Medical Care®. Los demás autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Conceptos clave
1. La baja capacidad de UF al inicio de DP es un trastorno de base heterogénea, cuyo manejo exige una adecuada caracterización.
2. La PEP al 3,86/4,25% y una correcta valoración clínica son los instrumentos esenciales para esa caracterización.
3. Errores en la PEP, mala información sobre balances en entorno clínico, malfunción de catéter y fugas de dializado son causas frecuentes de errores transitorios en el diagnóstico.
4. Seguramente, algunos pacientes presentan baja capacidad de UF al inicio de DP como variante de la normalidad (el trastorno se define por un límite arbitrario).
5. En su forma más típica, el fallo inicial de UF es un trastorno funcional, en ocasiones de base inflamatoria, mediado por una superficie capilar aumentada y una elevada tasa de reabsorción linfática, y reversible, al menos en parte, en la mayoría de los casos.
6. No se deben manejar la capacidad baja de UF y el transporte rápido de solutos pequeños de manera intercambiable, aunque el segundo sea una causa principal de la primera.
7. La protección de la FRR y la membrana peritoneal son objetivos especialmente importantes en estos pacientes, ya que facilitan el manejo y, potencialmente, la reversibilidad del trastorno.
8. Consejo dietético, diuréticos de asa, icodextrina y regímenes individualizados de DP automatizada son las mejores herramientas para mejorar el control de volumen en estos pacientes.
Correspondencia:
Miguel Pérez Fontán
Servicio de Nefrología. Hospital Universitario de A Coruña.
Xubias, 84.
15006 A Coruña (España).
Miguel.Perez.Fontan@sergas.es