La nefritis lúpica (NL) es una manifestación grave del lupus eritematoso sistémico que puede llevar a una enfermedad renal terminal. La mayor parte de los datos clínicos y pronósticos que manejamos, y sobre los que tomamos decisiones terapéuticas, proceden de cohortes internacionales con importantes diferencias étnicas y relativas al pronóstico renal. Para conocer los datos clínicos y pronósticos de los pacientes con NL en España se realizó una búsqueda bibliográfica de artículos relacionados con la NL publicados por autores españoles en revistas nacionales e internacionales entre 2005 y 2022. Las referencias seleccionadas mostraron que la biopsia no solo es clave en el diagnóstico de la NL, sino que su repetición puede ser útil en el seguimiento. En cuanto al tratamiento el abordaje estándar de la NL consiste en una fase de inducción y una fase de mantenimiento. Sin embargo, la aparición de nuevos fármacos ha motivado que se postule un nuevo paradigma de tratamiento en una sola fase continuada y personalizada.
Lupus nephritis (LN) is a serious manifestation of systemic lupus erythematosus that can lead to end-stage renal disease. Many clinical and prognostic data on which our therapeutic decisions are based come from international cohorts, which have important ethnic and prognostic differences. To identify clinical and prognostic data from patients with LN in Spain, we undertook a bibliographic search of LN-related papers by Spanish authors and published in national and international journals between 2005 and 2022. According to the selected references, renal biopsy is not only essential for LN diagnosis but its repetition can be useful for the follow-up. Regarding LN treatment, standard strategy consists of an induction phase and a maintenance phase. However, as new drugs have been released, a new paradigm of treatment in a single, continuing and personalized phase has been proposed.
- •
La nefritis lúpica afecta a entre el 35% y el 75% de los pacientes con LES.
- •
Alrededor del 32% de los pacientes con NL no responde satisfactoriamente al tratamiento estándar.
- •
La aparición de nuevos fármacos supone un cambio de paradigma en el abordaje terapéutico.
- •
La rebiopsia podría ser útil para mejorar el pronóstico de la enfermedad.
La nefritis lúpica (NL) es una manifestación grave y frecuente del lupus eritematoso sistémico (LES) causada por el depósito renal de inmunocomplejos1. Afecta a un alto porcentaje de los pacientes con LES, desde el 35-50%2 hasta el 75%3, según la población estudiada y los criterios y métodos diagnósticos empleados3. Suele manifestarse en la primera década de evolución del LES2 y es más frecuente en mujeres4.
La NL se asocia a una morbilidad y mortalidad importantes2. Múltiples factores demográficos, clínicos y serológicos influyen en la evolución de la NL, tanto en la respuesta al tratamiento como en la aparición de brotes y la progresión a una enfermedad renal terminal (ERT)5. Entre los factores asociados a ERT destacan el sexo masculino, la menor edad de inicio y la etnia africana, asiática o hispanoamericana4, así como la presencia de marcadores inmunológicos como los anticuerpos anti-C1q4. También se han identificado varios genes que predisponen a desarrollar una NL, así como factores desencadenantes ambientales, hormonales y epigenéticos1. El diagnóstico y el tratamiento precoces son clave para evitar la progresión a una ERT6.
Según los datos del registro de pacientes con LES de la Sociedad Española de Reumatología (registro RELESSER) en 2016, la eficacia de los tratamientos de la NL era insuficiente. Un 31,7% de los pacientes con NL no presentó una respuesta completa al tratamiento estándar, con enfermedad renal activa en el 17,9% y desarrollo de una ERT en el 10,35% de los pacientes. De estos últimos el 45% necesitó un trasplante renal7. Sin embargo, en los últimos años el diagnóstico y especialmente el tratamiento de la NL han experimentado una serie de cambios gracias a la investigación de la fisiopatología de la NL y al desarrollo de nuevos fármacos.
El objetivo de nuestro trabajo es conocer los datos clínicos y pronósticos de los pacientes con NL en España, así como la evolución del diagnóstico y las estrategias terapéuticas en la NL, según se refleja en publicaciones de autores españoles.
MétodosEn marzo de 2022 se buscaron los artículos relacionados con la NL, publicados por autores españoles entre 2005 y 2022 e indexados en las bases de datos PubMed, Science Direct, MEDES y SciELO. En líneas generales la estrategia de búsqueda se basó en las palabras clave «lupus» y «nephritis OR nephropathy» en el título o el abstract, junto con «Spain[Affiliation]». Un ejemplo de búsqueda en PubMed fue «((lupus[Title/Abstract]) AND (nephritis[Title/Abstract] OR nephropathy[Title/Abstract])) AND (Spain[Affiliation]) Filters: from 2005–2022».
Se obtuvieron 327 referencias con al menos un autor español con filiación en España. Las referencias fueron introducidas en un gestor bibliográfico, lo que permitió detectar y eliminar las repetidas. A continuación se tabularon las referencias y se pasaron a una hoja de Excel, resúmenes incluidos. Se excluyeron las publicaciones de autores españoles con filiación fuera de España, los resúmenes de congresos, los informes de casos y los artículos dedicados exclusivamente a pacientes con LES pediátrico. Finalmente, se seleccionaron 195 referencias, de las cuales solo se incluyeron las publicaciones referentes a diagnóstico y tratamiento de la NL, así como algunos estudios epidemiológicos para determinar el perfil de los pacientes con NL en nuestro país.
ResultadosPerfil clínico de los pacientes adultos con nefritis lúpica en EspañaLa mayor fuente de información de las características de los pacientes con NL en España es el registro RELESSER. De 3.575 pacientes con LES 1.092 (30,5%) presentaban una NL confirmada con biopsia renal. Las clases histológicas más frecuentes fueron las proliferativas (iii y iv) (67,3%). En cuanto a las características de los pacientes el 90,2% eran de etnia caucásica y el 85,7% eran mujeres. Sin embargo, el 48% de los pacientes varones incluidos en el registro RELESSER presentó una NL en comparación con un 31% de las mujeres, de manera que el riesgo de NL en los hombres fue casi 3 veces mayor que en las mujeres (OR 2,57 [IC 95%: 2,02-3,29], p<0,001)7. En la cohorte estudiada por el grupo Systemic Lupus International Collaborating Clinics (SLICC), con participación española, la NL también fue más frecuente en los hombres (44,3%) que en las mujeres (29,3%)4. En el registro RELESSER el riesgo de NL también aumentó en los pacientes con LES de inicio temprano, antes de los 16 años, siendo más de 6 veces mayor que en los pacientes con inicio después de los 50 años (OR 6,06 [IC 95%: 4,29-8,56], p<0,001). Asimismo, el riesgo en los pacientes hispanoamericanos casi duplicó el de los pacientes caucásicos (OR 1,85 [IC 95%: 1,37-2,51], p<0,001)7.
Con respecto al pronóstico renal el 68% de los pacientes con NL del registro RELESSER presentó una respuesta completa al tratamiento, definida como la normalización del análisis de orina y de la creatinina sérica. Sin embargo, el 10,35% de los pacientes desarrolló una ERT, definida según uno o más de los criterios siguientes: el índice de daño del SLICC y el American College of Rheumatology, la necesidad de diálisis y la de trasplante renal. El grupo de pacientes con ERT tuvo una alta morbimortalidad. En comparación con los pacientes sin afectación renal, los pacientes con NL tuvieron un riesgo de episodios cardiovasculares y cerebrovasculares más de 2 veces mayor (OR 2,69 [IC 95%: 1,4-3,44], p<0,001) y un riesgo de mortalidad más de 3 veces mayor (OR 3,7 [IC 95: % 2,58-4,95], p<0,001)7. El pronóstico renal en la NL se estudió también con los datos de 1.648 pacientes con diagnóstico histológico de NL incluidos en el Registro Español de Glomerulonefritis de la Sociedad Española de Nefrología (S.E.N.). Se determinó que los principales factores de riesgo de ERT son la edad (p<0,001), el sexo masculino (p=0,005), la hipertensión arterial (p<0,001) y los subtipos histológicos de NL III y IV (p=0,009), además de una proteinuria elevada (p<0,001). En los pacientes con una tasa de filtrado glomerular estimada (TGFe)<60ml/min/1,73m2, la media de la proteinuria fue de 4,3±3,1g/d, mientras que en aquellos con una TGFe≥60ml/min/1,73m2 la proteinuria fue de 3,2±2,7g/d (p<0,001)8. Además, se ha relacionado un mal pronóstico de la función renal con datos de la biopsia renal como el grado de inflamación tubulointersticial9 y la fibrosis tubulointersticial1. En cambio, una proteinuria <0,7-0,8g/d a los 12 meses de tratamiento indica un buen pronóstico, como ocurrió en los estudios Euro-Lupus10 y MAINTAIN11, ambos con participación española.
Debe tenerse en cuenta que algunos factores genéticos aumentan el riesgo de NL12, especialmente en los pacientes de etnia afroamericana, asiática e hispanoamericana en comparación con los pacientes de etnia caucásica12. Otros factores, como los culturales y los socioeconómicos13, influyen también en el riesgo de NL. Por lo tanto, la heterogeneidad de la población española con respecto a la etnia y otros factores demográficos puede condicionar la práctica clínica en nuestro país. En España, a partir de 1996, ha habido un aumento progresivo y estadísticamente significativo (p<0,001) de los pacientes de ascendencia hispanoamericana7, que en 2016 representaban un 7,5% de los pacientes con NL en el registro RELESSER7. La población con NL que no era caucásica ni de origen hispanoamericano suponía solo un 2,4% del total de pacientes7. Sin embargo, el incremento de la etnia hispanoamericana podría conllevar una mayor incidencia de la NL en España en los próximos años.
Diagnóstico de la nefritis lúpicaDebido a la variabilidad de la presentación clínica del LES y la NL es fundamental que diferentes especialistas se impliquen en la atención de estos pacientes2. Este enfoque holístico y multidisciplinar es el recomendado en la guía europea de 201914 y es el utilizado en España, donde los autores de las publicaciones sobre NL proceden principalmente de unidades de nefrología, reumatología, enfermedades autoinmunes sistémicas, medicina interna, anatomía patológica e inmunología. La participación de distintos especialistas queda también reflejada en el documento de consenso sobre diagnóstico y tratamiento de la NL publicado por el Grupo de Enfermedades Autoinmunes Sistémicas de la Sociedad Española de Medicina Interna (SEMI) y de la S.E.N. en 201215, así como en el protocolo de diagnóstico y tratamiento de la NL del Hospital Clínic de Barcelona16.
En la guía conjunta de la Liga Europea contra el Reumatismo, la Asociación Renal Europea y la Asociación Europea de Trasplante y Diálisis (EULAR/ERA-EDTA), en la que participaron autores españoles, se recomienda sospechar una NL ante un paciente con LES que presente signos de afectación renal como hematuria glomerular (cilindros, hematíes dismórficos), proteinuria>0,5g/d, disminución de la TGFe o aumento de la creatinina14. Además, se debe vigilar la aparición de signos de afectación renal en pacientes con LES y factores de riesgo mencionados anteriormente17. En el documento de consenso del Grupo de Estudio de Enfermedades Glomerulares de la S.E.N. (GLOSEN) recientemente publicado se recomiendan análisis periódicos de orina en todos los pacientes con LES, aunque con mayor frecuencia (al menos cada 6 o 12 meses) en los pacientes que además presentan factores de riesgo de NL18.
Un elemento esencial para mejorar el diagnóstico de la NL es la búsqueda de nuevos biomarcadores que evalúen la actividad de la NL y detecten brotes subclínicos para determinar la respuesta al tratamiento. Estos biomarcadores podrían sustituir a la biopsia renal19. Los biomarcadores tradicionales, como la creatinina sérica, la hematuria y la proteinuria son poco específicos y se utilizan desde hace más de 30 años20.
Se han investigado numerosas moléculas, aunque los resultados de los estudios han permitido descartar diversas citocinas Th1, Th2 y Th17 y factores de crecimiento como posibles biomarcadores en la NL21. La aportación española al campo de los posibles biomarcadores urinarios en la NL incluye la proteína quimiotáctica de monocitos 1 (MCP-1)1,21,22, TWEAK23–25 y los microARN exosómicos urinarios26, entre ellos el miR-146a27,28. También varios tipos de autoanticuerpos, cadenas ligeras libres y componentes del complemento como otros ejemplos de potenciales biomarcadores en orina29. Se están estudiando también marcadores inmunológicos en suero20.
Los parámetros clínicos y analíticos habituales generalmente no bastan para determinar las alteraciones histológicas renales18. Por este motivo, la confirmación del diagnóstico de la NL se obtiene mediante una biopsia renal, tal como se recomienda en los documentos españoles15,18 e internacionales14. La práctica de una segunda biopsia o rebiopsia en pacientes en tratamiento activo podría ser útil en algunos casos18.
Abordaje terapéutico de la nefritis lúpicaObjetivos del tratamientoEl tratamiento de la NL tiene como objetivos la estabilización o mejoría de la función renal y la reducción de la proteinuria en al menos un 25% a los 3 meses y un 50% a los 6 meses, además de una respuesta clínica completa, definida como un cociente proteína/creatinina en orina de 24horas (UPCR)<500-700mg/g a los 12 meses de iniciar el tratamiento. Si la proteinuria inicial está dentro del rango nefrótico, el tratamiento podría ser necesario durante 6-12 meses más14. En los documentos españoles se incluyen criterios similares aunque con ligeras variantes. En el documento de consenso del grupo GLOSEN se define «remisión completa» como la presencia de una proteinuria ≤0,5g/24h o UPCR≤0,5g/g, un sedimento urinario inactivo (≤5hematíes/campo), una albúmina sérica ≥3,5g/dl y una TGFe normal o ≤10% inferior al medido antes del brote18. A su vez, en el protocolo del Hospital Clínic de Barcelona se establecen los criterios de respuesta renal completa siguientes: una función renal normal (o una TFG con una variación±15% con respecto al inicial en caso de disfunción renal previa), una proteinuria ≤0,5g/d, un sedimento inactivo y una albúmina sérica>3g/d18.
Asimismo, el tratamiento de la NL debería aumentar la supervivencia de los pacientes, prevenir o retrasar la ERT, evitar los brotes y mejorar la calidad de vida de los pacientes. El tratamiento debe tener la mejor tolerabilidad posible y ha de incluir el manejo de las comorbilidades14. Sin embargo, menos del 50% de los pacientes presentan una respuesta completa a los 12 meses de tratamiento con inmunosupresores y corticoesteroides1.
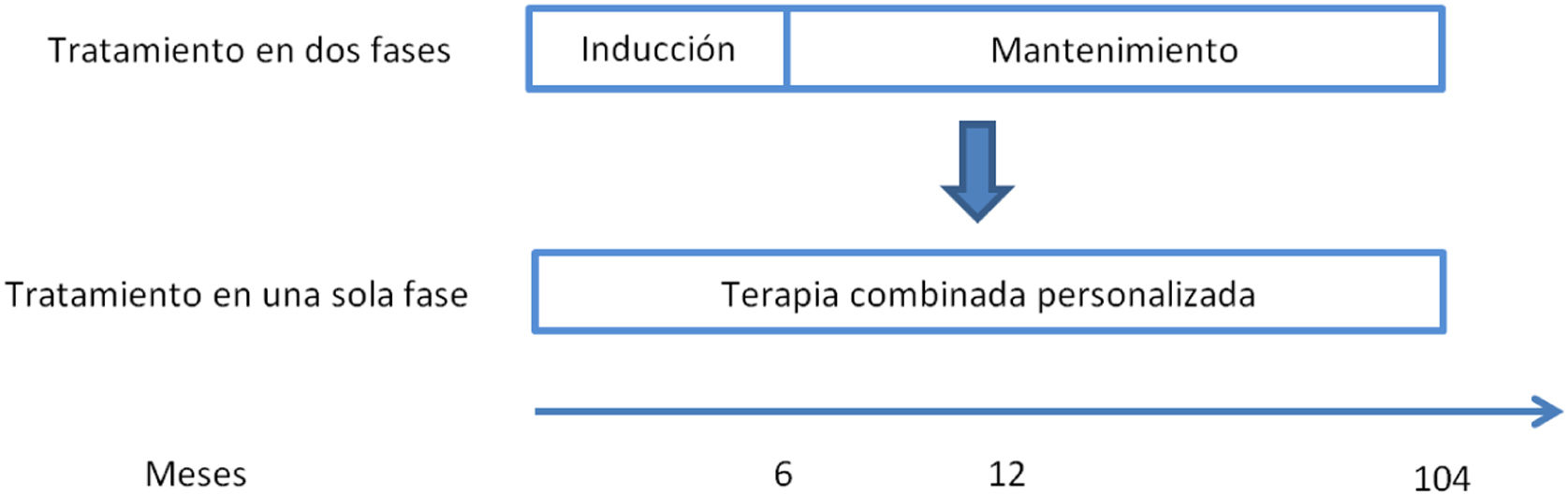
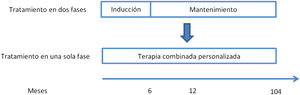
Evolución del tratamiento de la nefritis lúpicaHasta 2021 el tratamiento de la NL era secuencial, con una fase de inducción y una fase de mantenimiento. La fase de inducción tiene una duración de 3 a 6 meses y sus objetivos son revertir la inflamación renal y controlar la respuesta autoinmune. Los objetivos de la fase de mantenimiento, que es de larga duración, son controlar la autoinmunidad, mantener la remisión y prevenir los brotes. En la figura 1 se presenta un resumen de la evolución del tratamiento de la NL de clases iii y iv entre 2005 y 2021, incluyendo los fármacos empleados y sus dosis30.
Resumen de la evolución del tratamiento de la NL de clases iii-iv (±clase v): de un abordaje en 2 fases a una triple terapia personalizada.
AZA: azatioprina; CE: costicoesteroides; CYC: ciclofosfamida; MMF: micofenolato mofetilo (para todas las dosis de MMF, también se contempla una dosis equivalente de micofenolato sódico); MP: metilprednisolona; P: prednisona; TFGe: tasa de filtración glomerular estimada.
Reproducida de Moriano Morales et al.30.
El tratamiento en 2 fases, con una fase de inducción con corticoesteroides y micofenolato de mofetilo (MMF) o ciclofosfamida (CYC) y una fase de mantenimiento con corticoesteroides y MMF o azatioprina (AZA), se ha mantenido a lo largo de los años. No obstante, las dosis recomendadas han ido variando y se han reducido notablemente las dosis de corticoesteroides empleadas (fig. 1)30.
Las guías y los protocolos actuales recomiendan iniciar tratamiento con MMF o ácido micofenólico (AMF) o con dosis bajas de CYC (pauta Euro-Lupus) en los pacientes con NL grados iii y iv. En caso de proteinuria en rango nefrótico puede administrarse una combinación de MMF (o AMF) y un inhibidor de la calcineurina, preferiblemente tacrolimus. Todos los pacientes deben recibir hidroxicloroquina salvo contraindicación16,18,30.
En cuanto a los corticoesteroides, tanto en España como en los demás países se han usado en diferentes pautas de administración31,32. Actualmente, uno de los puntos clave del tratamiento de la NL es minimizar su dosis todo lo posible para evitar su toxicidad, que depende de la dosis administrada y de la dosis acumulada33. En el consenso de la SEMI y la S.E.N. de 2012 se recomendó iniciar la corticoterapia con prednisona a dosis ≤1mg/kg/d, con una dosis máxima de 60mg/d, aunque se planteó el uso inicial de dosis inferiores (≤0,5mg/kg/d) junto con pulsos de metilprednisolona15. El manejo actual de pacientes con NL se centra en utilizar la menor dosis posible de corticoesteroides y se han sugerido algunos esquemas terapéuticos como pulsos de metilprednisolona en los brotes moderados y graves, seguidos de prednisona oral y reducción rápida de dosis en unas 24 semanas hasta ≤5mg/d como dosis de mantenimiento a partir del quinto mes34. Otra alternativa podría ser la administración de 0,5mg/kg de prednisona sin pulsos previos de corticoesteroides, con una eficacia similar a la de pulsos de metilprednisolona y 1mg/kg/d de prednisona, pero con menos efectos adversos35. La minimización de la dosis de corticoesteroides también se recomienda en el documento de consenso del grupo GLOSEN, donde se sugiere administrar pulsos IV de metilprednisolona (250-500mg/día) durante 3 días consecutivos, y a continuación una pauta de mantenimiento con dosis reducida ≤5mg/d18, como ya se había recomendado en el consenso español de 201215. En el protocolo del Hospital Clínic de Barcelona, los bolos iniciales de metilprednisolona son de 125-500mg/d durante 3 días y a continuación prednisona oral a dosis decrecientes hasta 5mg/d a partir de la semana 14. Sin embargo, esta pauta de reducción puede variar según los síntomas extrarrenales del LES16.
Nuevas terapiasSe necesitan nuevos tratamientos que permitan alcanzar respuestas renales completas, frenar la progresión de la afectación renal en el LES a una ERT y aumentar la supervivencia de los pacientes1,5,20. Se ha descrito que casi un 30% de pacientes con NL no responde al tratamiento estándar o presenta problemas de seguridad y toxicidad36. En un estudio internacional con participación española, publicado en 2015, la NL todavía se asoció a ERT y muerte4.
En consecuencia, se han desarrollado nuevas terapias que podrían cambiar la manera de abordar la enfermedad. La diferenciación entre tratamiento de inducción y tratamiento de mantenimiento podría incluso desaparecer con el uso de estos nuevos fármacos30. Uno de ellos es el belimumab, un biológico aprobado en 2021 por la Agencia Europea del Medicamento para el tratamiento de la NL activa37. El belimumab es un anticuerpo monoclonal humano IgG1λ que se une específicamente a la forma soluble de la proteína estimuladora de linfocitos B humanos (BLyS), un activador de los linfocitos B cuyo nivel aumenta en los pacientes con LES. BLISS-LN fue un estudio internacional fase iii de belimumab en el que participaron 3 centros españoles. Se incluyó a 448 pacientes con NL que recibieron 10mg/kg de belimumab por vía intravenosa o placebo, además del tratamiento estándar con corticoesteroides y CYC o MMF en la fase de inducción seguidos de AZA o MMF, respectivamente, en el tratamiento de mantenimiento. Después de 2 años de seguimiento la adición de belimumab al tratamiento estándar mejoró significativamente los resultados, con mayores porcentajes de pacientes con respuesta renal (p=0,03) y respuesta renal completa (p=0,02) en comparación con el placebo. Además, los pacientes tratados con belimumab tuvieron un riesgo menor de desarrollar un acontecimiento renal o muerte con respecto a aquellos tratados solo con la terapia estándar (p = 0,001). En la guía europea de la EULAR/ERA-EDTA de 2019, previa a la publicación del estudio BLISS-LN, se menciona belimumab como posible estrategia en pacientes con NL y respuesta insuficiente al tratamiento estándar14. El belimumab ya está incluido en las recomendaciones españolas actuales desde la inducción para algunos perfiles de pacientes16,18,30.
Otro nuevo fármaco es la voclosporina, un inhibidor de la calcineurina de nueva generación que no requiere monitorizar las concentraciones valle38. Su eficacia se demostró en el estudio fase iii con participación española AURORA, donde se añadió voclosporina 23,9mg/12h o placebo al tratamiento estándar con corticoesteroides y MMF a 358 pacientes con NL activa. Después de 52 semanas el porcentaje de pacientes con respuesta renal completa fue superior (p<0,001) en el grupo tratado con voclosporina39. En las recomendaciones españolas actuales se contempla el uso de este inhibidor de la calcineurina16,18,30.
Numerosas moléculas están en estudio con intervención de investigadores españoles. Entre ellas, el obinutuzumab (un anticuerpo monoclonal anti-CD20)40 y el bortezomib (un inhibidor del proteasoma)41.
Nuevo paradigma en el tratamiento de la nefritis lúpicaLa disponibilidad de estos nuevos fármacos ha hecho posible que se postule un tratamiento de la NL de clases iii y iv (±clase v) en una sola fase continuada con una terapia combinada y personalizada desde el inicio20,30 (fig. 2). La triple terapia, consistente en añadir el belimumab o un inhibidor de la calcineurina como la voclosporina a la terapia estándar habitual de la NL (un corticoesteroide y un inmunosupresor), podría ofrecer mejores resultados16,18,30.
Otras estrategias para aumentar la supervivenciaPara reducir el riesgo de complicaciones de la NL y la mortalidad se recomiendan modificaciones del estilo de vida como aumentar la actividad física, reducir el índice de masa corporal, abandonar el hábito tabáquico y regular la ingesta de sodio16,18. Además, es fundamental controlar comorbilidades como la hipertensión arterial y las dislipidemias, seguir el calendario vacunal y prevenir la osteoporosis16,18.
Una estrategia en auge que puede aumentar la supervivencia en pacientes con NL es la rebiopsia o biopsia renal repetida. Esta prueba es útil para la evaluación de la NL resistente al tratamiento y para el diagnóstico de los brotes de NL42. También puede aportar información sobre la evolución de la enfermedad43, como el avance de la fibrosis renal o de la inflamación tubulointersticial44. La rebiopsia también puede ayudar a la toma de decisiones terapéuticas45, como una posible retirada del tratamiento ante la remisión de la NL46. También se usa en ensayos clínicos para evaluar la eficacia de los fármacos en estudio47.
La utilidad de la rebiopsia renal en pacientes con NL se ha evaluado en 2 estudios realizados en España en los últimos años. Piñeiro et al. describieron cómo con una rebiopsia renal pudo diferenciarse entre remisión clínica y remisión histológica en 35 pacientes con NL. Se observaron lesiones proliferativas en la rebiopsia renal de 5 de los 11 pacientes con respuesta parcial y de todos los pacientes que no respondieron al tratamiento. En cambio, no se hallaron lesiones proliferativas en las biopsias de los 21 pacientes con respuesta completa45. En el trabajo de Morales et al. se realizó una biopsia renal a 107 pacientes con NL y, transcurridos una media de casi 6 años, en 27 de ellos se repitió el procedimiento por indicación clínica. Debido a los resultados de la rebiopsia se cambió la clasificación de la NL en el 73,1% de los pacientes, de manera que en un 38,4% la NL se reclasificó como de clase superior, y en un 34,6% como de grado inferior. Por clases de NL el 75% de las NL de clase ii en la primera biopsia pasaron a claseiii/iv+v en la rebiopsia, mientras que solo el 16,6% de las NL proliferativas en la primera biopsia se reclasificaron como mixtas o sin lesiones proliferativas en la rebiopsia. Por lo tanto, rebiopsiar tuvo un impacto importante en la clasificación de la NL en estos pacientes. Además, se observó un aumento estadísticamente significativo de la glomeruloesclerosis, la fibrosis intersticial, la atrofia tubular y el índice de cronicidad, especialmente en los pacientes que evolucionaron a ERT. En estos pacientes la tasa de glomeruloesclerosis en la primera biopsia fue mayor y la tasa de remisión completa a los 12 meses de tratamiento fue menor en comparación con los demás pacientes43. En ambos estudios la rebiopsia renal fue útil en el seguimiento y para reorientar el tratamiento. Esta estrategia permitió intensificar o reducir el tratamiento en algunos casos y mantener la actitud terapéutica solo en el 17% de los pacientes del estudio de Piñeiro et al.45 y en el 19% de los del estudio de Morales et al43. Se espera que los resultados del estudio europeo con participación española ReBioLup (acrónimo en inglés de «biopsia renal repetida por protocolo en nuevos casos de NL») (NCT04449991) sean concluyentes acerca del valor real de la rebiopsia.
Un grupo de investigadores españoles ha propuesto un algoritmo que incluye biomarcadores clínicos, bioquímicos e inmunológicos junto con los resultados de la rebiopsia para decidir la continuación del tratamiento inmunosupresor a largo plazo. A los 36 meses del inicio del tratamiento inmunosupresor, con respuesta completa a los 12 meses, se practica una segunda biopsia. Entonces, si el índice de actividad es igual a 0, se suspende la inmunosupresión, pero si es≥1, se mantiene20.
Sin embargo, una biopsia es una técnica invasiva, por lo que se están estudiando métodos alternativos para la evaluación de la fibrosis renal y el riesgo de IRC, por ejemplo la resonancia magnética o la microscopía confocal ex vivo, junto con técnicas informáticas y de anatomía patológica digital44 o el uso de nuevos biomarcadores48.
ConclusionesLa actividad investigadora desarrollada en España sobre la NL nos ha proporcionado datos propios y característicos de la población a la que atendemos, lo que nos permitirá mejorar tanto el proceso diagnóstico como las decisiones terapéuticas. El diagnóstico y tratamiento precoces de la NL son importantes para evitar que la enfermedad renal progrese hasta una fase terminal. La implementación de una terapia combinada personalizada, en lugar de las clásicas fases de inducción y mantenimiento, parece ser el futuro del manejo de la NL. El desarrollo de nuevos fármacos en el LES es clave para modificar la estrategia terapéutica en la NL y mejorar el pronóstico de estos pacientes.
FinanciaciónEste trabajo ha contado con la financiación de GSK. Los autores declaran no haber recibido ninguna retribución.
Conflicto de interesesCSR es empleada de la compañía GSK. ER, CL y DB declaran no tener conflicto de intereses.
A Content Ed Net, que proporcionó asistencia editorial en la redacción de este artículo.