El ejercicio físico podría ofrecer múltiples beneficios al paciente con enfermedad renal crónica (ERC). No obstante, tradicionalmente no se recomendaba por la posibilidad de deteriorar la función renal y aumentar la proteinuria. El objetivo del estudio es revisar los ensayos sobre ejercicio en pacientes con ERC y describir su impacto sobre la progresión de la enfermedad renal y otros factores asociados. Se seleccionaron ensayos clínicos aleatorizados desde 2007 a 2018, en inglés y en español, que compararan un grupo intervención con un componente de ejercicio con un grupo control sin ejercicio físico en pacientes con ERC en prediálisis. Para la búsqueda se emplearon las bases de datos PubMed, Scopus, Embase, Ovid (Medline) y PEDro. Los efectos del ejercicio sobre las variables analizadas se resumieron calculando la diferencia de medias estandarizada (DME). No se encontraron diferencias en el filtrado glomerular ni en la proteinuria entre el grupo intervención y el grupo control (DME: −0,3; p=0,81; DME: 26,6; p=0,82). Se obtuvieron efectos positivos sobre el consumo pico de oxígeno (DME: 2,5; p<0,001), la capacidad funcional (DME: 56,6; p<0,001), la fuerza en miembros superiores (DME: 6,8; p<0,001) y la hemoglobina (DME: 0,3; p=0,003). También se evidenció mejoría sobre la calidad de vida usando los cuestionarios KDQOL-36 (DME: 3,56; p=0,02) y SF-36 (DME: 6,66; p=0,02). En conclusión, la práctica de ejercicio de forma rutinaria y a baja intensidad no tiene impacto negativo sobre la función renal. Por el contrario, mejora la capacidad aeróbica y funcional, repercutiendo positivamente en la calidad de vida.
Physical exercise may offer multiple benefits to patients with chronic kidney disease (CKD). However, it was not traditionally recommended because of the possibility of impairing renal function and increasing proteinuria. The objective of this study is to review the clinical trials on physical exercise in patients with CKD and describe its effect on the progression of kidney disease and other factors associated. Randomized clinical trials (RCT) comparing an intervention that included an exercise component with a control group without physical exercise in non-dialysis patients with CKD from 2007 to 2018 in English and Spanish were included. PubMed, Scopus, Embase, Ovid (Medline) and PEDro databases were used for the search. Effects of physical exercise were summarized by the standardized mean difference (SMD). No differences were found in glomerular filtration rate or proteinuria between the intervention group and the control group: SMD −0.3 (P=.81); SMD 26.6 (P=.82). Positive effects were obtained on peak oxygen consumption: SMD 2.5 (P<.001), functional capacity: SMD 56.6 (P<.001), upper limb strength: SMD 6.8 (P<.001) and hemoglobin: SMD 0.3 (P=.003). An improvement on the quality of life was also evident using the KDQOL-36 survey: SMD 3.56 (P=.02) and the SF-36 survey: SMD 6.66 (P=.02). In conclusion, the practice of low-intensity physical exercise routinely has no negative impact on renal function. On the contrary, it improves aerobic and functional capacity, impacting positively on the quality of life.
La enfermedad renal crónica (ERC) representa un estado de importante estrés oxidativo, proinflamatorio y de malnutrición. Esto conlleva la acumulación de productos de desecho del metabolismo y alteraciones en la homeostasis que afectan a muchos órganos diana, entre los que se encuentra el aparato cardiovascular, lo que conduce gradualmente a la reducción de la capacidad física y aumenta la mortalidad1-3. También se producen alteraciones a nivel del aparato locomotor, como osteoporosis y pérdida de masa muscular4. La sarcopenia se encuentra presente desde fases tempranas de la enfermedad y su prevalencia aumenta en fases más avanzadas, correlacionándose con una mayor mortalidad, discapacidad y aumento del riesgo de caídas, fracturas y hospitalización5-7.
Tradicionalmente la práctica de ejercicio físico no se recomendaba a los pacientes con ERC por la posibilidad de deteriorar la función renal y aumentar la proteinuria8. Hoy se conoce que el sedentarismo puede ser tanto causa como consecuencia de progresión de la enfermedad renal, de modo que el ejercicio físico se ve reducido a medida que disminuye el filtrado glomerular. Este es un punto clave en el que se debe intervenir, ya que es un factor modificable con un claro impacto en la supervivencia de estos pacientes9,10.
Dentro de las recomendaciones de salud se aconseja incluir el ejercicio físico regular desde estadios iniciales, lo cual mejora la condición física y psicológica a la vez que reduce la mortalidad, ofreciendo una mayor calidad de vida4,10. No obstante, a pesar de que los beneficios de la práctica de ejercicio en los pacientes con ERC parecen evidentes, aún no queda claro qué parámetros relacionados con la ERC se ven mejorados por el ejercicio físico, cuál es el mejor programa de entrenamiento, ni se encuentra de forma rutinaria dentro del manejo integrado de estos pacientes9-11.
El objetivo principal del presente trabajo es revisar sistemáticamente los estudios sobre ejercicio físico realizados en pacientes con ERC que no precisan aún tratamiento renal sustitutivo (TRS) y describir el impacto del ejercicio físico sobre la progresión de la enfermedad renal. Como objetivo secundario se revisó el efecto del ejercicio físico sobre los factores de riesgo cardiovascular, la condición física, la calidad de vida y la mortalidad.
Material y métodosFuente de datos y estrategia de búsquedaPara la búsqueda se han empleado las bases de datos PubMed, Scopus, Embase, Ovid (MEDLINE) y PEDro. Se introdujeron como palabras clave «exercise», «physical activity», «physical exercise», «physical function», «resistance training», «quality of life», «randomized controlled trial», «chronic kidney disease». Se incluyeron todos los términos anteriores y sus combinaciones.
Criterios de selecciónSe seleccionaron ensayos clínicos aleatorios (ECA) publicados entre 2007 y 2018, tanto en inglés como en español, que compararan una intervención que incluyera un componente de ejercicios con un control sin ejercicio en pacientes con ERC no en diálisis. Se incluyeron los estudios si los autores usaron palabras como «azar» o «aleatorio» para describir el método de asignación de los sujetos a los grupos. La revisión e inclusión de los artículos citados fue realizada por un único investigador.
Se excluyeron artículos de opinión, comunicaciones a congresos y casos clínicos. Asimismo, se excluyeron ensayos con pacientes en hemodiálisis, diálisis peritoneal o trasplante renal, ensayos que incluyeran pacientes con antecedentes de enfermedades cardiacas (insuficiencia cardiaca descompensada, angina inestable o arritmias), artículos con pacientes con enfermedad pulmonar (enfermedad pulmonar obstructiva crónica, asma bronquial, bronquitis crónica), artículos que incluyeran pacientes con enfermedades neurológicas degenerativas o del aparato locomotor y artículos en idiomas distintos a los citados.
Las intervenciones se clasificaron según la naturaleza de la fase principal del ejercicio: intervenciones aeróbicas o intervenciones aeróbicas combinadas con ejercicios de carga. No se hicieron restricciones de la frecuencia ni de la intensidad del ejercicio, aunque se exigió una duración mínima de 12semanas.
Análisis estadísticoEl análisis de los datos se realizó mediante el programa RevMan Analisys versión 5.3. Los resultados se presentaron como media y desviación estándar con un intervalo de confianza (IC) del 95% para las variables continuas, resumiéndose mediante el cálculo de la diferencia de medias estandarizada (DME). En el caso de las variables cualitativas los resultados se expresaron en frecuencias y odds ratio (OR). Como media se empleó la diferencia entre las medias de las variables pre y postintervención, utilizando la desviación típica posterior a la intervención. Los resultados se presentan mediante «forest plot».
Se evaluó la heterogeneidad entre los ensayos con las pruebas de heterogeneidad I2 y X2. Se consideraron valores de I2>50% y X2<0,1 como indicativos de heterogeneidad significativa. En este caso se empleó para el metaanálisis el modelo de efectos aleatorios. Se consideró estadísticamente significativo un valor p<0,05.
Evaluación de calidadUna vez realizada la búsqueda, se hizo una revisión crítica de la misma para descartar los trabajos que no debían ser incluidos en la revisión (no relacionados con los objetivos y/o criterios metodológicos). Para valorar la calidad metodológica de los ECA utilizamos la escala Jadad, que puntúa los ensayos clínicos de 0 a 5, considerando pobre calidad si la puntuación es inferior a 312.
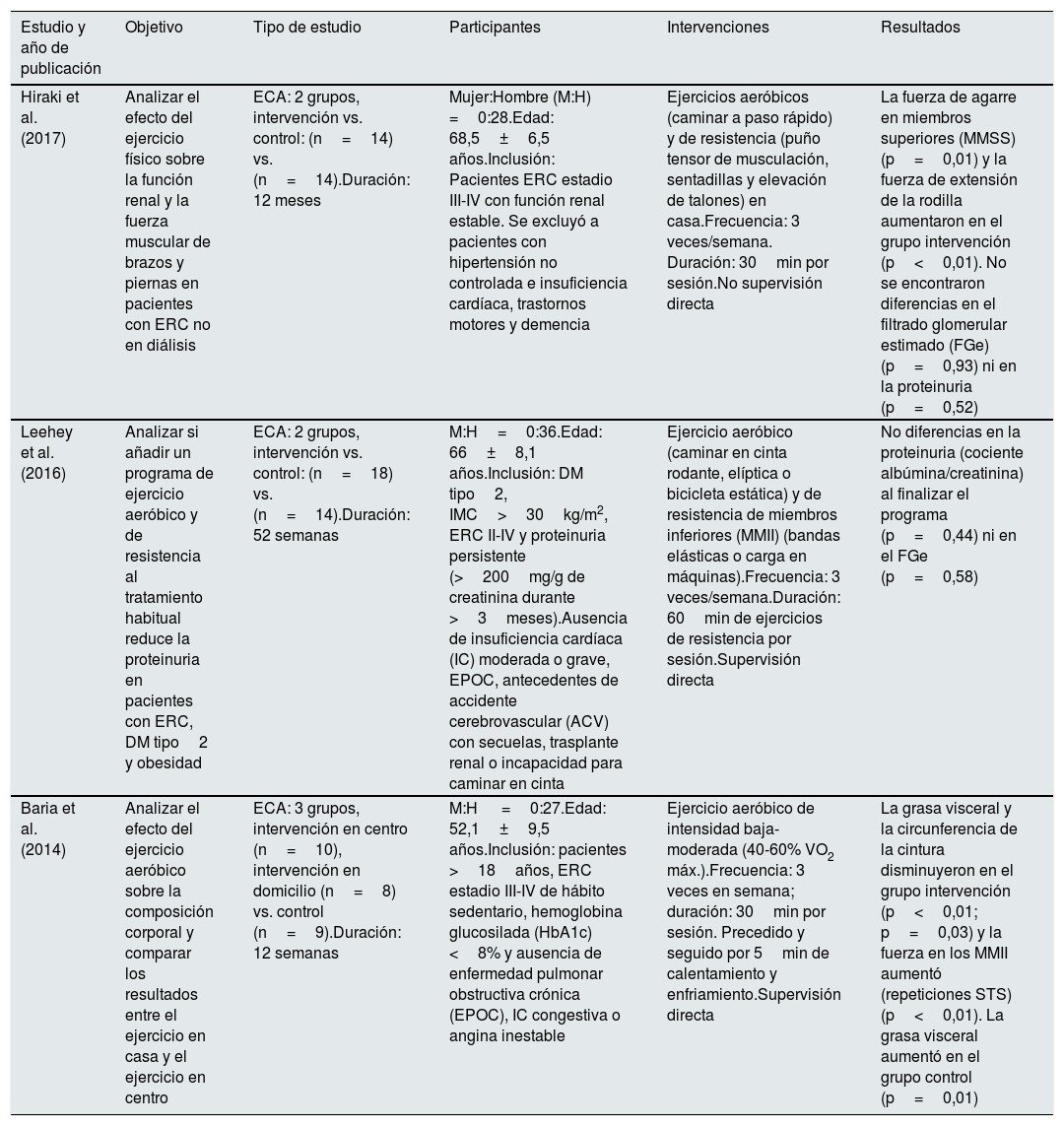
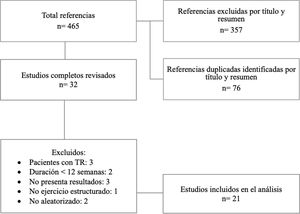
ResultadosDescripción de los estudiosEn total se encontraron 465 referencias con reportes potencialmente útiles: 219 en PubMed, 89 en Scopus, 107 en Embase, 50 en Ovid (MEDLINE) y ninguno en PEDro. Se descartaron 433 artículos. Después de ajustar por registros duplicados a partir de título y resumen, se dejaron para revisar en forma completa 32 reportes. Finalmente se incluyeron 21 estudios para el análisis. La búsqueda para la selección de los estudios incluidos y los motivos de exclusión se muestran en la figura 1. En la tabla 1 se resumen los aspectos principales de los trabajos incluidos.
Características de los estudios incluidos
| Estudio y año de publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Hiraki et al. (2017) | Analizar el efecto del ejercicio físico sobre la función renal y la fuerza muscular de brazos y piernas en pacientes con ERC no en diálisis | ECA: 2 grupos, intervención vs. control: (n=14) vs. (n=14).Duración: 12 meses | Mujer:Hombre (M:H) =0:28.Edad: 68,5±6,5 años.Inclusión: Pacientes ERC estadio III-IV con función renal estable. Se excluyó a pacientes con hipertensión no controlada e insuficiencia cardíaca, trastornos motores y demencia | Ejercicios aeróbicos (caminar a paso rápido) y de resistencia (puño tensor de musculación, sentadillas y elevación de talones) en casa.Frecuencia: 3 veces/semana. Duración: 30min por sesión.No supervisión directa | La fuerza de agarre en miembros superiores (MMSS) (p=0,01) y la fuerza de extensión de la rodilla aumentaron en el grupo intervención (p<0,01). No se encontraron diferencias en el filtrado glomerular estimado (FGe) (p=0,93) ni en la proteinuria (p=0,52) |
| Leehey et al. (2016) | Analizar si añadir un programa de ejercicio aeróbico y de resistencia al tratamiento habitual reduce la proteinuria en pacientes con ERC, DM tipo2 y obesidad | ECA: 2 grupos, intervención vs. control: (n=18) vs. (n=14).Duración: 52 semanas | M:H=0:36.Edad: 66±8,1 años.Inclusión: DM tipo2, IMC>30kg/m2, ERC II-IV y proteinuria persistente (>200mg/g de creatinina durante >3meses).Ausencia de insuficiencia cardíaca (IC) moderada o grave, EPOC, antecedentes de accidente cerebrovascular (ACV) con secuelas, trasplante renal o incapacidad para caminar en cinta | Ejercicio aeróbico (caminar en cinta rodante, elíptica o bicicleta estática) y de resistencia de miembros inferiores (MMII) (bandas elásticas o carga en máquinas).Frecuencia: 3 veces/semana.Duración: 60min de ejercicios de resistencia por sesión.Supervisión directa | No diferencias en la proteinuria (cociente albúmina/creatinina) al finalizar el programa (p=0,44) ni en el FGe (p=0,58) |
| Baria et al. (2014) | Analizar el efecto del ejercicio aeróbico sobre la composición corporal y comparar los resultados entre el ejercicio en casa y el ejercicio en centro | ECA: 3 grupos, intervención en centro (n=10), intervención en domicilio (n=8) vs. control (n=9).Duración: 12 semanas | M:H =0:27.Edad: 52,1±9,5 años.Inclusión: pacientes >18años, ERC estadio III-IV de hábito sedentario, hemoglobina glucosilada (HbA1c) <8% y ausencia de enfermedad pulmonar obstructiva crónica (EPOC), IC congestiva o angina inestable | Ejercicio aeróbico de intensidad baja-moderada (40-60% VO2 máx.).Frecuencia: 3 veces en semana; duración: 30min por sesión. Precedido y seguido por 5min de calentamiento y enfriamiento.Supervisión directa | La grasa visceral y la circunferencia de la cintura disminuyeron en el grupo intervención (p<0,01; p=0,03) y la fuerza en los MMII aumentó (repeticiones STS) (p<0,01). La grasa visceral aumentó en el grupo control (p=0,01) |
| Estudio y año de publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Leehey et al. (2009) | Analizar los efectos del ejercicio físico sobre el sistema cardiovascular y la proteinuria en pacientes diabéticos | ECA: 2 grupos, intervención vs. control: (n=7) vs. (n=6).Duración: 24 semanas | M:H =0:13.Edad: 66 (55-81).Inclusión: pacientes con ERC estadio II-IV, DM tipo2, IMC>30 con proteinuria persistente (>200 mg/g de creatinina durante >3meses) | Ejercicio aeróbico (caminar) de intensidad moderada (50-60% VO2 máx.).Frecuencia: 3 veces/semana. Duración: 30min por sesión. Precedido y seguido por 5min de calentamiento y enfriamiento.Sin supervisión directa | La capacidad aeróbica mejoró en el grupo intervención (mayor duración del ejercicio) (p<0,05). No cambios significativos en las cifras de presión arterial en reposo ni en proteinuria de 24h (p>0,05) |
| Gomes et al. (2017) | Analizar el efecto del ejercicio aeróbico en los marcadores del metabolismo óseo de pacientes con sobrepeso con ERC | ECA: 2 grupos, intervención vs. control: (n=24) vs. (n=14).Duración: 24 semanas | M:H=12:27.Edad: 55,5±8,3 años.Inclusión: Pacientes >18años, ERC estadio III-IV, IMC>25kg/m2. Ausencia de EPOC, insuficiencia cardíaca congestiva o angina inestable | Ejercicio aeróbico de intensidad baja-moderada (40-60% VO2 máx.) sin supervisión (caminar en parques o en la calle), o con supervisión directa (en una cinta rodante).Frecuencia: 3 veces/semana.Duración: 30min por sesión. Incremento de 10min por sesión cada 4 semanas hasta la 8.ª semana.Supervisión/no supervisión | La fosfatasa alcalina fue el único marcador del metabolismo óseo que aumentó en el grupo de intervención (p<0,05).La capacidad funcional mejoró en el grupo intervención (6MWT) (p<0,001), así como la capacidad aeróbica (VO2 máx.) (p<0,001).La función renal no mostró diferencia entre ambos grupos (CKD EPI) (p=0,209) |
| Van Craenenbroeck et al. (2015) | Analizar si un programa de entrenamiento aeróbico mejora la función endotelial periférica | ECA: 2 grupos, intervención vs. control: (n=25) vs. (n=23).Duración: 12 semanas | M.H=18:22.Edad: 53,18±13,0 años.Inclusión: pacientes ERC estadio III-IV y sin enfermedad cardiovascular establecida (enfermedad de las arterias coronarias, enfermedad vascular periférica o enfermedad cerebrovascular) | Programa de ejercicio aeróbico (ciclismo) a intensidad moderada (90% de la frecuencia cardíaca máxima).Frecuencia: 4 sesiones/día.Duración: 10min cada sesión.Supervisión parcial | No diferencias en la función vascular in vivo (dilatación mediada por flujo de la arteria braquial) (p=0,900). La capacidad aeróbica mejoró en el grupo intervención (VO2 máx.) (p<0,001) |
| Estudio y año de publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Aioke et al. (2015) | Analizar los beneficios de un programa de ejercicio físico en casa en pacientes ERC no en diálisis con sobrepeso | ECA: 2 grupos, intervención vs. control: (n=15) vs. (n=14).Duración: 48 semanas | M:H=27:35.Edad: 55,1±11,6 años.Inclusión: Pacientes ERC estadio III-IV con función renal estable y que tuvieran diabetes y/o hipertensión como causa de su enfermedad renal | Ejercicio aeróbico en casa (caminar el parque, la calle…).Frecuencia: 3 veces/semana. Duración: 30min por sesión. Incremento de 10min por sesión cada 4 semanas hasta la 8.ª semana. Precedido y seguido por 5min de calentamiento y enfriamiento.No supervisión directa | La capacidad funcional mejoró en el grupo intervención (6MWT) (p=0,028), desarrollando también más fuerza en MMSS y MMII (repeticiones curl de bíceps y STS) (p<0,001, p<0,001) así como la capacidad pulmonar (volumen ventilatorio máximo) (p=0,005).Disminución de la PAS y PAD (p=0,012, p=0,038) y mejor función renal (CKD EPI) (p=0,046) |
| Aioke et al. (2018) | Analizar los beneficios de un programa de ejercicio físico en casa o en centro en pacientes ERC no en diálisis con sobrepeso | ECA: 2 grupos, intervención vs. control: (n=25) vs. (n=15).Duración: 24 semanas | M:H=15:25.Edad: 55,5±8,3 años.Inclusión: Pacientes de 18-70 años, ERC estadio III-IV con función renal estable e IMC>25kg/m2 | Ejercicio aeróbico de intensidad baja-moderada (40-60% VO2 máx.).Frecuencia: 3 veces en semana; duración: 30min por sesión. Incremento de 10 min por sesión cada 4 semanas hasta la 8.ª semana. Precedido y seguido por 5min de calentamiento y enfriamiento.Supervisión directa | La capacidad funcional mejoró en el grupo intervención (6MWT) (p<0,05), desarrollando más fuerza en MMSS y MMII (repeticiones curl de bíceps y STS) (p<0,05, p<0,05). Mejoría en la calidad de vida percibida y en la calidad del sueño (medido por la escala SF-36) (p<0,05) |
| Estudio y año de publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Howden et al. (2015) | Analizar la eficacia, la adherencia y la seguridad de un programa de ejercicio físico con una fase en centro seguida de otra fase en centro en pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=36) vs. (n=36).Duración: 12 semanas | M:H=18:22.Edad: 61,1±9,1 años.Inclusión: pacientes con ERC estadio III-IV y uno o más factores de riesgo cardiovascular no controlado (HTA, IMC, control glucémico…). | Ejercicio aeróbico (caminar o trotar, montar en bicicleta, remar…) de intensidad moderada (RPE 13-15 puntos) y de resistencia (pesas o bandas elásticas).Frecuencia: no especificada. Duración: 30min por sesión.Supervisión parcial | La capacidad aeróbica (MET) (p<0,001) y la capacidad funcional mejoraron en el grupo de intervención (6MWT) (p<0,001).La fuerza en MMSS mejoró (puño tensor) (p=0,003) y el IMC se redujo (p=0,07). No diferencias en el FGe (MDRD) (p=0,3) ni en la proteinuria (cociente albúmina/creatinina) (p=0,9) |
| Howden et al. (2013) | Analizar el efecto del ejercicio físico sobre la capacidad respiratoria y el aparato cardiocirculatorio en pacientes con ERC. | ECA: 2 grupos, intervención vs. control: (n=36) vs. (n=36).Duración: 48 semanas | M:H=27:45.Edad: 61,1±9,1 años.Inclusión: pacientes con ERC estadio III-IV y uno o más factores de riesgo cardiovascular no controlado (HTA, IMC, control glucémico…) | Ejercicio aeróbico (cinta rodante, bicicleta estática, remo…) a intensidad moderada (RPE de 11-13) y ejercicios de resistencia.Frecuencia: 2-3 veces/semana.Duración: 20-30min por sesión. Precedido y seguido por una parte de calentamiento y enfriamiento.Supervisión parcial | El grupo intervención mejoró la capacidad aeróbica (VO2 máx.) (p=0,004) y redujo el peso (p=0,02). El FGe fue similar en ambos grupos (MDRD) (p=0,28) |
| Estudio y año de publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Gregory et al (2011) | Evaluar los cambios en el factor de crecimiento insulínico (IGF) y sus factores relacionados en pacientes con ERC en estadios III y IV tras un programa de entrenamiento físico progresivo | ECA: 2 grupos, intervención vs. no intervención:(n=10) vs. (n=11).Duración: 48 semanas | Edad: 54,9±11,0 años.Inclusión: pacientes con ERC II-IV y en tratamiento con IECA o ARA-II. Ningún paciente había estado en un programa de entrenamiento físico antes del comienzo del estudio | Ejercicio aeróbico (cinta rodante, bicicleta estática) a intensidad moderada (50-60% VO2 máx.) ?y asesoramiento nutricional.Frecuencia: 3 veces/semana.Duración: 55min por sesión. Precedido y seguido por 5min de calentamiento y enfriamiento.Supervisión directa | No diferencias significativas en ninguno de los componentes del sistema IGF (p>0,05). En el grupo intervención mejoró la capacidad aeróbica (VO2 máx.) (p=0,03) y tolerancia al ejercicio (tiempo total ejercicio) (p<0,01) |
| Headley et al. (2017) | Analizar la relación entre el ejercicio aeróbico y la respuesta aguda y crónica de la presión arterial en pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=25) vs. (n=21).Duración: 16 semanas | M:H=13:30.Edad: 58,5±8,5 años.Inclusión: pacientes ERC estadio III-IV con función renal estable y que tuvieran diabetes y/o hipertensión como causa de su enfermedad renal | Ejercicio aeróbico a intensidad moderada (50-60% VO2 máx.).Frecuencia: 3 veces/semana.Duración: 15-30min por sesión. Incrementos progresivos hasta 55min por sesión.Supervisión directa | Los pacientes presentaron hipotensión tras una sesión de ejercicio aeróbico, sin que se encontrasen diferencias en su frecuencia entre el grupo control e intervención pasadas 16 semanas de entrenamiento (p=0,60).No diferencias en la presión arterial sistólica ni diastólica entre ambos grupos al finalizar el estudio, medida de forma ambulatoria (p=0,67, p=0,32) |
| Estudio y año e publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Headley et al. (2014) | Analizar el efecto del ejercicio de intensidad moderada a corto plazo sobre la rigidez arterial en pacientes con ERC estadio III | ECA: 2 grupos, intervención (n=25) vs. control (n=21).Duración: 24 semanas | M:H =16:30.Edad: 57,5±8,5 años.Inclusión: pacientes ERC estadio III-IV con función renal estable y que tuvieran diabetes y/o hipertensión | Ejercicio aeróbico de intensidad moderada (50-60% VO2 máx.).Frecuencia: 3 veces/semana. Duración: 30min por sesión. Incremento progresivo del tiempo hasta 55min de ejercicio por sesión. Precedido y seguido por 5min de calentamiento y enfriamiento.Supervisión directa | En el grupo intervención aumentó el pico de VO2 (p=0,04) aunque no se modificó la velocidad de onda de pulso (p=0,8) |
| Headley et al. (2012) | Examinar el efecto del entrenamiento de intensidad moderada sobre la función renal y vascular en pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=10) vs. (n=11).Duración: 48 semanas | Edad: 54,9±11,0 años.Inclusión: pacientes con ERC estadio II-IV y edad 18-70. Se excluyó a los pacientes si tenían alguna contraindicación para hacer ejercicio | Ejercicio aeróbico de intensidad moderada (50-60% VO2 máx.).Frecuencia: 3 veces/semana.Duración: 45min por sesión. Precedido y seguido por 5min de calentamiento y enfriamiento.Sin supervisión directa | La capacidad aeróbica (VO2 máx.) mejoró en el grupo intervención (p<0,05), así como el colesterol LDL (p<0,05), sin cambios en la función renal (MDRD). La FC disminuyó (ambulatoria y en reposo) (p<0,05) |
| Balakrishnan et al (2010) | Analizar el efecto del entrenamiento de resistencia en el número de copias de ADN mitocondrial (ADNmt) del músculo esquelético y su asociación con el fenotipo muscular (masa muscular y fuerza) | ECA: 2 grupos, intervención (n=13) vs. control (n=10).Duración: 48 semanas | M:H =6:17.Edad: 64±10 años.Inclusión: pacientes adultos con ERC estadio III-IV con función renal estable sin tratamiento con terapia renal sustitutiva | Ejercicio de resistencia (prensa de pecho y piernas, extensión de rodilla y máquinas de entrenamiento de resistencia). A intensidad del 80% de una repetición máxima.Frecuencia: 3 veces/semana.Duración 35min por sesión. Precedido y seguido por 5min de calentamiento y enfriamiento.Supervisión directa | Aumento significativo en el ADNmt muscular en el grupo intervención (p=0,001). El cambio en el número de copias de ADNmt muscular se correlacionó positivamente con un aumento en el área de corte transversal de las fibras musculares de tipo I (r=0,56, p=0,01) y tipo II (r=0,46, p=0,05). |
| Estudio y año de publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Greenwood et al. (2015) | Analizar el efecto de un programa de ejercicio físico de intensidad moderada sobre la función renal e índices de riesgo cardiovascular en pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=8) vs. (n=10).Duración: 12 meses | M:H=3:15.Edad: 53,5±13,1 años.Inclusión: los participantes se incluyeron si tenían >18 años y evidencia de una tasa de disminución en la TFG en los 12meses antes de la intervención | Ejercicio aeróbico (bicicleta estática) de intensidad moderada (RPE 11 puntos) y de resistencia (curl de bíceps, prensa de piernas, extensión de rodillas…).Frecuencia: 3 veces/semana. Duración: 20-40min por sesión.Supervisión parcial | El grupo de intervención presentó menor deterioro del FGe (CKD-EPI) (p=0,02). Mejoraron la velocidad de onda de pulso (p=0,001), el IMC (p=0,01) y el peso (p=0,02) y la circunferencia de la cintura (p=0,003) |
| Tang et al. (2017) | Analizar el efecto de un programa de ejercicio físico sobre la función física, esfera psicológica y calidad de vida de los pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=42) vs. (n=42).Duración: 12 semanas | M:H=33:51.Edad: 43,1±14 años.Inclusión: pacientes de 18-70años. ERC estadio I-III con función renal estable | Ejercicio aeróbico (caminar, bicicleta o footing) de intensidad moderada (12-15 puntos en la RPE).Frecuencia: 3 veces/semana. Duración: 20-30min por sesión.No supervisión directa | Mejoría en la capacidad funcional en el grupo intervención (6MWT) (p=0,001), así como en la fuerza en MMII (STS) (p<0,005).Además se apreció una mejora en la calidad de vida del paciente (KDQOL-36) (p=0,002) |
| Petcher et al. (2013) | Analizar la relación del ejercicio físico acuático con mortalidad o inicio de diálisis en pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=7) vs. (n=9).Duración: 10 años | (M:H)=7:9.Edad: 49,7 (31-65) años.Inclusión: pacientes ERC estadios III-V no en diálisis | Ejercicio aeróbico acuático de intensidad baja (40-50% VO2 máx.).Frecuencia: 2 veces/semana.Duración: 30min por sesión (más 10min de calentamiento y 10min de enfriamiento).Supervisión directa | No diferencias entre ambos grupos en el endpoint final del estudio (p=0,089). Sin embargo, ninguno de los miembros del grupo de ejercicio inició diálisis o murió en 10años. En el grupo control el 55% de los pacientes requirieron inicio de terapia de reemplazo renal o fallecieron |
| Estudio y año de publicación | Objetivo | Tipo de estudio | Participantes | Intervenciones | Resultados |
|---|---|---|---|---|---|
| Rossi et al. (2014) | Analizar el beneficio del ejercicio físico sobre la condición física y la calidad de vida relacionada con la salud en pacientes ERC estadio III-IV | ECA: 2 grupos, intervención vs. control: (n=59) vs. (n=48).Duración: 12 semanas | M:H=51:56.Edad: 68,4±12,4 años.Inclusión: pacientes ERC estadio III-IV con función renal estable mayores de 18años | Ejercicio aeróbico (cinta de caminar y/o bicicleta estática) y de resistencia (extensiones de extremidades superiores e inferiores y flexiones con pesas libres).Frecuencia: 2 veces/semana. Duración: 60min por sesión.Supervisión directa | La capacidad funcional mejoró en el grupo intervención (6MWT) (p<0,001). La calidad de vida relacionada con la salud (RAND-36) mejoró en los ítems relacionados con la esfera física (p<0,001) |
| Chen et al. (2010) | Analizar el efecto de un programa de ejercicio personalizado sobre los valores bioquímicos de la sangre y otras variables relacionadas con el ejercicio en pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=45) vs. (n=49).Duración: 12 semanas | M:H=20:74.Edad: 73,2 (59-78) años.Inclusión: pacientes con ERC estadio III-V y función renal estable sin tratamiento con terapia renal sustitutiva | Ejercicio adecuado a las preferencias y posibilidades de cada paciente.Frecuencia: 3-5 veces/semana.Duración: 30min por sesión.Sin supervisión directa | Los niveles de colesterol se redujeron en el grupo intervención (p<0,001). No cambios significativos en hematocrito, hemoglobina o glucemia (p>0,05) |
| Koskamadis et al. (2011) | Analizar los efectos del ejercicio físico sobre pacientes con ERC | ECA: 2 grupos, intervención vs. control: (n=18) vs. (n=14).Duración: 24 semanas | M:H=13:19.Edad: 59,1 (31-83) años.Inclusión: pacientes con ERC estadio IV-V sin terapia renal sustitutiva. Los criterios de exclusión fueron edad <18años, embarazo y la discapacidad funcional o cardiovascular que limitasen gravemente la capacidad de ejercicio | Ejercicio aeróbico (caminar) de intensidad moderada (RPE de 12-14).Frecuencia: 5 veces/semana. Duración: 30min por sesión.Sin supervisión directa | La tolerancia al ejercicio mejoró en el grupo intervención tras el programa (aumento en RPE durante el entrenamiento) (p<0,001). También mejoró la calidad de vida (cuestionario FACIT-Sp) (p<0,05) y redujeron el peso (p=0,007) |
En los 21 estudios revisados se han incluido a un total de 927 pacientes; de ellos, 603 eran varones. Cuatro estudios13-16 excluyeron a las mujeres para evitar diferencias atribuibles al sexo.
Las principales causas de enfermedad renal descritas en los estudios incluidos son las glomerulopatías primarias y secundarias (13,2%), la diabetes mellitus (11,6%), la nefroangiosclerosis (12,7%) y la poliquistosis renal (2,2%).
Nueve14,15,17-23 de los estudios incluidos ofrecen información sobre la comorbilidad de la muestra. La prevalencia media de enfermedades más comunes fue: 30,8% de diabetes mellitus, 18,5% de hipertensión, 8,9% de dislipemia, 5% de enfermedad cardiovascular y 3,8% de enfermedad vascular periférica.
Programas de ejercicioLa frecuencia de las sesiones fue en 14 trabajos de 3 veces por semana13-17,19,20,23-29, con una duración aproximada de 30min. Algunos incluían incrementos semanales en el tiempo de ejercicio hasta llegar a 45-50min por sesión 17,19,20,24,25. Dos estudios programaron 2 sesiones semanales y otros dos incluyeron 5 sesiones30,31. Solo un programa realizó sesiones diarias19. El resto no especificó la frecuencia de las sesiones 21,22,32.
La intensidad del ejercicio en la mayoría de los trabajos fue leve-moderada. Al medirla mediante el volumen máximo de oxígeno calculado, esta varió entre el 40 y el 60%15,17,20,24,25,30. Otras intervenciones pautaron la intensidad del ejercicio en la escala de esfuerzo percibido (RPE) en una media de 11-15puntos sobre 2021,22,28,29,33. Un estudio aplicó el «talk test»32.
Diez estudios señalan haber sido supervisados durante toda la intervención por profesionales15,20,23-27,30,31. Nueve artículos incluían una primera fase dirigida (1-8semanas) con una segunda parte sin supervisión directa, aunque mantenían un seguimiento regular de los pacientes mediante llamadas telefónicas o entrevistas14,18,19,21,22,28. El resto de trabajos refieren no haber realizado un seguimiento periódico de los pacientes durante la intervención13,17,29,32.
Medidas de resultadosEl filtrado glomerular se analizó en 11 estudios, empleando en 5 de ellos la fórmula CKD EPI15,17,19,20,30 y en 6 la fórmula MDRD (Modification on Diet in Renal Disease)21-23,26,27,33. La proteinuria se estudió en 6 ensayos: 3 de ellos la midieron empleando el cociente albúmina/creatinina13,14,21 y 3 determinaron la albuminuria en 24h16,26,30. Solo uno de los estudios incluyó una medida de la supervivencia de los pacientes, así como el tiempo hasta su entrada en diálisis30.
Se usaron diversas medidas de resultado para evaluar la condición física. La capacidad aeróbica se analizó en 13 estudios empleando el consumo pico de oxígeno (VO2 máx.), definida como la cantidad máxima de oxígeno que el organismo puede absorber, transportar y consumir por unidad de tiempo14-20,22-26,28. En otro de los programas se analizaron los MET (unidad de medida del índice metabólico), que es la cantidad de energía que consume un individuo en reposo21. Otro de los estudios incluidos utilizó el rango de esfuerzo percibido.
Las pruebas físicas funcionales se aplicaron en 6 estudios, empleando para ello la prueba de 6min de marcha (6minutes walking test [6MWT])17,19-21,29,31.
La fuerza muscular se midió en 7 estudios, medida por el número de repeticiones de curl de bíceps19,20 y puño tensor21 para la fuerza en miembros superiores, y por número de repeticiones de la prueba de sentado a de pie (sit-to-stand [STS])15,19,20,29 para la fuerza en miembros inferiores.
En el análisis de la composición corporal se emplearon medidas antropométricas como el índice de masa corporal (IMC), recogido en 10 ensayos14,15,18-23,26,28, o la circunferencia de la cintura, analizada en 5 de los artículos incluidos15,22,23,26,28.
La calidad de vida relacionada con la salud se analizó en 6 estudios. Tres de ellos usaron el cuestionario SF-3614,20,25, 2 trabajos emplearon el Kidney Disease Quality of Life (KDQOL-36)18,29 y otro utilizó el Functional Assessment of Chronic Illness Therapy-Spirituality Scale Quality of Life Tool (FACIT-Sp)33.
Evaluación de la calidad de los estudiosA pesar de que los estudios de esta revisión sistemática incluían únicamente ensayos clínicos controlados con asignación aleatoria, solo 13 describen la forma de la generación de la secuencia, con una puntuación en la escala Jadad de 3 puntos13-15,18,20-22,24,25,28,29,31,32. Ocho artículos tenían 1punto16,17,19,23,26,27,30,33. Ninguno de los estudios se describe como doble ciego.
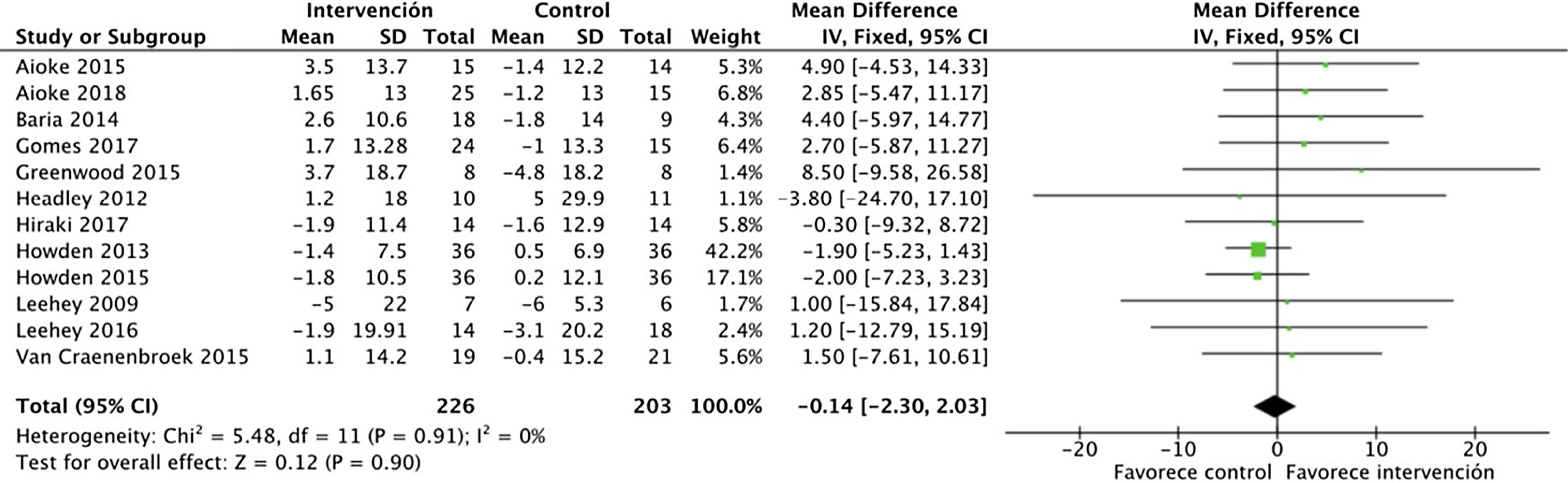
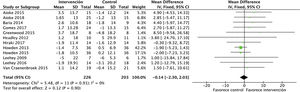
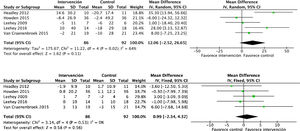
Efectos sobre la función renalEl análisis de datos agrupados de 429 pacientes demostró que el ejercicio físico no tiene impacto sobre la función renal, sin apreciarse diferencias en el filtrado glomerular estimado entre el grupo intervención y el grupo control al final del programa: DME −0,1 (IC95%: −2,3 a 2,0; p=0,90) (fig. 2).
Por otra parte, un ECA a largo plazo mostró que un programa de ejercicio aeróbico tuvo efectos positivos, aunque no significativos, en la progresión a ERC terminal o necesidad de inicio de TRS; OR 0,2 (IC95%: 0,01 a 4,9; p=0,32)30.
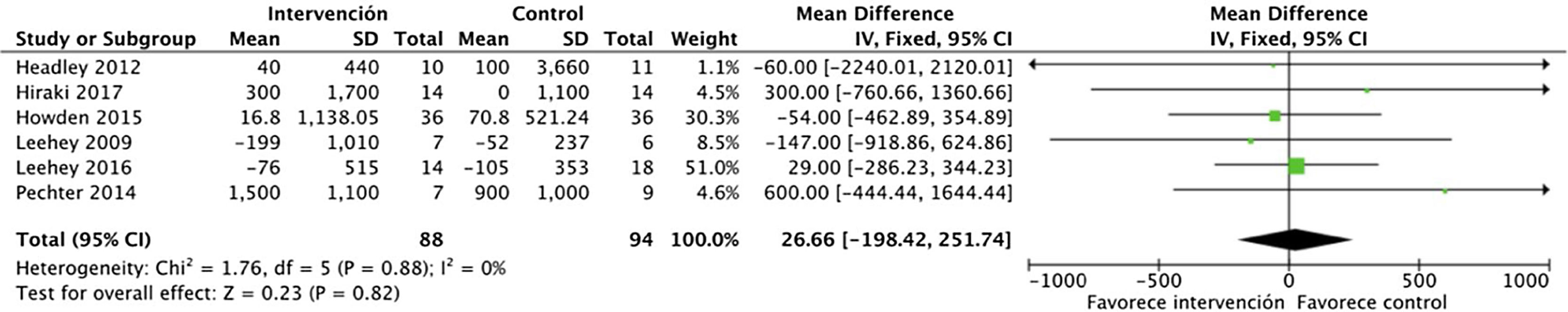
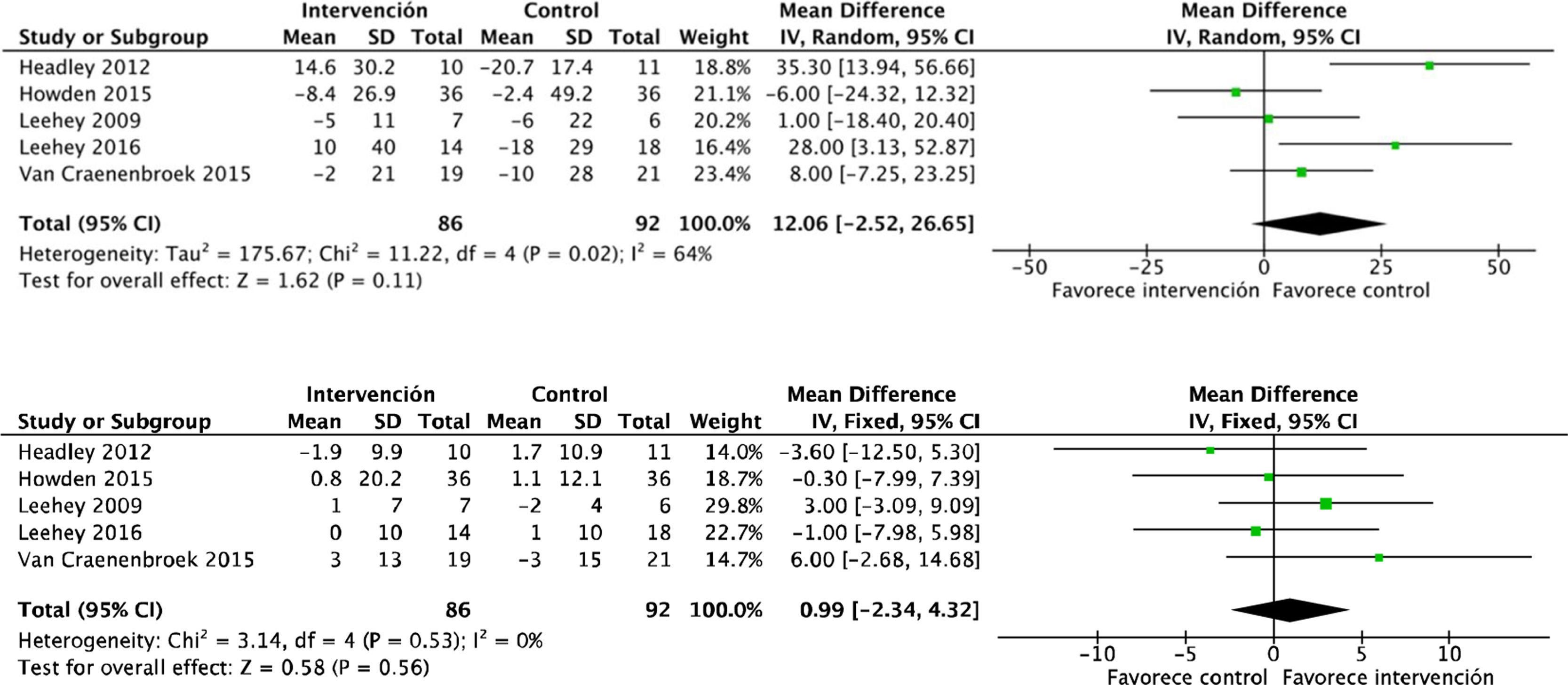
La proteinuria tampoco se vio modificada por el ejercicio físico, analizado mediante proteinuria en 24h y el cociente albúmina/creatinina. Se incluyeron en total 6 estudios que abarcaban datos de 182 pacientes: DME 26,6 (IC95%: −198,5 a 251,7; p=0,82) (fig. 3).
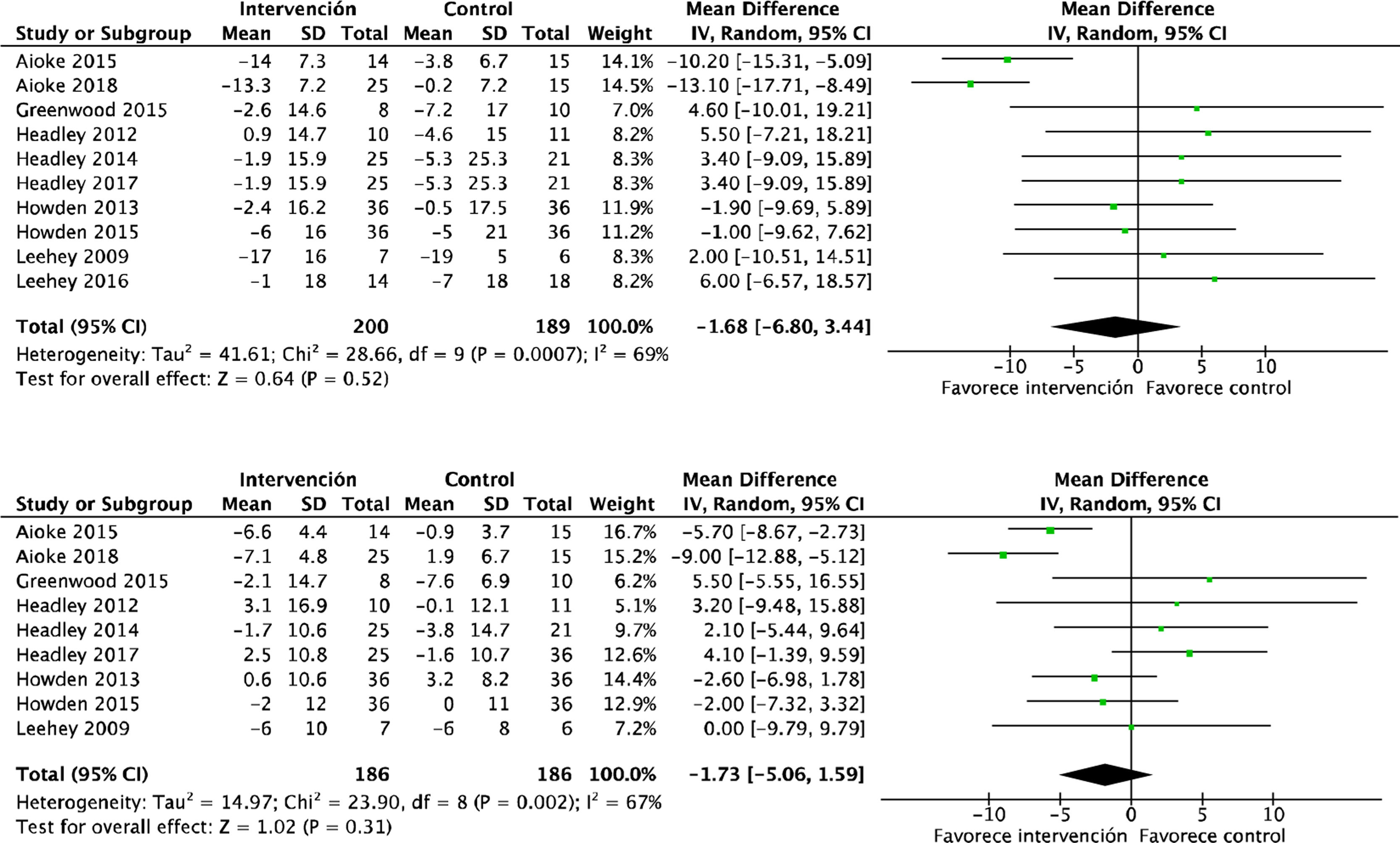
Efectos cardiovasculares y metabólicosLos efectos del ejercicio físico sobre la presión arterial sistólica (PAS): DME −1,6 (IC95%: −6,8 a 3,4; p=0,52) y la presión arterial diastólica (PAD) son conflictivos: DME −1,7 (IC95%: −5,0 a 1,5; p=0,31), según datos obtenidos del análisis de 389 y 372 pacientes, respectivamente. Ambos metaanálisis mostraron efectos positivos, aunque no significativos (fig. 4). Un solo estudio analizó mediante ecocardiografía la masa ventricular izquierda, sin encontrar diferencias en el grupo de intervención respecto a los controles (p=0,98)22.
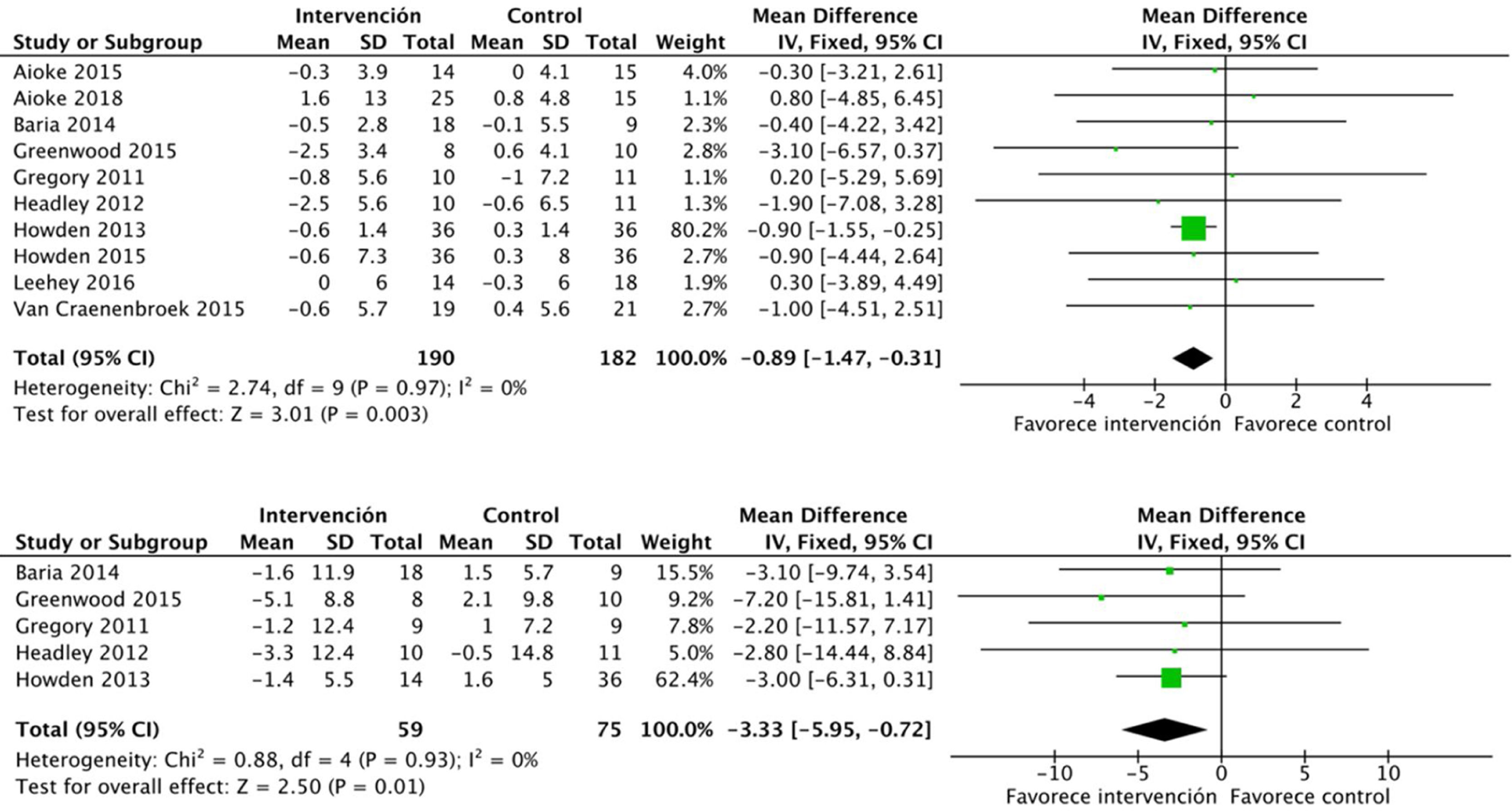
Algunos estudios analizan el efecto del ejercicio sobre la hemoglobina, reflejando resultados positivos sobre esta con una alta evidencia. Se incluyen datos agrupados de 168 pacientes: DME 0,3 (IC95%: 0,1 a 0,5; p=0,003)16,19,32,33.
Existe evidencia conflictiva sobre el efecto del ejercicio físico en el control del colesterol LDL: DME 12,0 (IC95%: −2,5 a 26,6; p=0,11). En cuanto a los niveles de colesterol HDL, no podemos hacer recomendaciones al respecto. Los datos obtenidos del metaanálisis muestran efectos positivos, aunque estos no son estadísticamente significativos: DME 0,9 (IC95%: −2,3 a 4,3; p=0,56) (fig. 5).
En 3 de los ensayos incluidos se analizó el efecto del ejercicio físico sobre la hemoglobina glucosilada. Los resultados obtenido del análisis de 115 pacientes no mostraron diferencias estadísticamente significativas entre ambos grupos: DME 0,1 (IC95%: −0,56 a 0,57; p=0,98)14,16,21.
Solo 2 trabajos analizaron otros factores relacionados con riesgo cardiovascular en el paciente con ERC, como fósforo, calcio, hormona paratiroidea (PTH) y vitaminaD. En ninguno de ellos se encontraron diferencias estadísticamente significativas entre el grupo intervención y el grupo control17,33.
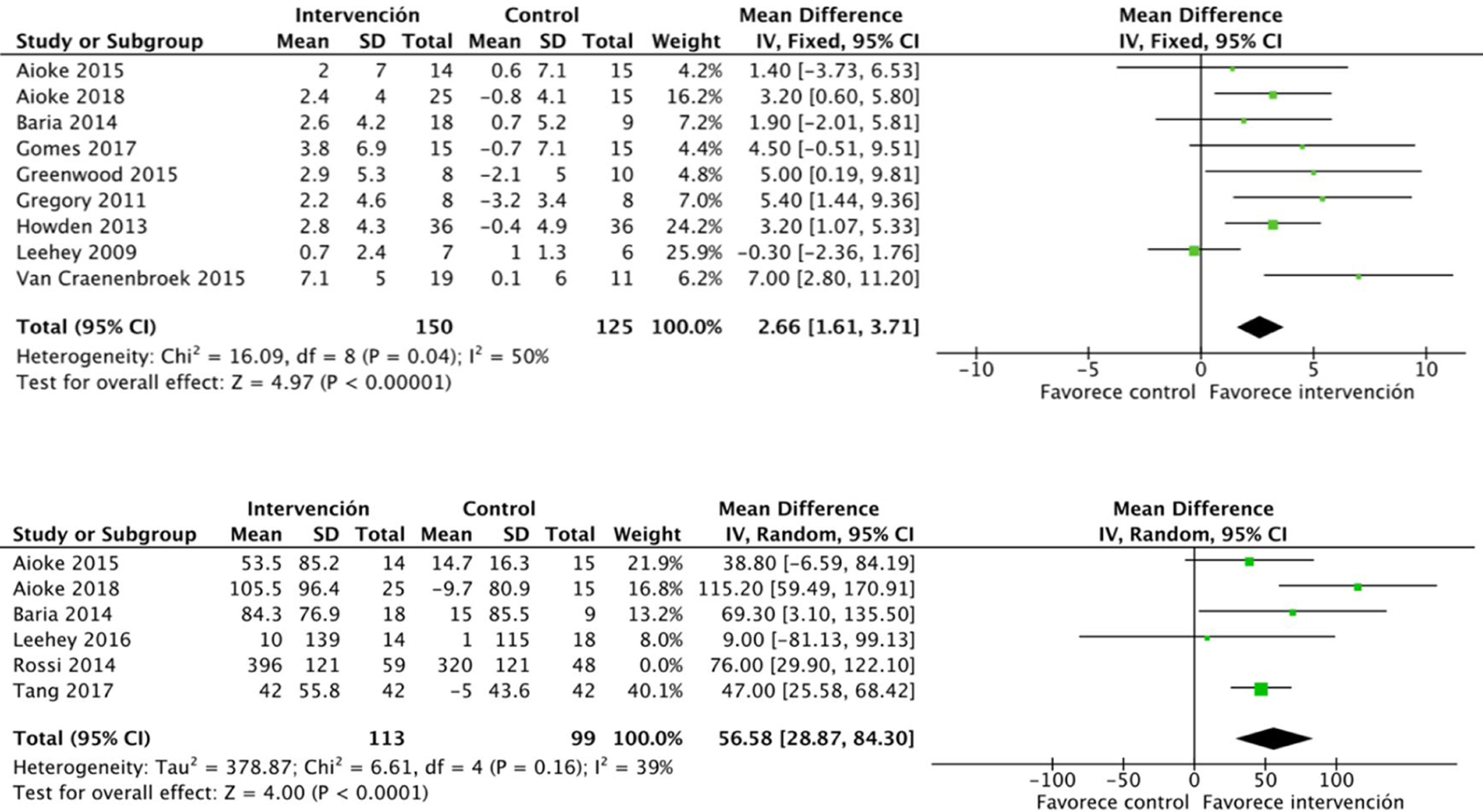
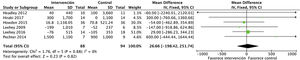
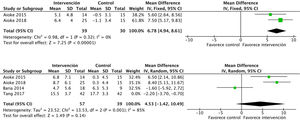
Efectos sobre la condición físicaEl ejercicio aeróbico combinado con ejercicio de resistencia a corto y a medio plazo presenta efectos positivos significativos sobre la condición física, medido mediante el consumo pico de oxígeno en la prueba de esfuerzo, tal y como se evidenció en los datos obtenidos de 275 sujetos: DME 2,6 (IC95%: 1,6 a 3,7; p<0,001). Los ensayos que utilizaron los MET y el RPE mostraron resultados similares21,33. Además, el análisis de 6 estudios que incluían 212 pacientes demostró una mejoría sobre la capacidad funcional medida por el 6MWT: DME 56,5 (IC95%: 28,8 a 84,3; p<0,001) (fig. 6).
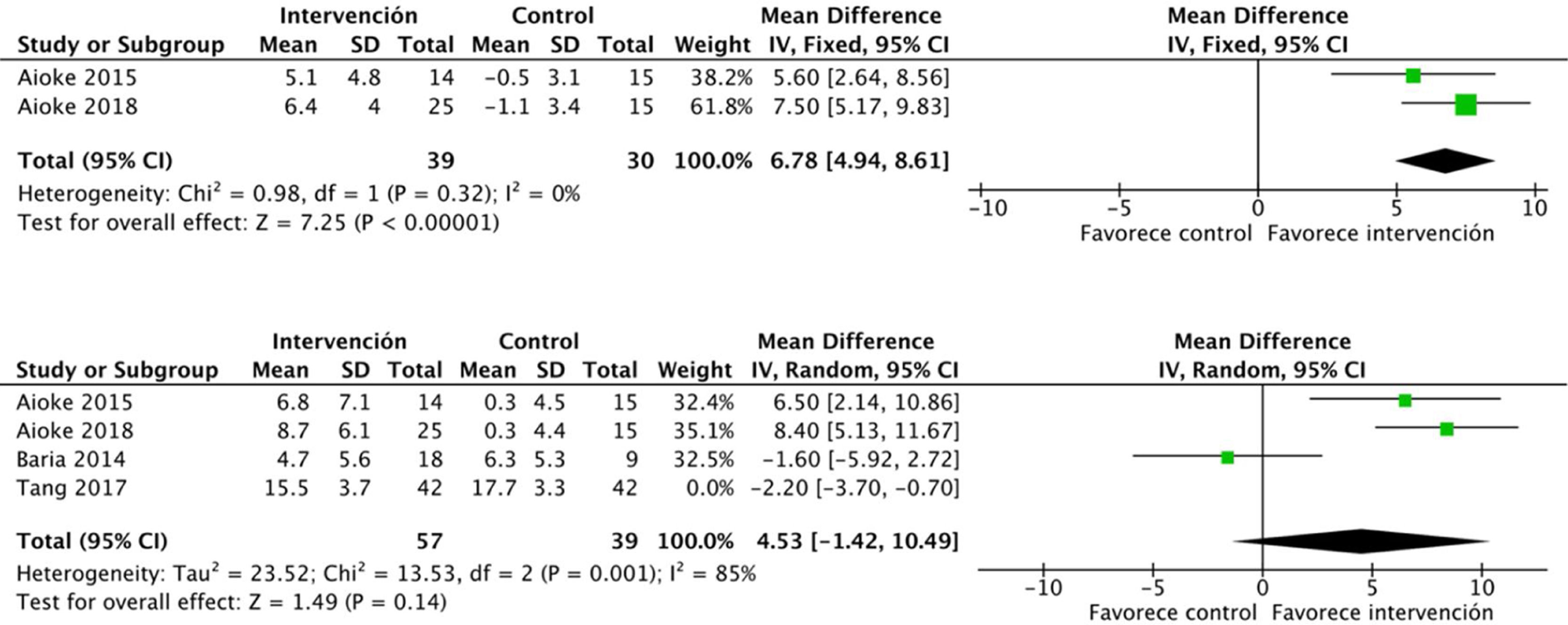
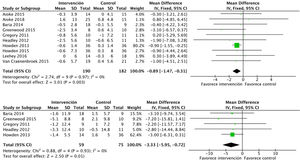
En relación con la fuerza en miembros, el ejercicio físico mejora la fuerza en miembros superiores, medida por el número de repeticiones en el curl de bíceps: DME 6,7 (IC95%: 4,9 a 8,6; p<0,001). Los estudios que midieron la fuerza en miembros superiores mediante la dinamometría ofrecen resultados positivos no significativos: DME 2,1 (IC95%: −1,5 a 5,7; p=0,25)17,21,24. Por otra parte, la evidencia es conflictiva sobre la fuerza en miembros inferiores. Se recogieron datos de 96 pacientes que mostraron efectos positivos, aunque no significativos: DME 4,5 (IC95%: −1,4 a 10,4; p=0,14) (fig. 7).
El efecto del ejercicio físico sobre variables antropométricas también fue evaluado en algunos estudios. Existe una evidencia clara sobre el efecto positivo del ejercicio aeróbico combinado con ejercicios de resistencia en el IMC: DME −0,8 (IC95%: −1,4 a −0,3; p=0,003). El ejercicio también se relaciona con una reducción en la circunferencia de la cintura: DME −3,3 (IC95%; −5,9 a −0,7; p=0,01) (fig. 8).
Efectos sobre la calidad de vidaEl ejercicio físico ofrece beneficios sobre la calidad de vida relacionada con la salud. De los 3 estudios que aplicaron el SF-36, el metaanálisis de 2 de ellos muestra efectos positivos estadísticamente significativos en el apartado físico: DME 6,66 (IC95%: 0,91 a 12,40; p=0,02)18,25. El tercer estudio presentaba la suma de cada uno de los ítems del cuestionario de forma independiente, por lo que no fue posible incluirlo en el metaanálisis31. Los trabajos que emplearon el cuestionario KDQOL-36 presentaron mejoría al analizar los efectos de la enfermedad sobre la calidad de vida: DME 3,56 (IC95%: 0,49 a 6,63; p=0,02)19,29. Solo un estudio aplicó la escala FACIT-Sp, obteniendo resultados positivos33.
Efectos sobre la mortalidadAl analizar los efectos en la mortalidad en pacientes con ERC, solo pudo ser incluido un único estudio. Este es un ECA de alta calidad (puntuación en la escala de Jadad de 3 puntos) con un seguimiento de 10años que muestra un efecto positivo, aunque no significativo: OR 0,1 (IC95%: 0,01 a 2,8; p=0,1)30.
DiscusiónEl objetivo de la presente revisión era describir el efecto de un programa de ejercicio sobre la progresión de la enfermedad renal y otros factores asociados a la ERC. En trabajos anteriores la práctica de ejercicio físico no se ha recomendado tradicionalmente para pacientes con ERC debido a que el aumento de la actividad nerviosa simpática durante el ejercicio disminuye el flujo sanguíneo renal, lo que podría alterar estructuras íntimas del riñón y afectar a su funcionamiento8,9. La revisión de los estudios incluidos en este metaanálisis mostró que la práctica de ejercicio no se relaciona con cambios en el filtrado glomerular. No obstante, solo 9 de los trabajos revisados analizaron el impacto del ejercicio físico sobre la progresión de la enfermedad renal, 3 de ellos con una calidad baja, por lo que debemos interpretar estos resultados con cautela15,17,19-22,28,30. Pechter et al.30 condujeron el estudio de mayor seguimiento de la revisión, incluyendo como punto final de estudio el inicio de TRS o muerte por todas las causas. Sin embargo, es preciso tener en cuenta que se trata de un estudio con una muestra muy pequeña, con 7 pacientes en el grupo intervención y 9 en el grupo control. En 10años de seguimiento de intervención de ejercicio aeróbico acuático encontraron que nadie del grupo de intervención llegó al punto final del estudio, mientras que el 55% del grupo control tuvo que someterse a diálisis o falleció. No obstante, estas diferencias no fueron estadísticamente significativas entre ambos grupos. Asimismo, la revisión publicada por MacKinnon et al.34 concluye que una mejor condición física y la práctica de ejercicio se correlacionan con un menor riesgo de mortalidad, así como de deterioro de la función renal, y una mayor supervivencia del injerto en los pacientes trasplantados. Otros estudios han identificado resultados similares sobre la mortalidad en población en hemodiálisis35.
La proteinuria también es un factor de riesgo fundamental en la progresión de la ERC. Se sabe que ciertas situaciones, como el ejercicio intenso, pueden favorecer la aparición o el incremento de la proteinuria36,37. En la revisión realizada la práctica de ejercicio físico moderado no condujo a un mayor grado de proteinuria, por lo que podría prescribirse de forma segura en los pacientes con ERC13,14,16,21,26,30.
Los efectos del ejercicio físico sobre la capacidad aeróbica son bien conocidos, y así se ha visto en los artículos incluidos en este metaanálisis16-20,22,23,28. Este grupo de pacientes presenta muy poca tolerancia al ejercicio debido, entre otras causas, a la acumulación de productos de desecho del organismo, la anemia y la pérdida de masa muscular. Todo ello lleva a bajos niveles de ejercicio físico en comparación con la población general38. La práctica de ejercicio muestra una mejora importante de la capacidad funcional y capacidad aeróbica, coincidiendo nuestros resultados con los de otro metaanálisis recientemente publicado por Vanden-Wyngaert et al.39. Por tanto, podemos afirmar que existe evidencia alta sobre las mejoras que un programa de ejercicio aporta en la capacidad funcional, observándose resultados desde las primeras 12 semanas de intervención14,15,19,20,29,31. Por otra parte, el aumento de los niveles de hemoglobina con el entrenamiento, constatado en la revisión que hemos realizado, puede contribuir a esta mejoría, reduciendo la sensación de astenia14,16,21.
La ERC es un factor de riesgo importante para la morbimortalidad cardiovascular. El aumento de la ERC en las últimas décadas ha sido paralelo al aumento de la obesidad, la diabetes y el síndrome metabólico. La ya comentada mejoría de la anemia asociada al ejercicio puede aportar a estos pacientes un evidente beneficio en el ámbito cardiovascular. Por otro lado, el entrenamiento físico podría mejorar otros aspectos como la presión arterial40,41. Un mejor control de la presión arterial es de gran importancia en estos pacientes, ya que presentan alto riesgo cardiovascular y la hipertensión es factor reconocido de daño renal y progresión de la ERC42. En los estudios de este metaanálisis se aprecia que la práctica de ejercicio aeróbico ofrece un mejor control de las cifras de PAS a corto y a medio plazo, aunque sin alcanzar diferencia significativa14,16,19-22,24-26,28. En cuanto a la PAD, tampoco se dispone de evidencia para hacer recomendaciones14,19-22,24-26,28.
Las cifras de HDL y LDL no se modificaron con el ejercicio físico14,16,18,21,26. Es importante recordar que el perfil lipídico de los pacientes con ERC es diferente al de la dislipemia de la población general, y varía según la severidad de la disfunción renal, lo que dificulta la interpretación de los resultados recogidos en los distintos estudios de esta revisión. La dislipemia en la ERC se caracteriza por hipertrigliceridemia, niveles variables de colesterol LDL y niveles bajos de colesterol HDL. En las fases iniciales aún encontramos niveles elevados de colesterol LDL, pero en estadios más avanzados este parámetro se normaliza o incluso se reduce. El Observatorio Nacional de Aterosclerosis en Nefrología (proyecto NEFRONA) observó un descenso progresivo en los niveles de colesterol total, colesterol LDL, colesterol HDL y colesterol no HDL proporcional al estadio de la enfermedad renal43.
La hemoglobina glucosilada no se modificó con el ejercicio físico según los resultados obtenidos en esta revisión. Ciertos trabajos relacionan niveles altos de hemoglobina glucosilada con una mayor mortalidad en pacientes en hemodiálisis. No obstante, factores diversos como la anemia y el uso de agentes eritropoyéticos o suplementos de hierro hacen que la presencia de ERC altere la relación entre glucemia y hemoglobina, lo que dificulta su interpretación y su aplicabilidad en estos pacientes44. Por otra parte, la hiperfosfatemia y el hiperparatiroidismo secundario se han relacionado con una mayor morbimortalidad cardiovascular en los pacientes con ERC. Algunos trabajos relacionan la práctica de ejercicio físico de alta y baja intensidad con cambios en el metabolismo óseo, junto con una leve disminución de la PTH45. En este metaanálisis no se encontraron diferencias estadísticamente significativas, aunque los ensayos incluidos eran de baja calidad, por lo que son necesarios más trabajos para poder hacer recomendaciones al respecto17,33.
En esta revisión analizamos variables antropométricas que también se han relacionado con enfermedad cardiovascular, como el IMC y la circunferencia de la cintura. En el primer caso, una intervención de ejercicio mostró una reducción significativa del IMC14,15,18-23,26,28. En cuanto a la circunferencia de la cintura, los pacientes mostraban una menor circunferencia al finalizar el programa de ejercicios15,22,23,26,28. Estos resultados son importantes, ya que ambas variables se han descrito como predictores de riesgo cardiovascular y de progresión de la ERC46.
A medida que la ERC progresa, también se incrementan las complicaciones. La disfunción musculoesquelética parece ser el principal factor limitante de la capacidad para realizar ejercicios y la degradación muscular es uno de los más fuertes pronosticadores de la mortalidad en individuos con ERC47. Basándonos en los resultados aportados por este metaanálisis, un programa de entrenamiento mejoró la fuerza de miembros superiores19,20. No obstante, para valorar los resultados del ejercicio sobre la fuerza en miembros inferiores se necesitan más estudios: hubo 4 ensayos clínicos, uno de ellos de alta calidad, donde se encontraron cambios positivos aunque no significativos15,19,20,29.
Los efectos sobre la calidad de vida también son de especial relevancia. La sintomatología propia de la enfermedad limita las actividades físicas, interfiere en las actividades diarias, intensifica el dolor y su efecto en el trabajo habitual, y hace que el paciente realice una peor valoración de su estado de salud48. Esta revisión aporta que un programa de ejercicio aeróbico ofrece beneficios en la calidad de vida mejorando el componente físico, el cual se ha descrito como el principal factor que altera la calidad de vida en pacientes con ERC sin diálisis ni trasplante14,18,25,26,29,31. Un metaanálisis publicado por Zhao et al.49 aporta que el ejercicio puede mejorar la fatiga, la ansiedad, la depresión en pacientes con ERC, especialmente aquellos en hemodiálisis. Por ello es necesario explorar el tipo de ejercicio físico adecuado para este tipo de pacientes, incluyéndolo desde etapas tempranas para mejorar su condición física y retrasar la progresión de la enfermedad.
Dentro de las limitaciones de nuestro estudio, encontramos que la revisión e inclusión de los artículos citados fue realizada por un único investigador. No obstante, todo el proceso y sus resultados fueron supervisados posteriormente por el resto de investigadores. Otras de las limitaciones a mencionar es la heterogeneidad de las características de los pacientes y en el diseño de los ensayos clínicos incluidos. Por tanto, encontramos dificultades a la hora de analizar algunos datos, puesto que entre los artículos se empleaban distintas unidades de medida y en algunos de ellos no se detallaba claramente los resultados o el programa de ejercicio empleado. A pesar de ello, la revisión ha sido exhaustiva, incluyéndose todos los artículos que cumplían los criterios de selección y analiz ndose todos los parámetros que fueron posibles desde el punto de vista metodológico. Finalmente solo se incluyeron informes en español e inglés; en consecuencia, es posible que falten datos de estudios relevantes publicados en otros idiomas. No obstante, los artículos en inglés y en español incluyen el mayor número de trabajos y las publicaciones de mayor impacto.
En conclusión, la práctica de ejercicio físico realizado de forma rutinaria y a intensidad baja-media ofrece importantes beneficios para el paciente con ERC. Mejora la capacidad aeróbica y funcional, repercutiendo positivamente en la calidad de vida percibida. Permite optimizar el control de las cifras de presión arterial y mejora ciertos parámetros analíticos como la hemoglobina. El esquema más empleado es el de 30min al día, de 3 a 5 veces a la semana, debiendo adaptar la intensidad y la frecuencia a la tolerabilidad del paciente. Los efectos del ejercicio sobre la progresión de la enfermedad renal y el inicio de TRS no están claros y la evidencia al respecto es limitada. No obstante, no muestra efectos negativos sobre la función renal. Por todo ello, se puede recomendar la práctica de ejercicio físico con seguridad en pacientes estables, y los resultados de este metaanálisis apoyan la inclusión del ejercicio como un pilar fundamental en la atención al paciente con ERC.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.