La hiponatremia es un trastorno multifactorial definido como una disminución en la concentración plasmática de sodio. Su diagnóstico diferencial requiere una evaluación adecuada del volumen extracelular. Sin embargo, la determinación del volumen extracelular, simplemente basada en la historia clínica, las constantes vitales, el examen físico y los hallazgos de laboratorio, conducen en ocasiones a un diagnóstico erróneo por lo que el enfoque terapéutico puede ser equivocado. El empleo de ecografía a pie de cama (Point-of-Care Ultrasound [PoCUS]), mediante la combinación de ecografía pulmonar (Lung Ultrasound [LUS]), Venous Excess UltraSound (VExUS) y la ecocardioscopia (Focused Cardiac Ultrasound [FoCUS]) permiten, en combinación con el resto de los parámetros, una valoración holística mucho más precisa del estado del volumen extracelular del paciente.
Hyponatremia is a multifactorial disorder defined as a decrease in plasma sodium concentration. Its differential diagnosis requires an adequate evaluation of the extracellular volume. However, extracellular volume determination, simply based on the clinical history, vital signs, physical examination, and laboratory findings can leads to misdiagnosis and inappropriate treatment. The use of Point-of-Care Ultrasound (PoCUS), through the combination of Lung Ultrasound (LUS), Venous Excess UltraSound (VExUS) and Focused Cardiac Ultrasound (FoCUS), allows a much more accurate holistic assessment of the patient's extracellular volume status in combination with the other parameters.
La hiponatremia se define como una concentración de sodio plasmático≤135mEq/l, afectando en torno a un 6-7% de la población general y hasta al 15-30% de los pacientes adultos hospitalizados1–3.
Su transcendencia radica en que ha demostrado asociarse de forma independiente a mayor mortalidad, un aumento en la estancia hospitalaria, alteraciones de la marcha, caídas, osteoporosis y un deterioro significativo de la calidad de vida4,5. Por ello, su correcta identificación junto con una adecuada aproximación diagnóstica y terapéutica es esencial, y en algunos casos continúa siendo una necesidad médica no cubierta.
La concentración de sodio plasmático depende del contenido de sodio intercambiable con relación al agua corporal total. La hiponatremia se relaciona con un exceso relativo de agua respecto al sodio extracelular (lo más común) o una pérdida absoluta de sodio (poco frecuente). La hormona antidiurética (ADH) es la principal reguladora de la excreción renal de agua, encontrándose elevada en la mayoría de los escenarios clínicos de hiponatremia6.
Caso clínicoMujer de 71 años entre cuyos antecedentes personales destacaba únicamente consumo de tabaco hasta hace 2 años (exposición 29 paquetes-año), dislipidemia y gonartrosis bilateral. Su tratamiento habitual solo incluía atorvastatina 20mg.
Acude a urgencias por un cuadro de 2 meses de evolución de astenia progresiva, pérdida de apetito, debilidad, y edematización progresiva de ambas extremidades inferiores. A la exploración física se encontraba afebril, con presión arterial de 135/86mmHg, frecuencia cardiaca 85 latidos por minuto y saturación de oxígeno del 96%. Hipoventilación en base pulmonar derecha y edema con fóvea bilateral hasta raíz de miembros inferiores. En los análisis, hiponatremia 122mEq/l (no disponemos de controles en el último año, pero sabemos que el sodio sérico era normal previamente), con función renal y glucosa normal. Osmolalidad plasmática baja 252mOsm/kg consistente con hiponatremia hipoosmolar. Péptido natriurético de tipo B N-terminal (NT-proBNP 745pg/ml. Nao<20mmol/L, Ko 36mmol/l y una osmolaridad (Osm) urinaria de 295mOsm/kg. La radiografía de tórax mostraba la presencia de derrame pleural derecho (no se disponía de estudios de imagen de tórax previos) con un índice cardiotorácico normal, sin claras condensaciones, masas, ni signos de redistribución vascular.
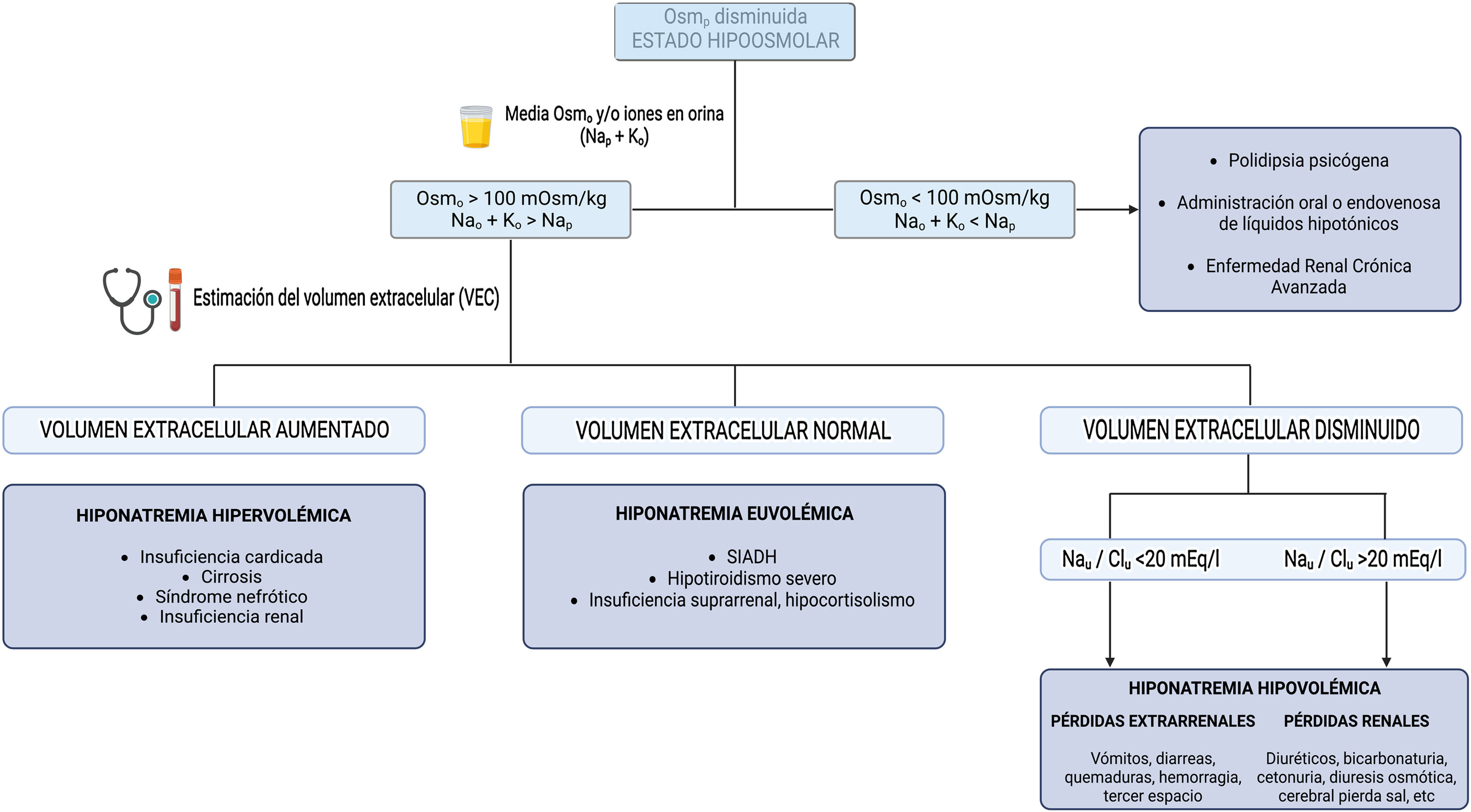
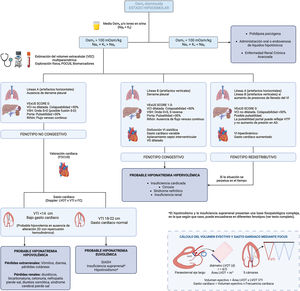
Aproximación diagnósticaLa aproximación diagnóstica más utilizada en la práctica clínica se basa en la realización de 3 preguntas (fig. 1):
- 1.
¿Cómo está la osmolalidad plasmática? Permite diferenciar las hiponatremias hipotónicas de las seudohiponatremias (hiperlipidemia o hiperproteinemia) y de las hiponatremias con osmolalidad normal o aumentada (hiperglucemia, administración de sustancias parenterales con poder osmolar como el manitol).
- 2.
¿Cómo está la osmolalidad urinaria o el aclaramiento de agua libre de electrólitos (Nao y Ko)? Permite distinguir entre las hiponatremias en las que el riñón elimina agua libre de forma adecuada y las hiponatremias en las que la respuesta renal es inadecuada, habitualmente por un exceso de ADH circulante.
- 3.
¿Cómo está el volumen extracelular (VEC)? Permite orientar sobre la causa última que ha desencadenado la hiponatremia.
Para ello, es fundamental conocer la Osm plasmática, la Osm urinaria, los principales iones en orina (Nao, Ko) y estimar el VEC, siendo este último punto en ocasiones un auténtico reto para el clínico. Lamentablemente, la exploración física aislada utilizando parámetros como el grado de hidratación de mucosas o de turgencia de la piel, el tono ocular, o la presencia o no de crepitantes pulmonares y edemas, tiene una baja sensibilidad y en algunos casos se asocia a un diagnóstico incorrecto7. Chung et al. demostraron en un estudio con 58 pacientes, todos ellos con hiponatremia (concentración Nap<130mEq/l), que solo identificaron adecuadamente el 47% de los pacientes hipovolémicos y el 48% de los pacientes euvolémicos8. Este hecho pone de manifiesto la necesidad de empleo de otras herramientas para una valoración más precisa del VEC.
En los últimos años emerge el concepto de la valoración multiparamétrica de la congestión en la que se ha propuesto el empleo de biomarcadores séricos de congestión como el NT-proBNP producido en respuesta al estrés al que se ven sometidos los miocardiocitos por una sobrecarga de volumen y/o de presión, siendo a día de hoy el biomarcador más ampliamente utilizado para el diagnóstico y pronóstico de la IC. Su elevación predomina en pacientes con disfunción diastólica del ventrículo izquierdo (VI). Factores como la edad y filtrado glomerular, entre otros, influyen en los niveles circulantes de NT-proBNP, por lo que su uso se ve limitado en un elevado número de pacientes. Otro biomarcador novedoso, recientemente descrito, es el antígeno carbohidrato 125 (CA 125) que se produce en las serosas como la pleura, el peritoneo y el pericardio en respuesta al aumento de presiones hidrostáticas tisulares y/o inflamación, y que muestra una asociación más fuerte que el NT-proBNP con el resto de los parámetros de congestión además de no verse influido por el filtrado glomerular. Pese a ello, parece razonable que su uso combinado podría aportar información complementaria, siendo el NT-proBNP una «ventana bioquímica al corazón izquierdo», mientras que el CA 125 tanto una «ventana al corazón derecho» en IC como un marcador de congestión en otros estados hidrópicos9–11.
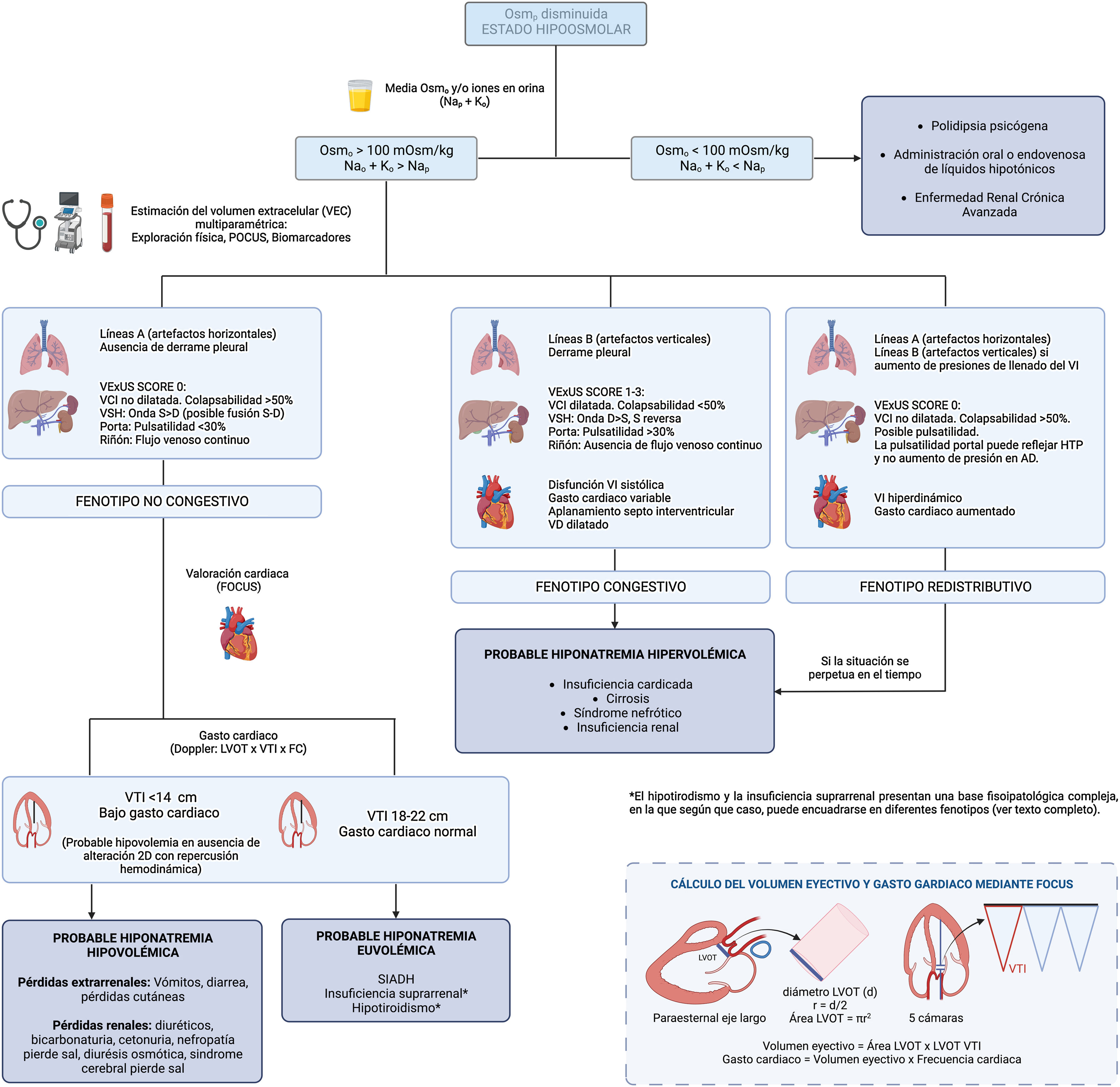
Incluir la insonación, como el quinto pilar de la exploración física12, mejora la sensibilidad y especificidad en la determinación del VEC. El estudio ecográfico incluye la realización de la ecocardioscopia para la valoración morfológica y funcional del corazón, además de permitir una valoración del volumen sistólico y del gasto cardiaco, el Venous Excess UltraSound (VExUS) permite fenotipificar y graduar la congestión venosa, y por último, el estudio de líquido libre, tanto pulmonar mediante ecografía pulmonar (Lung Ultrasound [LUS]) como abdominal13. Por ello en los últimos años se han publicado diferentes trabajos donde se resalta la utilidad de la ecografía a pie de cama (Point-of-Care Ultrasound [PoCUS]) en el paciente con hiponatremia14–18.
Con ello, sugerimos la implementación del PoCUS en la valoración rutinaria del paciente con hiponatremia, así como una actualización en el algoritmo diagnóstico de esta (fig. 2), teniendo presente que no todos los hallazgos ecográficos están siempre presentes y que con frecuencia la hiponatremia tiene un origen multifactorial.
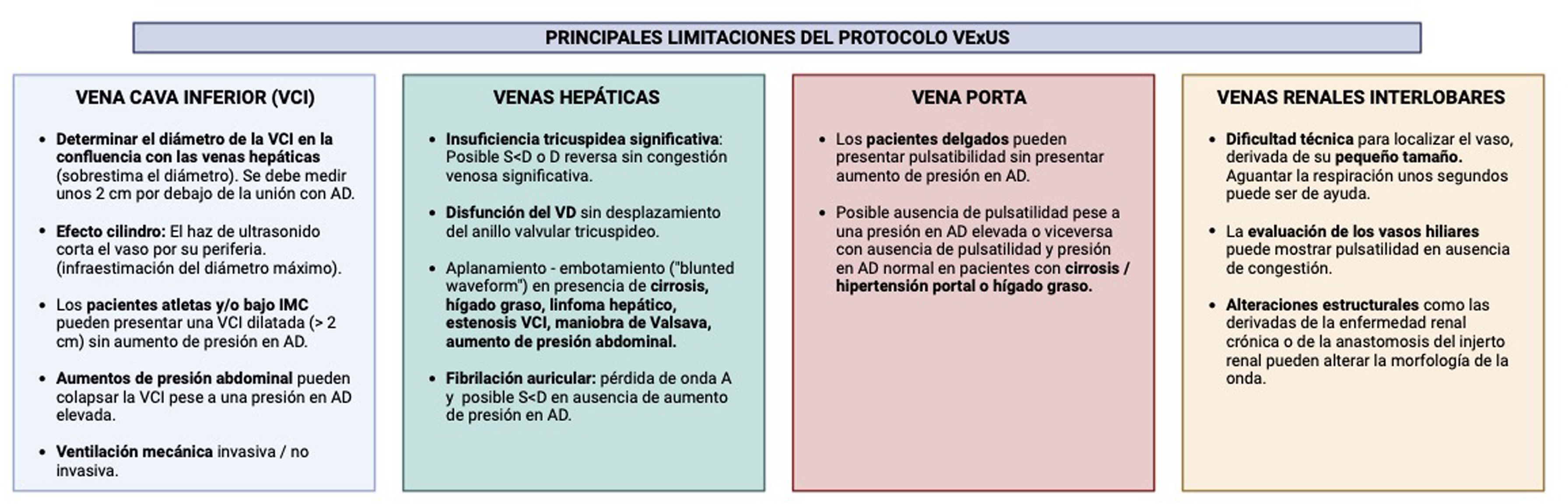
Además, aunque no es objeto de esta revisión una descripción de los principios básicos del VExUS en la determinación del VEC, es importante reconocer las principales limitaciones del mismo con el objetivo de minimizar los errores tanto en la adquisición de las imágenes como en su correcta interpretación (fig. 3).
Fenotipo no congestivoEn presencia de hipovolemia es habitual identificar un patrón de líneas A (artefactos horizontales, paralelos a la línea pleural) mediante LUS, acompañado de la disminución del volumen sistólico medido por la determinación del tamaño del tracto de salida del VI y la integral de la velocidad respecto al tiempo calculada en dicho punto, además de un ratio ventrículo derecho/VI preservado en el plano paresternal eje corto y la presencia de una vena cava inferior (VCI) no dilatada y con una colapsabilidad<50% (presión en aurícula derecha baja).
La presencia de una VCI de diámetro y colapsabilidad normal, en ausencia de líquido libre, indica ausencia de congestión venosa. Sin embargo, como normal general, no permite diferenciar per se al paciente hipovolémico de aquel en situación de euvolemia, aunque hallazgos extremos como una VCI completamente colapsada nos pueden orientar al primer escenario. En esta situación, la estimación del volumen sistólico resulta de ayuda, estando disminuido en caso de hipovolemia como se mencionó anteriormente.
Fenotipo congestivoEn caso de congestión, dependiendo de dónde predomine esta, será posible encontrar derrame pleural o la presencia de líneas B o «cometas pleurales» en la ecografía pulmonar y/o ascitis en la insonación abdominal, una VCI dilatada con colapsabilidad<50%, además de presencia de congestión venosa con un VExUS patológico y en la ecocardioscopia disfunción sistólica y/o diastólica del VI (si la etiología es la IC) tanto con un bajo gasto cardiaco (si IC sistólica), como un gasto cardiaco normal-alto, dilatación del ventrículo derecho y/o aplanamiento del septo interventricular (predominio en diástole si sobrecarga de volumen y sístole-diástole si sobrecarga de presión).
Fenotipo redistributivoAunque congestión y sobrecarga de volumen suelen ir de la mano, no son sinónimos. En ocasiones se produce una redistribución del líquido desde un reservorio venoso como el lecho esplácnico, con aumento del gasto cardiaco secundario y líneas B (solo en caso de aumento de presiones de llenado del VI), con una VCI con adecuada variabilidad, sin un aumento inicial del VEC, como puede objetivarse en determinados escenarios de insuficiencia cardiaca, en la fase inicial del síndrome hepatorrenal o en el paciente séptico. Si la condición que ha precipitado el desarrollo de este escenario no se revierte, la elevada avidez por el sodio y agua en el túbulo renal, así como del desequilibrio entre las presiones hidrostática y oncótica del compartimento intravascular e intersticial, conllevaría de forma más larvada al aumento del VEC.
Escenarios especialesTanto el hipotiroidismo como la insuficiencia suprarrenal han sido descartados del algoritmo por presentar una base fisiopatológica compleja en la que según qué mecanismo predomine, podrá objetivarse o no congestión, con sus diferentes fenotipos, así como un volumen sistólico variable.
En pacientes con mixedema, el acúmulo de mucopolisacáridos a nivel intersticial favorece el acúmulo de agua a este nivel, un bajo VCE y la consecuente liberación no osmótica de ADH19. En el hipotiroidismo grave agudo, como ocurre tras la suspensión del tratamiento con hormona tiroidea previo a la administración de yodo en pacientes con cáncer de tiroides, la disminución del filtrado glomerular y capacidad para excretar agua libre parecen ser el mecanismo predominante. En el hipotiroidismo crónico, la liberación no osmótica de ADH secundaria a un gasto cardiaco disminuido se postula como el principal mecanismo, aunque no es el único. Sin embargo, cada vez más es discutido el hipotiroidismo fuera del mixedema como causa de hipotiroidismo.
En la insuficiencia suprarrenal, los niveles bajos de aldosterona, a priori, favorecen la natriuresis, con desarrollo de hipovolemia y liberación secundaria de ADH. No obstante, muchas veces esta reducción es modesta sumado a que otros factores como el aumento de angiotensina II o de norepinefrina aumentan la reabsorción renal de sodio. Por otro lado, el déficit de glucocorticoides induce reducción de las cifras de presión arterial y del gasto cardiaco con liberación de ADH no osmótica, además de que el aumento de los niveles de hormona liberadora de CRH actúa per se como secretagogo de ADH20–22.
Resolución del caso clínicoEl estudio PoCUS demostraba la presencia de una VCI filiforme, colapsada, con un VExUS SCORE de 0 puntos. A nivel pulmonar presentaba un derrame pleural derecho sin líneas B de cuantía significativa. Por último, destacar la presencia de discreta cuantía de líquido libre abdominal, así como una masa pélvica sugestiva de patología tumoral. Ampliado el estudio con una TAC torácica, abdominal y pélvica urgente, se confirmó la presencia de una masa uterina con compresión de ambos territorios iliacos, así como de derrame pleural derecho y una lesión pulmonar en base derecha sugestiva de metástasis.
Con todo ello y pese a la presencia de derrame pleural, edemas y un sodio en orina bajo, que pudieran haber orientado a una hiponatremia hipervolémica con instauración de tratamiento diurético, se inició sueroterapia con suero salino fisiológico al 0,9% con normalización de las cifras de sodio sérico a las 72h de ingreso.
Este caso refleja la utilidad del PoCUS en situaciones en los que los datos clínicos y bioquímicos no orientan con claridad al diagnóstico. El aclaramiento de agua libre de electrólitos estimado por la eliminación de cationes y el aclaramiento osmolar estimado por la osmolalidad urinaria daban informaciones contradictorias.
Conceptos clave- •
La hiponatremia no es un diagnóstico, sino el resultado de una ganancia de agua libre por una dificultad para excretarla, a causa de una serie de patologías muy variadas que pueden coexistir.
- •
La valoración del VEC constituye un pilar fundamental en su aproximación diagnóstica. Sin embargo, determinarlo únicamente en base a herramientas clásicas conduce con relativa frecuencia a una aproximación diagnóstica y terapéutica errónea.
- •
La ecografía realizada a pie de cama o PoCUS se ha convertido en una herramienta muy útil para complementar la exploración física y los parámetros analíticos en el paciente con hiponatremia.
- •
PoCUS responde a una pregunta concreta de forma rápida, no invasiva y reproducible. Sin embargo, su realización e interpretación no está exenta de limitaciones, por lo que se considera necesario aumentar su presencia en los diferentes programas formativos, tanto de la especialidad como de las sociedades científicas nefrológicas.
Los autores declaran no tener ningún conflicto de intereses.