La paratohormona tiene un papel fundamental en el control del metabolismo mineral. Además es considerada como una toxina urémica al originar daño cardiovascular e influir en la mortalidad cardiovascular del paciente en diálisis. Existen dos métodos de medición denominados de 2.ª generación o PTH intacta (PTHi) y de 3.ª generación o bioPTH (PTHbio).
ObjetivoEvaluar las diferencias en la mortalidad del paciente en diálisis entre ambas formas de medición de PTH, así como el posible papel pronóstico de su cociente.
MétodosSe incluyeron 145 pacientes en hemodiálisis con un seguimiento de 2 años con determinación analítica basal y posteriormente de forma anual.
ResultadosVeintiún pacientes fallecieron el primer año y 28 el segundo. No se encontró correlación entre PTHi, PTHbio y cociente PTHbio/PTHi con la mortalidad. Ambas PTH tienen una buena correlación entre ellas y correlacionan de manera similar con otras moléculas del metabolismo mineral. Los valores basales de PTH extremos son los de mayor mortalidad. En la supervivencia por tramos de PTHi (según guías y estudio COSMOS) se observa una curva en J. A mayor aumento de PTHi el cociente desciende, posiblemente al aumentar los fragmentos no 1-84. No existe una mayor aproximación pronóstica sobre mortalidad con PTHbio que con PTHi. No se observan diferencias en el valor predictivo del cociente sobre la mortalidad. Tampoco hubo diferencias en mortalidad cuando se analiza la progresión del cociente PTHbio/PTHi.
ConclusionesNo encontramos ventajas en la utilización de PTHbio sobre la PTHi como marcador de mortalidad. Se deben reevaluar los límites de la PTHbio pues su relación con la PTHi no es constante. El no conocer esos límites condiciona su utilidad pronóstica.
Parathormone plays a key role in controlling mineral metabolism. PTH is considered a uremic toxin causing cardiovascular damage and cardiovascular mortality in dialysis patients. There are two different assays to measure PTH called 2nd generation or intact PTH (iPTH) and 3rd generation or bioPTH (PTHbio).
ObjectiveTo evaluate the differences in mortality of dialysis patients between both assays to measure PTH, as well as the possible prognostic role of the PTHbio/iPTH ratio.
Methods145 haemodialysis patients were included with 2-year monitoring including baseline laboratory test and annually thereafter.
Results21 patients died in the first year and 28 in the second. No correlation was found between PTH, PTHbio and PTHbio/iPTH ratio with mortality. Both PTH have a perfect correlation between them and correlate similarly with other molecules of the mineral metabolism. The extreme baseline values of PTH are those of higher mortality. In survival by iPTH intervals (according to guidelines and COSMOS study), a J curve is observed. When iPTH increases, the ratio decreases, possibly when increasing fragments no. 1-84. There is no greater prognostic approximation on mortality with PTHbio than PTHi. There was also no difference in mortality when progression ratio PTHbio/PTHi was analysed.
ConclusionsWe didn’t find any advantages to using bioPTH vs. PTHi as a marker of mortality. BioPTH limits of normality must be reevaluated because its relationship with iPTH is not consistent. Not knowing these limits affects its prognostic value.
La parathormona (PTH) es una proteína de 84 aminoácidos, con una función bien conocida en la regulación del metabolismo mineral que actúa sobre hueso, riñón e intestino entre otros órganos. Pese a ser una hormona, en el caso del paciente renal se cataloga como una verdadera toxina urémica por aumentar progresivamente en el transcurso de la enfermedad renal crónica (ERC), y ser responsable de múltiples efectos sistémicos1,2. Está incluida dentro de la clasificación de toxinas urémicas que originan daño cardiovascular3,4.
La PTH es una hormona con un importante papel en el control de las alteraciones del metabolismo mineral. Gran parte de los esfuerzos terapéuticos encaminados a controlar estas alteraciones lo son para un adecuado control de la PTH. Sin embargo, la PTH de los pacientes en hemodiálisis es un mal marcador de mortalidad. Solo grandes estudios permiten conocer los valores de PTH que se relacionan con una mayor mortalidad. Y en esos estudios los resultados son muy variables4–8.
Sin embargo otras moléculas como el calcio y fósforo han demostrado un mejor significado pronóstico sobre mortalidad, junto con la vitamina D, aunque con esta los resultados son menos concluyentes9,10.
La PTH circulante es una mezcla de péptidos como son la forma completa 1-84 y fragmentos de menor tamaño resultado del catabolismo de la PTH, denominados fragmentos no 1-84 o carboxiterminales. Solo la PTH 1-84 (proteína completa) es responsable de su actividad. Por otra parte, ciertos fragmentos carboxiterminales tienen una acción antagónica a la PTH 1-84. Al aclararse por el riñón, la PTH circulante varía en la proporción de estos péptidos según el estadio de ERC. Los métodos actualmente usados en la práctica clínica son de dos tipos. El denominado de 2.ª generación, llamado PTH intacta (PTHi) que mide la molécula 1-84 y multitud de fragmentos no 1-84. El otro es el método de 3.ª generación también llamada PTHbio, comercializados recientemente, y que determinan solo la PTH 1-84, aunque su uso no se está aún generalizado11,12.
En un intento de asociar la información de ambas moléculas, algunos autores han propugnado la utilidad de la proporción de estas moléculas mediante el ratio PTHbio/PTHi como marcador de la situación ósea13,14 y de mortalidad15.
En la práctica clínica existen en la actualidad dos criterios para definir los valores de normalidad de la PTH. El primero, y más clásico definido por las Guías KDOQI16 y las Guías SEN17, fue el histomorfométrico. En ese momento existían evidencias por biopsia ósea de que con una PTHi por debajo de 150pg/ml y por encima de 300pg/ml existen alteraciones óseas. Los valores de normalidad establecidos en estos casos, lo son por la relación con las lesiones observadas en la biopsia ósea18. Esos valores perduran aún en la mayoría de las recomendaciones. El otro criterio fue el de mortalidad. Existen varios estudios que encuentran incremento de la mortalidad con los valores extremos, pero con valores mucho más altos de 300pg/ml. Así, las Guías KDIGO19, definieron entre 2-9 veces los valores de normalidad de la PTHi como criterio a seguir. Sin embargo ambos criterios no dejan tranquila a la comunidad nefrológica. El reciente estudio COSMOS ha encontrado, en una amplia cohorte de pacientes seguidos durante 5 años, que los valores entre los cuales hay menos mortalidad están entre 168-674pg/ml20, muy similar a las recomendaciones KDIGO. Los autores del estudio COSMOS recomiendan modificar los valores de referencia de la PTHi actuales basados en los estudios histomorfométricos óseos, por otros de supervivencia. Aunque existen resultados contradictorios, parece que la mortalidad asociada a la PTH sérica describe una curva en J, con mayor mortalidad en los pacientes con valores más bajos y más altos. Pero además existe una variabilidad entre las diferentes casas comerciales que tienen métodos de 2.ª generación en la determinación de la PTH21 lo que dificulta la interpretación de los resultados.
La medición de la PTH plantea varios problemas a la hora de interpretar sus valores, así como a la hora de seleccionar los valores de normalidad a usar cuando se está tratando a un paciente renal. ¿Qué valores de normalidad usar?, ¿los derivados de estudios histomorfométricos?, ¿los de mortalidad?, ¿ambos?, ¿con qué método medir la PTH, de 2.ª o de 3.ª generación?
En este estudio hemos estudiado las diferencias en mortalidad entre métodos de medida de la PTH de 2.ª y 3.ª generación en un grupo de pacientes seguidos durante 2 años. Además hemos valorado el cociente PTHbio/PTHi como posible marcador de mortalidad, por si la proporción de las moléculas circulantes pudiera ser un marcador. Además hemos analizado la asociación entre mortalidad y PTHi sérica, para lo que hemos puesto los intervalos a analizar siguiendo los criterios KDOQI (150-300pg/ml) y COSMOS (168-674pg/ml) y hemos determinado qué valores representan mejor los criterios de mortalidad.
Material y métodosSe trata de un estudio prospectivo, en condiciones de práctica clínica de dos años de duración. El objetivo principal de este estudio es determinar la influencia de la PTH sérica sobre la supervivencia del paciente en hemodiálisis. En él se incluyeron 145 pacientes en hemodiálisis pertenecientes a un solo centro, a los cuales se realizó una determinación analítica basal, y posteriormente un seguimiento de dos años. Hemos determinado parámetros clínicos y analítica basal en la que se determinó la PTH por 2 métodos diferentes, uno de 2.ª y otra de 3.ª generación, así como calcio, fósforo, fosfatasa alcalina y fosfatasa alcalina ósea, el FGF23, la 25(OH)-vitamina D, y marcadores de remodelado. Los valores de PTH-intacta (PTHi) o PTH de 2.ª generación se determinaron por un método de electroquimioluminiscencia realizado en el autoanalizador Elecsys (Roche), que utiliza un anticuerpo dirigido contra los aminoácidos 26-32 de la molécula y otro contra la zona 55-64. Debido a ello no detecta los fragmentos carboxiterminales cortos, pero sí la PTH 1-84 y los fragmentos largos 7-84 y la amino-PTH11 (coeficientes de variación intra- e interensayo son <2,5 y <3% respectivamente y sensibilidad del método 1,2pg/ml). Los valores de PTHi fueron normalizados según las fórmulas de la SEN a la PTHi de Allegro. Los valores de la PTH de 3.ª generación o PTH-bio se determinaron por un método de electroquimioluminiscencia realizado en el autoanalizador Elecsys (Roche), que utiliza un anticuerpo dirigido contra los aminoácidos 1-4 de la molécula y otro contra la zona 55-64, midiendo la molécula 1-84 y la amino-PTH11 (coeficientes de variación intra- e interensayo son <3 y <6% respectivamente y la sensibilidad del método es 5,50pg/ml). Los valores de normalidad de la PTHbio fueron definidos como el 50% del valor de la PTHi15.
Se realizó también el cálculo del cociente entre las moléculas PTHbio/PTHi con el fin de determinar la proporción de fragmentos 7-84.
En el seguimiento anual y a los dos años, se hizo un registro de pacientes fallecidos por cualquier causa y se determinaron de nuevo parámetros analíticos generales, del metabolismo mineral, inflamación y nutrición. Tanto en la analítica anual como en la de los dos años, la PTH medida fue la de 2.ª generación o PTHi.
Mediante el autoanalizador ADVIA CENTAUR 2400 se determinaron la albúmina sérica (técnica de unión al colorante verde de bromocresol; coeficientes de variación intra- e interensayo son <1,3 y <2%, y la sensibilidad del método es 1g/dl), el calcio sérico (técnica del arsenazo III; coeficientes de variación intra- e interensayo son <1,2 y <2%, y la sensibilidad del método es 0,5mg/dl), la creatinina sérica (técnica del picrato alcalino; coeficientes de variación intra- e interensayo son <3,1 y <4%, y la sensibilidad del método es 0,2mg/dl), el fósforo inorgánico sérico (técnica del fosfomolibdato UV; coeficientes de variación intra- e interensayo son <2,2 y <3%, y la sensibilidad del método es 0,3mg/dl), las proteínas totales séricas (técnica del biuret; coeficientes de variación intra- e interensayo son <1,3 y <2%, y la sensibilidad del método es 2g/dl), la PCR (técnica turbidimétrica potenciada con látex; coeficientes de variación intra- e interensayo son<4,9 y <6%, y la sensibilidad del método es 0,003mg/dl), y la fosfatasa alcalina sérica (hidrólisis el p-nitrofenil fosfato; coeficientes de variación intra- e interensayo son <1,9 y <2,4%, y la sensibilidad del método es 5U/l).
Los valores de prealbúmina sérica se determinaron en un autoanalizador SPA plus mediante turbidimetría, con coeficientes de variación intra- e interensayo son <4,4 y <6% respectivamente y sensibilidad de 0,006g/l.
Los valores de vitamina D total (25[OH] vitamina D2 y D3) se determinaron por un método de electroquimioluminiscencia realizado en el autoanalizador Elecsys (Roche) con coeficientes de variación intra- e interensayo son <7,5 y <8% respectivamente y sensibilidad de 3ng/ml.
El factor de crecimiento fibroblástico 23 (FGF-23) en plasma (C-terminal) se determinó mediante un método de ELISA (Immutopics, EE. UU.) utilizando 2 anticuerpos policlonales dirigidos hacia la fracción C-terminal del FGF-23 (coeficientes de variación intra- e interensayo son <1,7 y <3,5%, respectivamente y la sensibilidad del método es de 1,5 RU/ml).
La isoenzima ósea de la fosfatasa alcalina se determinó en suero mediante ELISA (OSTASE BAP, IDS, UK) (coeficientes de variación intra- e interensayo son <4,5 y <6,4% respectivamente y la sensibilidad del método es 0,7μg/l).
La determinación del propéptido C terminal del procolágeno tipo I (PINP) y del β-Cross Laps (β-CTX) en suero se realizó mediante electroquimioluminiscencia en el autoanalizador Elecsys (Roche) (para el PINP coeficientes de variación intra- e interensayo son <2,9 y <3,7% respectivamente y la sensibilidad del método es 5μg/l; para el β-CTX, coeficientes de variación intra- e interensayo son <4,6 y <4,7% respectivamente y sensibilidad del método es 0,07ng/ml).
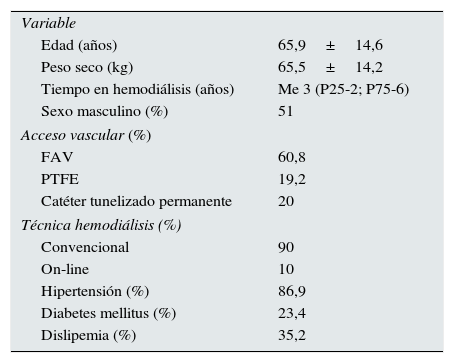
ResultadosSe han estudiado de una manera prospectiva a 145 pacientes en hemodiálisis durante dos años, de los cuales un 49% eran mujeres. En la tabla 1 se expresan los datos basales de la población estudiada, tanto analíticos como clínicos. Un 85,1% de los pacientes estaban con algún activador del receptor de vitamina D, y un 17,9% con cinacalcet.
Características demográficas y clínicas y valores analíticos basales de la población estudiada
| Variable | |
| Edad (años) | 65,9±14,6 |
| Peso seco (kg) | 65,5±14,2 |
| Tiempo en hemodiálisis (años) | Me 3 (P25-2; P75-6) |
| Sexo masculino (%) | 51 |
| Acceso vascular (%) | |
| FAV | 60,8 |
| PTFE | 19,2 |
| Catéter tunelizado permanente | 20 |
| Técnica hemodiálisis (%) | |
| Convencional | 90 |
| On-line | 10 |
| Hipertensión (%) | 86,9 |
| Diabetes mellitus (%) | 23,4 |
| Dislipemia (%) | 35,2 |
| M±DE | |
|---|---|
| Hemoglobina (g/dl) | 11,8±1,6 |
| Hematocrito (%) | 35,5±4,6 |
| Urea (mg/dl) | 117,7±36,5 |
| Proteínas totales (g/dl) | 6,5±0,6 |
| Albúmina (g/dl) | 3,6±0,4 |
| Hierro (μg/dl) | 65,4±28 |
| Índice saturación hierro (%) | 31,7±14,3 |
| Calcio (mg/dl) | 9,2±0,7 |
| Fósforo (mg/dl) | 4,7±1,6 |
| CO2 | 21,4±3,5 |
| Colesterol total (mg/dl) | 158±35 |
| Prealbúmina (mg/dl) | 33±10 |
| Ferritina (ng/dl) | 406±242,1 |
| Me (P25;P75) | |
|---|---|
| Fosfatasa alcalina ósea (μg/l) | 29,6 (20,7;41,9) |
| PINP (μg/l) | 255,3 (161,2;486,6) |
| β-CTX (ng/ml) | 1,8 (1,3;2,5) |
| PTH 2.ª gen o PTHi (pg/ml) | 205 (116,5;386,1) |
| PTH 3.ª gen o PTHbio (pg/ml) | 119,5 (76,2; 240 |
| Cociente PTHbio/PTHi | 0,61 (0,56;0,68) |
| 25OH-vitamina D (ng/dl) | 22,9 (12,7;34,2) |
| Creatinina (mg/dl) | 7,6 (5,6;9,1) |
| Fosfatasa alcalina (UI/l) | 111 (89;145) |
| Triglicéridos (mg/dl) | 146 (102;193) |
| Proteína C reactiva (mg/dl) | 0,6 (0,25;1,97) |
| ProBNP (pg/ml) | 8325 (3422;17450) |
| FGF-23 (RU/ml) | 788 (384;3258) |
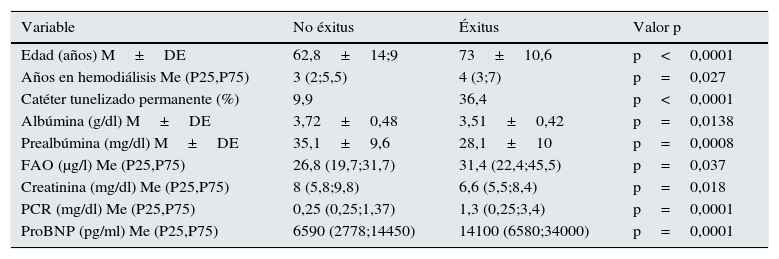
Durante el seguimiento 21 pacientes fallecieron en el primer año y 28 en el segundo. Cuando analizamos los factores clínicos y analíticos responsables observamos aquellos que se correlacionan con mortalidad (tabla 2). Los parámetros relacionados con mortalidad fueron la albúmina, prealbúmina, proteína C reactiva, ProBNP, creatinina, edad, tipo de acceso vascular, así como la fosfatasa alcalina ósea. Sin embargo los valores de PTH tanto de 2.ª (PTHi) como de 3.ª generación (PTHbio) de los pacientes que fallecieron y los que no, no son significativos. Tampoco se relacionó el cociente, PTHi o PTHbio en valores absolutos.
Variables que han presentado relación con mortalidad en la población estudiada
| Variable | No éxitus | Éxitus | Valor p |
|---|---|---|---|
| Edad (años) M±DE | 62,8±14;9 | 73±10,6 | p<0,0001 |
| Años en hemodiálisis Me (P25,P75) | 3 (2;5,5) | 4 (3;7) | p=0,027 |
| Catéter tunelizado permanente (%) | 9,9 | 36,4 | p<0,0001 |
| Albúmina (g/dl) M±DE | 3,72±0,48 | 3,51±0,42 | p=0,0138 |
| Prealbúmina (mg/dl) M±DE | 35,1±9,6 | 28,1±10 | p=0,0008 |
| FAO (μg/l) Me (P25,P75) | 26,8 (19,7;31,7) | 31,4 (22,4;45,5) | p=0,037 |
| Creatinina (mg/dl) Me (P25,P75) | 8 (5,8;9,8) | 6,6 (5,5;8,4) | p=0,018 |
| PCR (mg/dl) Me (P25,P75) | 0,25 (0,25;1,37) | 1,3 (0,25;3,4) | p=0,0001 |
| ProBNP (pg/ml) Me (P25,P75) | 6590 (2778;14450) | 14100 (6580;34000) | p=0,0001 |
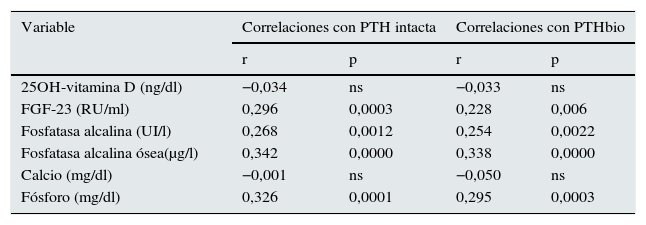
Debemos recordar que el objetivo principal de este estudio es intentar definir el efecto que sobre la mortalidad tienen los valores de PTH tanto de 2.ª como de 3.ª generación, así como el cociente entre ambas. La PTH de 2.ª generación (PTHi) y la PTH de 3.ª generación (PTHbio) tienen una buena correlación entre ellas. Las correlaciones de la PTH tanto de 2.ª generación como de 3.ª, son similares con otras moléculas del metabolismo mineral (tabla 3).
Correlaciones de PTH de 2.ª y 3.ª generación (ambas determinaciones tienen correlaciones similares con moléculas del metabolismo mineral)
| Variable | Correlaciones con PTH intacta | Correlaciones con PTHbio | ||
|---|---|---|---|---|
| r | p | r | p | |
| 25OH-vitamina D (ng/dl) | −0,034 | ns | −0,033 | ns |
| FGF-23 (RU/ml) | 0,296 | 0,0003 | 0,228 | 0,006 |
| Fosfatasa alcalina (UI/l) | 0,268 | 0,0012 | 0,254 | 0,0022 |
| Fosfatasa alcalina ósea(μg/l) | 0,342 | 0,0000 | 0,338 | 0,0000 |
| Calcio (mg/dl) | −0,001 | ns | −0,050 | ns |
| Fósforo (mg/dl) | 0,326 | 0,0001 | 0,295 | 0,0003 |
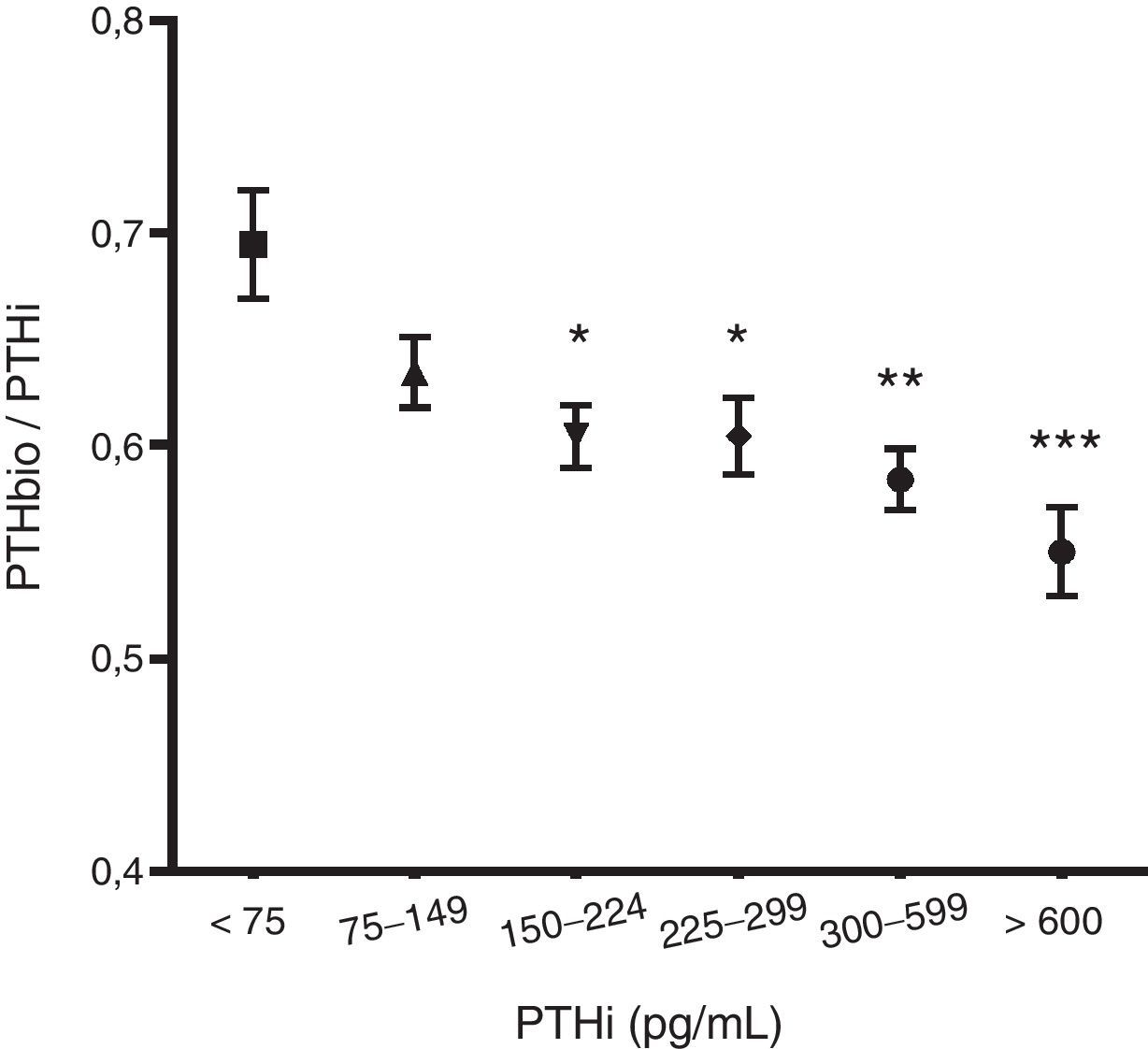
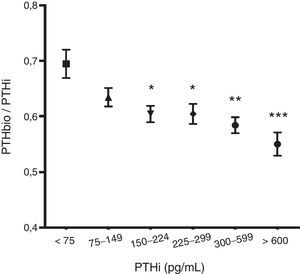
Al analizar el cociente de PTHbio/PTHi observamos que a medida que se eleva el valor de la PTHi el cociente disminuye, sugiriendo que, aunque la PTH 1-84 se incremente, aumentan más los fragmentos no 1-84, probablemente debido a un aumento de la degradación de PTH conforme aumenta la mólecula 1-84 (fig. 1).
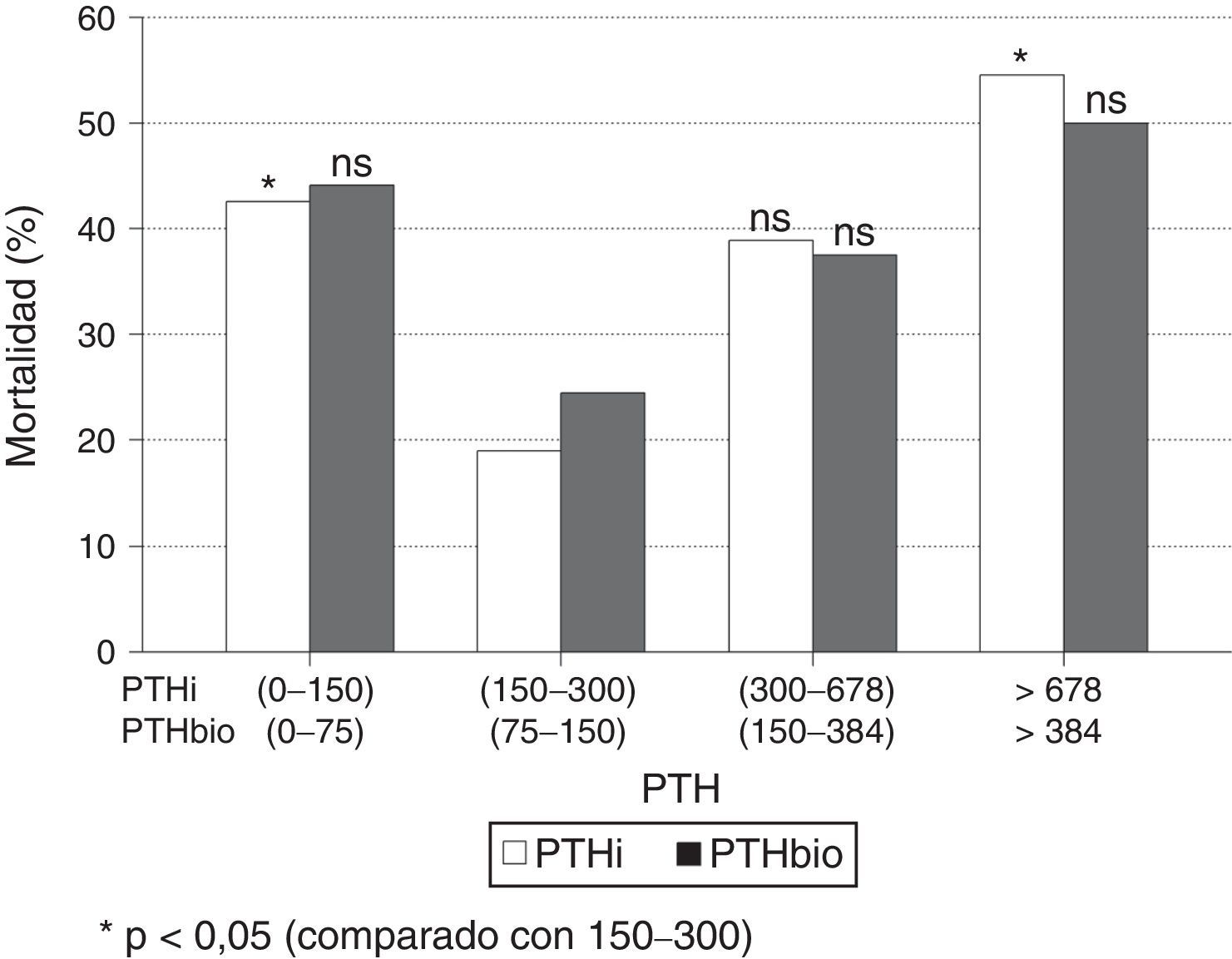
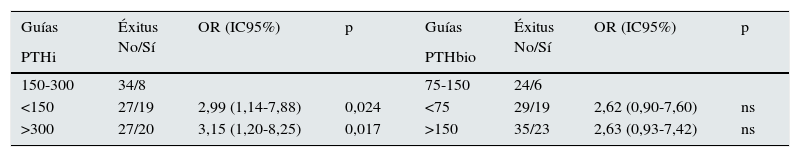
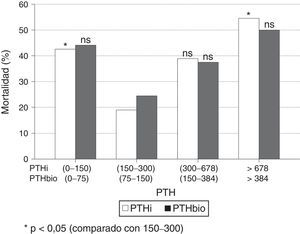
Al estratificar los pacientes por intervalos de PTH, se observa un incremento significativo de mortalidad en aquellos enfermos con valores extremos de PTHi: mayores de 678pg/ml y menores de 150pg/ml, con respecto al grupo de pacientes con PTH entre 150-300pg/ml (fig. 2); esta diferencia es significativa. Aunque la mortalidad es mayor entre los pacientes con PTHi entre 300 y 678pg/ml que en aquellos cuya PTHi es 150-300pg/ml (fig. 2), esta diferencia no alcanza significación estadística. Con la PTHbio calculada como el 50% de la PTHi las diferencias no son significativas, en los mismos intervalos.
Si comparamos de forma independiente la mortalidad con los valores definidos en las actuales guías SEN y KDOQI de PTHi (150-300pg/ml) y los valores establecidos por el estudio COSMOS (164-678pg/ml) (tabla 4), el riesgo relativo de mortalidad es solo significativo con PTH superiores a 300 pgml e inferiores a 150pg/ml. Esto implica que los pacientes con PTHi superior a 300 tienen mayor mortalidad solo cuando se incluyen a los que tienen una PTHi mayor de 678pg/ml. En nuestro estudio la PTHi muestra un mejor valor predictivo de mortalidad que la PTHbio teniendo como referencia 150-300 (75–150) pg/ml, pero lo es gracias a los pacientes con PTH más altas (tabla 4).
Comparación de mortalidades con métodos de PTH intacta (PTHi) y PTHbio con los valores de referencia establecidos por Guías SEN y KDOQI (150-300pg/ml) y por los del estudio COSMOS (168-674pg/ml)
| Guías | Éxitus No/Sí | OR (IC95%) | p | Guías | Éxitus No/Sí | OR (IC95%) | p |
|---|---|---|---|---|---|---|---|
| PTHi | PTHbio | ||||||
| 150-300 | 34/8 | 75-150 | 24/6 | ||||
| <150 | 27/19 | 2,99 (1,14-7,88) | 0,024 | <75 | 29/19 | 2,62 (0,90-7,60) | ns |
| >300 | 27/20 | 3,15 (1,20-8,25) | 0,017 | >150 | 35/23 | 2,63 (0,93-7,42) | ns |
| Cosmos | Éxitus No/Sí | OR (IC95%) | p | Cosmos | Éxitus No/Sí | OR (IC95%) | p |
|---|---|---|---|---|---|---|---|
| PTHi | PTHbio | ||||||
| 168-674 | 47/22 | 84-337 | 56/27 | ||||
| <168 | 36/20 | 1,19 (0,56-2,50) | ns | <84 | 25/15 | 1,24/0,57-2,74) | ns |
| >674 | 5/6 | 2,56 (0,71-9,32) | ns | >337 | 7/7 | 2,07 (0,66-6,51) | ns |
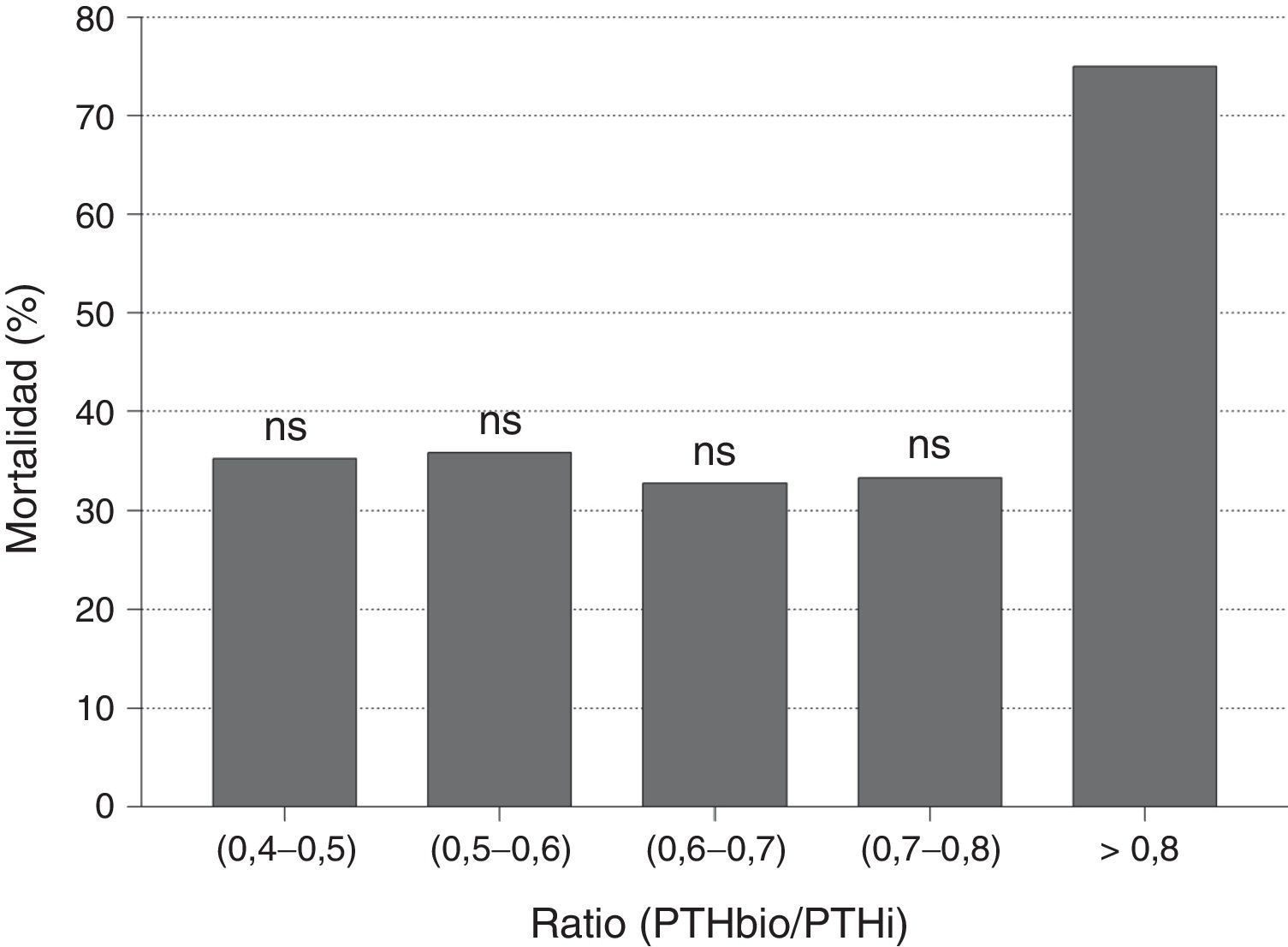
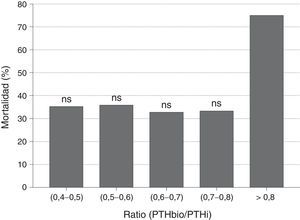
Cuando analizamos el valor predictivo del cociente PTHbio/PTHi sobre la mortalidad no se observaron diferencias entre los pacientes que fallecen y los que no. Igualmente no se observaron diferencias en mortalidad cuando se analiza por quintiles el cociente PTHbio/PTHi, con lo que no parece ser un marcador de mortalidad (fig. 3). El valor superior a 0,8 tiene una mayor mortalidad, pero al ser un grupo muy reducido de pacientes esta diferencia no es significativa.
DiscusiónLas alteraciones del metabolismo mineral son un factor de riesgo cardiovascular en el paciente renal con una alta importancia22. Sin embargo es la PTH la que tiene un menor peso como marcador de morbimortalidad en el paciente renal. En nuestro estudio observamos cómo la PTH no es un marcador de mortalidad cuando se analiza en conjunto con otros factores de más peso como edad, años en diálisis, albúmina o acceso vascular. Sin embargo es un importante modulador de todas las alteraciones de este metabolismo, por lo que no se debe descuidar su control. Como observamos la PTHbio y PTHi se correlacionan muy bien con otros parámetros como fósforo, FGF23, fosfatasa alcalina ósea y años de diálisis. Todos con una alta relación con morbimortalidad. De hecho muchos grupos encuentran un mayor interés en relacionar varios parámetros de metabolismo mineral como marcador de mortalidad9.
Pero el objetivo principal de este trabajo ha sido definir no solo el papel de la PTH como marcador de mortalidad, sino conocer con qué tipo de ensayos y con qué valores de referencia debemos de trabajar. Esto puede aclarar más el cómo interpretar la PTH en la práctica clínica diaria.
La relación PTHi y mortalidad es controvertida. Algunos autores no encuentran que la PTHi sea un predictor de mortalidad9, aunque la mayoría de los estudios encuentran que la PTHi puede ser un marcador de mortalidad, si bien los resultados son muy variables. Cuando analizamos la mortalidad observamos que aunque los valores establecidos de 150-300pg/ml lo fueron por criterios histomorfométricos, representan también valores que sirven como puntos de inflexión en la mortalidad. No todos los estudios encuentran una mortalidad con curva de J como muestra el metaanálisis de Natoli et al.8. En nuestro caso la curva de mortalidad que encontramos sí tiene forma de J, donde los valores con menor mortalidad se encuentran dentro del intervalo de PTHi de 150-300pg/ml.
Al igual que otros autores23, encontramos una correlación entre la PTHi y la PTHbio. En un principio, según esos parámetros y una vez ajustados los valores de normalidad podrían usarse indistintamente. Además ambas determinaciones se correlacionan con los mismos parámetros clínicos y analíticos, por lo que no demuestran una diferencia que haga pensar que uno de los métodos aporte ventaja sobre el otro. Es conocido que a medida que desciende el filtrado glomerular aumentan los fragmentos no 1-8424. Sí llama la atención cómo a medida que la PTH 1-84 aumenta, lo hacen también estos fragmentos, aunque lo hacen en mayor medida que la propia molécula 1-84. Como los fragmentos no 1-84 tienen una acción antagónica con la PTH 1-84, se podría suponer que a un mayor valor de PTHi, los efectos sistémicos, especialmente óseos, se verían reducidos por estas moléculas. Este aspecto deberá ser estudiado para conocer su importancia. Estos cambios en la proporción de fragmentos tienen importancia a la hora de definir los valores de normalidad de la PTHbio.
Sin embargo en nuestro estudio no observamos que los pacientes con ratio PTHbio/PTHi bajo tengan una menor mortalidad por aumento de los fragmentos 7-84, lo que parece indicar que la molécula de PTH 1-84 tiene un papel relevante sobre la mortalidad de estos pacientes.
En la literatura se definen los valores de normalidad de la PTHbio como un 54% de la PTHi15. Sin embargo en nuestro estudio se observa que esta proporción varía al modificarse la PTHi. Es decir a mayor PTH 1-84 los fragmentos no 1-84 aumentan en mayor medida que lo hace la propia 1-84. Por lo tanto, actualmente se desconocen los valores de normalidad de la PTH 1-84 medida por métodos de 3.ª generación en el paciente en hemodiálisis, pues no están aún establecidos estos en ninguna recomendación. Según nuestros resultados los límites de PTHbio deben ser más estrechos, pues a medida que aumenta la PTH 1-84 también lo hacen en mayor proporción los fragmentos no 1-84, lo que podría tener importancia a la hora de establecer los valores de normalidad de PTHbio. No se conoce aún cómo interpretar los valores de PTHbio al eliminar el factor de distorsión que suponen los fragmentos no 1-84, pues no existen estudios a ese fin. Asumir la PTHbio como el 50-54% de la PTHi no nos parece correcto, pues no corresponde a la realidad. Se debe realizar un estudio multicéntrico con un gran número de pacientes para definir estos valores.
El estudio COSMOS encuentra cómo una PTHi hasta 674ng/ml puede ser establecida como límite superior del intervalo de referencia en cuanto mortalidad. En nuestro estudio no encontramos, al igual que otros autores25, una mayor mortalidad en los pacientes con PTHi entre 300-674 que en aquellos con PTHi entre 150-300ng/ml. Estos resultados nos hacen ser prudentes antes de establecer el valor de 678ng/ml como valor de referencia superior en el paciente en hemodiálisis. La mortalidad es significativa por encima de 678pg/ml, pero no debemos en ningún caso alcanzar esa cifra como valor de seguridad. La significación estadística en un sentido o en otro no debe hacernos pensar que un aumento de PTHi de hasta 9 veces los valores de normalidad, sea seguro. Está claro que una PTHi tan elevada representa posiblemente una serie de alteraciones del metabolismo mineral que pueden repercutir negativamente en el paciente renal. Existe una zona de confianza entre 300-678pg/ml en la que la mortalidad es baja pero pensamos que estar cerca de 300 es más seguro que de 678pg/ml.
El cociente PTHbio (1-84)/PTHi (1-84+no 1-84) ha sido estudiado como marcador de cambios histomorfométricos y como marcador de mortalidad, para intentar tener en cuenta la implicación de las moléculas 1-84 y no 1-84 sobre el hueso y supervivencia. Sin embargo la evidencia es aún escasa. Al igual que el estudio de Melamed et al.15, nuestros resultados muestran que el cociente no se asocia a mortalidad. Otros autores han encontrado que el cociente PTHbio/PTHi sí es un buen marcador de mortalidad en varones en hemodiálisis26. Aquellos pacientes con niveles mayores de cociente PTHbio/PTHi tendrían mayor mortalidad.
Las limitaciones de nuestro estudio son varias. La muestra estudiada es pequeña, pues es necesario un grupo de valores extremos de PTH más amplio. Otra limitación de nuestro estudio es haber realizado la PTHbio solo en el momento basal y no en revisiones sucesivas.
ConclusionesSegún nuestros resultados los valores de PTHi definidos por criterios histomorfométricos son unos límites acertados como marcadores de mortalidad del paciente en hemodiálisis, y con una muestra muy inferior, el valor 300pg/ml define mejor el punto de corte superior que el 674 definido en el estudio COSMOS, aunque la mortalidad entre 150-300 y 300-678pg/ml es la misma. Los métodos de 3.ª generación que definen la PTHbio no aportan mayor precisión a la hora de definir mortalidad, si bien los valores de normalidad de PTHi no están bien definidos, por lo que posiblemente no puedan compararse la PTHi y la PTHbio con los valores planteados actualmente. El cociente PTHbio/PTHi no es un buen marcador de mortalidad.
Conflicto de interesesRoche España ha financiado los métodos de determinación de la PTHbio. No han influido ni en el diseño ni la elaboración de esta publicación.
Agradecimiento a Maribel Villarino por su ayuda durante el desarrollo del trabajo. L.R-O es profesional en Formación en Investigación Sanitaria «Río Hortega» (CM13/00131), Ministerio de Educación, Gobierno de España. R.V-B es un profesional con contrato posdoctoral «Sara Borrell» (CD14/00198) y por un proyecto (SAF2014-60699-JIN) del Ministerio de Economía (MINECO) y Competitividad en asociación a fondos FEDER. PI14/00386. PI16/01298. FEDER funds ISCIII-RETIC REDinREN/RD06/0016, RD12/0021.