La enfermedad linfoproliferativa difusa postrasplante (ELPD) es un grupo heterogéneo de enfermedades que se caracteriza por una proliferación de linfocitos después de un trasplante de órgano sólido y que presenta un espectro que comprende desde hiperplasias a agresivos linfomas.
Material y métodosHemos evaluado, en un estudio observacional multicéntrico retrospectivo que incluye 21.546 receptores adultos de trasplante renal simple trasplantados en España de 1990 al 2009, la incidencia de ELPD durante un periodo de 22 años, su relación con el virus de Epstein-Barr, los factores de riesgo clásico y su pronóstico.
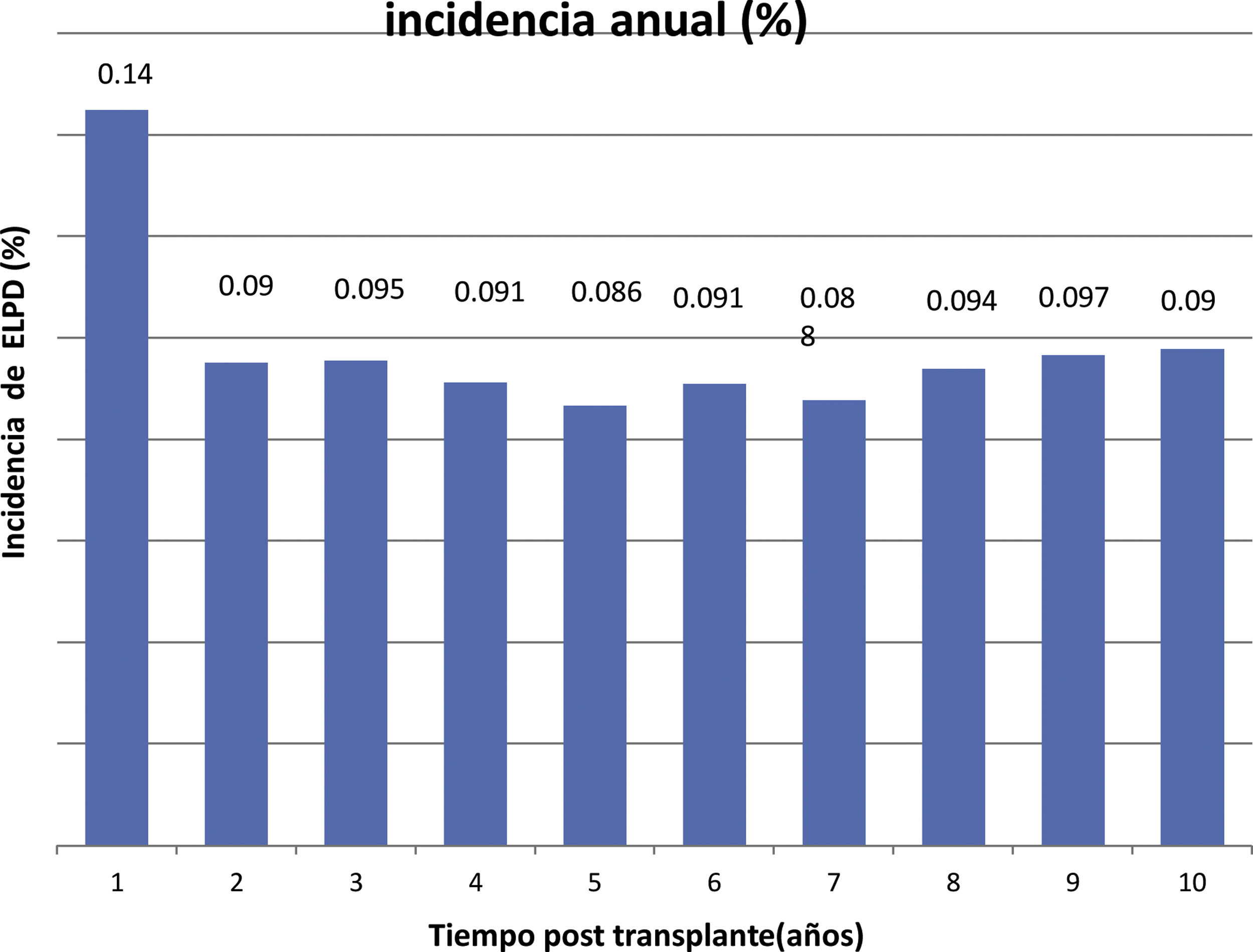
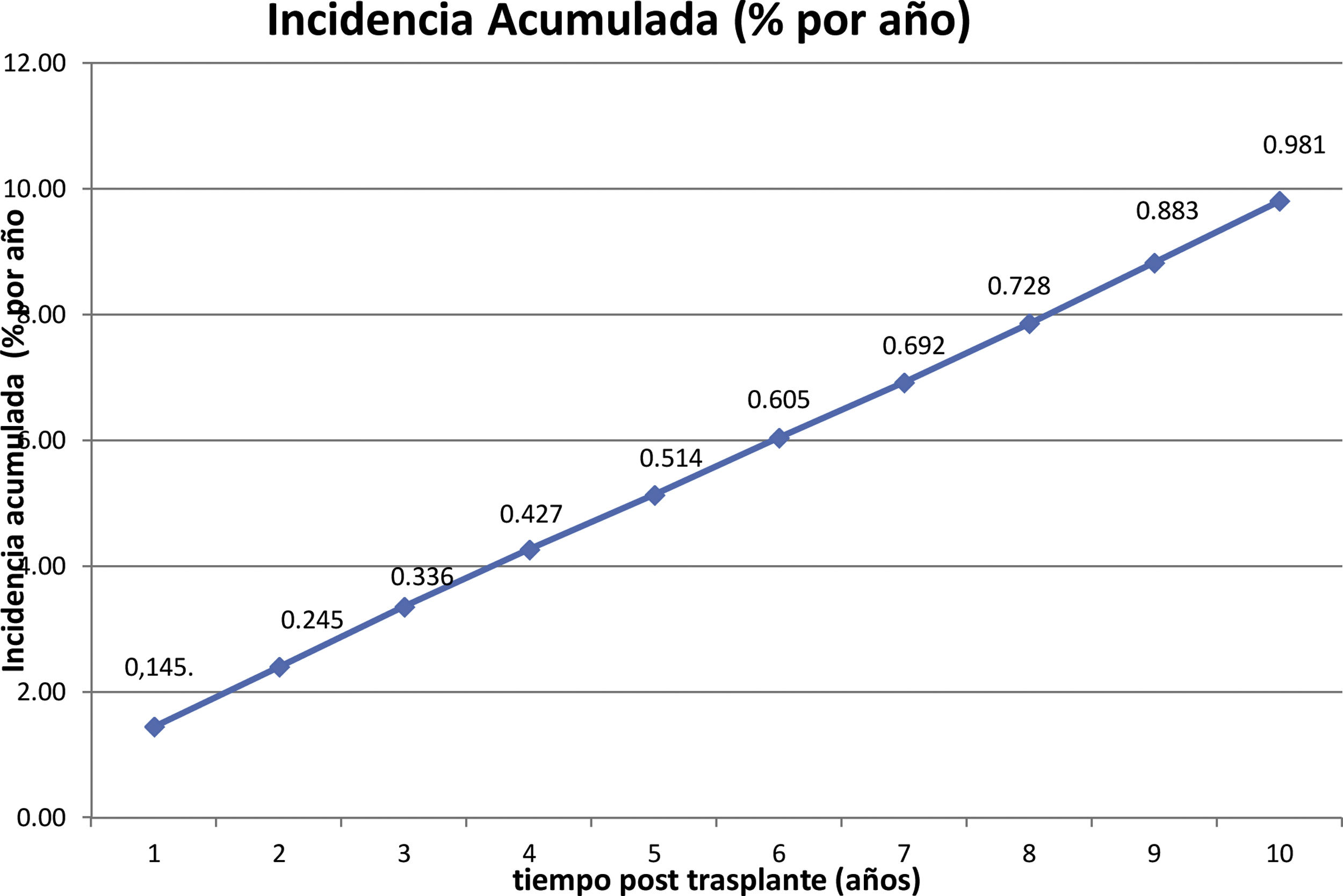
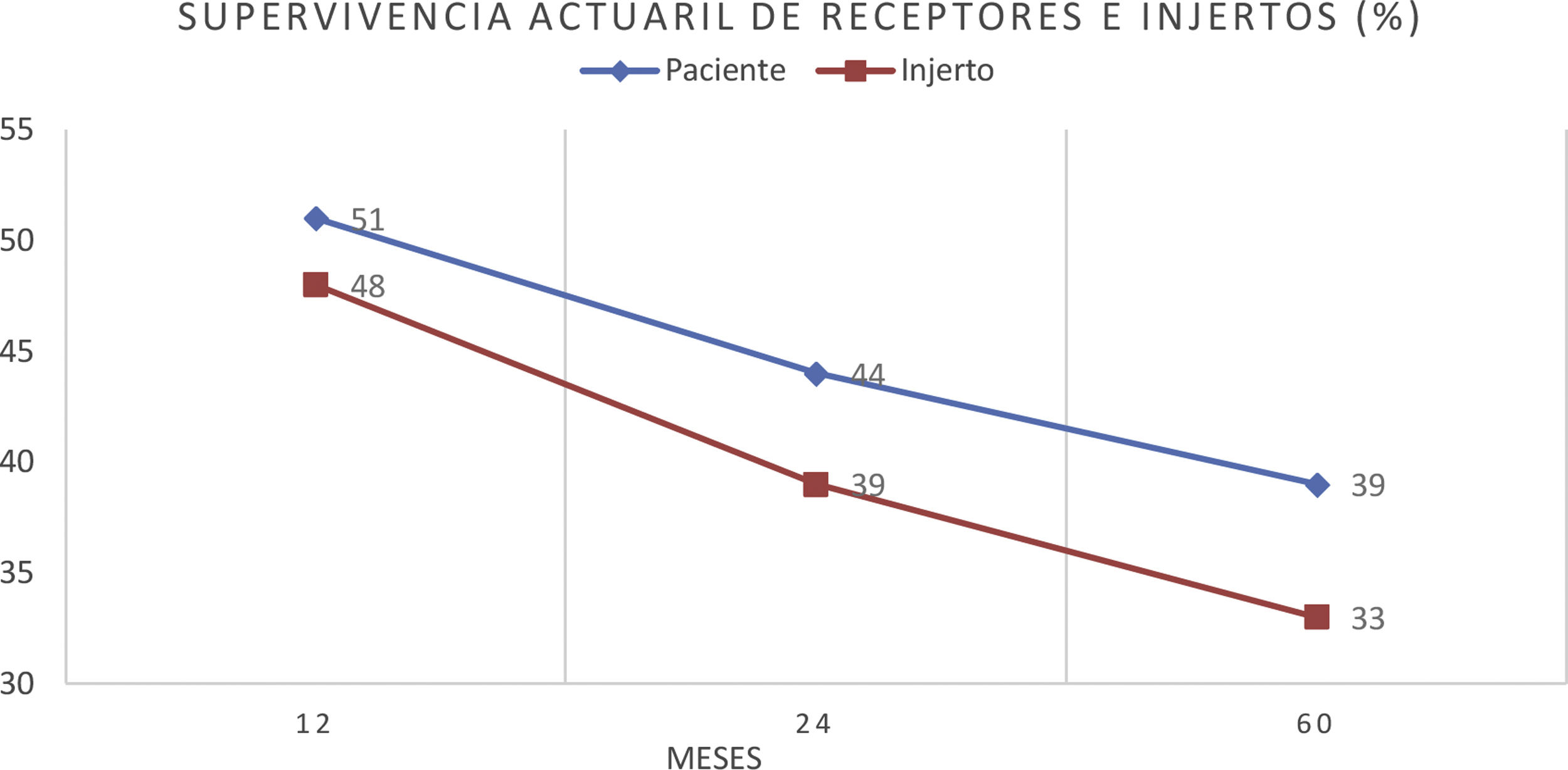
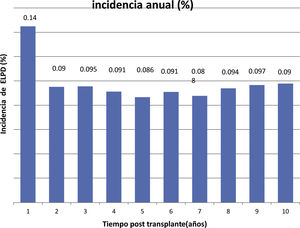
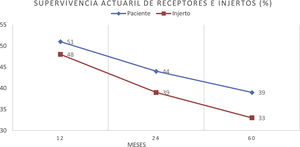
ResultadosUn total de 275 receptores desarrollaron ELPD durante el seguimiento (1,2%), siendo 195 varones (70,9%) y 80 mujeres (29,1%), con una mediana de edad al diagnóstico de 59,2 (p25 44,7; p75 68) años. Doscientos cuarenta y cinco (89,0%) eran primeros trasplantes y 269 (97,8%) fueron de donante cadáver. Se objetivó virus de Epstein-Barr en el tejido proliferativo de 94 de los 155 casos estudiados (60,6%) y el 86,0% de las proliferaciones eran linfocitos B. La mediana del tiempo de desarrollo después del trasplante fue de 42 (p25 12; p75 77,5) meses. Un total de 188 receptores de 275 (68,3%) tenían algún factor de riesgo clásico. La incidencia anual fue de 0,14% el primer año y de 0,98% la acumulada en 10 años postrasplante. El periodo de seguimiento postrasplante de los receptores fue de 3 a 22 años. Durante el seguimiento 172 pacientes murieron (62,5%) y 103 (37,5%) tuvieron remisión completa. La causa de muerte más frecuente fue la progresión (n=91, 52,9%), seguida de la sepsis (n=24, 13,9%). La supervivencia del paciente después del diagnóstico fue del 51% al año, del 44% al segundo año y del 39% al quinto año. La supervivencia del injerto fue de 48, 39 y 33%, respectivamente.
ConclusiónEste estudio muestra una baja incidencia de ELPD en receptores de trasplante renal en un periodo de 22 años. La mayoría de las proliferaciones se asocian a linfocitos B y presentan una importante relación con el virus de Epstein-Barr. La entidad puede desarrollarse en ausencia de factores de riesgo clásicos y su incidencia es mayor en el primer año postrasplante, presentando un mal pronóstico principalmente en los primeros meses de la enfermedad que condiciona una mala supervivencia del paciente que, si sobrevive, puede mantener su injerto.
Posttransplant lymphoproliferative disorders (PTLD) are heterogeneous lymphoid proliferations in recipients of solid organs which seem to be related to Epstein-Barr virus. The use of antilymphocyte antibodies, Epstein-Barr virus seronegativity in the recipient, acute rejection and CMV infection have been identified as classical risk factors.
Material and methodsWe have studied, in a retrospective observational study, the incidence of PTLD in a period of 22 years, its relationship with Epstein-Barr virus, presence of classical risk factors and outcome in 21,546 simple adult renal transplant recipients from cadaveric and living donors, transplanted in 21 hospitals from 1990 to 2009.
ResultsA total of 275 recipients developed PTLD (1.2%), 195 males (70.9%), 80 females (29.1%), aged 59.2 (p25 44.7; p75 68) years. Two hundred forty-five (89.0%) were first transplant recipients and 269 (97.8%) from cadaveric donors. Epstein-Barr virus in the tissue was reported in 94 out of the 155 studied recipients (60.6%) and 86.0% of the proliferations were due to B lymphocytes. PTLD median appearance after transplant were 42 (p25 12; p75 77.5) months. One hundred eighty-eight recipients out of 275 patients (68.3%) had any classical risk factor and the use of antilymphocyte antibodies was the most frequent. During the follow-up, 172 patients died (62.5%) and 103 (37.5%) had a complete remission. The main cause of death was PTLD progression (n=91, 52,9%), followed by sepsis (n=24, 13.9%). The follow-up period post-transplant of the recipients was between 3 and 22 years.
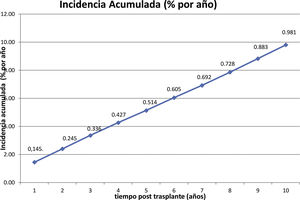
The incidence was 0.14% during the first year post-trasplant and 0.98% the cumulative incidence at 10 years.
Patient survival after diagnosis was 51, 44 and 39% after one, 2 and 5 years, respectively. Finally, overall graft survival was 48, 39 and 33% at the same periods.
ConclusionPTLD has a low incidence in renal transplant recipients. Most of the proliferations are due to B lymphocytes and seem to have a close relationship with Epstein-Barr virus. PTLD can develop in the absence of classical risk factors. The prognosis is poor, mainly due to PTLD progression, but the survivors can even maintain their grafts.
La enfermedad linfoproliferativa difusa postrasplante (ELPD) es un grupo heterogéneo de trastornos que se caracteriza por una proliferación de linfocitos después de un trasplante sólido y que presenta un espectro que comprende desde hiperplasias a agresivos linfomas no Hodgkin1,2.
La incidencia de ELPD es muy variable y depende del órgano de trasplante, siendo el trasplante renal el que tiene la incidencia más baja1,3. Sin embargo, debido a que el trasplante renal es el que en mayor número se realiza cada año, la mayor parte de las ELPD se diagnostican en receptores de trasplante renal.
Esta entidad es más prevalente en los receptores de trasplante de órganos sólidos que en la población general y sus tasas de mortalidad son más elevadas4. Estas proliferaciones tienen mayoritariamente su origen en linfocitos B5,6 y desde hace mucho tiempo se ha considerado que el virus de Epstein-Barr (VEB) está implicado en su patogénesis6–8. Se considera el desarrollo de esta enfermedad como una complicación yatrogénica del tratamiento inmunosupresor asociado al trasplante de órganos sólidos, el cual conduce a una reducción del control inmunológico de este virus por las células T, que condiciona la proliferación de células B infectadas por el VEB6.
Se han descrito clásicamente varios factores de riesgo en el desarrollo de esta entidad9–12, como receptores seronegativos para el VEB que reciben injertos de donantes seropositivos4,7,9,12, la carga de inmunosupresión especialmente con el uso de anticuerpos antilinfocitos7,11–13, el rechazo agudo12,14 y la infección por citomegalovirus10,11,15.
Hemos evaluado, en un estudio observacional multicéntrico retrospectivo que incluye una cohorte de 21.546 receptores adultos de trasplante renal simple trasplantados en España de 1990 al 2009, la incidencia de ELPD durante un periodo de 20 años. El estudio recoge datos demográficos, clínicos y diferentes factores de riesgo implicados en el desarrollo de esta entidad, así como su pronóstico.
Material y métodosEstudio observacional retrospectivo multicéntrico y de ámbito nacional que incluyó 21 hospitales terciarios españoles.
La población a estudio reúne 21.546 receptores adultos, que recibieron un trasplante renal simple de donante cadáver o vivo desde el 1 de enero de 1990 al 31 de diciembre del 2009. El periodo de estudio fue de 22 años, desde el 1 de enero de 1990 hasta el 31 de diciembre de 2012.
Los criterios de inclusión fueron: receptores con más de 18 años en el momento del trasplante y un injerto funcionante en el momento del diagnóstico de la ELPD. El diagnóstico de ELPD se efectuó mediante análisis histopatológico cuando se disponía de biopsia o con sospecha clínica fuerte cuando la biopsia no fue posible. El estudio histológico fue realizado por el patólogo del centro correspondiente.
Los datos de los 21 hospitales participantes se recogieron mediante un cuestionario electrónico diseñado, que incluía las diferentes variables del estudio. El tiempo hasta el desarrollo de ELPD se definió como el periodo en meses desde el trasplante del órgano hasta la fecha del diagnóstico de la ELPD. El seguimiento terminó con la muerte del paciente o el final del estudio, el 31 de diciembre del 2012.
El análisis incluyó variables sociodemográficas como edad y género, datos clínicos como la fecha del trasplante, el tipo de donante (cadáver o vivo), el número de trasplantes realizados al paciente, la inmunosupresión en el momento del diagnóstico de ELPD, la fecha de diagnóstico, el método diagnóstico, la presencia de VEB en el tejido proliferativo, el tipo de proliferación (B o T), factores de riesgo clásicos y evolución (remisión completa, pérdida del injerto, muerte, pérdida de seguimiento).
Los tratamientos inmunosupresores incluían el uso de los siguientes agentes, solos o en combinación: tacrolimus (FK), ciclosporina A (CsA), azatioprina, micofenolato de mofetilo (MMF), everolimus, sirolimus, esteroides y anticuerpos (ATG, ATGAM, OKT3, anti-CD 25, timoglobulina).
Los factores de riesgo estudiados fueron: receptores VEB seronegativos, infección por citomegalovirus, rechazo agudo y tratamiento con anticuerpos mono o policlonales en la inducción o en el tratamiento de rechazo agudo.
La incidencia de ELPD se calculó con el número de casos observados sobre el total de la población en riesgo y se valoró la incidencia anual y acumulada a 10 años.
Análisis estadísticoEl análisis estadístico se realizó con el software SPSS 19.0 para Windows (SPSS Inc., Chicago, IL, EE. UU.). Las características demográficas de los pacientes se expresaron como porcentajes para las variables cuantitativas. Las variables cualitativas independientes se analizaron mediante tablas de contingencia con el método estadístico chi-cuadrado.
Las medias se determinaron con desviación estándar para las variables cuantitativas con distribución normal. Cuando las variables no seguían una distribución normal se usó la media con rango intercuartil. La supervivencia de los receptores diagnosticados de ELPD y de los injertos se analizó mediante curvas de supervivencia de Kaplan-Meier.
ResultadosSe efectuaron un total de 21.546 trasplantes renales durante el periodo de estudio y 275 receptores desarrollaron ELPD (1,2%).
En la tabla 1 se muestra el sexo y la edad media de los receptores en el momento del diagnóstico de la enfermedad, el tiempo postrasplante de aparición de la entidad, los porcentajes de primeros trasplantes, del tipo de donante, de la proliferación de estirpe B y de la presencia de VEB en el tejido proliferativo. También se expresan los porcentajes de pacientes con algún factor de riesgo clásico en total y de los diferentes factores de forma individualizada, así como el porcentaje de muertes y la causa de dichas muertes.
Datos clínicos de los receptores que desarrollaron enfermedad linfoproliferativa difusa postrasplante
| Número de casos | 275 |
| Edad media (años) | 59,2 (p25 44,7; p75 68) |
| Sexo | Varones: 195 (70,9%)Mujeres: 80 (29,1%) |
| Donante cadáver | 269/275 (97,8%) |
| Tiempo medio posttrasplante ELPD (meses) | 42 (p 25 12,7; p75 77,5), rango 1-240 |
| Primer trasplante | 245/275 (89,0%) |
| Proliferaciones linfocitos B | 172/200 (86%) |
| VEB en tejido | 94/155 (60,6%) |
| Factores de riesgo | Ninguno: 84/275 (31,7%)Alguno: 188/275 (68,3%)Seronegativo VEB: 46/186 (24,7%)Anticuerpos: 96/275 (34,9%)Rechazo agudo: 83/275 (30,1%)Infección CMV: 44/275 (16,0%) |
| MuerteCausa | 172/275 (62,5%)Progresión: 91/172 (52,9%)Infección: 24/172 (13,9%) |
CMV: citomegalovirus; ELPD: enfermedad linfoproliferativa difusa; VEB: virus de Epstein-Barr.
Un total de 182 de los 275 casos habían recibido el trasplante entre 1990 y 1999 y recibían en el momento del diagnóstico en el 77,1% de los casos CsA, el 24,7% MMF y solo en el 17,1% de los casos FK. El resto, 93 casos, habían sido trasplantados en el periodo 2000-2009, con un cambio evidente en la inmunosupresión, ya que recibían en el 78,1% de los casos FK, en el 76,7% MMF y solo en el 16,4% CsA.
El diagnóstico de ELPD se efectuó mediante estudio histológico en 260/275 receptores (94,5%), en 16 de ellos en la necropsia y en el resto, 15 (5,5%), con base en datos clínicos y exploraciones complementarias.
La incidencia anual se muestra en la figura 1 y la acumulada a 10 años postrasplante en la figura 2.
La supervivencia del paciente después del diagnóstico fue del 51% al año, del 44% al segundo año y del 39% al quinto año. La supervivencia del injerto fue de 48, 39 y 33%, respectivamente (fig. 3).
El seguimiento postrasplante mínimo de los receptores fue de 3 años y el máximo de 22 años.
DiscusiónHemos realizado un estudio multicéntrico longitudinal en España durante un largo periodo de tiempo, 1990-2012, para evaluar la incidencia y el pronóstico de la ELPD. Esto permite mejorar el conocimiento del impacto real de esta complicación potencialmente mortal comparado con anteriores estudios realizados en su solo centro. donde el número de casos era demasiado bajo para alcanzar suficiente peso16. En este estudio seleccionamos solo receptores adultos, ya que la epidemiologia de la ELPD en pacientes pediátricos se comporta de manera diferente a la población adulta17,18.
La incidencia global observada en nuestro estudio fue del 1,2%, dentro del rango clásico para trasplante renal del 1-3%3,12,19,20, mientras que la acumulada a 10 años fue de 0,98%, mientras Quinlan et al. reportan un 1,4%21, Opelz y Döhler un 1,6%22 y Caillard et al. un 2,1%7.
La incidencia parece disminuir con la época en que se efectúa el trasplante. Así, en un estudio publicado por Caillard et al. se comprueba una reducción de la incidencia en el periodo del 2002 al 2005 frente al periodo del 1998 al 20017. Un estudio nacional realizado en Suecia evidencia una disminución de la incidencia durante la última década, pero solo entre receptores no renales23. Los autores consideran que el uso más racional de anticuerpos y la utilización de nuevos fármacos inmunosupresores son los responsables de este comportamiento. No obstante, otros estudios no muestran diferencias significativas en la incidencia de ELPD en los diferentes periodos de tiempo10,22. En nuestro estudio registramos un menor número de casos en la segunda década, pero debemos considerar que el seguimiento de ese periodo de tiempo ha sido inferior.
Los diferentes agentes inmunosupresores y la carga de inmunosupresión se han implicado directamente en el desarrollo de ELPD y han sido extensamente estudiados13,16,23–25. Generalmente, la inmunosupresión es un factor clave en el desarrollo de ELPD en los receptores de trasplante renal24. El hecho de que los pacientes en los cuales el injerto fracasa y que reinician diálisis tengan un menor riesgo de desarrollar la enfermedad confirma esta hipótesis25,26. Cabe destacar la tendencia al cambio de inhibidor de la calcineurina en la última década, refrendada en nuestro estudio y que podría alterar la incidencia de la ELPD. Los inmunosupresores más utilizados en la segunda década fueron FK y MMF, que se asocian a un menor riesgo de desarrollar la enfermedad según varios estudios7,12,27, pero la relación entre el uso de FK y ELPD permanece controvertida28, aunque su impacto parece inferior que el de CsA29. Hay que destacar que aunque la CsA es un inmunosupresor menos potente que el FK, en la época de su uso el empleo de anticuerpos mono o policlonales en inducción era más frecuente y la dosis acumulada mayor, lo que podría justificar la mayor incidencia de ELPD en ese periodo7,23.
Una tercera parte de los casos analizados en nuestro estudio no presentaban un factor de riesgo clásico asociado (tabla 1). Este hecho resalta la falta de conocimiento sobre todos los factores que podrían influir en el desarrollo de ELPD, así como la heterogeneidad de este tipo de enfermedades que hace difícil las estrategias de predicción. En esta línea, diferentes estudios han evaluado y propuesto otros factores de riesgo, como la edad del receptor, la etnia, la incompatibilidad HLA entre donante y receptor, la creatinina sérica, los niveles de LDH y tener tumores pretrasplante7,9,12,30.
Existe controversia sobre si hay 2 tipos diferentes de entidades dentro de la ELPD dependiendo del tiempo de su aparición5,9,21,24. Así, cuando el estudio es suficientemente largo para representar una curva de incidencia acumulada, suele aparecer una curva de forma bimodal7,9,21,25. La primera elevación correspondería a proliferaciones durante el primer año, se relaciona con la infección por VEB y responde bien a la disminución de la inmunosupresión21,25,31–33. La segunda elevación aparece mucho después del trasplante, incluso décadas, y se asocia raramente al VEB, con una mala evolución y baja sensibilidad a la reducción de la inmunosupresión5,9,21,25,34. Debido a que ambos grupos tienen un origen distinto, así como la evolución, su desarrollo podría estar influido de manera diferente por los factores de riesgo, que deberían ser estudiados y tratados de manera distinta. Quinlan et al. ponen de manifiesto en su estudio la existencia de las 2 entidades e identifican diferentes factores de riesgo para cada una de ellas21. En nuestro estudio hemos observado una incidencia mayor en el primer año, al igual que otros estudios7,12,13,21,22,26,35, y una estabilización en el resto del seguimiento, no evidenciando la curva bimodal quizá por cortar la incidencia acumulada a los 10 años.
La mediana del tiempo de aparición de ELPD en el postrasplante en las diferentes series es muy variable debido a la gran dispersión de los casos en el tiempo, al ser el periodo de tiempo estudiado muy prolongado. En nuestro estudio, la mediana fue de 42 meses, con casos de aparición muy tardía, hasta 240 meses postrasplante. Otras series presentan medianas más largas, como Morton et al., de 74 meses, con 3 casos que desarrollaron la enfermedad más de 20 años postrasplante35, o como Caillard et al., de 89 meses en el registro francés, con un rango de uno a 397 meses31. Estas medianas tan prolongadas se producen al compensar una incidencia precoz más elevada con la inclusión de casos muy tardíos, al tener las series mencionadas un seguimiento postrasplante muy prolongado. En el otro extremo objetivamos medianas de tiempo de aparición más cortos, como en el registro americano, de solo 12 meses, al analizar la serie durante un periodo de tiempo mucho más breve12. En conclusión, la mediana del tiempo de aparición parece ser proporcional al tiempo de seguimiento de la serie.
La patogénesis de la ELPD está asociada al VEB6–8,24. Esta asociación está en relación con una respuesta inmune específica para VEB que resulta en una reactivación incontrolada del virus o una infección primaria6. La etiología de la ELPD con VEB negativo parece deberse a la pérdida de vigilancia inmunológica relacionada con la edad21. La relación ELPD-VEB parece clara al evidenciarse en nuestro estudio la presencia del virus en el 60,6% de los casos en los que se analizó en el tejido proliferativo (tabla 1). En su estudio, Morton et al. detectan VEB en el 68% de los casos estudiados en su serie35, cifra similar a la nuestra, lo que corrobora nuestros datos.
El pronóstico de los pacientes con ELPD es malo, mucho peor que en los receptores que no desarrollan la enfermedad12,16,31,35–37. En nuestro estudio, la supervivencia actuarial del receptor fue baja (39% a los 5 años) (fig. 3), en el rango de otros estudios, como el de Faull et al., que comunican la misma supervivencia a 5 años36, o el de Opelz y Döhler22, quizá también marcada por la presencia de casos muy antiguos sin acceso a los tratamientos actuales38,39.
La experiencia más amplia en ELPD en receptores adultos de trasplante renal está recogida en el registro francés, que incluye 500 pacientes diagnosticados entre 1998 y 2007, que presentan una supervivencia actuarial de 53 y 45% a los 5 y 10 años del diagnóstico, respectivamente31. Los datos obtenidos de la base de datos americana muestran una supervivencia algo mejor, del 64% a los 5 años, pero significativamente inferior a la de los receptores que no desarrollan ELPD12,16.
El desarrollo de ELPD disminuye significativamente la supervivencia del paciente, principalmente durante el primer año16,22,36, ya que en ese periodo la carga de inmunosupresión es más alta y la aparición de infecciones oportunistas más frecuente13,16,23–25, pero la supervivencia del injerto es buena si el paciente sobrevive, por lo que la mayoría de los pacientes que no murieron mantuvieron sus injertos (fig. 3).
El análisis multivariable del registro francés evidenció 5 variables en el momento del diagnóstico que se asociaron independiente con una supervivencia inferior: mayor edad (>55 años), creatinina sérica>1,5mg/dl, LDH elevada, localización de la enfermedad, e histología monomórfica o con células T31.
La principal limitación de nuestro estudio se asocia a su carácter retrospectivo, así como a las deficiencias inherentes a las grandes bases de datos, como las diferencias en la práctica clínica y la falta de algunos datos especialmente en relación con el estado serológico del VEB y su determinación en el tejido proliferativo, práctica que se realiza de manera rutinaria en los últimos años pero no en los primeros. La recogida de los factores de riesgo en la población trasplantada que no desarrolló la enfermedad hubiera sido clave a efectos comparativos para extraer conclusiones.
El punto fuerte de nuestro estudio es el gran número de pacientes que incluye, todos adultos, receptores de trasplante renal simple y con un periodo de seguimiento extenso. Además, el diagnóstico de la enfermedad se efectuó en más del 94% de la serie con base histológica, lo que da fiabilidad al diagnóstico de los casos.
En conclusión, este estudio de ámbito nacional muestra una baja incidencia de ELPD en receptores de trasplante renal en un periodo de 20 años. La mayoría de las proliferaciones se asocian a linfocitos B y presentan una importante relación con el VEB. La entidad puede desarrollarse en ausencia de factores de riesgo clásicos y su incidencia es mayor en el primer año postrasplante, presentando un mal pronóstico principalmente en los primeros meses de la enfermedad, lo que condiciona una mala supervivencia del paciente que, si sobrevive, puede mantener su injerto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los nefrólogos de trasplante que integran el grupo de trabajo GREAT que han aportado los datos para la realización de este estudio.