Ante un síndrome nefrótico (SN) resistente a corticoesteroides por una glomeruloesclerosis focal y segmentaria (GFS), los inhibidores de la calcineurina (ICN) constituyen la primera línea de tratamiento, aunque la respuesta es variable. Este estudio analizó la activación linfocitaria en estos pacientes mediante la expresión de receptores de IL-2 en linfocitos y los niveles séricos de IL-2Rα (CD25 soluble) para evaluar su relación con la respuesta al tratamiento con los ICN.
Material y métodosSe realizó un estudio caso-control multicéntrico en 39 pacientes con SN por GFS resistente a corticoides, diagnosticada por biopsia renal, y 23 controles sanos. Se evaluaron variables clínicas, bioquímicas e inmunológicas. Los niveles de CD25 soluble se midieron mediante ELISA y la activación linfocitaria mediante citometría de flujo. Tanto los criterios de tratamiento como la evaluación de la respuesta a los ICN se definieron según los criterios de las guías KDIGO. Los datos se analizaron mediante curvas ROC para determinar el rendimiento diagnóstico de CD25 soluble.
ResultadosUn 48,7% de los pacientes respondió al tratamiento con los ICN. Los niveles de CD25 soluble y la expresión de IL-2 en linfocitos CD3 se asociaron significativamente con la respuesta a los ICN (p<0,01) con valores de CD25 soluble 477± 84,47 (respondedores) vs. 290,28±85,98pg/ml (no respondedores). Tras la remisión, los pacientes sensibles a los ICN mostraron una reducción significativa de CD25 soluble (−35,8%), linfocitos CD3 y CD3-IL2+, junto con un incremento en CD8 DR+ y células T reguladoras. El análisis ROC identificó un punto de corte de 324pg/ml de CD25 soluble, con una sensibilidad del 94% y una especificidad del 75% para predecir la respuesta a los ICN.
ConclusionesEn nuestro estudio, los niveles elevados de CD25 soluble y la activación linfocitaria T se asoció con una mejor respuesta al tratamiento con los ICN. La medición de CD25 soluble podría integrarse como un biomarcador predictivo útil para identificar de manera temprana a los pacientes con mayor probabilidad de respuesta, optimizando así las decisiones terapéuticas y evitando tratamientos innecesarios en la GFS resistente a corticoides. Este estudio presenta ciertas limitaciones, como el tamaño reducido de la muestra y la ausencia de validación externa.
Calcineurin inhibitors (CNI) are the first-line treatment for steroid-resistant nephrotic syndrome (SRNS) due to focal segmental glomerulosclerosis (FSGS), though response rates vary. This study analyzed lymphocyte activation through IL-2 receptor expression on T lymphocytes and serum IL-2Rα (soluble CD25) levels in these patients to evaluate their relationship with response to CNI therapy.
Materials and methodsA multicenter case-control study was conducted with 39 patients with steroid-resistant FSGS, diagnosed via renal biopsy, and 23 healthy controls. Clinical, biochemical, and immunological variables were assessed. Soluble CD25 levels were measured using ELISA, and lymphocyte activation was analyzed by flow cytometry. Treatment criteria and response evaluation followed KDIGO guidelines. Diagnostic performance was assessed using ROC curves for soluble CD25.
ResultsThe 48.7% of patients responded to CNI treatment. Soluble CD25 levels and IL-2 expression on CD3 T lymphocytes were significantly associated with CNI response (P<.01): responders had higher CD25 levels (477±84.47 pg/ml) compared to non-responders (290.28±85.98 pg/ml). Responders showed a significant reduction in soluble CD25 (−35.8%) and CD3-IL2+ cells after remission, alongside increases in CD8 DR+ cells and regulatory T cells. ROC analysis identified a soluble CD25 cutoff of 324 pg/ml, with 94% sensitivity and 75% specificity for predicting response to CNI.
ConclusionsElevated soluble CD25 levels and T cell activation were associated with better CNI response. Soluble CD25 could be a predictive biomarker to identify patients with higher likelihood of response, optimizing therapeutic decisions and avoiding unnecessary treatments in steroid-resistant FSGS.
La glomeruloesclerosis focal y segmentaria (GFS) idiopática representa una causa importante de síndrome nefrótico (SN) y puede mostrar resistencia al tratamiento con corticoides. Esta resistencia puede evidenciarse desde el primer ciclo terapéutico o manifestarse tras varios ciclos de tratamiento1. La respuesta a corticoides se ha definido como el principal indicador pronóstico a largo plazo, en todas las etapas de la vida2,3. En casos de corticoresistencia, los inhibidores de la calcineurina (ICN) son actualmente el tratamiento de primera línea, con tasas de respuesta variables que oscilan entre el 31 y el 89% para la remisión completa, y entre el 19 y el 38% para la remisión parcial, dependiendo de los criterios de selección utilizados4. La eficacia de los ICN se asocia con una reducción significativa en el riesgo de progresión a enfermedad renal crónica avanzada4.
El mecanismo de acción de los ICN se fundamenta en la inhibición de la calcineurina, que regula la expresión de genes implicados en la síntesis de citoquinas esenciales para la activación y proliferación de los linfocitos T citotóxicos5,6. Entre estas citoquinas se encuentran la IL-2, IL-4, el interferón gamma y el factor de necrosis tumoral alfa. De todas ellas, la IL-2 es particularmente relevante, ya que desempeña un papel crucial como regulador de la célula T en numerosos procesos inmunitarios. La inhibición de la calcineurina conduce a una disminución en la producción de IL-2 y otras citoquinas proinflamatorias, así como a una supresión de la proliferación linfocitaria7. Adicionalmente, los ICN estabilizan el citoesqueleto de actina en los podocitos, reduciendo así la proteinuria y mejorando la función glomerular8.
La activación linfocitaria, medida mediante la expresión linfocitaria de IL-2 y los niveles séricos de IL-2Rα (CD25 soluble), es característica de diversas enfermedades inmunológicas, incluido el síndrome nefrótico idiopático (SNI)9. Durante episodios de recaída, se han documentado niveles elevados de IL-2, IL-4 e IL-8 en lod pacientes con SNI10,11, mientras que los linfocitos T de pacientes corticoresistentes muestran una mayor expresión de ARNm de IL-2 en comparación con pacientes sensibles a corticoides11. Otros estudios han identificado en los pacientes con GFS patrones de respuesta inflamatoria caracterizados por una mayor prevalencia de las citoquinas IL-1 e IL-6, lo cual se asocia con una mayor resistencia a los corticoesteroides12,13. A pesar de esta asociación evidente, el mecanismo exacto mediante el cual la activación linfocitaria puede relacionarse con la alteración de la barrera de filtración o con la lesión podocitaria, es desconocida en el momento actual. Estudios en modelos animales han sugerido que el exceso de IL-2 podría promover la regulación positiva de moléculas proapoptóticas y la pérdida de la integridad estructural de la barrera glomerular14.
En este contexto, el objetivo del presente estudio es analizar el estado de activación de los linfocitos T en los pacientes con GFS corticoresistente, evaluando la expresión de receptores de IL-2 y los niveles séricos de IL-2Rα (CD25 soluble), y explorar su posible asociación con la respuesta al tratamiento con los ICN.
Material y métodoDiseño del estudio y criterios de inclusiónSe realizó un estudio multicéntrico caso-control en los pacientes con SN corticoresistente causado por GFS idiopática, diagnosticada mediante biopsia renal. El estudio incluyó pacientes adultos y pediátricos atendidos en 4 centros hospitalarios entre enero de 2012 y marzo de 2019. Los criterios de inclusión fueron: resistencia a esteroides, diagnóstico histológico de GFS en la biopsia renal, ausencia de etiologías secundarias tras realizar un estudio sistemático y protocolizado, ausencia de antecedentes familiares de nefropatía y resultado negativo en el estudio genético. Además, se incluyeron solo pacientes que aún no habían recibido tratamiento con esteroides, inmunosupresores, bloqueadores del receptor de angiotensina II o estatinas en el momento de la obtención de muestras de sangre y orina. Las etiologías secundarias excluidas incluyeron reducción de la masa renal, obesidad mórbida, nefropatía asociada al VIH, consumo de heroína o cocaína, infección por parvovirus B19, consumo de analgésicos, bisfosfonatos o interferón, reflujo vesicoureteral y apnea obstructiva del sueño. Se realizó un estudio genético para descartar mutaciones patógenas en todos los pacientes con corticoresistencia menores de 35 años, mediante un panel renal previamente descrito y validado (Bullich G. et al., 2018).
El diseño constó de 2 fases: 1) una fase observacional caso-control para analizar la respuesta a los ICN y las variables asociadas, y 2) un seguimiento prospectivo de la cohorte de enfermos tratada, para evaluar la evolución de las variables estudiadas tras el tratamiento en función del resultado.
Definiciones operativasEl SN idiopático (SIN) se definió por valores de excreción de proteínas en orina de 24h>3,5g/día en adultos y >40mg/m2/h en niños, asociado con hipoalbuminemia <3,5g/dl y edema. Después del diagnóstico, tanto el seguimiento clínico como los criterios de tratamiento se llevaron a cabo siguiendo las recomendaciones indicadas en las guías KDIGO15 a criterio de cada centro participante. Para poder ser incluido en el estudio, los criterios de corticoresistencia se definieron explícitamente y fueron los mismos para todos los centros. En los pacientes pediátricos, la resistencia a corticoides se definió como la falta de remisión completa (reducción de la relación proteína/creatinina en orina a <0,2mg/mg) después de 8 semanas de terapia con prednisona a una dosis estándar de 60mg/m2/día. En los pacientes adultos, la resistencia a corticoides se definió como la falta de remisión (reducción de la proteinuria a <0,3g/día, niveles de creatinina sérica estables y niveles de albúmina sérica >3,5g/dl) después de una exposición mínima de 16 semanas a prednisona a una dosis diaria de 1mg/kg o a una dosis en días alternos de 2mg/kg. No se incluyeron pacientes con remisión parcial a corticoesteroides; se consideraron únicamente como corticoresistentes aquellos pacientes que, según la definición, no alcanzaron remisión, independientemente de si presentaron una disminución de la proteinuria sin llegar al umbral establecido para remisión parcial. El tipo de ICN indicado (tacrolimus o ciclosporina), fue seleccionado libremente por cada uno de los centros participantes. Las directrices para el tratamiento en cuanto a dosis, niveles valle y controles, fueron las mismas en todos los centros y se basaron asimismo en las recomendaciones de las guías KDIGO15. Se consideró que había respuesta al tratamiento con los ICN si, tras el inicio del tratamiento se conseguía una remisión total o parcial de la proteinuria, de acuerdo con los criterios descritos en las guías KDIGO para los pacientes pediátricos y los adultos. Se consideró paciente pediátrico a los pacientes <18 años.
El grupo control incluyó a sujetos sanos pareados por edad y sexo, seleccionados de una base de datos electrónica que contiene datos demográficos de 450 donantes de sangre sanos y de individuos sanos en edad pediátrica, obtenidos de estudios preoperatorios de procesos dermatológicos o cirugía menor local. Todos los participantes en el estudio firmaron el consentimiento informado correspondiente antes de su inclusión. En el caso de los controles en edad pediátrica, las muestras de sangre fueron obtenidas tras consentimiento informado de sus padres o tutores. El estudio se realizó de acuerdo con los parámetros establecidos por la Declaración de Helsinki y la ley local de protección de datos personales (LOPD 15/1999). El protocolo del estudio fue aprobado por el comité de bioética independiente de los centros participantes (código interno 2551).
Métodos de laboratorioTodas las muestras de sangre, suero y ADN se obtuvieron antes de iniciar cualquier tratamiento inmunosupresor o inmunomodulador. Las muestras de sangre se obtuvieron en tubos estándar sin aditivos, se centrifugaron a 1.500g durante 10min, y se almacenaron a −80°C hasta su uso. La creatinina sérica se midió mediante el método compensado trazable a IDMS (Hitachi Modular P-800 Roche Diagnostics, Alemania). La tasa de filtración glomerular estimada (TFGe) se calculó utilizando la ecuación de Schwartz en niños y la fórmula de la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) en adultos. Los niveles séricos de CD25 se midieron mediante ELISA (Quantikine R&D Systems, Inc., MN, EE. UU.). Todos los análisis de ELISA se realizaron en el mismo laboratorio, por el mismo equipo y por duplicado. Además, para analizar la reproducibilidad de las mediciones, en una muestra de 15 pacientes se realizaron 3 o más determinaciones durante la fase de brote nefrótico, antes de iniciar cualquier tratamiento. En todos los casos, los coeficientes de variación de las mediciones repetidas fueron <10%.
El análisis de la activación linfocitaria, se realizó mediante citometría de flujo multicanal (Cytoflex Beckman Coulter, EE. UU.), incluyendo: subpoblaciones de linfocitos T (helper (CD4 DR+), citotóxicos (CD8 DR+) y células T reguladoras), receptor soluble de IL-2 (CD25) y porcentaje de linfocitos CD3 con expresión de CD25. Para ello, se utilizaron anticuerpos monoclonales conjugados con fluoróforos, específicos para cada marcador (Abyntek Biopharma, España).
Análisis anatomopatológico de las biopsias renalesTodas las biopsias renales fueron analizadas centralmente a ciegas por 2 anatomopatólogos experimentados que confirmaron el patrón morfológico de GFS caso por caso. Las biopsias renales se tiñeron con hematoxilina y eosina, ácido periódico de Schiff-metenamina y tricrómico de Masson para el análisis morfológico, y se realizaron estudios de inmunofluorescencia con anticuerpos contra inmunoglobulina A (IgA), IgG, IgM, C3, fibrinógeno y cadenas ligeras, y se procesaron para un estudio con microscopio electrónico.
Métodos estadísticosLas variables cuantitativas se expresan como media±desviación estándar y las variables cualitativas como proporciones. Las comparaciones de medias entre grupos para datos independientes se realizaron utilizando la prueba t de Student o la U de Mann-Whitney, en caso de distribuciones no normales. La comparación de 2 medias intragrupo, se realizó mediante la t de Student para datos apareados o su equivalente, el test de Wilcoxon para variables no paramétricas. La asociación entre variables cuantitativas, se analizó mediante el coeficiente de correlación de Pearson o el de Spearman en función de la distribución de la variable. La comparación entre variables categóricas se realizó utilizando la prueba de Chi-cuadrado. Para analizar la normalidad en la distribución de los datos, se utilizaron las pruebas de Kolmogorov-Smirnov o Shapiro-Wilk. Se aceptó como valor significativo una p<0,05. Después de clasificar a los pacientes según la respuesta a los ICN, se realizó un análisis univariado para analizar las variables asociadas a remisión. Los valores de corte para las variables cuantitativas asociadas con la respuesta al tratamiento se calcularon mediante curvas ROC, utilizando el índice de Youden para seleccionar el valor óptimo. Los cálculos estadísticos se realizaron utilizando el programa SPSS®, versión 20.0.
ResultadosCaracterísticas demográficas, clínicas y bioquímicas en el momento de la inclusiónSe incluyeron un total de 39 pacientes con GFS resistente a corticoides, 15 (38,5%) eran pacientes pediátricos (15±2 años) y 24 (61,5%) eran mayores de 18 años (38±17 años). El grupo control, incluyó a 23 controles sanos, de los cuales el 26,1% eran pediátricos con una edad promedio de 17±1 año y el 73,9% eran mayores de 18 años con una edad promedio de 34±12 años.
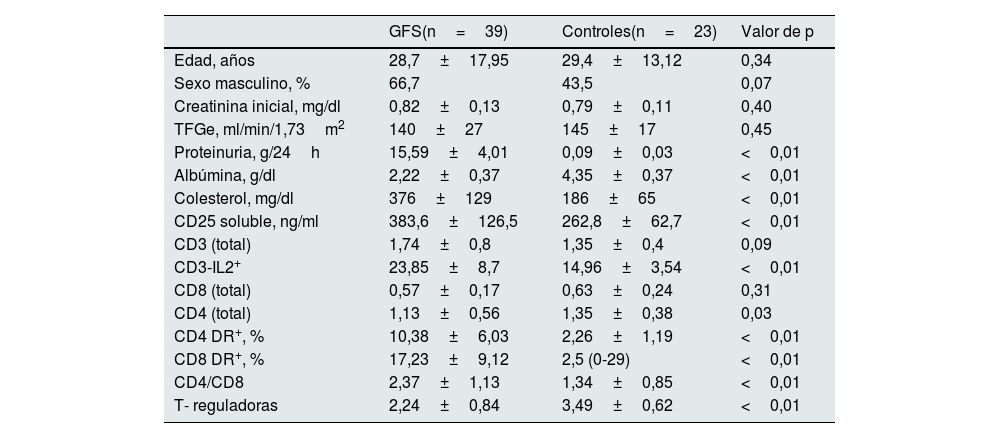
En la tabla 1, se resumen las variables demográficas, características clínicas y bioquímicas de ambos grupos. No se observaron diferencias estadísticamente significativas en cuanto a edad, sexo y TFGe entre los pacientes con GFS y los controles sanos. Sin embargo, los pacientes con GFS mostraron niveles significativamente mayores de CD25 soluble, expresión de receptores de IL2 en linfocitos T CD3 (CD3-IL2+), y DR en linfocitos CD4 y CD8, así como un mayor cociente CD4/CD8 en comparación con los controles (p<0,01).
Características demográficas y bioquímicas de los enfermos con GFS y de los controles sanos
| GFS(n=39) | Controles(n=23) | Valor de p | |
|---|---|---|---|
| Edad, años | 28,7±17,95 | 29,4±13,12 | 0,34 |
| Sexo masculino, % | 66,7 | 43,5 | 0,07 |
| Creatinina inicial, mg/dl | 0,82±0,13 | 0,79±0,11 | 0,40 |
| TFGe, ml/min/1,73m2 | 140±27 | 145±17 | 0,45 |
| Proteinuria, g/24h | 15,59±4,01 | 0,09±0,03 | <0,01 |
| Albúmina, g/dl | 2,22±0,37 | 4,35±0,37 | <0,01 |
| Colesterol, mg/dl | 376±129 | 186±65 | <0,01 |
| CD25 soluble, ng/ml | 383,6±126,5 | 262,8±62,7 | <0,01 |
| CD3 (total) | 1,74±0,8 | 1,35±0,4 | 0,09 |
| CD3-IL2+ | 23,85±8,7 | 14,96±3,54 | <0,01 |
| CD8 (total) | 0,57±0,17 | 0,63±0,24 | 0,31 |
| CD4 (total) | 1,13±0,56 | 1,35±0,38 | 0,03 |
| CD4 DR+, % | 10,38±6,03 | 2,26±1,19 | <0,01 |
| CD8 DR+, % | 17,23±9,12 | 2,5 (0-29) | <0,01 |
| CD4/CD8 | 2,37±1,13 | 1,34±0,85 | <0,01 |
| T- reguladoras | 2,24±0,84 | 3,49±0,62 | <0,01 |
Media±DE.
DE: desviación estándar; GFS: glomeruloesclerosis focal y segmentaria; TFGe: tasa de filtración glomerular estimada.
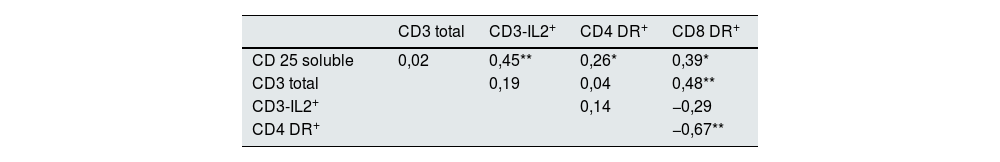
En la tabla 2, se resume la matriz de correlaciones entre las variables relacionadas con la activación de los linfocitos T estudiadas, en el grupo total de enfermos con GFS. El nivel de CD25 soluble presentó una moderada asociación con la expresión de IL2 en linfocitos CD3 y más leve con la expresión DR en CD4 y CD8. Se apreció asimismo una asociación significativa entre el número total de linfocitos CD3 y el número de linfocitos CD8 DR+ y una asociación fuertemente negativa entre el número de linfocitos CD4 DR+ y el número de linfocitos CD8 DR+. En el grupo de controles sanos, no se apreciaron asociaciones significativas entre ninguna de las variables estudiadas (datos no mostrados).
Matriz de correlaciones entre variables en el grupo de enfermos con GFS
| CD3 total | CD3-IL2+ | CD4 DR+ | CD8 DR+ | |
|---|---|---|---|---|
| CD 25 soluble | 0,02 | 0,45** | 0,26* | 0,39* |
| CD3 total | 0,19 | 0,04 | 0,48** | |
| CD3-IL2+ | 0,14 | −0,29 | ||
| CD4 DR+ | −0,67** |
Las correlaciones entre las variables se calcularon utilizando el coeficiente de correlación de Pearson. Los valores de p fueron considerados significativos cuando eran menores a 0,05 (*p<0,05) o 0,01 (**p<0.01). Las correlaciones se interpretaron de la siguiente manera: A) Correlación positiva: Indica una relación directa entre las variables (a mayor valor de una variable, mayor valor de la otra). B) Correlación negativa: Indica una relación inversa entre las variables (a mayor valor de una variable, menor valor de la otra).
GFS: glomeruloesclerosis focal y segmentaria.
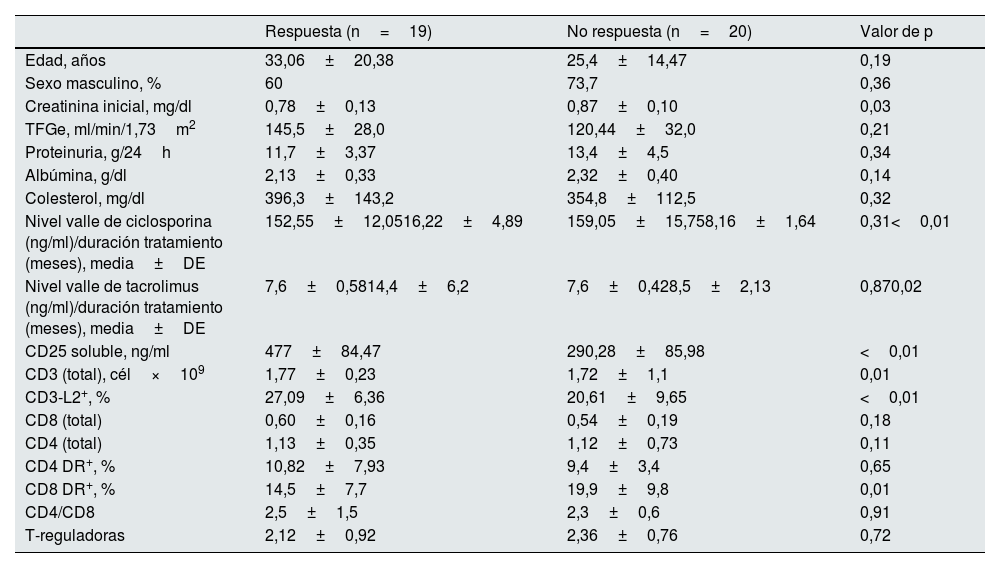
La duración mínima del tratamiento con inhibidores de calcineurina fue de 6 meses, siguiendo las recomendaciones de las guías clínicas, con una media de 11,7±5,35 meses (rango: 6-24 meses), sin diferencias significativas en la duración entre ciclosporina A y tacrolimus (p=0,92). Sin embargo, al analizar según la respuesta o resistencia a los ICN, se observaron diferencias estadísticamente significativas: los pacientes respondedores recibieron más meses de tratamiento, mientras que, en los casos sin ningún tipo de respuesta, el tratamiento se interrumpió antes para evitar efectos secundarios no deseados ante la falta de eficacia (tabla 3).
Características demográficas, bioquímicas de los enfermos con GFS en función de la respuesta al tratamiento con los ICN
| Respuesta (n=19) | No respuesta (n=20) | Valor de p | |
|---|---|---|---|
| Edad, años | 33,06±20,38 | 25,4±14,47 | 0,19 |
| Sexo masculino, % | 60 | 73,7 | 0,36 |
| Creatinina inicial, mg/dl | 0,78±0,13 | 0,87±0,10 | 0,03 |
| TFGe, ml/min/1,73m2 | 145,5±28,0 | 120,44±32,0 | 0,21 |
| Proteinuria, g/24h | 11,7±3,37 | 13,4±4,5 | 0,34 |
| Albúmina, g/dl | 2,13±0,33 | 2,32±0,40 | 0,14 |
| Colesterol, mg/dl | 396,3±143,2 | 354,8±112,5 | 0,32 |
| Nivel valle de ciclosporina (ng/ml)/duración tratamiento (meses), media±DE | 152,55±12,0516,22±4,89 | 159,05±15,758,16±1,64 | 0,31<0,01 |
| Nivel valle de tacrolimus (ng/ml)/duración tratamiento (meses), media±DE | 7,6±0,5814,4±6,2 | 7,6±0,428,5±2,13 | 0,870,02 |
| CD25 soluble, ng/ml | 477±84,47 | 290,28±85,98 | <0,01 |
| CD3 (total), cél×109 | 1,77±0,23 | 1,72±1,1 | 0,01 |
| CD3-L2+, % | 27,09±6,36 | 20,61±9,65 | <0,01 |
| CD8 (total) | 0,60±0,16 | 0,54±0,19 | 0,18 |
| CD4 (total) | 1,13±0,35 | 1,12±0,73 | 0,11 |
| CD4 DR+, % | 10,82±7,93 | 9,4±3,4 | 0,65 |
| CD8 DR+, % | 14,5±7,7 | 19,9±9,8 | 0,01 |
| CD4/CD8 | 2,5±1,5 | 2,3±0,6 | 0,91 |
| T-reguladoras | 2,12±0,92 | 2,36±0,76 | 0,72 |
Media±DE.
DE: desviación estándar; GFS: glomeruloesclerosis focal y segmentaria; ICN: inhibidores de la calcineurina; TFGe: tasa de filtración glomerular estimada.
De los 39 pacientes, 19 (48,7%) respondieron al tratamiento con ICN, de los cuales 12 (63,2%) lograron una respuesta parcial y 7 (36,8%) una respuesta completa. Los pacientes respondedores presentaron niveles estadísticamente significativos mayores de CD25 soluble, número absoluto de linfocitos CD3 y expresión de IL-2 en linfocitos CD3, y una menor expresión de DR en linfocitos CD8, en comparación con los no respondedores (p<0,05, tabla 3).
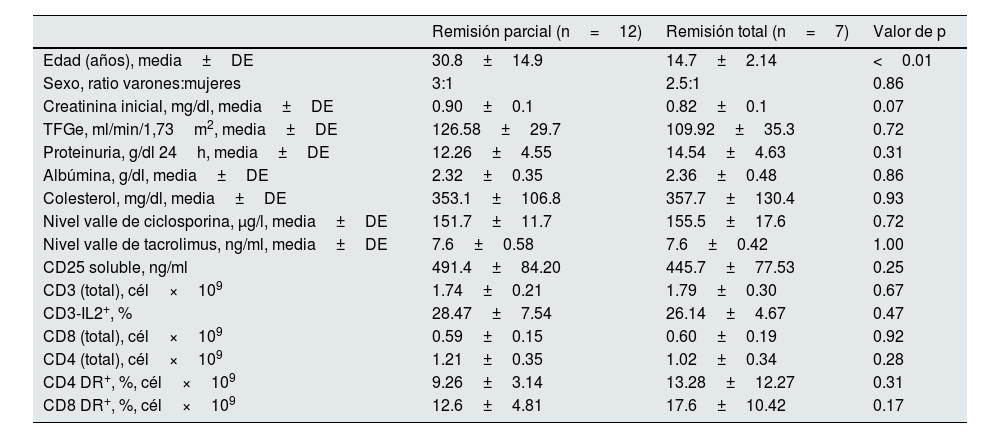
Al comparar el grupo de pacientes que respondieron al tratamiento con ICN, diferenciando entre aquellos con remisión parcial y completa (tabla 4), se observó que los pacientes con remisión completa eran significativamente más jóvenes, mientras que no se encontraron diferencias importantes en el resto de las variables estudiadas (tabla 4).
Características demográficas y bioquímicas de los enfermos con GFS con respuesta al tratamiento con los ICN, en función del tipo de respuesta
| Remisión parcial (n=12) | Remisión total (n=7) | Valor de p | |
|---|---|---|---|
| Edad (años), media±DE | 30.8±14.9 | 14.7±2.14 | <0.01 |
| Sexo, ratio varones:mujeres | 3:1 | 2.5:1 | 0.86 |
| Creatinina inicial, mg/dl, media±DE | 0.90±0.1 | 0.82±0.1 | 0.07 |
| TFGe, ml/min/1,73m2, media±DE | 126.58±29.7 | 109.92±35.3 | 0.72 |
| Proteinuria, g/dl 24h, media±DE | 12.26±4.55 | 14.54±4.63 | 0.31 |
| Albúmina, g/dl, media±DE | 2.32±0.35 | 2.36±0.48 | 0.86 |
| Colesterol, mg/dl, media±DE | 353.1±106.8 | 357.7±130.4 | 0.93 |
| Nivel valle de ciclosporina, μg/l, media±DE | 151.7±11.7 | 155.5±17.6 | 0.72 |
| Nivel valle de tacrolimus, ng/ml, media±DE | 7.6±0.58 | 7.6±0.42 | 1.00 |
| CD25 soluble, ng/ml | 491.4±84.20 | 445.7±77.53 | 0.25 |
| CD3 (total), cél×109 | 1.74±0.21 | 1.79±0.30 | 0.67 |
| CD3-IL2+, % | 28.47±7.54 | 26.14±4.67 | 0.47 |
| CD8 (total), cél×109 | 0.59±0.15 | 0.60±0.19 | 0.92 |
| CD4 (total), cél×109 | 1.21±0.35 | 1.02±0.34 | 0.28 |
| CD4 DR+, %, cél×109 | 9.26±3.14 | 13.28±12.27 | 0.31 |
| CD8 DR+, %, cél×109 | 12.6±4.81 | 17.6±10.42 | 0.17 |
DE: desviación estándar; GFS: glomeruloesclerosis focal y segmentaria; ICN: inhibidores de la calcineurina; TFGe: tasa de filtración glomerular estimada.
El análisis de los niveles de CD25 mostró diferencias estadísticamente significativas entre los pacientes GFS respondedores y los controles (477±84 vs. 262±62pg/ml, respectivamente; p<0,01). En contraste, no se encontraron diferencias significativas entre los GFS no respondedores y los controles (290±86 vs. 262±62 pg/mL, respectivamente; p=0,31).
Análisis por subgrupos: población pediátrica (<18 años)La cohorte pediátrica incluyó un total de 15 pacientes, de los cuales el 52,4% eran de sexo masculino. La edad media fue de 14,7±2,1 años. Al comparar las características demográficas, clínicas y bioquímicas entre la población pediátrica y adulta, no se observaron diferencias significativas. Asimismo, no se identificaron diferencias en los niveles séricos de CD25 soluble, en la proporción de linfocitos CD3 con expresión de IL-2 ni en el resto de las subpoblaciones linfocitarias analizadas.
En cuanto a la respuesta al tratamiento con los ICN, el 53,3% (n=8) de los pacientes pediátricos lograron criterios de respuesta. De estos, el 87,5% (n=7) alcanzaron remisión total del SN, lo que representa una diferencia estadísticamente significativa en comparación con la población adulta, donde ninguno de los pacientes alcanzó remisión completa (p<0,01).
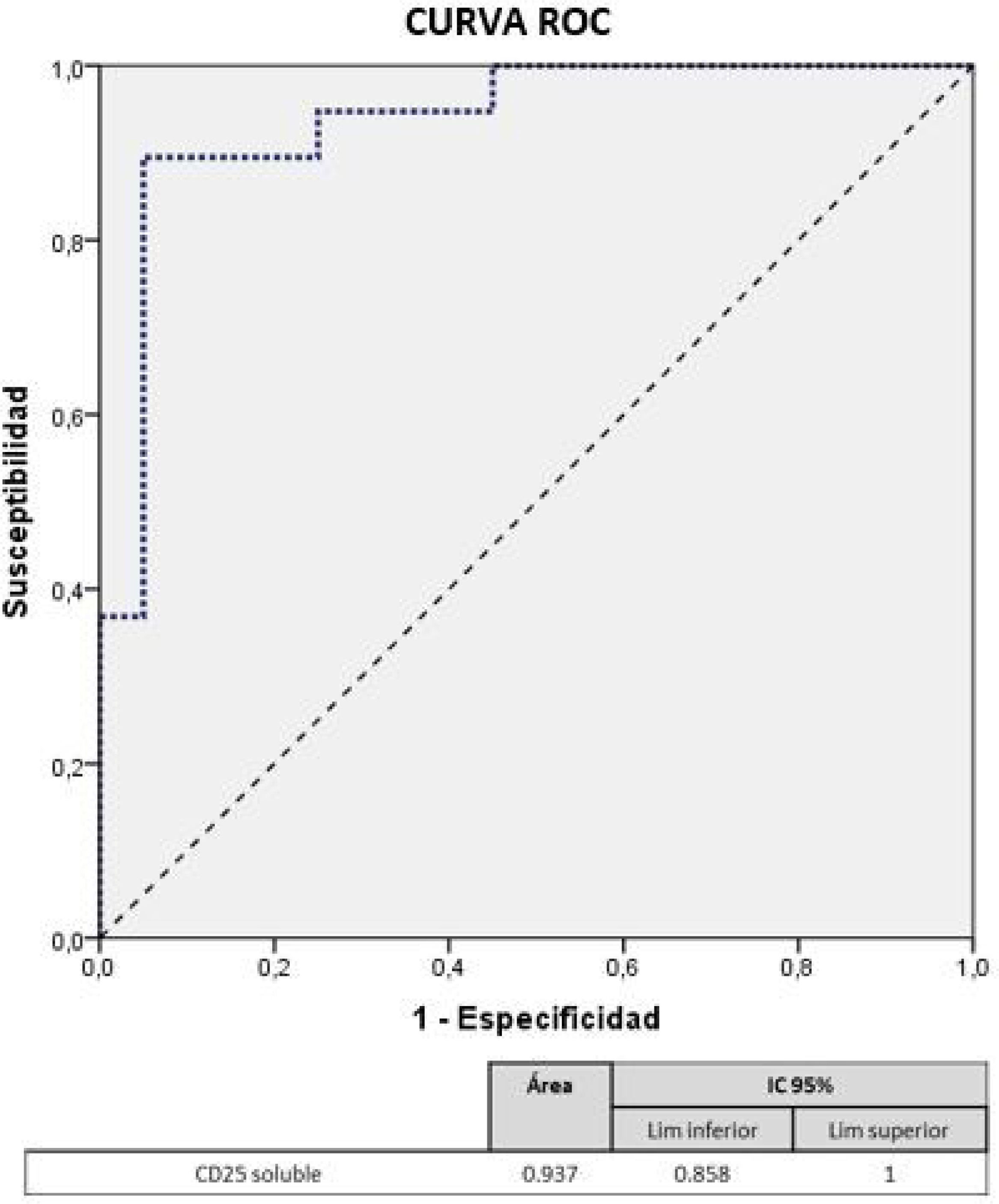
Análisis predictivoDe las variables estadísticamente significativas del estudio bivariante se realizó un modelo de regresión logística binaria donde se obtuvo únicamente como modelo final significativo la variable CD25.
La curva ROC mostró una AUC de 0,937 e identificó un punto de corte de 324pg/ml para CD25 soluble, con una sensibilidad del 94%, especificidad del 75%, valor predictivo positivo el 78% y valor predictivo negativo del 94% (fig. 1).
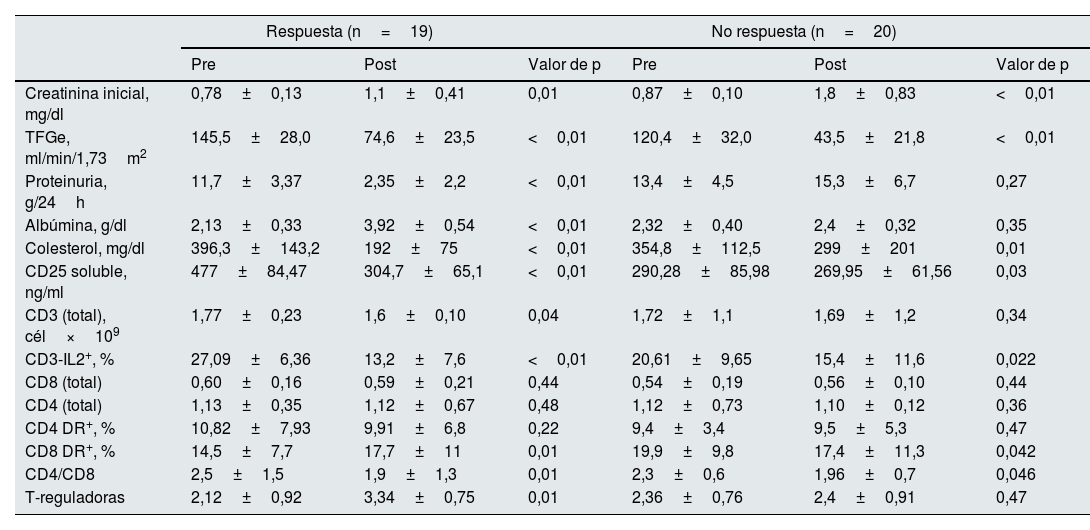
Evolución tras el tratamientoTras un seguimiento promedio de 13,7±5,3 meses, ambos grupos (respondedores y no respondedores) mostraron un deterioro significativo en TFGe y un incremento en los niveles de creatinina sérica. La pérdida de función renal fue mayor en los no respondedores (−6,97 [p25: −1,92; p75: −4,8ml/min/mes) en comparación con los respondedores (−3,39 [p25: −0,3; p75: −2,2ml/min/mes; p<0,01).
En los pacientes respondedores, se observó una reducción estadísticamente significativa en la proteinuria, niveles de colesterol y un incremento en los niveles de albúmina sérica. Además, presentaron una reducción estadísticamente significativa en los niveles de CD25 soluble, numero de linfocitos CD3, CD3-IL2+ y ratio CD4/CD8. Por otro lado, presentaron un incremento significativo en CD8 DR+ y en el número de células T reguladoras. En los enfermos sin respuesta al tratamiento, se apreció una reducción significativa en los niveles de CD25 soluble, en los niveles de CD3 IL-2+, CD8DR+ y una reducción significativa en la ratio CD4/CD8, sin cambios en las demás variables (tabla 5).
Evolución de las distintas variables bioquímicas y variables relacionadas con la activación de los linfocitos T en los enfermos con GFS, clasificados en función de la respuesta al tratamiento y comparando los valores pretratamiento y postratamiento
| Respuesta (n=19) | No respuesta (n=20) | |||||
|---|---|---|---|---|---|---|
| Pre | Post | Valor de p | Pre | Post | Valor de p | |
| Creatinina inicial, mg/dl | 0,78±0,13 | 1,1±0,41 | 0,01 | 0,87±0,10 | 1,8±0,83 | <0,01 |
| TFGe, ml/min/1,73m2 | 145,5±28,0 | 74,6±23,5 | <0,01 | 120,4±32,0 | 43,5±21,8 | <0,01 |
| Proteinuria, g/24h | 11,7±3,37 | 2,35±2,2 | <0,01 | 13,4±4,5 | 15,3±6,7 | 0,27 |
| Albúmina, g/dl | 2,13±0,33 | 3,92±0,54 | <0,01 | 2,32±0,40 | 2,4±0,32 | 0,35 |
| Colesterol, mg/dl | 396,3±143,2 | 192±75 | <0,01 | 354,8±112,5 | 299±201 | 0,01 |
| CD25 soluble, ng/ml | 477±84,47 | 304,7±65,1 | <0,01 | 290,28±85,98 | 269,95±61,56 | 0,03 |
| CD3 (total), cél×109 | 1,77±0,23 | 1,6±0,10 | 0,04 | 1,72±1,1 | 1,69±1,2 | 0,34 |
| CD3-IL2+, % | 27,09±6,36 | 13,2±7,6 | <0,01 | 20,61±9,65 | 15,4±11,6 | 0,022 |
| CD8 (total) | 0,60±0,16 | 0,59±0,21 | 0,44 | 0,54±0,19 | 0,56±0,10 | 0,44 |
| CD4 (total) | 1,13±0,35 | 1,12±0,67 | 0,48 | 1,12±0,73 | 1,10±0,12 | 0,36 |
| CD4 DR+, % | 10,82±7,93 | 9,91±6,8 | 0,22 | 9,4±3,4 | 9,5±5,3 | 0,47 |
| CD8 DR+, % | 14,5±7,7 | 17,7±11 | 0,01 | 19,9±9,8 | 17,4±11,3 | 0,042 |
| CD4/CD8 | 2,5±1,5 | 1,9±1,3 | 0,01 | 2,3±0,6 | 1,96±0,7 | 0,046 |
| T-reguladoras | 2,12±0,92 | 3,34±0,75 | 0,01 | 2,36±0,76 | 2,4±0,91 | 0,47 |
GFS: glomeruloesclerosis focal y segmentaria; TFGe: tasa de filtración glomerular estimada.
La reducción en los niveles de CD25 soluble, fue significativamente superior en los enfermos que respondieron al tratamiento que en los que no respondieron (reducción media: −169,5±99,2 vs. −20,15±8,9pg/ml, respectivamente, p<0,01). Cuando se analizó la reducción de niveles de CD25 soluble según remisión parcial o total no se obtuvieron diferencias estadísticamente significativas.
DiscusiónLos resultados obtenidos indican que los pacientes con GFS corticoresistente presentan un perfil heterogéneo de activación linfocitaria T, en cuanto a la distribución de las variables analizadas. Sin embargo, el perfil clínico, especialmente en términos de función renal y gravedad del SN, es comparable entre todos los pacientes.
El incremento en los niveles de CD25 soluble se asocia, de forma significativa, a la expresión de IL-2 en linfocitos CD3. Esto puede indicar que el nivel soluble de CD25 se debe, al menos en parte, a una activación de linfocitos CD3. Sin embargo, esta activación no está presente en todos los enfermos con GFS, al menos en el momento en que se realizó el estudio y la extracción de las muestras de sangre. Además, se relaciona de forma clara con la respuesta al tratamiento con inhibidores de calcineurina.
Nuestros datos sugieren que puede haber mecanismos distintos responsables de un mismo tipo de lesión podocitaria, dado que no existe ninguna evidencia que indique que el SN, por sí mismo, sea capaz de alterar los niveles de CD25 soluble; que tanto la gravedad como las características clínicas de los enfermos que responden son comparables a las de los enfermos resistentes; que en los criterios de inclusión, se aseguró en la medida de lo posible que el estado de activación de los linfocitos T no estuviera influido por factores farmacológicos externos; y que no hay evidencia de que los corticoesteroides induzcan cambios irreversibles en el estado de activación linfocitaria. Esto podría deberse a mecanismos patogénicos diversos, como se ha demostrado en estudios previos, o a diferentes etapas de actividad de un mismo proceso patogénico. En cualquiera de las 2 hipótesis, los datos sugieren que la medición de los niveles de CD25 soluble previos al inicio del tratamiento puede ser de utilidad para predecir la probabilidad de respuesta a los inhibidores de calcineurina, aunque no para predecir si el tipo de respuesta esperable será una remisión total o parcial.
Los cambios en los niveles de CD25 soluble observados tras el tratamiento indican que la remisión se asocia a una reducción significativa en los parámetros relacionados con la activación de linfocitos T. Esta reducción no puede atribuirse al SN por sí mismo, ya que sigue un comportamiento distinto en función del tipo de respuesta y no es evidente en los enfermos que no responden al tratamiento. El número de linfocitos CD3 que expresan receptores de IL-2 también es un indicador de activación de los linfocitos T. Sin embargo, el análisis realizado revela que, aunque este número es superior en los enfermos que responden al tratamiento, su valor predictivo es muy inferior al observado con los niveles solubles de CD25.
El mecanismo de acción exacto de los ICN en la GFS aún no se comprende completamente. Según la literatura, se postula que las células T actúan sobre los podocitos causando proteinuria, y que el efecto antiproteinúrico de los ICN resulta de la inhibición de la señalización del factor nuclear de las células T. Los ICN ejercen sus efectos inmunosupresores al reducir la producción de IL-2 y la expresión de su receptor, lo que lleva a una disminución en la activación de las células T. Este mecanismo se basa en la inhibición de la activación de los linfocitos T al unirse a diversas proteínas intracelulares, inhibiendo así la actividad fosfatasa de la calcineurina16. Sin embargo, otros autores sugieren que los ICN también podrían tener un efecto no inmunológico sobre los podocitos8. Se ha descrito un efecto dosis-dependiente sobre la resistencia vascular de la arteria aferente, lo que conlleva una reducción del flujo sanguíneo renal, la presión de filtración glomerular y, consecuentemente, la disminución de la proteinuria filtrada17. Además, algunos investigadores han sugerido que los ICN pueden mejorar la selectividad de carga y tamaño de la barrera de filtración glomerular18. Finalmente, se podría explicar su efecto por la protección que brindan a la fosforilación de la sinaptopodina, la cual es crucial para la integridad del citoesqueleto de actina de los podocitos8. Aunque no se pueden excluir otras hipótesis, los datos indican claramente que, al menos en gran medida, el efecto beneficioso de los ICN en la GFS corticoresistente podría estar relacionado con una reducción en la activación de los linfocitos T.
Un hallazgo destacado en cuanto a los datos sociodemográficos es que todos los pacientes con respuesta total fueron pacientes pediátricos. Este hallazgo subraya la relevancia de la edad como un factor determinante en la respuesta al tratamiento con los ICN en los pacientes con GFS cortico resistente. La eficacia observada exclusivamente en los pacientes pediátricos podría estar relacionada con diferencias en la patogenia de la enfermedad renal entre niños y adultos o en considerar que los adultos podrían hallarse, en muchos casos, en fases más avanzadas de lesión podocitaria, que no permitirían observar respuestas completas.
A pesar de que tanto la distribución de las poblaciones de linfocitos CD4 y CD8 que expresan DR+ en su membrana como la de linfocitos T reguladores es distinta en función del tipo de respuesta a los inhibidores de calcineurina, ninguno de estos parámetros es útil para la predicción de la respuesta.
La presente investigación presenta varias limitaciones que deben ser consideradas al interpretar los resultados. En primer lugar, el punto de corte propuesto para los niveles de CD25 soluble no está respaldado por evidencias previas en la literatura, y sería relevante explorar su variabilidad en diferentes cohortes o condiciones clínicas para evaluar su aplicabilidad general. Además, el tamaño de la muestra fue relativamente pequeño, lo que puede limitar la capacidad para generalizar los hallazgos a poblaciones más amplias, especialmente en lo que respecta al análisis de subgrupos, como la comparación entre los pacientes pediátricos y adultos. Futuras investigaciones con muestras más grandes podrían validar y ampliar estos resultados. Aunque el estudio se realizó en múltiples centros, las diferencias en la práctica clínica entre ellos podrían haber influido en los resultados, por lo que sería recomendable estandarizar los protocolos clínicos en estudios multicéntricos futuros. Asimismo, los hallazgos no han sido validados en cohortes externas o en diferentes contextos poblacionales, por lo que sería esencial replicar estos resultados en otras poblaciones para confirmar su aplicabilidad clínica. Además, aunque los niveles de CD25 soluble mostraron un valor predictivo significativo, se limita el enfoque a un solo biomarcador, lo cual podría ser ampliado mediante la inclusión de otros biomarcadores complementarios que mejoren la precisión diagnóstica y la predicción de la respuesta al tratamiento. Por último, el período de seguimiento fue limitado, lo que impide evaluar los efectos a largo plazo de los inhibidores de calcineurina en la progresión de la enfermedad renal crónica y en la supervivencia renal; por lo que un seguimiento más extenso permitiría comprender mejor los efectos duraderos de estos tratamientos.
ConclusiónEste estudio respalda la idea de que los niveles de CD25 soluble podrían ser un factor predictivo útil para la respuesta al tratamiento en los pacientes con GFS cortico resistente. El análisis realizado revela que los valores de CD25 soluble superiores a 342pg/ml se asocian con una alta sensibilidad para identificar la respuesta al tratamiento con los ICN, aunque no permiten predecir el tipo de remisión esperada. La implementación de este enfoque diagnóstico podría reducir la exposición de los pacientes a los efectos secundarios a largo plazo de los ICN, al identificar de manera más precisa a aquellos que podrían beneficiarse de este tratamiento inmunosupresor. Sin embargo, es crucial que estos hallazgos sean validados en estudios prospectivos más amplios, y que se considere la evaluación integral de la respuesta al tratamiento, teniendo en cuenta otros factores clínicos y biológicos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores de este manuscrito no tienen conflictos de intereses que declarar.
Trabajo apoyado por la Unidad de Inmunohistoquímica e Histología de IRBLleida.