El déficit de hierro es frecuente en los pacientes con enfermedad renal crónica no en diálisis y se asocia con unos valores más bajos de hemoglobina y una menor respuesta al tratamiento con agentes estimuladores de la eritropoyesis. Por ello, la ferroterapia constituye uno de los pilares del tratamiento de la anemia en esta población. La ferroterapia en la enfermedad renal crónica está indicada en la prevención y tratamiento del déficit de hierro o en pacientes en tratamiento con agentes estimuladores de la eritropoyesis.
En los pacientes con enfermedad renal crónica no en diálisis puede administrarse por vía oral o por vía intravenosa. Ambas vías tienen sus ventajas y sus inconvenientes. Aunque las guías europeas aconsejan preferentemente la vía oral en esta población, los problemas de absorción intestinal e intolerancia gastrointestinal limitan su eficacia y cumplimiento terapéutico. La vía intravenosa podría ser más eficaz que la vía oral para conseguir los objetivos de hemoglobina, ferritina e índice de saturación de transferrina. Sin embargo, asocia un cierto riesgo de reacciones de hipersensibilidad y otros riesgos potenciales asociados a su uso que deberían ser evaluados en ensayos clínicos a largo plazo, con eventos duros para demostrar la seguridad de esta alternativa en esta población. Las nuevas formulaciones de hierro intravenoso de mayor peso molecular, más estables y que liberan menos hierro libre durante la infusión podrían ser útiles al permitir una estrategia de altas dosis y baja frecuencia en esta población, con un excelente perfil de eficacia y seguridad.
Iron deficiency is common in patients with non-dialysis-dependent chronic kidney disease and is associated with lower haemoglobin values and a poorer response to treatment with erythropoiesis-stimulating agents. Consequently, iron therapy is one of the cornerstones of the treatment of anaemia in this population. Iron therapy in chronic kidney disease is indicated in the prevention and treatment of iron deficiency or in patients under treatment with erythropoiesis-stimulating agents.
In patients with non-dialysis-dependent chronic kidney disease, iron agents can be administered orally or intravenously. Both routes have advantages and disadvantages. Although the European guidelines recommend the preferential use of the oral route in this population, problems of intestinal absorption and gastrointestinal intolerance limit the efficacy of these drugs and treatment adherence. The intravenous route could be more effective than the oral route to achieve target levels of haemoglobin, ferritin and transferrin saturation index. However, this route is associated with a certain risk of hypersensitivity reactions as well as other potential risks that should be assessed in long-term clinical trials with hard endpoints to demonstrate the safety of this alternative in this population. The new intravenous iron formulations with a higher molecular weight, which are more stable and release less free iron during infusion could be useful as they allow a strategy of high doses and low frequency in this population and have an excellent safety and efficacy profile.
INtRoDUCCIóN
La enfermedad renal crónica (ERC) se asocia con frecuencia con anemia y su prevalencia aumenta a medida que progresa la enfermedad1. Su origen es multifactorial y entre las causas de esta anemia se incluyen: una producción insuficiente de eritropoyetina (EPO) y el déficit absoluto o funcional de hierro, entre otros (tabla 1).
El déficit de hierro es frecuente en pacientes con ERC, ya que afecta a cerca del 50% de pacientes con ERC estadios 3 y 42, y se asocia con valores de hemoglobina (Hb) más bajos en estos pacientes3. En pacientes con ERC en estadios 3-5 no en diálisis y atendidos en consultas externas de nefrología, la prevalencia de ferropenia oscila entre el 36 y el 60% y está infratratada4-6. Como causas de la ferropenia en la ERC se han implicado: a) las pérdidas sanguíneas (analíticas frecuentes, hemorragia gastrointestinal u otros asociados a la trombopatía urémica); b) una absorción intestinal de hierro disminuida (por el uso de antiácidos o de quelantes del fósforo, las restricciones dietéticas prescritas y/o la menor apetencia por alimentos ricos en hierro en estos pacientes, o el aumento de los valores de hepcidina en la ERC, que bloquean la absorción intestinal de hierro); c) la disminución de la liberación de hierro desde los depósitos tisulares por el aumento de los valores de hepcidina, y d) el aumento de la utilización de hierro durante el tratamiento con agentes estimuladores de la eritropoyesis (AEE)7.
Dada la elevada prevalencia de anemia y ferropenia en la ERC, la ferroterapia es pues un pilar fundamental en el tratamiento de la anemia en esta población.
INDICaCIoNES DE la FERRotERapIa EN la ENFERMEDaD RENal CRóNICa No EN DIálISIS
La ferroterapia está indicada en pacientes anémicos con ERC y con déficit absoluto de hierro (ferritina < 100 ng/ml e índice de saturación de transferrina [IST] < 20%), así como en pacientes anémicos en que se quiere incrementar los valores de Hb y retrasar un tratamiento con AEE, o en pacientes tratados con AEE para aumentar los valores de Hb y/o reducir las dosis de AEE8-10. Ello es así porque muchos pacientes con anemia renal responden a la repleción de hierro con un aumento de los valores de Hb y/o una reducción de las dosis de AEE aun con valores de ferritina > 100 ng/ml o IST > 20%. Sin embargo, la probabilidad de respuesta a la ferroterapia es menor cuando los valores de IST alcanzan el 30-35%11 y los de ferritina los 500 ng/ ml12. La suplementación con hierro en esta situación podría además asociarse potencialmente a acumulación y toxicidad por este metal, por lo que debería evitarse su uso.
Dado que la repleción de los depósitos de hierro consigue los valores de Hb objetivo en un porcentaje significativo de pacientes con ERC no en diálisis, sin necesidad de AEE13,14, en el paciente anémico con ERC deben asegurarse unos parámetros férricos adecuados como primera opción y, solo cuando se hayan conseguido estos, se hayan corregido otros déficits posibles (p. ej., vitamina B12 o ácido fólico) y persista una anemia subsidiaria de tratamiento, se indicará el tratamiento con AEE.
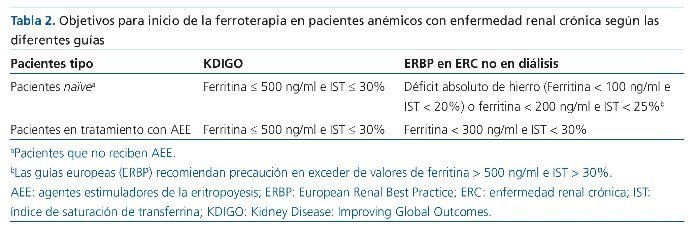
Las diferentes guías clínicas no coinciden en los objetivos y estrategia de la ferroterapia en la ERC. Mientras la guía Kidney Disease: Improving Global Outcomes (KDIGO) aconseja un uso más liberal de la ferroterapia8, las recomendaciones europeas (European Renal Best Practice [ERBP]) proponen un uso más prudente de la suplementación marcial9 (tabla 2). Así, la guía KDIGO sugiere para pacientes con ERC y anemia que no reciben hierro y/o AEE una prueba con hierro intravenoso (i.v.) (o alternativamente ferroterapia vía oral [v.o.] durante 1-3 meses) si se persigue un aumento de la Hb sin necesidad de iniciar AEE y el IST ≤ 30% y ferritina ≤ 500 ng/ml. En pacientes en tratamiento con AEE que no reciben suplementos de hierro también sugieren una prueba con hierro i.v. (o ferroterapia v.o. durante 1-3 meses) si se persigue un aumento de la Hb o una reducción de las dosis de AEE y el IST ≤ 30% y la ferritina es ≤ 500 ng/ml8.
Las recomendaciones europeas (ERBP)9 indican que en el paciente anémico con ERC la ferroterapia está indicada cuando exista un déficit absoluto de hierro. También sugieren hacer una prueba de suplementación de hierro con ferroterapia v.o., como primera opción, o i.v. cuando se quiere conseguir un aumento de la Hb sin AEE en pacientes con IST < 25% y ferritina < 200 ng/ml. En pacientes con ERC en tratamiento con AEE y que no reciben suplementos de hierro se sugiere también una prueba con ferroterapia v.o. como primera opción o i.v. si se quiere un aumento de los valores de Hb o una reducción de las dosis de AEE y el IST < 30% y la ferritina < 300 ng/ml. En ambas situaciones recomiendan no exceder valores de ferritina > 500 ng/ml, especialmente si el IST > 30%. De forma similar, las guías británicas del National Institute for Care Excellence (NICE) recomiendan iniciar con hierro v.o. como primera opción en pacientes anémicos con ERC no en diálisis10.
Los pacientes anémicos con ERC que reciben tratamiento con AEE también precisarán frecuentemente suplementos de hierro de forma continuada para mantener unos depósitos adecuados de hierro, por el aumento de la movilización del hierro de los depósitos tisulares durante el tratamiento con AEE. De hecho, el déficit de hierro es la causa más frecuente de resistencia al tratamiento con AEE en la ERC y es fácilmente corregible15.
Sin embargo, no es recomendable mantener de forma rutinaria la ferroterapia cuando los valores de ferritina sean superiores a 500 ng/ml9, aunque cada paciente debe ser valorado individualmente. Especialmente, porque no se dispone de información sobre la seguridad a largo plazo de la ferroterapia con valores elevados de ferritina en esta población y por los riesgos potenciales asociados a una sobrecarga de hierro16, como ya se ha comentado en el artículo anterior.
FERRotERapIa EN la ENFERMEDaD RENal CRóNICa No EN DIálISIS: oRal FRENtE INtRavENoSa
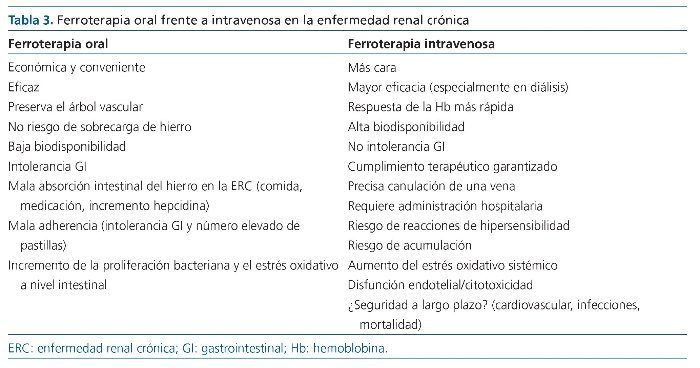
La ferroterapia está pues indicada para el tratamiento y la prevención del déficit de hierro en pacientes anémicos con ERC. Respecto a la prescripción de ferroterapia, las guías europeas (ERBP) son claras, en pacientes con ERC no en diálisis y anemia leve-moderada, la ferroterapia v.o. debe prescribirse como primera elección durante un mínimo de 3 meses, en ausencia de intolerancia gastrointestinal, para preservar el árbol venoso para un posible acceso vascular futuro para hemodiálisis9. Por el contrario, la ferroterapia i.v. sería de primera elección en pacientes con anemia grave o cuando la ferroterapia v.o. no es efectiva o no es tolerada. Similares recomendaciones se hacen en las recientes guías NICE10.
Ferroterapia oral en la enfermedad renal crónica no en diálisis
La ferroterapia v.o. no es cara, es fácilmente accesible, no requiere un acceso i.v. ni ser administrada en un centro hospitalario con personal entrenado. Los estudios aleatorizados clásicos no han demostrado de forma concluyente que la ferroterapia v.o. sea inferior a la ferroterapia i.v. en pacientes con ERC no en diálisis, aunque los seguimientos en estos estudios son demasiado cortos para concluir si la duración de la ferroterapia v.o. era suficiente para contestar la pregunta de forma definitiva17-20. En un metaanálisis de la Cochrane se observó un aumento superior de la Hb, de la ferritina y del IST asociados al tratamiento con hierro i.v. frente a la ferroterapia v.o., pero las diferencias en estos parámetros eran menores en los pacientes con ERC no en diálisis que en los pacientes en diálisis21. Así, las guías KDIGO reconocen que no hay un beneficio claro de la ferroterapia i.v. en esta población, por lo que puede darse hierro i.v. o v.o. en los pacientes con ERC no en diálisis8. Sin embargo, el hierro i.v. consiguió de forma consistente mayores valores de ferritina e IST, por lo que, a largo plazo, la vía i.v. también podría ser superior a la v.o. en esta población22. En este sentido, estudios más recientes que han utilizado las nuevas formulaciones de hierro i.v., como el hierro carboximaltosa (FCM), hierro isomaltósido 1000 o ferumoxytol, que permiten administrar dosis más altas en cada administración, sí parecen demostrar una superioridad de la ferroterapia por vía i.v. frente a la v.o. en esta población23-26. Por otro lado, deberían contemplarse los riesgos y beneficios de cada vía de administración, así como las implicaciones económicas de elegir la v.o. sobre la i.v. en esta población, que son complejas y no fácilmente cuantificables sin un estudio prospectivo de intervención22 (tabla 3).
Los compuestos clásicos de hierro v.o. presentan importantes limitaciones. La interacción con alimentos reduce su absorción y su precipitación en el tracto gastrointestinal, especialmente a las dosis altas requeridas por estos pacientes (200 mg de hierro elemental al día). Su absorción intestinal también puede estar limitada en estos pacientes por el uso frecuente de antiácidos (inhibidores de la bomba de protones, antagonistas H2) o de quelantes del fósforo. Por ello, los suplementos de hierro v.o. deberían administrarse en ayunas, si el paciente lo tolera, y alejados de la administración de estos fármacos. Además, su absorción puede estar mermada por la inhibición de la captación y transporte de hierro desde los enterocitos al plasma por los valores elevados de hepcidina circulantes. La oxidación de Fe2+ a Fe3+ puede generar estrés oxidativo en la mucosa gastrointestinal y toxicidad local27. Así, la suplementación con dosis terapéuticas de hierro v.o., frecuentemente causa efectos secundarios gastrointestinales como náuseas, vómitos, estreñimiento, diarrea, coloración oscura de las heces y/o molestias abdominales en más de un 25% de pacientes. Ello limita el cumplimiento terapéutico u obliga a reducir las dosis. En este sentido se estima que alrededor de un 20% de los pacientes que inician ferroterapia v.o. deja la medicación por sus efectos adversos28. Además, el hierro v.o. induce la expresión de hepcidina, inhibiendo la absorción de hierro, por lo que es mejor que el hierro se administre en una dosis diaria. El hierro es un factor importante para el crecimiento bacteriano y su absorción intestinal es muy limitada. Además, en estos pacientes los valores elevados de hepcidina limitan todavía más su absorción intestinal, con lo que el hierro disponible para la microflora intestinal es mayor y puede modificarla aumentando el número de bacterias patógenas y afectando a la inmunidad intestinal, como se ha demostrado en otras poblaciones29,30, por lo que puede especularse que agrave la disbiosis de la microflora intestinal asociada a la ERC, aumente la producción de toxinas urémicas derivadas del intestino, así como la traslocación bacteriana y de productos bacterianos, lo que podría incrementar la toxicidad urémica y/o el estado inflamatorio propios de la ERC, aunque ello no se ha analizado hasta la fecha.
Tras la administración de dosis altas de sales de hierro
v.o., también puede haber una difusión de Fe2+, lo que lleva a un aumento de hierro no ligado a la transferrina (hierro libre) en plasma. La fracción lábil de este hierro libre (con actividad redox) puede ser captada de forma no regulada por el sistema endocrino, el corazón u otros tejidos e inducir estrés oxidativo y daño celular31,32. En este sentido, compuestos no iónicos de hierro u otras formulaciones diferentes de las sales clásicas (sulfato, fumarato o glutamato ferrosos) podrían inducir menor estrés oxidativo33.
Se han desarrollado diferentes tipos de formulaciones de hierro v.o. en un intento de mejorar estos problemas, como la intolerancia gastrointestinal, la biodisponibilidad o permitir su ingestión con alimentos, como complejos férricos no iónicos (p. ej., Fe3+-polimaltosa), el hierro heme polipéptido o el hierro liposomado. Estos compuestos podrían tener ventajas respecto a las sales de hierro clásicas, en cuanto a eficacia y tolerancia, pero los estudios con estos compuestos son pequeños y con escaso tiempo de seguimiento34,35 para aconsejar su uso generalizado.
Ferroterapia intravenosa en la enfermedad renal crónica no en diálisis
La ferroterapia i.v. está indicada en el tratamiento del déficit de hierro en pacientes anémicos con ERC no en diálisis con intolerancia gastrointestinal al hierro v.o., en los que la ferroterapia v.o. es inefectiva, y en pacientes con anemia grave9.
Las diferentes formulaciones de hierro parenteral (hierro dextrano, hierro sacarosa, gluconato férrico, FCM, ferumoxytol o hierro isomaltósido 1000), generalmente están formadas por un núcleo de hierro trivalente (Fe3+) protegido por un recubrimiento de carbohidratos con diferentes pesos moleculares y propiedades fisicoquímicas, que tienen una cinética de degradación y una capacidad de liberación de hierro “libre” a la circulación distintas36. Ello determina la dosis máxima única para cada compuesto. Las nuevas formulaciones de mayor peso molecular, que forman unos complejos más estables, al ligar el hierro más ávidamente, minimizan la liberación de hierro lábil durante la infusión y permiten administrar dosis más altas en intervalos de tiempo más cortos36. La liberación de hierro catalíticamente activo es mayor con hierro gluconato > hierro sacarosa > hierro dextrano > ferumoxytol. Asimismo, las nuevas formulaciones (FCM o hierro isomaltósido 1000) también liberan muy poco hierro libre al plasma tras su administración37-39. Sin embargo, estos productos se administran en bolos de 100-1.000 mg, que exceden en mucho la capacidad del pool de transferrina libre y representa una cantidad enorme, comparado con la absorción intestinal de 1-2 mg/día de hierro. Ello puede generar hierro lábil (catalíticamente activo) y, aunque parte de este hierro libre es captado por la transferrina y otras proteínas, el resto puede ser captado de forma no regulada por diferentes tipos celulares o traslocarse libremente a través de la membrana celular. Ello puede agravarse en la ERC, ya que los valores de transferrina (y, por ende, su capacidad de transporte de hierro) están frecuentemente disminuidos en estos pacientes. Este hierro libre intracelular constituye el pool de hierro lábil (no ligado a ferritina), que puede inducir diversos efectos tóxicos, como producción de especies reactivas de oxígeno y, subsiguientemente, daño del ADN o peroxidación lipídica y proteica. Este aumento del estrés oxidativo y daño celular puede agravar el estrés oxidativo y la inflamación asociados a la ERC. Independientemente del preparado de hierro prescrito, una vez que el hierro es captado por los eritrocitos, macrófagos u otros sitios de almacenamiento del organismo, el aumento de hepcidina inducido por el propio hierro y la consiguiente regulación a la baja de la ferroportina limitarán la disponibilidad del hierro para el reciclaje y el uso subsiguiente. Las otras complicaciones conocidas o potenciales de la ferroterapia i.v. están incluidas en la tabla 3, han sido objeto de un reciente documento de consenso de la KDIGO40 y revisadas en el capítulo anterior.
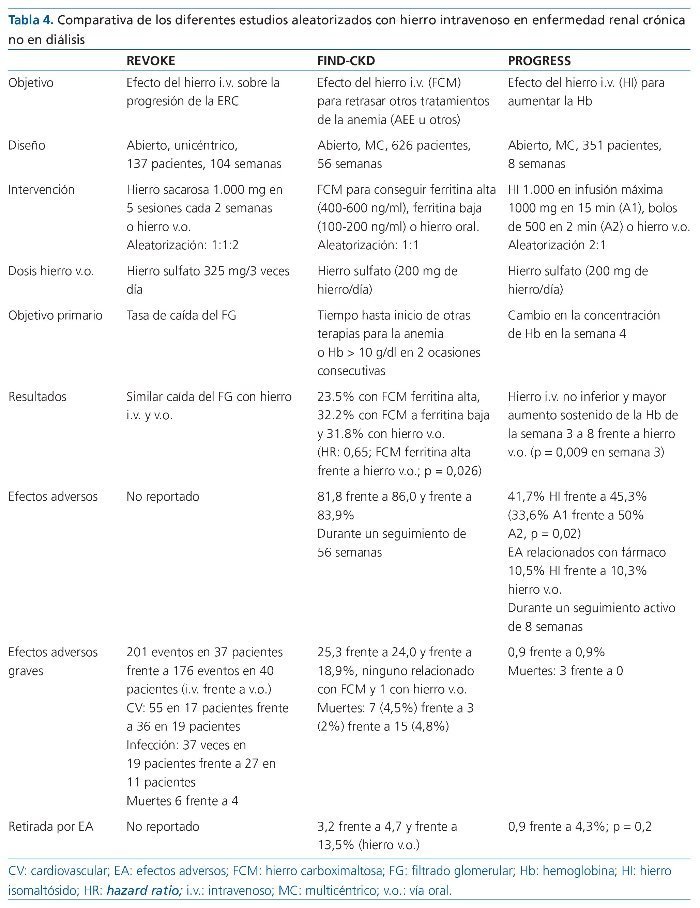
La mayoría de estudios publicados hasta la fecha adolecen de un período de seguimiento corto para evaluar la seguridad a largo plazo de la ferroterapia i.v. Recientemente, la seguridad a largo plazo de la ferroterapia i.v. en pacientes con ERC no en diálisis ha sido cuestionada por el estudio Randomized trial to Evaluate intraVenous and Oral iron in chronic KidnEy disease (REVOKE)41. El objetivo de este estudio fue analizar el efecto de la ferroterapia i.v. sobre la función renal en pacientes con ERC. Para ello se hizo un estudio aleatorizado, abierto, de grupos paralelos en pacientes con ERC estadios 3-4 y anemia por déficit de hierro, que se aleatorizaron a sulfato ferroso v.o. (69 pacientes a dosis de 325 mg 3 veces al día durante 8 semanas) o hierro sacarosa i.v. (67 pacientes con 200 mg cada 2 semanas, dosis total de 1 g). El objetivo primario fue la diferencia entre los grupos en la pendiente de cambio del filtrado glomerular, el cual se midió mediante el aclaramiento de iodotalamato basalmente, a las 8 semanas, 6 meses, 12 meses y 24 meses tras la aleatorización. El estudio solo reclutó 136 pacientes de los 200 requeridos para el análisis estadístico. Basalmente, los pacientes aleatorizados a hierro i.v. eran más jóvenes, tenían menos enfermedad cardiovascular e historia de infecciones. La Hb mejoró con el tiempo en ambos grupos, sin diferencias entre ellos. El filtrado glomerular se redujo de manera similar a los 2 años en ambos grupos de tratamiento (hierro v.o. –3,6 ml/min/1,73 m2, hierro i.v. –4,0 ml/min/1,73 m2, diferencia entre los grupos –0,35 ml/min/1,73 m2; intervalo de confianza del 95% [IC del 95%], –2,9 a 2,3). No hubo diferencias en la albuminuria ni en la calidad de vida entre los 2 grupos. El ensayo se terminó prematuramente, tras la recomendación de una comisión de supervisión de datos y seguridad independiente basada en las pocas posibilidades de hallar diferencias en los cambios de filtrado glomerular, pero un mayor riesgo de eventos adversos graves en el grupo de tratamiento con hierro i.v. (201 frente a 176). Hubo 36 eventos cardiovasculares graves entre los 19 participantes asignados al grupo de tratamiento con hierro v.o. y 55 eventos entre los 17 participantes del grupo de hierro i.v. Aunque no hubo diferencias significativas cuando se ajustó por diversas variables, la razón de tasas de incidencia ajustada fue de 2,51 (1,56-4,04; p < 0,001). La incidencia de hospitalización por insuficiencia cardíaca fue cerca de 2 veces superior en el grupo de hierro i.v. El riesgo de complicaciones infecciosas que requirieron hospitalización tuvieron una tasa de incidencia ajustada de 2,12 (1,24-3,64; p = 0,006). El estudio concluyó que entre los pacientes con ERC no en diálisis y anemia por déficit de hierro, la terapia de hierro i.v. se asociaba con un mayor riesgo de eventos adversos graves, incluidos los debidos a causas cardiovasculares e infecciosas. Sin embargo deben tenerse en cuenta varias consideraciones: el número de sujetos que experimentaron efectos adversos fue similar, pero estos eran más frecuentes en los paciente aleatorizados a hierro i.v. Las diferencias solo fueron significativas tras ajustar por una serie de variables, lo cual es cuestionable en un ensayo clínico (tabla 4).
Algunos estudios limitados sugieren que los diferentes compuestos de hierro i.v. pueden tener diferentes efectos sobre los marcadores de estrés oxidativo y de inflamación, y que ello no está necesariamente relacionado con el peso molecular de los compuestos, su estabilidad o la capacidad de liberación de hierro libre a la circulación42, por lo que los resultados con un compuesto podrían no ser extrapolables a otros. Asimismo, la seguridad comparada de las diferentes formulaciones de hierro i.v. en pacientes con ERC es desconocida por la falta de ensayos clínicos comparativos sobre eventos duros (p. ej., mortalidad, riesgo cardiovascular o infecciones) y su seguridad a largo plazo (tabla 5).
NUEvoS aGENtES DE hIERRo INtRavENoSo: ENtENDIENDo El EStUDIo FIND-CKD
Los nuevos agentes de hierro i.v., FCM y hierro isomaltósido 1000 tienen un mayor peso molecular y una mayor estabilidad, lo que permite que se administren dosis de hierro mayores en cada sesión, lo cual es especialmente atractivo en pacientes con ERC no en diálisis. De hecho, las recientes guías NICE aconsejan que la ferroterapia i.v. en estos pacientes siga una estrategia de dosis altas y baja frecuencia10.
El Ferinject® Assessment in Patients with Iron Deficiency Anaemia and Non-Dialysis-Dependent Chronic Kidney Disease (FIND-CKD) es un estudio aleatorizado, abierto, multicéntrico y prospectivo de 56 semanas de duración, que incluyó a 626 pacientes con ERC no en diálisis, anemia y déficit de hierro que no recibían AEE25. Los pacientes fueron aleatorizados (1:1:2) a la administración i.v. de FCM, con el objetivo de conseguir una ferritina (400-600 mg/l) o una ferritina más baja (100-200 mg/l) o la suplementación con hierro v.o. (hierro sulfato a dosis de 100 mg de hierro/día). El evento primario fue el tiempo hasta el inicio de otro tratamiento de la anemia (AEE, otra terapia de hierro o transfusión de sangre) o un valor de Hb < 10 g/ dl en 2 ocasiones consecutivas durante las semanas 8-5225.
La dosis acumulativa de hierro fue de 2.685 mg en el grupo aleatorizado a ferritina alta y 1.040 mg en el grupo a ferritina baja. El evento primario ocurrió en 36 (23,5%), 49 (32,2%) y 98 (31,8%) pacientes en el grupo FCM-ferritina alta, FCM-ferritina baja y grupo de hierro v.o., respectivamente (hazard ratio [HR]: 0,65; IC del 95%, 0,44-0,95; p = 0,026 para el grupo FCM-ferritina alta en comparación con el grupo de hierro v.o.). Es decir, el 76,5% de los pacientes FCM-ferritina alta no precisó ningún tratamiento durante el seguimiento, frente al 67,8% de los pacientes del grupo FCM-ferritina baja y el 68,2% de los pacientes asignados a hierro v.o. El aumento de la Hb fue mayor en el grupo FCM-ferritina alta frente al grupo de hierro v.o. (p = 0,014), y la respuesta de la Hb fue más rápida en el primer grupo. Una mayor proporción de los pacientes logró un aumento de Hb ³ 1 g/dl en el grupo FMC-ferritina alta frente al grupo de hierro v.o. (HR: 2,04; IC del 95%, 1,52-2,72; p < 0,001). No se observaron diferencias entre los 3 grupos respecto a la calidad de vida. Las tasas de eventos adversos y eventos adversos graves fueron similares en todos los grupos. El 21,1% de los pacientes del grupo de ferroterapia v.o. abandonó el estudio, comparado con el 14,2 y el 11,7% en los grupos FCM-ferritina alta y FCM-ferritina baja, respectivamente, y 23 pacientes del grupo de hierro v.o. abandonaron el estudio por intolerancia (7,5%). No se observaron diferencias en el filtrado glomerular ni en la progresión a diálisis entre los 3 grupos.
Los autores concluyeron que, en comparación con el hierro v.o., la administración de FCM i.v. con el objetivo de alcanzar una ferritina de 400 a 600 mg/l se conseguía más rápidamente y se mantenían los valores de Hb y se retrasaba y/o reducía la necesidad de otros tratamientos de la anemia, incluyendo AEE. Dentro de las limitaciones de este estudio, no se observó toxicidad renal y no hubo diferencias en la aparición de eventos cardiovasculares o infecciosos entre los diferentes grupos (tabla 4).
Estos resultados, con un tamaño muestral más grande y un seguimiento a 1 año vienen a cuestionar los resultados del estudio REVOKE, ya que no se observaron más efectos adversos graves en el grupo de FCM a dosis altas que en el grupo de hierro v.o. Sin embargo, y a pesar de tener un tiempo de seguimiento más largo que estudios previos con ferroterapia i.v. en pacientes con ERC no en diálisis (1 año frente a hasta 8 semanas en la mayoría de los estudios previos) y que no observó diferencias en el perfil de seguridad entre los diferentes tratamientos, los autores reconocen que este estudio no tiene la potencia suficiente para evaluar un evento de seguridad, por lo que no se puede concluir de forma fehaciente el perfil de beneficio/riesgo a largo plazo del tratamiento con FCM. Serían deseables más estudios aleatorizados con un tamaño muestral mayor y un mayor tiempo de seguimiento, para demostrar la seguridad de la ferroterapia i.v. en esta población. Sin embargo, este y otros estudios recientes sugieren que las nuevas formulaciones de hierro parenteral parecen ser superiores en eficacia y tolerabilidad a las sales de hierro clásicas v.o. o formulaciones de hierro i.v. más antiguas23,25,43.
El estudio PROGRESS es un estudio de fase III de no inferioridad, aleatorizado, multicéntrico y abierto que comparó hierro isomaltósido 1000 por vía i.v. frente a hierro v.o. en pacientes con ERC no en diálisis y anemia. Se incluyeron 351 pacientes con ERC no en diálisis y ferropenia. Los pacientes fueron aleatorizados 2:1 a hierro isomaltósido 1000 (grupo A) o sulfato ferroso (200 mg de hierro elemental/día) por v.o. (grupo B). Los pacientes del grupo A fueron a su vez aleatorizados en 2 grupos: A1 (infusión de un máximo de 1.000 mg en dosis única durante 15 min) y A2 (bolos de 500 mg en 2 min). Para calcular la dosis de hierro i.v. se utilizó una fórmula de Ganzoni modificada. El evento primario fue el cambio de Hb entre el período basal y la semana 4. Hierro isomaltósido 1000 fue no inferior al hierro v.o. en la semana 4 (p < 0,001) y mantuvo un aumento de Hb superior al hierro v.o. desde la semana 3 (p = 0,009) y hasta el final del estudio en la octava semana. La respuesta de la Hb fue mayor con dosis de hierro isomaltósido 1000 ³ 1.000 mg (p < 0,05). Los valores de ferritina e IST también fueron superiores con hierro i.v. Los efectos adversos se observaron en un 10,5% con hierro isomaltósido 1000 y un 10,3% con hierro v.o. Más pacientes con hierro v.o. abandonaron el estudio por efectos adversos (el 4,3 frente al 0,9%; p = 0,2)26 (tabla 4).
Por lo tanto, el hierro isomaltósido 1000 fue más eficaz que el hierro v.o. para aumentar la Hb y fue bien tolerado en pacientes con ERC no en diálisis. Aunque no se observó ningún problema de seguridad. De hecho, es un ensayo clínico de 8 semanas, y posteriormente a las 8 semanas hubo un seguimiento pasivo de los pacientes, ya que tras este período se pedía a los participantes que informaran a los investigadores si tenían efectos adversos, pero no hubo una búsqueda sistemática de efectos adversos a diferencia del REVOKE o del FIND-CKD.
hIERRo SaCaRoSa oRIGINal FRENtE a SIMIlaRES DE hIERRo SaCaRoSa
Con la intención de reducir los costes derivados del tratamiento han aparecido en el mercado fármacos similares de hierro sacarosa (ISS). La minimización de costes se basa en el principio de la sustitución de los medicamentos originales por alternativas terapéuticamente equivalentes, esperando resultados similares pero con un coste reducido. Sin embargo, 2 estudios observacionales en pacientes en hemodiálisis han objetivado que el uso de ISS frente a hierro sacarosa original se asocia con un aumento de las dosis de hierro y de AEE para mantener los valores de Hb en estos pacientes44,45. Asimismo, el índice de resistencia a la EPO44 y la variabilidad de la Hb45 (2 parámetros asociados a una mayor morbimortalidad en esos pacientes)46-48 aumentaron durante el tratamiento con ISS. Ello además derivó en un incremento del coste del tratamiento de la anemia en estos pacientes44.
Estos hallazgos pueden atribuirse a la diferencia en la cinética de disociación de hierro por los cambios en la estabilidad del núcleo del complejo hierro-sacarosa49. Pequeños cambios en el proceso de producción pueden conducir a cambios en la estructura, distribución de peso molecular y estabilidad del núcleo de hierro oxihidróxido del complejo hierro-sacarosa50. Análisis morfométricos en modelos animales han demostrado una disminución de hierro en su forma de almacenamiento fisiológica, ferritina, tras la administración de formulaciones de ISS frente al original51, así como diferencias en la generación de estrés oxidativo y marcadores de inflamación, tanto en plasma52 como en células endoteliales en cultivo53. Asimismo, Martín-Malo et al objetivaron que un ISS inducía un aumento de la generación de radicales libres de oxígeno y de la expresión de la molécula de adhesión intercelular (ICAM-1), y una mayor apoptosis en células mononuclerares que la formulación original54. Resultados similares de mayor toxicidad se han descrito recientemente en estudios no clínicos con una copia de FCM de India comparado con el hierro sacarosa original55.
Asimismo, la tolerancia de los ISS no parece equivalente a la del hierro sacarosa original en poblaciones diversas56,57. Por todo ello es cuestionable el proceso de aprobación de fármacos complejos, como el ISS, y si estos fármacos ISS pueden sustituir al original sin estudios adecuados para demostrar su eficacia y seguridad en la práctica clínica diaria, como ocurre con los fármacos genéricos. Ello ha quedado recientemente reflejado en un documento de reflexión de la EMA destacando las reservas sobre la evaluación actual experimental y clínica de compuestos de hierro, sugiriendo la necesidad de estudios preclínicos y clínicos para su evaluación58, y discusiones similares tienen lugar en la Food and Drug Administration59. De hecho, los complejos de hierro i.v. se consideran fármacos complejos no biológicos (FCNB) que no están compuestos por una única sustancia fácilmente caracterizable, como ocurre con los fármacos genéricos comunes, que están formados por moléculas pequeñas. Esta complejidad los hace más propensos a cambios en su estructura y propiedades biológicas, incluso con cambios mínimos en su proceso de fabricación50. Por ello, la evaluación de FCNB desarrollados como similares a un producto de referencia debería incluir estudios clínicos y/o no clínicos para evaluar la farmacocinética, farmacodinamia, eficacia y seguridad en poblaciones relevantes de pacientes. Hasta que no se demuestre la equivalencia terapéutica y del perfil de seguridad de estos fármacos, los expertos desaconsejan el intercambio y la sustitución automática entre FCNB originales y sus similares50.
FERRotERapIa EN la ENFERMEDaD RENal CRóNICa y la INSUFICIENCIa CaRDíaCa. SíNDRoME CaRDIoRRENal
La anemia es una complicación frecuente en la insuficiencia cardíaca, ya que afecta a un tercio de los pacientes60. Además, la presencia de ERC es muy frecuente en esta población y la prevalencia de insuficiencia cardíaca aumenta a medida que disminuye el filtrado glomerular61. Asimismo, la anemia es más prevalente en pacientes con insuficiencia cardíaca y enfermedad renal crónica62. La anemia en la insuficiencia cardíaca se asocia con una mayor sintomatología, una mayor tasa de hospitalización y una mayor mortalidad en esta población. De tal forma, que esta complicación está emergiendo como un factor importante y potencialmente modificable en el tratamiento global de la insuficiencia cardíaca crónica60,63. La presencia de ERC o anemia se asocia con un aumento de la morbimortalidad en la insuficiencia cardíaca, y la interacción de un filtrado glomerular disminuido y el valor de Hb sobre la mortalidad son factores de riesgo más que aditivos64. Entre las causas de la anemia en esta patología están: el déficit de hierro, la disfunción renal y la activación neurohormonal y de citocinas proinflamatorias, que conllevan a una producción deficiente de EPO y una utilización deficiente de hierro, así como la malnutrición frecuente en estos pacientes o la hemodilución.
En pacientes con insuficiencia cardíaca, el déficit de hierro es frecuente, con una prevalencia variable de entre el 30-50% y se asocia con un peor pronóstico y un mayor riesgo de mortalidad, independientemente del valor de Hb65, ya que además contribuye a la disfunción muscular cardíaca y periférica. Por ello, el déficit de hierro es reconocido como un nuevo objetivo terapéutico en estos pacientes. De hecho, en varios estudios aleatorizados en pacientes con déficit de hierro e insuficiencia cardíaca, el tratamiento con hierro i.v. tuvo un efecto beneficioso sobre la capacidad de ejercicio, la clase funcional, la fracción de eyección del ventrículo izquierdo, la función renal y la calidad de vida66-69. Por ello, dada la ausencia de evidencia del beneficio de la ferroterapia v.o. y el beneficio observado con el hierro i.v., en pacientes con insuficiencia cardíaca congestiva y ferropenia se aconseja la administración de hierro i.v.70.
Conflicto de intereses
A. Cases y A. Martínez Castelao manifiestan que han recibido honorarios de Roche, Amgen y Vifor por la realización de conferencias. J.L. Górriz ha participado en conferencias patrocinadas por Vifor Pharma. R. Ojeda no presenta conflicto de intereses.
CoNCEptoS ClavE
• El déficit de hierro es frecuente en los pacientes con ERC no en diálisis y se asocia con niveles más bajos de Hb y peor respuesta al tratamiento AEE.
• La ferroterapia en la ERC está indicada en la prevención y tratamiento del déficit de hierro o en pacientes en tratamiento con AEE.
• La ferroterapia puede administrarse por v.o. o por vía i.v. Ambas vías tienen sus ventajas y sus inconvenientes. Aunque las guías europeas aconsejan preferentemente la v.o. en la ERC no en diálisis, los problemas de absorción intestinal e intolerancia gastrointestinal limitan su eficacia y cumplimiento terapéutico.
• La ferroterapia i.v., especialmente con las formulaciones más modernas, de mayor peso molecular, más estables y que liberan menos hierro lábil durante su infusión, podría ser más eficaz que la ferroterapia v.o. para conseguir los objetivos de Hb, ferritina e IST.
• La ferroterapia i.v. se asocia a un mayor riesgo de reacciones de hipersensibilidad, aunque son bajas con las nuevas formulaciones, y existen unos riesgos potenciales asociados a su uso a largo plazo que precisan ser estudiados en ensayos clínicos a largo plazo y con un tamaño muestral adecuado.
• Las nuevas formulaciones de hierro i.v., como FCM, permiten administrar dosis más altas en una sola sesión, con un excelente perfil de eficacia y tolerancia, y son de elección en esta población. En este sentido, las guías NICE aconsejan una estrategia de alta dosis y baja frecuencia en pacientes con ERC no en diálisis.
Correspondencia:
adases@clinic.ub.es (A. Cases).
* Relación de nombres del Grupo de Anemia de la SEN en el anexo.