La asociación entre fracaso renal agudo (FRA) y rabdomiólisis es bastante frecuente. Dependiendo de la comorbilidad del paciente, se ha descrito una asociación entre casos de rabdomiólisis y FRA de hasta el 30%1,2. Distinguimos entre causas traumáticas y no traumáticas de rabdomiólisis. Es reseñable que las causas no traumáticas asociadas a fármacos y fármacos de uso habitual representan hoy en día un porcentaje de casos en aumento. Además, se han descrito factores de riesgo asociados, como la edad avanzada, la enfermedad renal crónica, la diabetes, el hipotiroidismo, las miopatías inflamatorias o metabólicas y los traumatismos. En una población progresivamente más envejecida y además polimedicada, la posibilidad de interacciones farmacológicas es más frecuente. Comunicamos un caso alusivo.
Varón de 89 años, exfumador e hipertenso, con estenosis aórtica moderada, hipotiroideo, dislipidémico, con enfermedad renal crónica estadio G3bA1 (creatinina basal: 1,9mg/dl; filtrado glomerular [FG] CKD-EPI: 32ml/min/1,73 m2) y apnea del sueño; ingresa en el hospital con una rabdomiólisis severa. Tuvo un ictus lacunar 10 años antes con una ataxia-hemiparesia residual y un carcinoma in situ de vejiga grado iv, tratado mediante resección transuretral (RTU). Fue diagnosticado 12 años antes, de un adenocarcinoma prostático grado iv, tratándose con radioterapia en combinación con hormonoterapia. Recibió un segundo tratamiento con radioterapia y triptorelina bianual, 5 años antes, debido a la progresión bioquímica con aparición de metástasis óseas.
Hacía un año tuvo un episodio de rabdomiólisis severa (creatina fosfocinasa [CPK] 13.000 IU/l), secundario a una caída accidental con traumatismo, que se acompañó de FRA AKIN III no oligúrico y buena respuesta a tratamiento conservador. En ese momento estaba en tratamiento con levotiroxina, candesartán, hidroclorotiazida, ácido acetilsalicílico, rosuvastatina, triptorelina y omeprazol. Un mes antes, debido a la progresión de la enfermedad (nódulos pulmonares, linfoadenopatías retrocrurales y retroperitoneales), comenzó una nueva línea de tratamiento con abiraterona 1.000mg/24h por vía oral y prednisona. Además del tratamiento descrito, estaba con los siguientes fármacos: calcifediol, carbonato cálcico, bisoprolol, cetirizina y denosumab.
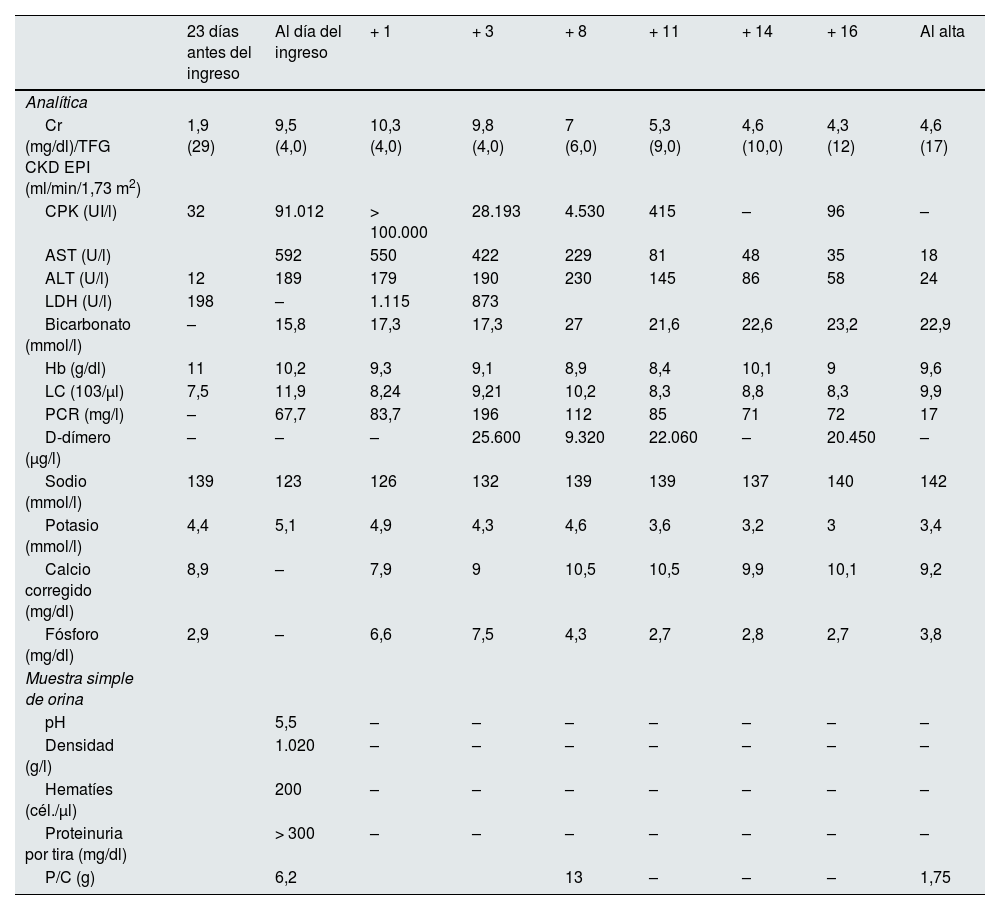
Un año después, ingresa en el hospital tras una caída accidental con una contusión lumbar. Se objetiva además un FRAA y rabdomiólisis severa (tabla 1). Se excluye la uropatía obstructiva mediante una ecografía renal. Se inicia tratamiento de soporte, con escasa respuesta y desarrollo progresivo de insuficiencia cardíaca congestiva, requiriendo hemodiálisis aguda y ultrafiltración a partir del tercer día de ingreso. La CPK se normaliza al décimo día del ingreso. A pesar de la recuperación clínica, el paciente continúa dependiente de hemodiálisis.
Evolución de los parámetros analíticos
| 23 días antes del ingreso | Al día del ingreso | + 1 | + 3 | + 8 | + 11 | + 14 | + 16 | Al alta | |
|---|---|---|---|---|---|---|---|---|---|
| Analítica | |||||||||
| Cr (mg/dl)/TFG CKD EPI (ml/min/1,73 m2) | 1,9 (29) | 9,5 (4,0) | 10,3 (4,0) | 9,8 (4,0) | 7 (6,0) | 5,3 (9,0) | 4,6 (10,0) | 4,3 (12) | 4,6 (17) |
| CPK (UI/l) | 32 | 91.012 | > 100.000 | 28.193 | 4.530 | 415 | – | 96 | – |
| AST (U/l) | 592 | 550 | 422 | 229 | 81 | 48 | 35 | 18 | |
| ALT (U/l) | 12 | 189 | 179 | 190 | 230 | 145 | 86 | 58 | 24 |
| LDH (U/l) | 198 | – | 1.115 | 873 | |||||
| Bicarbonato (mmol/l) | – | 15,8 | 17,3 | 17,3 | 27 | 21,6 | 22,6 | 23,2 | 22,9 |
| Hb (g/dl) | 11 | 10,2 | 9,3 | 9,1 | 8,9 | 8,4 | 10,1 | 9 | 9,6 |
| LC (103/μl) | 7,5 | 11,9 | 8,24 | 9,21 | 10,2 | 8,3 | 8,8 | 8,3 | 9,9 |
| PCR (mg/l) | – | 67,7 | 83,7 | 196 | 112 | 85 | 71 | 72 | 17 |
| D-dímero (μg/l) | – | – | – | 25.600 | 9.320 | 22.060 | – | 20.450 | – |
| Sodio (mmol/l) | 139 | 123 | 126 | 132 | 139 | 139 | 137 | 140 | 142 |
| Potasio (mmol/l) | 4,4 | 5,1 | 4,9 | 4,3 | 4,6 | 3,6 | 3,2 | 3 | 3,4 |
| Calcio corregido (mg/dl) | 8,9 | – | 7,9 | 9 | 10,5 | 10,5 | 9,9 | 10,1 | 9,2 |
| Fósforo (mg/dl) | 2,9 | – | 6,6 | 7,5 | 4,3 | 2,7 | 2,8 | 2,7 | 3,8 |
| Muestra simple de orina | |||||||||
| pH | 5,5 | – | – | – | – | – | – | – | |
| Densidad (g/l) | 1.020 | – | – | – | – | – | – | – | |
| Hematíes (cél./μl) | 200 | – | – | – | – | – | – | – | |
| Proteinuria por tira (mg/dl) | > 300 | – | – | – | – | – | – | – | |
| P/C (g) | 6,2 | 13 | – | – | – | 1,75 |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; Cr: creatinina plasmática; TGF CKD-EPI: filtrado glomerular estimado mediante CKD-EPI; CPK: creatina fosfocinasa; Hb: hemoglobina; LC: leucocitos; LDH: lactato deshidrogenasa; P/C: ratio proteinuria/creatinuria; PCR: proteína C reactiva; TFG: filtrado glomerular.
La abiraterona es un inhibidor del CYP17A1 aprobado por la Food and Drug Administration en el 2011 para el cáncer de próstata metastásico. Bloquea la síntesis de andrógenos en la próstata, los testículos y las glándulas adrenales, ocasionando mediante la inhibición de la enzima 17α hidroxilasa, el incremento en la síntesis de ACTH y mineralocorticoides. Esto puede inducir hipopotasemia, diarrea, elevación de la presión arterial, edema y deterioro de la función hepática. No interacciona directamente con el metabolismo de las estatinas, pero inhibe a un transportador: el polipéptido hepático transportador de aniones orgánicos 1B1 (OATP1B1), dependiente del gen SLCO1B1, que es un sustrato para la rosuvastatina. Esto puede dificultar su absorción hepática y provocar un aumento de sus niveles. Además, sabemos que en ciertas variantes polimórficas en las que la actividad de transporte está genéticamente reducida3,4, puede inducir un incremento en la concentración de la rosuvastatina, con riesgo de toxicidad y rabdomiólisis. Se absorbe rápidamente por vía oral y se metaboliza casi exclusivamente en el hígado, uniéndose en un 99% a proteínas plasmáticas y alcanzando una concentración plasmática máxima a las 2 h. Su metabolismo hepático utiliza 2vías enzimáticas: el citocromo p450 (CYP) 3A4 y la sulfotransferasa (SULT) 2A1. La excreción se realiza fundamentalmente a través de las heces, siendo excretada en menos de un 5% por vía urinaria5. Marbury et al.5 estudian el metabolismo de abiraterona en la insuficiencia renal grave y concluye que no hay diferencias farmacocinéticas apreciables en la clínica entre pacientes con función renal conservada e insuficiencia renal.
Se han descrito en la literatura unos pocos casos de la administración de abiraterona en pacientes con FRA avanzado y en hemodiálisis. Sin embargo, a pesar de ser anecdótico avalaría su seguridad6,7.
A fecha de hoy, se han publicado 3 casos de rabdomiólisis inducida por abiraterona junto con rosuvastatina1,2,8. En 2de esos casos, se asocia además de la rosuvastatina, un tercer fármaco: el denosumab. En nuestro caso, el paciente presentaba 7 puntos de la escala de interacciones de Horn y 6 en la escala de efectos indeseables de Naranjo9,10, lo que otorga un criterio de probabilidad significativo a nuestro caso.
El paciente inició con rabdomiólisis severa que indujo FRA, requiriendo hemodiálisis. Se podría hipotetizar que la abiraterona desencadenó un fallo hepático que provocó un aumento de concentración de rosuvastatina y de ella misma. En un paciente anciano con hipotiroidismo, insuficiencia renal previa, tratamiento con inhibidores de la enzima conversora de angiotensina y diuréticos, deshidratación, inmovilidad prolongada por sus secuelas neurológicas y polifarmacia (13 fármacos), la posibilidad de interacciones es muy alta11. Este caso ilustra la importancia de hacer un seguimiento estrecho en pacientes polimedicados con elevada comorbilidad, y a aquellos con fármacos inductores de rabdomiólisis.
FinanciaciónLos autores del estudio declaran que no han percibido ningún tipo de financiación para la realización del mismo.
Conflicto de interesesTodos los autores declaran que no hay conflictos de intereses.