El citomegalovirus (CMV) es un virus oportunista por excelencia que afecta a la mayoría de los pacientes inmunocomprometidos, entre ellos, los trasplantados1. La infección se produce generalmente por una reactivación de una cepa del receptor en estado latente y, más raramente, por una infección de una cepa exógena. El periodo de mayor riesgo de presentar una infección por CMV es durante los 6 primeros meses postrasplante, siendo infrecuente a partir del sexto mes2. A partir de la introducción de los nuevos agentes inmunosupresores, sobre todo del micofenolato mofetilo, se ha descrito un aumento de la incidencia de infección por CMV3. Sin embargo, es excepcional que una infección por CMV comience como una complicación grave y, sobre todo, una vez pasados los 6 primeros meses del trasplante1. Presentamos el caso de un trasplantado renal de larga evolución y con bajas dosis de inmunosupresores que desarrolló una enfermedad intestinal severa por CMV que precisó cirugía urgente.
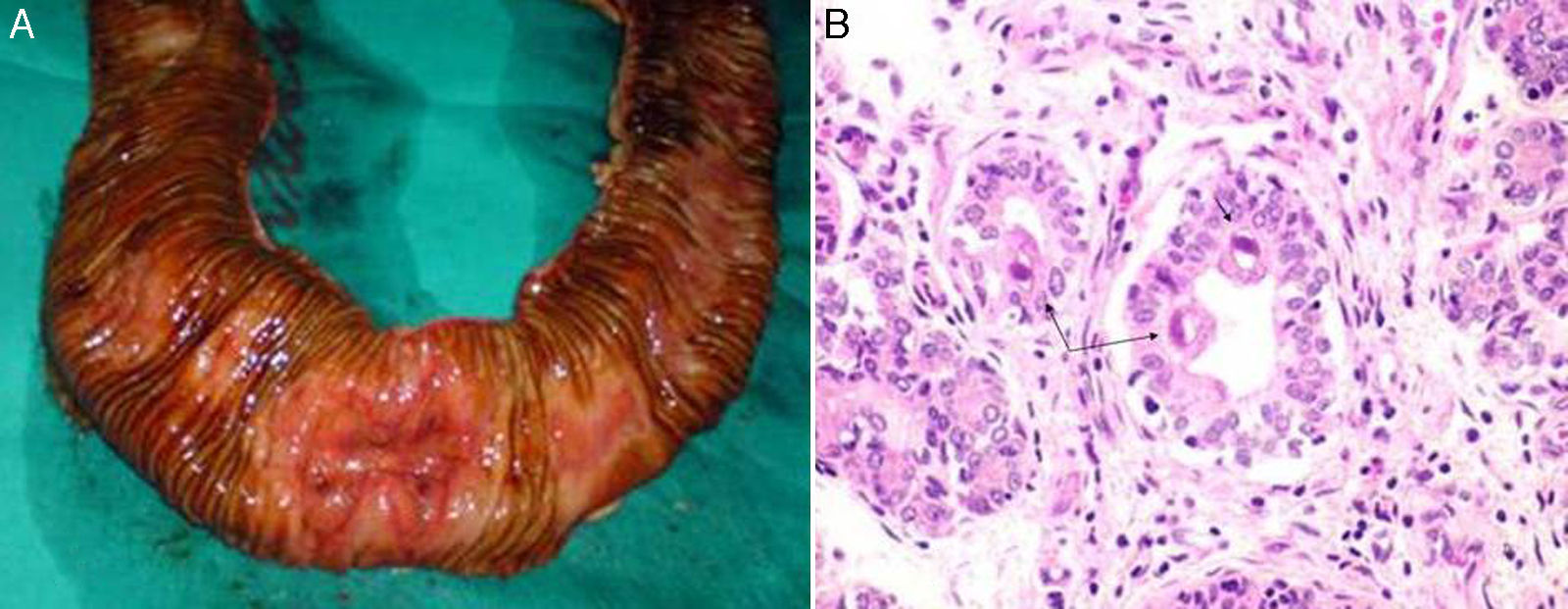
Mujer de 65 años hipertensa y diabética tipo 2 que lleva un trasplante renal 12 años, por poliquistosis renal, actualmente con bajas dosis de inmunosupresión (ciclosporina 75mg/12h y micofenolato mofetilo 50mg/12h). Consulta en Urgencias por dolor abdominal de 48 h de evolución, localizado en mesogastrio y asociado a vómitos. En la analítica destacaba una hemoglobina de 6g/dl, sin objetivarse signos de sangrado digestivo. La endoscopia digestiva alta fue normal y la baja mostraba múltiples úlceras superficiales con signos de sangrado a nivel del íleon terminal y del colon ascendente. La biopsia informó de inmunotinción positiva para CMV. Se solicitó una PCR de CMV en la que se obtuvieron más de 10.000 copias, por lo que se instauró tratamiento intravenoso con ganciclovir e inmunoglobulina. A las 48 h presentó una hemorragia digestiva baja severa que precisó transfusión de 6 concentrados de hematíes. Se realizó una arteriografía de ambas arterias mesentéricas que no evidenció el punto sangrante, la colonoscopia mostró la no mejoría de las úlceras previas y a nivel de íleon se observaba una úlcera penetrante y con sangrado activo que se esclerosó endoscópicamente. A las 12 h presentó un nuevo sangrado digestivo severo, por lo que se intervino a la paciente mediante una resección del íleon afecto y del ciego. En la pieza quirúrgica se evidenciaron múltiples úlceras superficiales y una úlcera de unos 2cm de diámetro que alcanzaba la serosa (fig. 1A). El diagnóstico definitivo fue de enteritis ulcerativa por CMV (fig. 1B). El postoperatorio fue favorable y, actualmente, a los 3 años del cuadro, no ha presentado recidiva de la infección por CMV.
A) Imagen intraoperatoria de la pieza resecada. Se ha realizado la apertura del asa de intestino delgado resecada y puede observarse la ulceración origen del sangrado. B) Imagen histológica con H-E×400. Inclusiones citomegálicas (flechas) en el interior de las células intestinales deplecionadas de moco.
La infección por CMV constituye una de las enfermedades infecciosas oportunistas más frecuentes tras un trasplante renal, que conlleva un aumento de la morbilidad y de la mortalidad del receptor. Así, afecta a entre el 60 y el 80% de los pacientes, de los cuales el 25-50% desarrollan enfermedad clínica1,2. La infección sintomática por CMV en el tracto digestivo ocurre en el 5-10% de los pacientes trasplantados de riñón, y puede afectar desde el esófago hasta el colon. Las úlceras se producen porque el CMV origina una vasculitis en el aparato digestivo, que puede ocasionar sangrado digestivo e incluso perforación intestinal4. Sin embargo, la enfermedad tardía por CMV (pasados los 6 primeros meses desde el trasplante) es poco frecuente, sobre todo, si no hay un aumento del tratamiento inmunosupresor por un rechazo agudo tardío4,5.
Diferentes estudios, algunos multicéntricos, han mostrado que el uso de micofenolato mofetilo disminuye la incidencia de episodios de rechazo agudo, sin embargo, parece aumentar la frecuencia y la severidad de la infección por CMV3,6, tal y como se observa en nuestra paciente. Así, Cornelis et al.3 indican que, aunque no supone un incremento de la infección primaria por CMV, sí produce un incremento en el desarrollo de enfermedad por CMV. Nuestro caso presenta una peculiaridad respecto a lo descrito por varios autores, y es la agresividad de la afectación intestinal a pesar de las bajas dosis de inmunosupresión y del tratamiento antiviral instaurado7–10.
El tratamiento de elección en estos casos de infección tardía por CMV es el uso de antivirales específicos, que en la mayoría de los casos resulta efectivo1,8. La colonoscopia es un buen método diagnóstico y terapéutico en aquellos casos en que se localice un punto sangrante. En nuestro caso localizó bien la lesión pero no fue efectivo el tratamiento. La terapia con embolización por radiología intervencionista es aplicable en estos casos de sangrado masivo, sin embargo, es necesario un flujo de 0,5 a 1ml/min para evidenciar sangrado y esto, en ocasiones, supone un problema diagnóstico debido al carácter intermitente de los sangrados digestivos, tal y como ocurrió en nuestro caso. La cirugía se reserva para los casos en los que fracasa todo lo anterior, y su gran problema es localizar el punto sangrante, pues no es lo mismo una resección segmentaria, como en nuestro caso, que una resección masiva de intestino. La mortalidad de la cirugía oscila entre el 10 y el 55%1. En nuestro caso, el hecho de realizar una resección segmentaria favoreció la buena evolución de la paciente.
En conclusión, la infección tardía intestinal por CMV debe sospecharse en trasplantados tratados con micofenolato que comienzan con clínica digestiva larvada. La cirugía es el último escalón terapéutico y resulta fundamental la localización del punto sangrante para poder controlar el cuadro.