La enfermedad renal diabética es la principal causa de enfermedad renal crónica (ERC) en el mundo y tanto la diabetes mellitus (DMT2) como la ERC son importantes factores de riesgo para mortalidad. Sin embargo, se desconoce si la presencia simultánea de ambas enfermedades modifica el riesgo de muerte.
ObjetivoEvaluar la presencia de interacción entre DMT2 y estadio ERC respecto a la mortalidad en una población representativa de un país latinoamericano.
MétodosEstudio analítico en dos cohortes de pacientes con diagnóstico de ERC con cuatro años de seguimiento entre 2004 y 2008. Se calculó la tasa de incidencia, progresión, supervivencia (Kaplan-Meier), interacción (aditiva y multiplicativa) e impacto de la presencia de los diferentes estadios de ERC en pacientes con y sin DMT2 mediante un análisis de riesgos proporcionales de Cox.
ResultadosEn esta población de estudio de 5.663 pacientes, tanto la DMT2 como el estadio de ERC son factores de riesgo para mortalidad (p < 0,001). La diferencia en la supervivencia entre diabéticos y no diabéticos en estadios 3 – 4 – 5 fue estadísticamente significativa (Log-rank p = 0,0076). Se encontró una interacción estadísticamente significativa en las escalas aditiva y multiplicativa entre la presencia de DMT2 y el estadio de ERC, con respecto a la mortalidad (p = 0,005). Se confirmó el impacto de la diabetes como factor de riesgo de mortalidad (Hazard Ratio 1,61 p < 0,001), pero en los pacientes con DMT2 solamente la edad, la dislipidemia y los nefroprotectores estuvieron asociados significativamente con la mortalidad.
ConclusiónLa interacción entre ERC y DMT2 modifica de forma negativa el riesgo de muerte de ambas enfermedades. Es decir que el efecto conjunto observado es menor al esperado.
Diabetic kidney disease is the main cause of chronic kidney disease (CKD) worldwide. Both CKD and diabetes mellitus (DMT2) are important risk factors for mortality. However, it is still unknown if the risk of death is modified by the simultaneous presence of these diseases.
ObjectiveTo evaluate the presence of an interaction between DMT2 and CKD for mortality in a representative population of a Latin American country.
MethodsIt is an analytical cohort study of patients with CKD, who were followed for 4 years (between 2004 and 2009). We calculated the incidence rate, progression, survival (using Kaplan–Meier curves), interaction (on the additive and multiplicative scales) and impact of the different stages of CKD in patients with and without DMT2 (using a cox proportional hazards model).
ResultsIn this population of 5663 individuals, both DMT2 and CKD are risk factors for mortality (P < 0.001). We found a statistically significant difference in mortality between individuals with and without DMT2, who also had CKD stages 3 – 4 – 5 (Log-rank P = 0.0076). Additionally, we found a statistically significant interaction for mortality in both the additive and multiplicative scales between DMT2 and CKD (P = 0.005). DMT2 was found to be a risk factor for mortality (Hazard Ratio 1.61 P < 0.001), but in individuals with DMT2, the only risks significantly associated with mortality, were age, dyslipidemia and nephroprotective drugs.
ConclusiónThe interaction between CKD and DMT2 negatively modifies the risk of death of both diseases. This means that when the two diseases are present, the risk of mortality is lower than expected.
Tanto la enfermedad renal crónica (ERC) como la diabetes mellitus son problemas de salud pública, siendo la diabetes la principal causa de la ERC en el mundo1. Ambas condiciones se comportan como factores de riesgo para mortalidad1–3. Globalmente, la ERC se presenta en 25-40% de los pacientes con diabetes mellitus tipo 2 (DMT2)4,5 y en el 7-12% de la población general1. En países como Singapur, Malasia y la región de Jalisco en México, la incidencia de enfermedad renal diabética es mayor al 50%6, mientras que la prevalencia de DMT2 es de un 12-14% en E.E. U.U.7.
A pesar de la alta prevalencia de ambas enfermedades, hasta la fecha no se ha determinado con exactitud en poblaciones de países latinoamericanos si la asociación de cada una con la mortalidad se modifica en presencia o ausencia de la otra, es decir, si existe una interacción entre ellas. Para nuestro conocimiento, la mayoría de los estudios son realizados en población con o sin DMT2 de países desarrollados; sin explorar adecuadamente las diferencias entre ambos grupos de acuerdo con la afectación renal8–10. Un metaanálisis que evaluó la interacción entre ERC y DMT2 reportó un aumento en la mortalidad con la disminución de la tasa de filtración glomerular (TFG), pero sin diferencias significativas ni interacción al comparar diabéticos con no diabéticos8. Sin embargo, solo uno de los 30 estudios incluidos en la revisión sistemática tuvo representación mínima de países de Sudamérica, y correspondía a un ensayo clínico realizado hace casi 20 años para estimar la eficacia de los antagonistas del receptor de angiotensina II. El objetivo de este estudio es determinar, en una población representativa de un país latinoamericano, si el riesgo de mortalidad dado por el estadio de la ERC se modifica en presencia o ausencia de DMT2.
MetodologíaDiseño del estudioSe realizó un estudio analítico con dos cohortes de pacientes con diagnóstico de ERC y cuatro años de seguimiento, evaluadas en un estudio previo11 para determinar la efectividad de un programa de protección renal (PPR).
Escenario y participantesLa población evaluada en el estudio pertenece a dos empresas prestadoras de servicios en salud (EPS) del departamento de Antioquia en Colombia, específicamente en la ciudad de Medellín y su área metropolitana y municipios del oriente de Antioquia. La recolección de datos se realizó de ambas EPS entre enero 2007 y junio de 2009. Los datos registrados en historia clínica electrónica desde abril 2004 (el comienzo del PPR) hasta junio 2007, fueron analizados retrospectivamente y se continuó con análisis prospectivo hasta abril 30 de 2008, para un total de cuatro años de seguimiento.
Cada EPS, de donde se tomaron los datos para el estudio, atendía a sus pacientes con un programa de protección renal (PPR) o con tratamiento convencional (TC). El PPR es un programa de manejo interdisciplinario y especializado de los pacientes -con un enfoque preventivo desde los estadios iniciales-, mientras que el TC consiste en el manejo en un primer nivel de forma menos preventiva y más terapéutica.
Los criterios de inclusión de los pacientes fueron: estar afiliado a la EPS durante los cuatro años en los que se realizó el estudio y cumplir con los criterios diagnósticos de ERC establecidos por la fundación nacional del riñón en la iniciativa Kidney Disease Outcomes Quality Initiative 9,12. Pacientes menores de 15 años y aquellos registrados en ambas instituciones en cualquier momento durante la realización del estudio, fueron excluidos. El seguimiento comenzó cuando fueron diagnosticados con ERC o fueron incluidos en el PPR. Este estudio fue aprobado por el comité de ética de las instituciones involucradas y todos los pacientes de la fase prospectiva firmaron el consentimiento informado para la participación en el estudio.
VariablesCriterios diagnósticos de ERC: cualquiera de TFG < 60 mL/min/1,73 m2 (calculado con la fórmula de Cockroft-Gault), alteración renal en el ultrasonido, proteinuria > 150 mg/día, sedimento urinario anormal y en el caso de diabéticos: microalbuminuria > 30 mg/g o 30 mg/24 h.
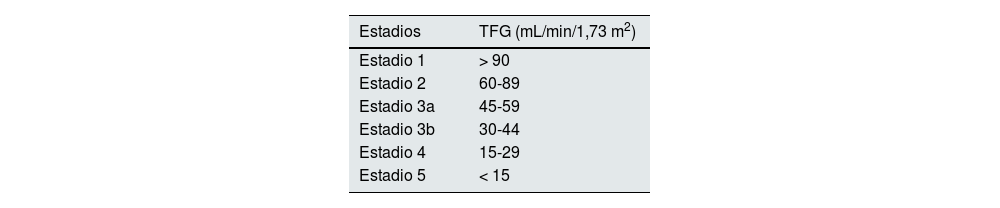
Variables de exposición: diagnóstico por historia clínica de DMT2 y estadios de la enfermedad renal crónica definidos según la guía KDIGO 201213 (tabla 1).
Estadios de enfermedad renal crónica según guía KDIGO 201213
| Estadios | TFG (mL/min/1,73 m2) |
|---|---|
| Estadio 1 | > 90 |
| Estadio 2 | 60-89 |
| Estadio 3a | 45-59 |
| Estadio 3b | 30-44 |
| Estadio 4 | 15-29 |
| Estadio 5 | < 15 |
TFG: tasa de filtración glomerular.
Se definen cinco estadios, siendo uno el de menor gravedad y cinco el más grave.
Variables dependientes: mortalidad por cualquier causa, progreso del estadio de la ERC.
Variables descriptivas: cifras de tensión arterial al momento del diagnóstico, glicemia en ayunas, hemoglobina glicada, creatinina sérica, proteinuria en 24 horas, colesterol HDL y LDL, hemoglobina, electrolitos (potasio, calcio, fosfato), albúmina y hormona paratiroidea.
Variables de confusión: Según la literatura revisada1,14, las siguientes variables fueron asumidas como potenciales variables de confusión: edad, sexo, estadio de la ERC al momento del diagnóstico, hipertensión arterial (HTA), dislipidemia, EPS, nefrotóxicos, nefroprotectores y enfermedad cardiovascular (definido como historia de infarto agudo de miocardio, enfermedad coronaria o accidente cerebrovascular).
Fuente de datos y medicionesLa información fue tomada manualmente de las bases de datos provenientes de cada EPS y de los registros de historias clínicas, obteniendo información progresiva durante el tiempo de estudio.
SesgosPara evitar sesgos de medición, el equipo encargado de la recolección de datos fue entrenado, el proceso para aplicar las herramientas fue estandarizado y se realizó una prueba piloto. Además, cada historia clínica fue ingresada a la base de datos por dos profesionales diferentes. Durante el estudio, se hizo un esfuerzo por reducir el riesgo de pérdida de pacientes. Para esto, se buscaron nuevos números de teléfono de los pacientes en las historias y en otros documentos de las EPS. Igualmente, se buscaron números de teléfono de amigos y familiares de los pacientes a través del equipo a cargo de los programas. Todos los pacientes fueron contactados telefónicamente para verificar su estado de salud luego de finalizar el estudio. Se pudo obtener información del 80% de ellos, sin ninguna diferencia entre ambas EPS. Se asumieron como censuras los casos en los que no estaba reportada la muerte como desenlace al final del estudio, las pérdidas de seguimiento y los pacientes que se retiraron del estudio. El momento de censura fue definido como la fecha con el último reporte de supervivencia del paciente.
Tamaño de muestraEl número de participantes en el estudio se definió luego de realizar el censo de población de las aseguradoras que cumplía con el criterio de ERC según KDOQI y contaba con registro de historia clínica electrónica. No se hizo un cálculo formal de tamaño de muestra en el estudio original, ya que se incluyó la totalidad de la población que cumplió criterios de inclusión.
Variables cuantitativasLa TFG se tuvo en cuenta como variable de progresión en cada estadio. Para el análisis estadístico se asumió estadio 1 y 2 como grupo control y estadios 3a, 3b, 4 y 5 como grupo de exposición. La edad se dividió en dos grupos: menores de 65 años y mayores de 65 años. Este punto de corte se definió por ser la media de la población total estudiada y el umbral declarado por la Organización Mundial de la Salud (OMS) para diferenciar población vieja de adulta.
Análisis estadísticoPara la estadística descriptiva se usaron distribuciones de frecuencia, medias o medianas con su correspondiente medida de dispersión, dependiendo del tipo de dato. Para el análisis bivariado se utilizó la prueba de X2 para evaluar el riesgo de mortalidad en estadio 3 (a y b), 4, 5 de ERC y en pacientes diabéticos, así como la asociación entre la DMT2 y progresión de la ERC. Mediante el análisis de curvas de supervivencia de Kaplan-Meier se evaluó la probabilidad de muerte en estadios 3, 4 y 5 en pacientes diabéticos vs. no diabéticos. Posteriormente, se analizaron por separado los subgrupos estadio 3a-3b y 4-5 en presencia o ausencia de DMT2. Se realizaron modelos de riesgos proporcionales de Cox en pacientes con y sin DMT2, ajustando por covariables. La razón de las tasas de incidencia se estimó con un intervalo de confianza del 95%.
Para detectar la presencia de la interacción se realizó primero un análisis estratificado de mortalidad en los estadios de ERC mediante la técnica de Mantel-Haenszel, confirmado con la prueba de Breslow-Day. La interacción se evaluó de forma aditiva y multiplicativa. La escala aditiva evalúa si el efecto combinado de ambas variables es diferente a la suma algebraica de los riesgos absolutos individuales, mientras que la escala multiplicativa evalúa si dicho efecto es diferente al producto de los efectos individuales15. La escala aditiva ha demostrado ser importante en los análisis de salud pública y al evaluar interacción biológica, pero la recomendación general es evaluar siempre ambas escalas16. Posteriormente se realizaron dos modelos de riesgos proporcionales de Cox para evaluar el riesgo de mortalidad en pacientes con ERC, ajustando por covariables y la interacción estadio ERC-DMT2. Ambos modelos fueron evaluados mediante prueba de razón de verosimilitud para determinar la diferencia entre el modelo completo y el anidado. Para el análisis se utilizó SPSS versión 22 y STATA versión 14.
ResultadosParticipantesFueron revisadas 9.887 historias clínicas, 56% del programa PPR y 44% del programa TC, de las cuales 5.663 cumplieron los criterios de inclusión y 3.832 tuvieron un seguimiento de al menos dos años, 8,9% se retiraron y 5,5% murieron.
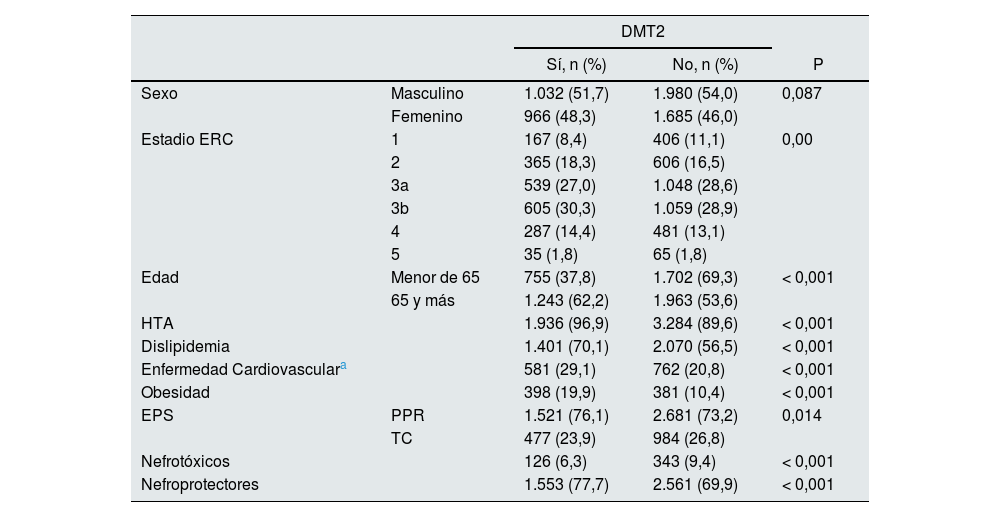
La media de edad fue de 67 años, sin diferencias significativas en la distribución por sexo. El 35,3% de los pacientes (n = 1998) tenía diagnóstico de DMT2 y más del 50% de los pacientes con DMT2 y ERC 3, 4, y 5, tenían 65 o más años. El 57,6% de la población tenía ERC estadio 3 (a o b) y el 1,8% tenía ERC estadio 5 (tabla 2 y Tabla suplementaria 1).
Características de la población de dos cohortes de pacientes en atención renal (Medellín, Colombia, 2004-2009)
| DMT2 | ||||
|---|---|---|---|---|
| Sí, n (%) | No, n (%) | P | ||
| Sexo | Masculino | 1.032 (51,7) | 1.980 (54,0) | 0,087 |
| Femenino | 966 (48,3) | 1.685 (46,0) | ||
| Estadio ERC | 1 | 167 (8,4) | 406 (11,1) | 0,00 |
| 2 | 365 (18,3) | 606 (16,5) | ||
| 3a | 539 (27,0) | 1.048 (28,6) | ||
| 3b | 605 (30,3) | 1.059 (28,9) | ||
| 4 | 287 (14,4) | 481 (13,1) | ||
| 5 | 35 (1,8) | 65 (1,8) | ||
| Edad | Menor de 65 | 755 (37,8) | 1.702 (69,3) | < 0,001 |
| 65 y más | 1.243 (62,2) | 1.963 (53,6) | ||
| HTA | 1.936 (96,9) | 3.284 (89,6) | < 0,001 | |
| Dislipidemia | 1.401 (70,1) | 2.070 (56,5) | < 0,001 | |
| Enfermedad Cardiovasculara | 581 (29,1) | 762 (20,8) | < 0,001 | |
| Obesidad | 398 (19,9) | 381 (10,4) | < 0,001 | |
| EPS | PPR | 1.521 (76,1) | 2.681 (73,2) | 0,014 |
| TC | 477 (23,9) | 984 (26,8) | ||
| Nefrotóxicos | 126 (6,3) | 343 (9,4) | < 0,001 | |
| Nefroprotectores | 1.553 (77,7) | 2.561 (69,9) | < 0,001 | |
La mediana del peso en el grupo con DMT2 fue 68 kg y en el grupo sin DMT2 fue de 60 kg (p < 0,001). La mediana de proteinuria en 24 horas fue de 265 mg/día y 190 mg/día en los grupos con DMT2 y sin DMT2 respectivamente (p < 0,001). En cuanto al perfil lipídico, la mediana del valor de los triglicéridos y HDL fue de 170 mg/dL y 41 mg/dL en los pacientes con DMT2 y de 154 mg/dL y 43,3 mg/dL en los pacientes del grupo control, respectivamente (p < 0,005) (Tabla suplementaria 2).
Dentro del grupo de pacientes con ERC estadio 3, 4 y 5, se encontró mayor prevalencia de comorbilidades como hipertensión, dislipidemia y enfermedad cardiovascular, así como un uso más frecuente de nefroprotectores, todas con diferencias significativas (p < 0,01). No se encontraron diferencias significativas respecto a la prevalencia de DMT2 en ambos grupos (Tabla suplementaria 1).
Riesgo de mortalidad según estadio y presencia de DMT2En el análisis se encontró que tanto el estadio de la ERC (RR estadios 3,4,5 vs. 1,2 = 3,6; IC 95% = 2,6;4,8) como la diabetes (RR = 1,7; IC 95% = 1,35; 2,14) se comportan como factores de riesgo significativos para mortalidad.
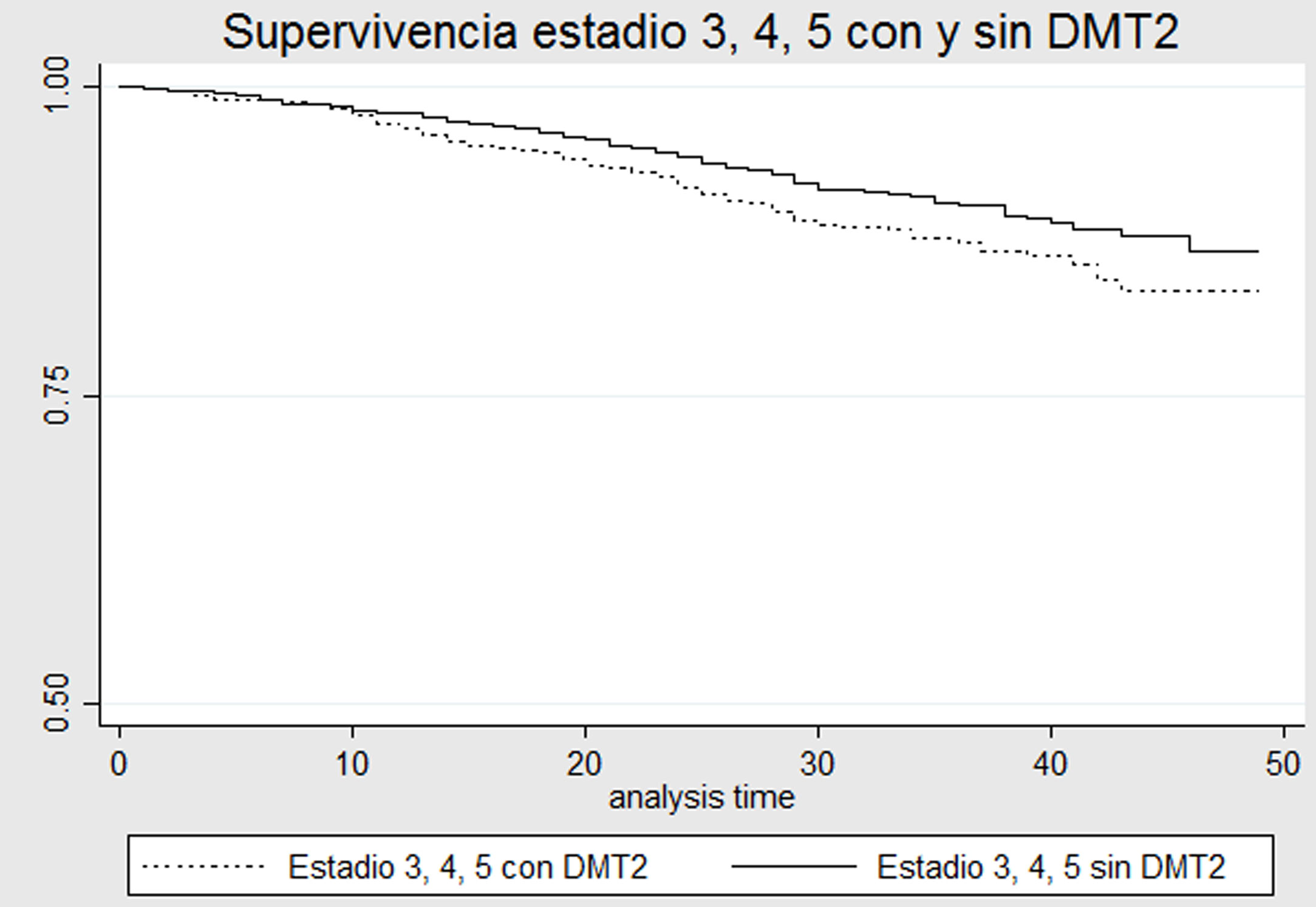
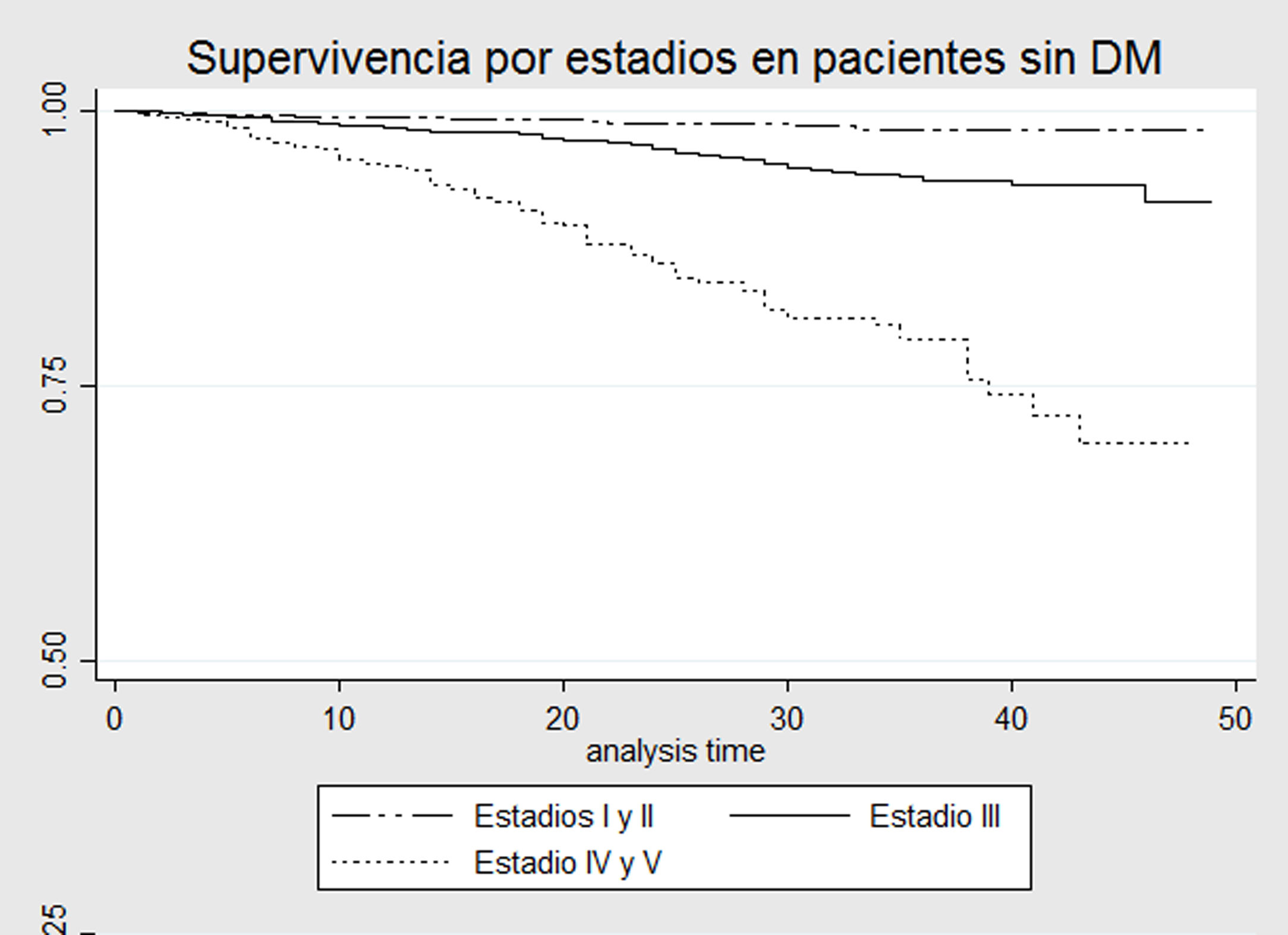
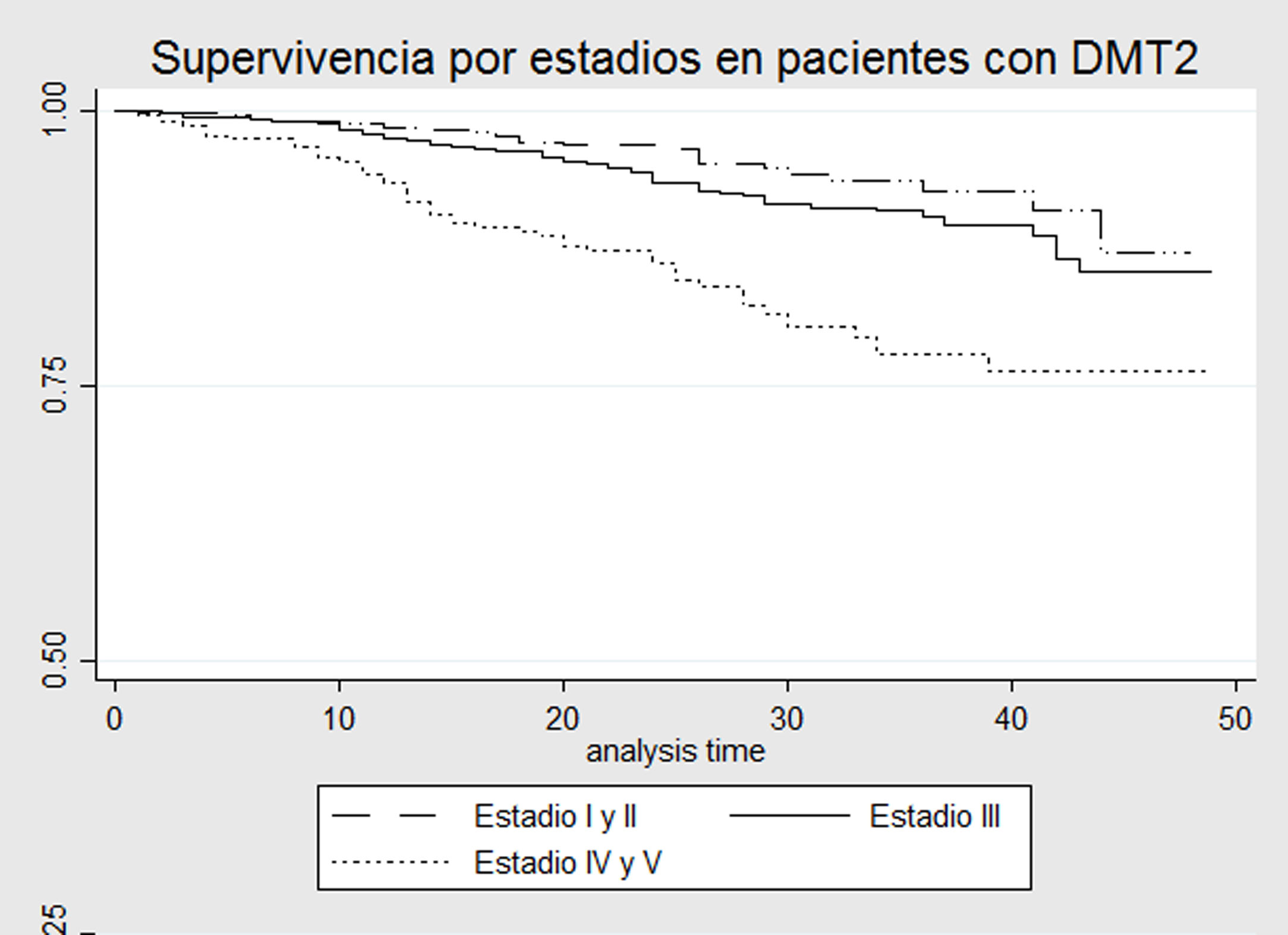
Modelos de supervivenciaEn las curvas de Kaplan-Meier, comparando pacientes con DMT2 vs. aquellos sin DMT2, todos en estadio ERC 3-4-5, se observa que la probabilidad de supervivencia es mayor en el grupo sin DMT2 con diferencias estadísticamente significativas (Log-rank p = 0,0076) (fig. 1). Al realizar un análisis por subgrupos de pacientes con y sin diabetes, no se observaron diferencias significativas entre los estadios de ERC 3 o 4-5 (prueba de Log-Rank p = 0,70 y p = 0,95, figs. 2 y 3, respectivamente).
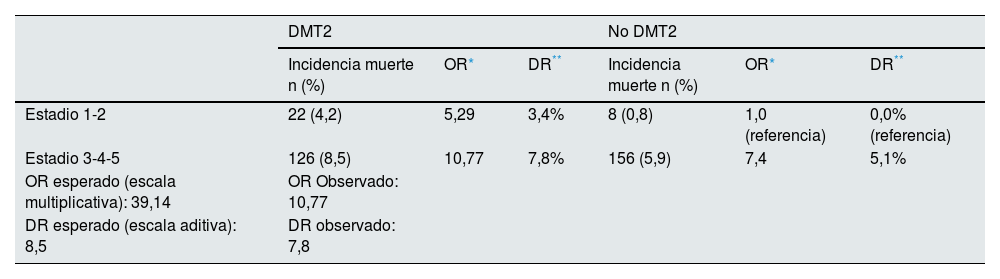
Se evaluó la asociación de DMT2 con mortalidad entre los diferentes estratos de estadio ERC mediante la técnica de Mantel-Haenszel, encontrando diferencias estadísticamente significativas en estadio 3-4-5: OR 1,49 (IC 95%: 1,17; 1,91) y en estadio 1-2: OR 5,47 (IC 95%: 2,42; 12,39). El criterio estadístico de Breslow-Day muestra un valor p de 0,002, confirmando que el estadio se comporta como una variable de interacción en la asociación de DMT2 con mortalidad.
Al realizar el análisis de la interacción en las escalas aditiva y multiplicativa, se encontró que fue significativa en ambas escalas: el efecto conjunto observado es menor al esperado, lo cual da cuenta de una interacción negativa o antagonista. Se observa igualmente heterogeneidad en los estratos de ambas escalas, lo cual indica que se trata de una interacción cuantitativa, es decir, la asociación con el desenlace de muerte está en la misma dirección, aunque con diferente magnitud (tabla 3).
Evaluación de la interacción estadio ERC*DMT2 en dos cohortes de pacientes en atención renal (Medellín, Colombia, 2004-2009)
| DMT2 | No DMT2 | |||||
|---|---|---|---|---|---|---|
| Incidencia muerte n (%) | OR* | DR** | Incidencia muerte n (%) | OR* | DR** | |
| Estadio 1-2 | 22 (4,2) | 5,29 | 3,4% | 8 (0,8) | 1,0 (referencia) | 0,0% (referencia) |
| Estadio 3-4-5 | 126 (8,5) | 10,77 | 7,8% | 156 (5,9) | 7,4 | 5,1% |
| OR esperado (escala multiplicativa): 39,14 | OR Observado: 10,77 | |||||
| DR esperado (escala aditiva): 8,5 | DR observado: 7,8 | |||||
En el análisis multivariable se evaluó igualmente la interacción DMT2 – estadio por medio de un término adicional, ajustando por covariables, encontrando que era estadísticamente significativa (p = 0,005). Lo anterior se confirmó por la diferencia en el test de razón de verosimilitud entre el modelo completo y el anidado (p = 0,0028) (Tablas suplementarias 3 y 4).
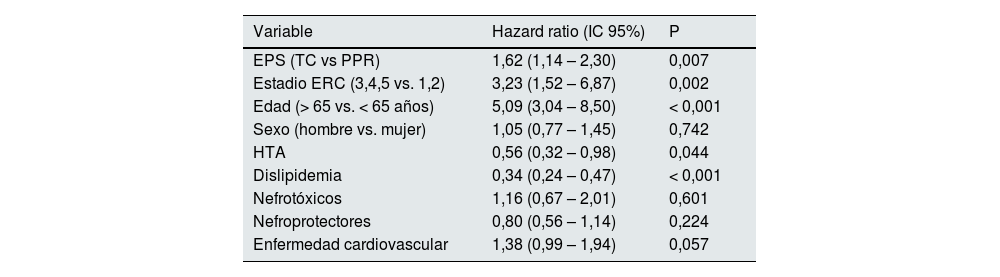
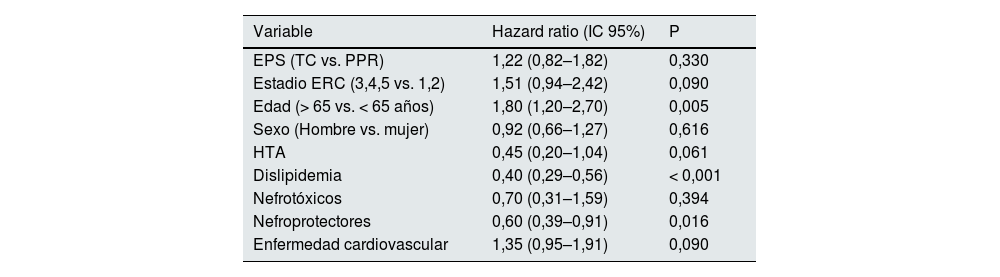
Análisis ajustado final por subgrupos de DMT2En el análisis multivariable se encontró que tanto el estadio de ERC, como las covariables edad, hipertensión, dislipidemia y EPS se asocian con mortalidad en pacientes sin DMT2 (tabla 4). Por el contrario, en los pacientes con DMT2, sólo la edad, la dislipidemia y el uso de nefroprotectores se encontraron asociadas de manera significativa con la mortalidad (tabla 5).
Modelo de riesgos proporcionales de Cox para muerte en pacientes con ERC sin DMT2 (n = 3.665)
| Variable | Hazard ratio (IC 95%) | P |
|---|---|---|
| EPS (TC vs PPR) | 1,62 (1,14 – 2,30) | 0,007 |
| Estadio ERC (3,4,5 vs. 1,2) | 3,23 (1,52 – 6,87) | 0,002 |
| Edad (> 65 vs. < 65 años) | 5,09 (3,04 – 8,50) | < 0,001 |
| Sexo (hombre vs. mujer) | 1,05 (0,77 – 1,45) | 0,742 |
| HTA | 0,56 (0,32 – 0,98) | 0,044 |
| Dislipidemia | 0,34 (0,24 – 0,47) | < 0,001 |
| Nefrotóxicos | 1,16 (0,67 – 2,01) | 0,601 |
| Nefroprotectores | 0,80 (0,56 – 1,14) | 0,224 |
| Enfermedad cardiovascular | 1,38 (0,99 – 1,94) | 0,057 |
EPS: empresa prestadora de servicios de salud; ERC: enfermedad renal crónica; HTA: hipertensión arterial; PPR: programa de protección renal; TC: tratamiento convencional.
Modelo de riesgos proporcionales de Cox para muerte en pacientes con ERC con DMT2 (n = 1998)
| Variable | Hazard ratio (IC 95%) | P |
|---|---|---|
| EPS (TC vs. PPR) | 1,22 (0,82–1,82) | 0,330 |
| Estadio ERC (3,4,5 vs. 1,2) | 1,51 (0,94–2,42) | 0,090 |
| Edad (> 65 vs. < 65 años) | 1,80 (1,20–2,70) | 0,005 |
| Sexo (Hombre vs. mujer) | 0,92 (0,66–1,27) | 0,616 |
| HTA | 0,45 (0,20–1,04) | 0,061 |
| Dislipidemia | 0,40 (0,29–0,56) | < 0,001 |
| Nefrotóxicos | 0,70 (0,31–1,59) | 0,394 |
| Nefroprotectores | 0,60 (0,39–0,91) | 0,016 |
| Enfermedad cardiovascular | 1,35 (0,95–1,91) | 0,090 |
EPS: empresa prestadora de servicios de salud; ERC: enfermedad renal crónica; HTA: hipertensión arterial; PPR: programa de protección renal; TC: tratamiento convencional.
Nuestro estudio confirmó la interacción o modificación del efecto entre el estadio de la ERC y la presencia de DMT2, con respecto al riesgo de muerte, en dos cohortes de diferentes programas de atención a pacientes con enfermedad renal.
La asociación entre DMT2 y ERC con la mortalidad se explica por la fisiopatología de dichas condiciones y su relación causal1–3,17–19 ha sido reportada en múltiples estudios previos20–25. En 2011, Astor et al. en una cohorte con 21.688 pacientes, encontraron que la reducción de la TFG en 15 mL/min/1,73 m2 por debajo de 45 mL/min/1,73 m2 se asocia con un aumento en la tasa de mortalidad del 47%10. Los resultados de estudios previos respecto a la interacción ERC-DMT2 son variables: En 2013 un estudio con 15.046 individuos que incluyó pacientes de la base de datos National Health and Nutrition Examination Survey III encontró que la interacción aditiva entre DMT2 y enfermedad renal fue significativa, más no la multiplicativa. Más del 50% de los pacientes considerados dentro del grupo de enfermedad renal tenían un TFG > 60 mlL/min/1,73 m2 (estadio 1 y 2) y fueron incluidos en este grupo por contar sólo con la presencia de albuminuria26, lo cual hace los resultados poco comparables con los nuestros. Un metaanálisis publicado en 2012 que incluyó más de un millón de pacientes, encontró que la interacción entre DMT2 y ERC no es significativa respecto a la mortalidad, tanto en el rango total de TFG como en los diferentes estadios de ERC8. Sin embargo, sí encontró un aumento del riesgo de mortalidad de pacientes con ambos factores de riesgo comparado con pacientes que solo tienen ERC8. Resultados similares fueron presentados en 2018 en un trabajo preliminar27 que incluyó 2.108 pacientes. La mayoría de los estudios que evalúan mortalidad en pacientes con ERC o DMT2, no evalúan diferencias de riesgo en pacientes con y sin DMT210,28–32. Las diferencias observadas entre los estudios pueden deberse a las diferencias raciales entre la población latina y norteamericana y a los criterios utilizados para definir ERC.
A diferencia de los estudios mencionados previamente, en este estudio se encontró la presencia de interacción tanto en la escala aditiva como multiplicativa entre el estadio de la ERC y la presencia de DMT2. El tipo de interacción, además, es negativa, es decir que, si bien cada una de las covariables tuvo un efecto independiente en el aumento del riesgo de muerte, en presencia de ambas enfermedades el aumento del riesgo es menor al esperado. Al comparar la mortalidad entre diabéticos y no diabéticos en estadios 3-4-5, se encontraron diferencias significativas, con un riesgo mayor en los pacientes con DMT2 (fig. 1). Sin embargo, al dividir los diferentes estadios por estratos, no se encontraron diferencias significativas respecto a mortalidad entre pacientes con y sin diagnóstico de DMT2 (figs. 2-3). Esto podría explicarse por la baja tasa de mortalidad en el estadio 3 y el pequeño tamaño de muestra los estadios 4-5, que no permite detectar diferencias estadísticamente significativas.
Encontramos además que en presencia de DMT2 y al ajustar por covariables, solo la edad continúa siendo un factor de riesgo significativo para muerte, mientras la dislipidemia y el uso de nefroprotectores parecen conferir cierta disminución de dicho riesgo. El hallazgo de dislipidemia como factor protector puede corresponder al fenómeno conocido de «epidemiología inversa»11. Es decir, aunque la dislipidemia es conocida como un factor de riesgo independiente para morbimortalidad, en este caso en los pacientes con estadios avanzados de ERC representa un factor protector. Como explicación a esto se propone que bajos niveles de lípidos se comportan como marcador de inflamación y desnutrición en enfermos renales, por lo que altos niveles de estos representan mejor pronóstico en pacientes en diálisis11,33.
La DMT2 juega un rol importante como factor de riesgo de mortalidad en los pacientes con ERC y ante su presencia, otras variables dejan de ser significativas. Tonelli et al, en un metaanálisis del 2006, que incluyó más de un millón de pacientes, mostró que el riesgo de mortalidad en pacientes con ERC era menor en aquellos estudios que realizaban análisis ajustado por covariables, comparado con los que solo presentaban análisis crudo21. Esto puede representar el impacto de las comorbilidades como DMT2 sobre el riesgo de mortalidad.
Dentro de las limitaciones de este estudio resalta el diseño observacional, con datos tomados de un estudio previo, que fueron recalculados y adaptados a las guías actuales. Algunas variables de riesgo cardiovascular y de muerte convencionales como tabaquismo, sobrepeso o mal control de enfermedades crónicas (como DMT2 o HTA) no fueron tenidas en cuenta por no contar con los datos. Lo anterior no permite realizar ajuste por dichas variables o análisis de subgrupos según el grado de control. La población del estudio es exclusivamente colombiana, lo cual permite que los resultados se adapten a otros países de Latinoamérica, pero dificulta su generalización a países por fuera de la región. Los datos faltantes en algunos individuos pudieran representar un sesgo de información, pero dado que esas pérdidas no fueron diferenciales entre vivos y muertos, es de esperar que las asociaciones observadas sean incluso de mayor magnitud.
Este estudio sugiere evidencia adaptable a latinoamérica del impacto sobre la mortalidad que tiene la adición de otros factores de riesgo como la diabetes a pacientes con ERC, así como la posible necesidad de un control estricto de esas comorbilidades para reducir el riesgo de muerte. Es necesario realizar un estudio que incluya individuos de otros países de Latinoamérica y con mediciones sobre el grado de control de la DMT2 y demás comorbilidades.
ConclusiónEl riesgo de mortalidad en pacientes con ERC estadio 3-4-5 se modifica en presencia de DMT2 en la escala aditiva y multiplicativa con una relación negativa. El aumento observado del riesgo en individuos con ambas enfermedades es menor al esperado.
FinanciaciónEste trabajo fue financiado por Colciencias, Universidad de Antioquia y EPS Sura.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Johana Ascuntar (BSc).