Los pacientes con diabetes mellitus tipo2 (DM2) tienen un riesgo incrementado de desarrollar enfermedad renal crónica (ERC). La ERC se define tanto por el descenso del filtrado glomerular, como por la presencia de albuminuria. Aunque se recomienda la determinación del cociente albúmina-creatinina en orina desde el momento del diagnóstico de la DM2 y posteriormente al menos una vez al año, en la práctica clínica dicha determinación se encuentra infrautilizada en muchos pacientes. En la etiopatogenia de la enfermedad renal diabética intervienen factores hemodinámicos, metabólicos, proinflamatorios y profibróticos. Asimismo, en el síndrome cardio-reno-metabólico la adiposidad excesiva o disfuncional juega un papel fundamental, promoviendo el desarrollo de enfermedad renal, DM2 y enfermedad cardiovascular. Por ello, en su tratamiento es necesaria una estrategia multifactorial que incluya el uso de fármacos inhibidores del sistema renina-angiotensina-aldosterona (factores hemodinámicos), inhibidores de SGLT2 (factores hemodinámicos y metabólicos), finerenona (efectos antiinflamatorios y antifibróticos) y los agonistas del receptor de GLP1 con beneficio renal demostrado (factores metabólicos) con el objetivo de reducir con mayor eficacia la progresión de la ERC y disminuir el riesgo de presentar complicaciones cardiovasculares. En este artículo de revisión proponemos estrategias para facilitar la adecuada evaluación e implementación del tratamiento recomendado por las guías de práctica clínica en el paciente con diabetes y albuminuria, presentando un decálogo para mejorar el manejo integral y colaborativo de estos pacientes.
Patients with type2 diabetes mellitus (T2DM) have an increased risk of developing chronic kidney disease (CKD). CKD is defined by both a decline in glomerular filtration rate and the presence of albuminuria. Although the measurement of the urine albumin-to-creatinine ratio is recommended from the time of T2DM diagnosis and subsequently at least once a year, in clinical practice, this assessment is underutilized in many patients. The pathophysiology of diabetic kidney disease involves hemodynamic, metabolic, pro-inflammatory, and pro-fibrotic factors. Likewise, in cardio-reno-metabolic syndrome, excessive or dysfunctional adiposity plays a fundamental role, promoting the development of kidney disease, T2DM and cardiovascular disease. Therefore, its management requires a multifactorial approach that includes the use of renin-angiotensin-aldosterone system inhibitors (targeting hemodynamic factors), SGLT2 inhibitors (targeting both hemodynamic and metabolic factors), finerenone (with anti-inflammatory and anti-fibrotic effects), and GLP-1 receptor agonists with demonstrated renal benefits (targeting metabolic factors), with the aim of more effectively slowing CKD progression and reducing the risk of cardiovascular complications. In this review article, we propose strategies to facilitate the proper assessment and implementation of guideline-recommended treatment in patients with diabetes and albuminuria, presenting a ten-point framework to improve the comprehensive and collaborative management of these patients.
La diabetes mellitus (DM) tipo2 (DM2) es un problema de salud pública mundial, constituyendo una epidemia global. Así, en el año 2024 se estimaba una prevalencia de 589 millones de personas con DM en la población adulta entre 20 y 79años (un 11,1% del total de la población mundial adulta), correspondiendo más del 90% a personas con DM21. En España, la prevalencia de población adulta con DM2 alcanza el 14%, estando infradiagnosticada hasta en la mitad de los casos2. Además, existe una distribución desigual según las comunidades autónomas, siendo mayor en Canarias y Murcia, seguidas de Andalucía, Valencia y Baleares3. La DM2 se asocia con un consumo elevado de recursos sanitarios y económicos4.
La prevalencia de enfermedad renal crónica (ERC) en personas con DM es muy elevada, afectando aproximadamente al 30-45% de las personas con DM, y al contrario, en la población con ERC es frecuente la presencia de DM2. De hecho, la DM es la principal causa de ERC, por delante de otras causas, como la hipertensión arterial5-8. Además, se estima que la prevalencia y las consecuencias asociadas a la ERC irán aumentando de manera marcada en los próximos años9.
El desarrollo de ERC en la población con DM aumenta marcadamente el riesgo de desarrollar complicaciones cardiovasculares y de progresión hacia las fases finales de la enfermedad renal5. Así, a mayor deterioro de la función renal, mayor riesgo de complicaciones cardiovasculares y renales. En este sentido, la enfermedad cardiovascular supone casi la mitad de las causas de muerte en las personas con DM y ERC en sus etapas más avanzadas10. Es importante recordar que la ERC puede estar ya presente en el momento del diagnóstico de la DM211, por lo que en todos los pacientes con DM2 se debe investigar la presencia de ERC, mediante la evaluación en el laboratorio del cociente albúmina creatinina urinario (CAC) y la tasa de filtrado glomerular estimado (FGe), con el objetivo de realizar las intervenciones necesarias para evitar la progresión de la ERC, así como evitar potenciales eventos cardiovasculares futuros12-15.
Por otra parte, el síndrome cardiovascular-reno-metabólico, en cuya base etiopatogénica subyace la adiposidad excesiva o disfuncional, promueve el desarrollo de enfermedades cardiovasculares, la ERC y la DM2. En este contexto, la prevención y el tratamiento precoz de este círculo vicioso es imprescindible para disminuir el riesgo de presentar complicaciones durante el seguimiento16.
Importancia de la albuminuria en el paciente con ERCLa ERC se categoriza en función del FGe (G1-G5) y de la albuminuria (A1-A3)5. Por lo tanto, la albuminuria constituye un elemento esencial para el diagnóstico de ERC, y también pronóstico, permitiendo categorizar la ERC en distintos grupos de riesgo cardiovascular11,12,17.
La albuminuria, además de ser un método diagnóstico no invasivo, barato y de alta rentabilidad para evaluación de riesgo cardiovascular18, es un factor de riesgo independiente de morbimortalidad cardiovascular y de mortalidad por cualquier causa6,7,13. De hecho, tanto el FGe como la albuminuria son predictores independientes de eventos cardiovasculares y renales, así como de una mayor mortalidad, multiplicándose el riesgo cuando ambas circunstancias concurren5,14. Así, por ejemplo, en el estudio ADVANCE, donde se siguió a 10.640 pacientes con DM2 un promedio de 4,3años, se comprobó que, según aumentaba el CAC o disminuía el FGe, aumentaba el riesgo de eventos cardiovasculares. Además, no hubo evidencia de interacción entre los efectos de un mayor CAC y un menor FGe (tabla 1)19.
Riesgo de complicaciones cardiovasculares y renales en función del filtrado glomerular y el cociente albúmina-creatinina en pacientes con diabetes tipo2
| Eventos CVMuerte CVEventos renales | FGe ≥ 90 | FGe 60-89 | FGe <60 |
| Normoalbuminuria (< 30 mg/g) | 1 (referencia) | 0,98 (0,78-1,22)1,22 (0,81-1,84)0,89 (0,31-2,58) | 1,33 (1,02-1,75)1,85 (1,17-2,92)3,95 (1,38-11,34) |
| Microalbuminuria (30-299 mg/g) | 1,48 (1,09-2,01)1,96 (1,16-3,32)0,45 (0,05-3,83) | 1,54 (1,20-1,98)2,52 (1,65-3,84)3,17 (1,15-8,74) | 2,04 (1,54-2,69)3,37 (2,15-5,30)16,19 (6,16-42,54) |
| Proteinuria (≥ 300 mg/g) | 1,18 (0,52-2,69)2,87 (1,01-8,18)7,82 (1,51-40,53) | 1,67 (1,09-2,57)3,61 (2,02-6,43)16,13 (5,49-47,42) | 3,23 (2,20-4,73)5,93 (3,45-10,20)22,20 (7,62-64,72) |
CV: cardiovascular; FGe: filtrado glomerular estimado (ml/min/1,73 m2).
Fuente: tabla realizada con datos de Ninomiya et al.19.
En resumen, la albuminuria persistente aislada por sí sola basta para diagnosticar la ERC, además de aumentar el riesgo de presentar complicaciones renales, cardiovasculares y la mortalidad20-22.
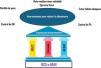
La albuminuria debería ser evaluada rutinariamente en los pacientes con DM, independientemente del valor del FGe, ya que es un indicador precoz de daño renal. El retraso en el diagnóstico está asociado con mayores riesgos de progresión de la enfermedad y complicaciones cardiovasculares. Por ello, identificar y tratar a los pacientes con ERC de manera temprana es crucial para prevenir la progresión de la ERC y para reducir eventos cardiovasculares (fig. 1)11,12. Sin embargo, en la práctica clínica, la detección de la albuminuria sigue siendo insuficiente7. En este contexto, es prioritario mejorar las estrategias de detección temprana, incluyendo pruebas de cociente albúmina creatinina en orina11. La mayoría de las guías de práctica clínica recomiendan el cribado anual para detectar ERC en el paciente con DM. En los pacientes con DM tipo1 (DM1) se debe comenzar a los 5años del diagnóstico, y en la DM2, en el momento del diagnóstico de la enfermedad, independientemente del tratamiento de base5,11,12.
Aproximación global para reducir la albuminuria.
ARA II: antagonistas de los receptores de angiotensinaII; AR-GLP1: agonistas del receptor péptido similar al glucagón tipo1; DM: diabetes mellitus; IECA: inhibidores de la enzima convertidora de angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa2; PA: presión arterial.
Fuente: figura realizada con datos del American Diabetes Association Professional Practice Committee11 y de Montero et al.12.
El manejo del paciente con ERC y DM2 exige un tratamiento global e integral que abarque todos los aspectos asociados a la progresión de la enfermedad renal y el riesgo de desarrollar complicaciones cardiovasculares, lo que implica, como primer escalón, modificaciones en el estilo de vida, control de la presión arterial y de lípidos, junto con la combinación de diferentes tratamientos farmacológicos (fig. 2)11,12.
Etiopatogenia de la ERC en la DM2 y aproximación terapéutica.
ARA II: antagonistas de los receptores de angiotensinaII; GLP1: péptido similar al glucagón tipo1; IECA: inhibidores de la enzima convertidora de angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa2; PA: presión arterial; RM: receptor mineralocorticoide.
Fuente: figura realizada con datos del American Diabetes Association Professional Practice Committee11, de Montero et al.12, Alicic et al.43, Zelniker y Braunwald44 y Heerspink et al.45.
En cuanto a las modificaciones en el estilo de vida, se recomienda la adquisición de hábitos dietéticos y de vida saludable, incluyendo la dieta de predominio de proteínas vegetales y fibra, evitando los ultraprocesados. Además, se recomienda reducir el peso en caso de presencia de obesidad, para evitar la aparición de sarcopenia y dinapenia. Asimismo, dado que los pacientes suelen ser de edad avanzada, la recomendación del ejercicio es de gran importancia a la hora de evitar la fragilidad11,12.
Dentro de este tratamiento holístico, diferentes fármacos han demostrado reducir el riesgo o retrasar la progresión de la ERC y reducir el riesgo cardiovascular, con efectos complementarios y aditivos. Dentro de esta aproximación global se incluiría la optimización del tratamiento de la DM, el control lipídico con estatinas, asociado o no a otros tratamientos hipolipemiantes, que permitan llegar al colesterol LDL objetivo, el control de la presión arterial (objetivo de presión arterial<130/80mmHg), siendo el tratamiento de base los inhibidores de la enzima convertidora de angiotensina (IECA) o los antagonistas de los receptores de angiotensinaII (ARAII) para aquellas personas con albuminuria y/o FGe <60ml/min/1,73m2 a la dosis máxima tolerada. Asimismo, en personas con DM2 y ERC se recomienda el uso de un inhibidor del cotransportador de sodio-glucosa2 (iSGLT2) con beneficio demostrado en la reducción de la progresión de la ERC y los eventos cardiovasculares en personas con FGe ≥20ml/min/1,73m2. Otro de los pilares para reducir los eventos cardiovasculares y la progresión de la ERC en personas con DM2, ERC, albuminuria y un FGe ≥25ml/min/1,73m2 es el empleo de finerenona, un antagonista del receptor mineralocorticoide no esteroideo11,12.
Este enfoque con diferentes fármacos permite actuar sobre los distintos factores que influyen en el desarrollo de la ERC en el paciente con DM2. Así, los inhibidores del sistema renina-angiotensina-aldosterona (ISRAA) reducen el tono de la arteriola eferente, la hiperfiltración y el remodelado cardiaco. Los iSGLT2 aumentan el tono de la arteriola aferente, tienen efectos antiinflamatorios y antifibróticos, además de reducir la hiperfiltración, la proteinuria y el estrés oxidativo. La finerenona reduce la inflamación, la fibrosis, la disfunción endotelial, el remodelado tisular y la proteinuria21,23. Finalmente, los Ar-GLP1, además de reducir el peso corporal, también disminuyen el estrés oxidativo y la disfunción endotelial11,12.
En consecuencia, el tratamiento holístico con todos estos fármacos proporciona una mayor protección renal y cardiovascular en esta población de alto riesgo cardiovascular.
Inhibición del sistema renina-angiotensina-aldosterona (ISRAA)Tanto los IECA como los ARAII constituyen el tratamiento de elección en pacientes con DM2, hipertensión arterial y ERC, por su capacidad para reducir la progresión de la enfermedad renal y el riesgo de eventos cardiovasculares11,24-26. Así, en el estudio RENAAL, el uso de losartán redujo el CAC un 35%23, ofreciendo los IECA y ARAII resultados similares27,28. Las evidencias sobre el beneficio del tratamiento con IECA o ARAII en la protección renal serían menos sólidas para pacientes con albuminuria sin hipertensión arterial29,30. El tratamiento con IECA o ARAII se puede asociar con alteraciones de la función renal como del potasio sérico, por lo que se debería realizar una bioquímica sanguínea basal y, tras el inicio y/o titulación de estos fármacos, con analíticas posteriores de control11,12.
Es importante resaltar que, a pesar de los beneficios mostrados por IECA y ARAII en albuminuria, tanto en el estudio RENAAL (con losartán) como en el IDNT (con irbesartán) se objetivó progresión de la ERC en el 43,5% y el 32,6% de los pacientes, respectivamente24,31, lo que indica la necesidad de tratamientos adicionales y complementarios en esta población por el riesgo residual asociado21.
Inhibidores SGLT2Se recomienda el empleo de iSGLT2 en pacientes con FGe ≥20ml/min/1,73m2 y DM2, ya que retrasan la progresión de la ERC y reducen el riesgo de insuficiencia cardíaca independientemente del control glucémico11,12. Tanto canagliflozina (estudio CREDENCE) como dapagliflozina (estudio DAPA-CKD) y empagliflozina (estudio EMPA-Kidney) han demostrado los beneficios de los iSGLT2 en pacientes con ERC y albuminuria. Este beneficio, además, es independiente de la función renal, de los niveles de albuminuria y de la presencia de DM2 (tabla 2)32-34. En estos ensayos clínicos, canagliflozina, dapagliflozina y empagliflozina redujeron el CAC en un 31%, un 29% y un 19%, respectivamente32-34. Son fármacos muy bien tolerados, si bien pueden causar un discreto deterioro inicial de la función renal, que es transitorio, así como depleción de volumen y reducción de las cifras de presión arterial, por lo que habrá que considerar el estado volémico del paciente y el tratamiento diurético y antihipertensivo concomitante, sobre todo en los pacientes más frágiles, antes de iniciar el tratamiento con iSGLT2. Además, el tratamiento con iSGLT2 también se asocia con un mayor riesgo de infecciones genitourinarias en relación con la glucosuria inducida a través de su mecanismo de acción, aspecto que hay que considerar para iniciar el tratamiento antibiótico precoz en caso de sospecha clínica32-34.
Resultados principales de ensayos clínicos realizados con inhibidores SGLT2 en pacientes con ERC
| Estudio | Participantes | Fármaco | Seguimiento | Resultado CV | Resultado renal |
|---|---|---|---|---|---|
| CREDENCE | 4.401 pacientes con DM2 y ERC (FGe 30 <90ml/min/1,73m2 y CAC >300 a 5.000mg/g) | Canagliflozina 100mg vs placebo | Mediana 2,62 años | • Muerte CV, infarto de miocardio o ictus: RR: 0,80; IC95%: 0,67-0,95; p=0,01)• Hospitalización por IC (RR: 0,61; IC95% 0,47-0,80; p<0,001) | • ERT (diálisis, trasplante o FGe <15ml/min/1,73m2), duplicación de creatinina o muerte por causas renales o CV (RR: 0,70; IC95% 0,59-0,82; p=0,00001)• ERT, duplicación del nivel de creatinina o muerte por causas renales (RR: 0,66; IC95%: 0,53-0,81; p<0,001)• ERT (HR: 0,68; IC95%: 0,54-0,86; p=0,002) |
| DAPA-CKD | 4.304 pacientes con FGe 25-75ml/min/1,73m2, y CAC 200 a 5.000mg/g | Dapagliflozina 10 mg o placebo | Mediana 2,4 años | • Muerte CV u hospitalización por insuficiencia cardíaca (RR: 0,71; IC95%: 0,55-0,92; p=0,009)• Mortalidad por cualquier causa (RR: 0,69; IC95%: 0,53-0,88; p=0,004)• Mortalidad CV (RR: 0,81; IC95%: 0,58-1,12) | • Disminución sostenida FGe ≥50%, ERT o muerte por causas renales o CV (RR: 0,61; IC95%: 0,51-0,72; p=0,001)• Disminución sostenida TFGe ≥50%, ERT o muerte por causas renales (RR: 0,56; IC95%: 0,45-0,68; p<0,001) |
| Los efectos de la dapagliflozina fueron independientes de la presencia de DM2 | |||||
| EMPA-Kidney | 6.609 pacientes con ERC (FGe 20-<45ml/min/1,73m2 o FGe 45-<90ml/min/1,73m2 con CAC ≥200mg/g | Empagliflozina 10 mg o placebo | Mediana 2,0 años | • Hospitalización por insuficiencia cardíaca o muerte por causas cardiovasculares (RR: 0,84; IC95%: 0,67-1,07 | • ERT, disminución sostenida FGe <10ml/min/1,73m2, disminución sostenida FGe ≥40% desde el inicio, o muerte por causas renales o muerte CV (RR: 0,72; IC95%: 0,64-0,82; p<0,001• Progresión enfermedad renal (RR: 0,71; IC95%: 0,62-0,81 |
| Los resultados fueron consistentes entre los pacientes con o sin diabetes y entre los subgrupos definidos según los rangos de FGe | |||||
CAC: cociente albúmina creatinina; CV: cardiovascular; DM2: diabetes mellitus tipo2; ERC: enfermedad renal crónica; ERT: enfermedad renal terminal; FGe: filtrado glomerular estimado; IC: insuficiencia cardiaca; IC 95%: intervalo de confianza 95%; RR: riesgo relativo; SGLT2: cotransportador de sodio-glucosa2.
Fuente: tabla realizada con datos de Perkovic et al.32, Heerspink et al.33 y Herrington et al.34.
Se han descrito diversos mecanismos hemodinámicos y metabólicos por los cuales los iSGLT2 ralentizan la progresión de la enfermedad renal, y que van más allá de su efecto sobre la glucemia. Así, los iSGLT2 reducen la reabsorción tubular renal de glucosa y la hiperfiltración, así como el estrés oxidativo y la inflamación, además de aumentar el angiotensinógeno y disminuir el peso corporal, la presión arterial sistémica, la presión intraglomerular, la sobrecarga de volumen y la albuminuria, ralentizando la pérdida de función renal35-38. Asimismo, también se han descrito efectos pleiotrópicos adicionales de los iSGLT2 a nivel vascular, cardiaco y renal39.
Por otra parte, datos recientes muestran que los iSGLT2 también podrían ser beneficiosos tras un trasplante renal, ya que se ha objetivado que su empleo se asociaría con una reducción significativa de muerte por cualquier causa, fallo del injerto o duplicación de la creatinina sérica40. En cambio, en pacientes con ERC en diálisis, aunque hay algunos datos preliminares prometedores, en la actualidad no está claro si la inhibición de SGLT2 será efectiva para prevenir resultados clínicamente relevantes y/o si es lo suficientemente segura en este contexto41.
En cualquier caso, a pesar de los beneficios claros sobre la progresión de la ERC, los ensayos clínicos han demostrado que sigue habiendo un riesgo residual de progresión de la enfermedad renal, a pesar del tratamiento con ISRAA e iSGLT2, lo que indica que son necesarios enfoques adicionales y complementarios para reducir este riesgo32-34.
FinerenonaA pesar del tratamiento con IECA/ARAII y del uso de iSGLT2, en el paciente con DM2 y ERC todavía existe un riesgo residual significativo de presentar complicaciones cardiovasculares y renales. Por ejemplo, en el estudio CREDENCE, el 11% de los pacientes con ERC y DM2 presentaron progresión de la ERC o muerte cardiovascular a los 36meses de seguimiento32. De hecho, esta progresión de la ERC se asocia con una mayor morbimortalidad cardiovascular, una disminución de la expectativa de vida, una peor calidad de vida, junto con un aumento de los costes sanitarios42.
En la etiopatogenia de la enfermedad renal diabética no solo intervienen factores hemodinámicos y metabólicos, sino que también juegan un papel fundamental la inflamación y la fibrosis, en donde IECA/ARAII o iSGLT2 no actuarían de manera específica, y que por lo tanto explicarían este riesgo residual a pesar del tratamiento con dichos fármacos (fig. 2)43-45.
La inflamación y la fibrosis se producen principalmente por una hiperactivación mineralocorticoide, que provoca un aumento del estrés oxidativo, junto con la liberación de citoquinas proinflamatorias y mediadores profibróticos. Por lo tanto, es importante diferenciar la inflamación sistémica (relacionada con la arteriosclerosis) de la inflamación dependiente de ligando, que es la que se presenta en pacientes con hiperactividad mineralocorticoide, especialmente en la población con DM243,45. La corrección de esta hiperactividad mineralocorticoide es diana terapéutica en estos pacientes11,12.
Es importante subrayar que no todos los antagonistas del receptor mineralocorticoide tienen las mismas propiedades fisicoquímicas y, por lo tanto, sus efectos sobre la presión arterial, la albuminuria y los eventos cardiovasculares y renales son diferentes, al igual que el riesgo de efectos secundarios, principalmente la hiperpotasemia (tabla 3)21,46-51. En este sentido, la finerenona tiene propiedades únicas, y su antagonismo selectivo sobre el receptor mineralocorticoide induce un cambio conformacional al unirse al mismo, que es diferente al cambio observado con los antagonistas del receptor mineralocorticoide esteroideos. Además, este cambio resulta en un reclutamiento de cofactores específico para cada tipo celular. Asimismo, finerenona bloquea la transcripción de genes proinflamatorios y profibróticos en varios tipos celulares, lo que promueve su acción antiinflamatoria y antifibrótica. En consecuencia, finerenona ofrece grandes ventajas sobre la espironolactona y la eplerenona, a pesar de que estos también reducen la albuminuria, aunque en menor medida, que se traducen en que finerenona sea el único antagonista del receptor mineralocorticoide que haya demostrado reducir la progresión de la enfermedad renal y el riesgo de desarrollar complicaciones cardiovasculares en los pacientes con DM2 y ERC, además de presentar un menor riesgo de hiperpotasemia21,46-51.
Efectos diferenciales de los distintos antagonistas del receptor mineralocorticoide
| Espironolactona | Eplerenona | Finerenona | |
|---|---|---|---|
| Estructura | Esteroideo (plana) | Esteroideo (plana) | No esteroideo (voluminoso) |
| Modo de unión | Pasivo | Pasivo | Voluminoso-pasivo |
| Potencia al RM | Alta | Moderada | Alta |
| Selectividad al RM | Baja | Moderada | Alta |
| Distribución tejidos | Riñón > Corazón (≥6veces) | Riñón > Corazón (∼3veces) | Riñón-Corazón (1:1) |
| Efecto sobre el reclutamiento de cofactores del RM | |||
| En ausencia de aldosteronaEn presencia de aldosterona | Agonista parcialBloqueo reclutamiento | Agonista parcialBloqueo reclutamiento | AntagonistaBloqueo de la unión del coactivador del RM |
| Efecto sobre PA | ↓↓ | ↓↓ | ↓ |
| Efecto sobre albuminuria | ↓ | ↓ | ↓↓ |
| Riesgo hiperpotasemia | ↑↑ | ↑↑ | ↑ |
| Efectos secundarios sexuales | Sí (ginecomastia) | Menos que espironolactona | No |
Los ensayos clínicos faseIII que han demostrado los beneficios cardiovasculares y renales del tratamiento con finerenona en pacientes con DM2 y ERC con albuminuria han sido los estudios FIDELIO-DKD y FIGARO-DKD, junto con el análisis combinado de ambos, el estudio FIDELITY (tabla 4)52-54. En conjunto, estos estudios ofrecen un programa clínico amplio sobre los pacientes con DM2 y ERC a lo largo del espectro de la severidad de la ERC. En conjunto, finerenona redujo de manera significativa la albuminuria en un 32% tras solo 4meses de tratamiento, manteniéndose esta reducción a lo largo de los estudios. Asimismo, finerenona redujo el riesgo de progresión de enfermedad renal en un 15-23%, según el criterio de valoración, y en un 14% el riesgo de eventos cardiovasculares tras 3años de seguimiento54. Los beneficios de finerenona fueron consistentes, independientemente del valor inicial del FGe, CAC y del empleo de iSGLT-2 o Ar-GLP1 (tabla 5)54, siendo además un tratamiento bien tolerado52-55. Así, en el estudio FIDELITY los eventos adversos relacionados con la hiperpotasemia ocurrieron con mayor frecuencia con finerenona (14,0%) frente a placebo (6,9%), pero ningún evento adverso relacionado con la hiperpotasemia fue mortal y solo una pequeña proporción condujo a la interrupción permanente del tratamiento (1,7% vs 0,6%) u hospitalización (0,9% vs 0,2%, respectivamente). Los pacientes que recibieron finerenona tuvieron una reducción moderada de la presión arterial sistólica media en comparación con los pacientes que recibieron placebo a los 4meses de tratamiento (−3,2 vs +0,5mmHg). No se reportaron más casos de ginecomastia con finerenona54. Por último, diferentes estudios en vida real con finerenona en pacientes con DM2 y ERC han comunicado resultados consistentes con los ensayos clínicos55,56. En cuanto al manejo práctico, la dosis de inicio será de 20mg/día en caso de FGe ≥60ml/min/1,73m2 y de 10mg diarios si FGe 25-59ml/min/1,73m2. En caso de que el potasio sérico se incrementase por encima de 5,5mmol/l, se debería interrumpir el tratamiento y reconsiderar posteriormente el inicio con la dosis de 10mg, mientras que si la dosis inicial era de 10mg y el potasio permanece ≤4,8mmol/l, se podría plantear subir a la dosis de 20mg, si el FGe presentase cambios <30%. Con respecto a las analíticas de control, el potasio sérico y el filtrado glomerular se deben medir basalmente y a las 4semanas tras el inicio, reinicio o aumento de la dosis de finerenona21.
Resultados principales ensayos clínicos fase III con finerenona en pacientes con DM2 y ERC
| FIDELIO DKD (n=5.734) | FIGARO DKD (n=7.437) | FIDELITY (n=13.171) | |
|---|---|---|---|
| Características del estudio | |||
| Diseño | Ensayo clínico faseIII, multicéntrico, aleatorizado, doble ciego, controlado con placebo | Análisis combinado FIDELIO DKD y FIGARO DKD | |
| Criterios de inclusión | Edad ≥18años, DM2, dosis máxima tolerada IECA/ARAII, potasio sérico ≤4,8mmol/l, ERC | ||
| Definición ERC | • CAC 30-<300mg/g, FGe 25-<60ml/min/1,73m2 y retinopatía diabética, o• CAC 300-5.000mg/g y FGe 25-<75ml/min/1,73m2 | • CAC 30-<300mg/g y FGe 25-90ml/min/1,73m2, o• CAC 300-5.000mg/g y FGe ≥60ml/min/1,73m2 | |
| Variable primaria | Tiempo hasta insuficiencia renal, descenso sostenido FGe ≥40% desde niveles basales o muerte renal | Tiempo hasta muerte CV, infarto de miocardio no mortal, ictus no mortal u hospitalización por IC | Variable renal: tiempo hasta insuficiencia renal, descenso sostenido FGe ≥57% desde niveles basales o muerte renalVariable CV: tiempo hasta muerte CV, infarto de miocardio no mortal, ictus no mortal u hospitalización por IC |
| Variable secundaria | Tiempo hasta muerte CV, infarto de miocardio no mortal, ictus no mortal u hospitalización por IC | Tiempo hasta insuficiencia renal, descenso sostenido FGe ≥40% desde niveles basales o muerte renal | |
| Características basales | |||
|---|---|---|---|
| Edad, años | 65,6 | 64,1 | 64,8 |
| Sexo (masculino), % | 70,2 | 69,4 | 69,8 |
| HbA1c, % | 7,7 | 7,7 | 7,7 |
| FGe, ml/min/1,72 m2 | 44,3 | 67,8 | 57,6 |
| CAC ≥300 mg/g, % | 87,5 | 50,7 | 66,7 |
| IECA o ARA II, % | 100 | 100 | 100 |
| iSGLT2, % | 4,6 | 8,4 | 6,7 |
| Agonistas GLP1, % | 6,9 | 7,5 | 7,2 |
| Resultados | |||
|---|---|---|---|
| Mediana seguimiento, años | 2,6 | 3,4 | 3,0 |
| Insuficiencia renal, disminución sostenida FGe ≥40% con respecto a niveles basales o muerte renal | RR: 0,82 (IC95%: 0,73-0,93) | RR: 0,87 (IC95%: 0,76-1,01) | RR: 0,85 (IC95%: 0,77-0,93) |
| Insuficiencia renal, disminución sostenida FGe ≥57% con respecto a niveles basales o muerte renal | RR: 0,68 (IC95%: 0,55-0,82) | RR: 0,77 (IC95%: 0,60-0,99) | RR: 0,77 (IC95%: 0,67-0,88) |
| Insuficiencia renal | RR: 0,87 (IC95%: 0,72-1,05) | RR: 0,72 (IC95%: 0,49-1,05) | RR: 0,84 (IC95%: 0,71-0,99) |
| Enfermedad renal terminal | RR: 0,86 (IC95%: 0,67-1,10) | RR: 0,64 (IC95%: 0,41-0,99) | RR: 0,80 (IC95%: 0,64-0,99) |
| Muerte CV, infarto de miocardio no mortal, ictus no mortal, hospitalización IC | RR: 0,86 (IC95%: 0,75-0,99) | RR: 0,87 (IC95%: 0,76-0,98) | RR: 0,86 (IC95%: 0,78-0,95) |
ARA II: antagonistas de los receptores de angiotensina II; CAC: cociente albúmina creatinina; CV: cardiovascular; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; FIDELIO-DKD: Finerenone in Reducing Kidney Failure and Disease Progression in Diabetic Kidney Disease; FIGARO-DKD: Finerenone in Reducing Cardiovascular Mortality and Morbidity in Diabetic Kidney Disease; GLP1: péptido similar al glucagón tipo 1; HbA1c: hemoglobina glicosilada; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima convertidora de angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa 2; RR: riesgo relativo.
Fuente: tabla realizada con datos de Bakris et al.52, Pitt et al.53 y Agarwal et al.54.
Beneficios cardiovasculares de finerenona en diferentes subgrupos, en el estudio FIDELITY
| Categoría | Finerenona (n=6.519 | Placebo (n=6.507) | RR (IC 95%) | p interacción |
|---|---|---|---|---|
| n/N (n/100PY) | n/N (n/100PY) | |||
| FGe Ml/min/1,73 m2 | ||||
| <25 | 11/81 (5,2) | 23/81 (12,2) | 0,48 (0,22-1,03) | 0,14 |
| 25-<45 | 321/2.117 (5,7) | 331/2.115 (5,8) | 0,94 (0,81-1,10) | |
| 45-<60 | 197/1.717 (4,0) | 247/1.717 (5,1) | 0,80 (0,66-0,97) | |
| ≥60 | 295/2.603 (3,6) | 337/2.592 (4,2) | 0,87 (0,74-1,01) | |
| CAC mg/g | ||||
| <30 | 10/120 (2,4) | 15/110 (4,3) | 0,59 (0,24-1,45) | 0,41 |
| 30-<300 | 260/1.076 (3,8) | 292/2.023 (4,4) | 0,86 (0,73-1,02) | |
| ≥ 300 | 554/4.321 (4,7) | 631/4.371 (5,4) | 0,89 (0,79-1,00) | |
| iSGLT-2 basal | ||||
| No | 786/6.081 (4,4) | 887/6.068 (5,1) | 0,87 (0,79-0,96) | 0,41 |
| Sí | 39/438 (3,0) | 52/439 (4,1) | 0,63 (0,40-<1,00) | |
| Agonista GLP basal | ||||
| No | 767/6.022 (4,4) | 875/6.060 (5,0) | 0,87 (0,79-0,96) | 0,63 |
| Sí | 58/497 (3,8) | 64/447 (4,9) | 0,76 (0,52-1,11) | |
CAC: cociente albúmina creatinina; FGe: filtrado glomerular estimado; GLP1: péptido similar al glucagón tipo 1; iSGLT2: inhibidores del cotransportador de sodio-glucosa 2; PY: pacientes-año; RR: riesgo relativo.
Fuente: tabla realizada con datos de Agarwal et al.54.
Por todo ello, finerenona se posiciona como un fármaco importante en la estrategia global del tratamiento integral del paciente con DM2 y ERC con albuminuria, ya que es el único que incide específicamente sobre la inflamación y la fibrosis.
Incidiendo en la importancia del tratamiento holístico multifactorial, recientemente se ha publicado que, en comparación con el tratamiento convencional, la combinación de iSGLT2, agonistas del receptor de GLP1 y finerenona en pacientes con DM2 y albuminuria reduce en un 35% la aparición de eventos cardiovasculares adversos mayores (infarto de miocardio no mortal, ictus no mortal o muerte cardiovascular) (RR: 0,65; IC95%: 0,55-0,76)57.
Agonistas del receptor GLP1Algunos Ar-GLP1 han mostrado efectos beneficiosos a nivel renal en pacientes con DM2 (tabla 6)58-65. Sin embargo, salvo el estudio FLOW, realizado específicamente en población con DM2 y ERC, el resto de los ensayos clínicos se han hecho en pacientes con DM2, generalmente con riesgo cardiovascular elevado, pero solo algunos con ERC58-64.
Efecto de los agonistas GLP1 sobre los eventos renales en ensayos clínicos realizados en pacientes con DM2
| Estudio | Participantes | Fármaco | Seguimiento | Resultado renal |
|---|---|---|---|---|
| ELIXA | 6.068 pacientes con DM2 y evento coronario reciente | Lixisenatide sc 10-20μg diarios vs placebo | Mediana seguimiento 108 semanas | • Cambio CAC desde niveles basales: −1,69% (IC95%: −11,69 a 8,30; p=0,7398) en pacientes con normoalbuminuria, −21,10% (IC95%: −42,25 a 0,04; p=0,0502) en pacientes con microalbuminuria, y −39,18% (IC95%: −68,53 a −9,84; p=0,0070) en pacientes con macroalbuminuria• Lixisenatide se asoció con una reducción en el riesgo de aparición de macroalbuminuria vs placebo (RR: 0,808; IC95%: 0,660-0,991; p=0,0404)• Doblar la creatinina sérica ocurrió en 1% de ambos grupos (RR: 1,163; IC95% 0,741-1,825; p=0,5127) |
| LEADER | 9.340 pacientes con DM2 y riesgo CV elevado | Liraglutida sc 1,8 mg al día vs placebo | Mediana de seguimiento 3,8 años | • Reducción de eventos renales (macroalbuminuria de nueva aparición o doblar la creatinina sérica y FGe ≤45ml/min/1,73m2, necesidad de terapia renal sustitutiva o muerte de causa renal) con liraglutida (RR: 0,78; IC95%: 0,67-0,92; p=0,003) |
| SUSTAIN-6 | 3.297 pacientes con DM2 y un riesgo CV elevado | Semaglutida sc (0,5mg o 1,0mg) vs placebo | 104 semanas | • Reducción en el riesgo de nuevo o empeoramiento enfermedad renal (macroalbuminuria persistente, doblar creatinina sérica y aclaramiento de creatinina <45ml/min/1,73m2 MDRD, o necesidad de tratamiento sustitutivo renal) con semaglutida (RR: 0,64; IC95%: 0,46-0,88; p=0,005) |
| EXSCEL | 14.752 pacientes con DM2 y amplio rango de riesgo cardiovascular | Exenatida sc 2mg una vez a la semana vs placebo | Promedio de 3,3 años | • Exenatida no redujo FGe significativamente (0,21ml/min/1,73m2; IC95%: −0,27 a 0,70)• Macroalbuminuria: exenatida (2,2%) vs placebo (2,5%) (RR: 0,87; IC95%: 0,70-1,07)• Ninguno de las variables renales se redujo con exenatida en los análisis no ajustados, pero sí en el análisis ajustado (RR: 0,85; IC95%: 0,74-0,98) |
| HARMONY OUTCOMES | 9.463 pacientes ≥40años con DM2 y enfermedad CV | Albiglutida sc (30-50mg) una vez a la semana vs placebo | Mediana de 1,6 años | • Daño renal (RR: 0,87; IC95%: 0,75-1,02)• La diferencia en FGe entre albiglutida y placebo a los 8 meses fue −1,11; IC95%: −1,84 a −0,39, y a los 16 meses −0,43; IC95%: −1,26 a +0,41 |
| REWIND | 9.901 pacientes con DM2 con o sin enfermedad CV | Dulaglutida sc (1,5mg) una vez a la semana vs placebo | Mediana de 5,4 años | • Reducción de eventos renales (macroalbuminuria de nueva aparición, descenso sostenido FGe ≥30% o terapia sustitutiva renal) con dulaglutida (RR: 0,85; IC95% 0,77-0,93; p=0,0004) |
| PIONEER 6 | 3.183 pacientes con DM2 y elevado riesgo CV (edad ≥50años con enfermedad CV establecida o ERC o edad ≥60años con factores de riesgo CV solo) | Semaglutida oral 14mg/día vs placebo | Mediana de 15,9 meses | • Daño renal agudo: 2,0% (semaglutida) vs 2,3% (placebo) |
| FLOW | 3.533 pacientes con DM2 y ERC (FGe 50-75ml/min/1,73m2 y CAC >300 y <5.000mg/g o FGe 25-<50ml/min/1,73m2 y CAC >100 y <500mg/g) | Semaglutida sc 1,0 mg semanal vs placebo | Mediana de 3,4 años | • El riesgo de la variable primaria (diálisis, trasplante, FGe <15ml/min/1,73m2, ≥50% FGe desde el inicio o muerte por causas renales o cardiovasculares) fue un 24% menor con semaglutida (RR: 0,76; IC95% 0,66-0,88; p=0,0003)• Los resultados fueron similares para los componentes renales de la variable primaria (RR: 0,79; IC95%: 0,66-0,94• Muerte CV (RR: 0,71; IC95%: 0,56-0,89)• MACE (RR: 0,82; IC95%: 0,68-0,98; p=0,029)• Muerte cualquier causa (RR: 0,80; IC95%: 0,67-0,95, p=0,01) |
CAC: cociente albúmina creatinina; CV: cardiovascular; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; GLP1: péptido similar al glucagón tipo 1; IC 95%: intervalo de confianza 95%; RR: riesgo relativo.
Fuente: tabla realizada con datos de Muskiet et al.58, Marso et al.59,60, Bethel et al.61, Hernandez et al.62, Gerstein et al.63, Husain et al.64 y Perkovic et al.65.
En el estudio FLOW se incluyó a 3.533 pacientes con DM2 y ERC, definida por un FGe de 50 a 75ml/min/1,73m2 y un CAC urinario de >300 y <5.000mg/g o un FGe de 25 a <50ml/min/1,73m2 y un CAC urinario de >100 y <5.000mg/g. Los pacientes fueron aleatorizados a recibir semaglutida subcutánea (1,0mg semanal) o placebo. Semaglutida redujo en un 32% el CAC. La variable primaria del estudio fueron eventos de enfermedad renal grave, formados por una combinación de aparición de insuficiencia renal (diálisis, trasplante o FGe de <15ml/min/1,73m2), una reducción ≥50% en el FGe desde el inicio o la muerte por causas renales o cardiovasculares. Tras una mediana de seguimiento de 3,4años, semaglutida redujo en un 24% el riesgo de la variable primaria, en un 21% la variable compuesta por los eventos renales, la mortalidad cardiovascular en un 29%, el riesgo de MACE en un 18% y la muerte por cualquier causa en un 20%. El riesgo de efectos adversos graves fue menor en el grupo de semaglutida, si bien fue más frecuente con semaglutida el riesgo de discontinuación por efectos adversos en comparación con placebo (13,2% vs 11,9%), debido, principalmente a un mayor número de efectos adversos gastrointestinales (4,5% vs 1,1%)65.
Los efectos beneficiosos a nivel renal de los Ar-GLP1 serían independientes de su efecto glucémico. Así, estos fármacos ejercen efectos beneficiosos sobre varios factores de riesgo cardiovasculares, como la hipertensión arterial, el metabolismo lipídico o la pérdida de peso, lo que, junto con la natriuresis, tendría un efecto reductor sobre la albuminuria. Además, la inhibición del intercambiador de sodio-hidrógeno3 (NHE3) a nivel proximal tendría un efecto sobre la natriuresis y secundariamente sobre la presión arterial. Los agonistas GLP1 también mejorarían la función hemodinámica renal al reducir la hiperfiltración glomerular a través de la activación de la retroalimentación tubuloglomerular. Igualmente se han descrito propiedades antiinflamatorias, antioxidantes y antiisquémicas con los Ar-GLP166-68.
Asimismo, dado que en la etiopatogenia del síndrome cardio-reno-metabólico la adiposidad juega un papel central, los Ar-GLP1 resultarían de especial interés en este contexto clínico, ya que han demostrado, además de reducir el apetito, la pérdida de peso y un mejor control glucémico, ser protectores a nivel renal, cardiovascular y metabólico16.
Por último, pequeños ensayos clínicos y estudios observacionales están mostrando beneficios modestos a nivel glucémico y sobre el peso corporal, tanto en pacientes con enfermedad renal terminal como en pacientes con trasplante renal. En cualquier caso, se necesitan más estudios para poder valorar correctamente los efectos en estas poblaciones69,70.
Perspectiva actual y recomendaciones de mejoraLas guías de la American Diabetes Association (ADA) del año 2025 aconsejan, con un nivel de recomendaciónA, el empleo de finerenona en pacientes con DM2, ERC (FGe ≥25ml/min/1,73m2) y albuminuria para reducir los eventos cardiovasculares y la progresión de la ERC11, mientras que el consenso de la Sociedad Española de Nefrología para el manejo de la nefropatía diabética del año 2024 sugiere el empleo de finerenona en pacientes con DM2, un FGe ≥25ml/min/1,73m2, concentración de potasio sérico normal (≤5,1mmol/l) y albuminuria (CAC ≥30mg/g), a pesar de las dosis máximas toleradas de un ISRAA, con un nivel de recomendación1A12.
En definitiva, el tratamiento de los pacientes con ERC y DM2 debe seguir una estrategia integral, que exige una aproximación global que incluya tanto el control de los diferentes factores de riesgo cardiovascular, como el empleo de aquellos fármacos que han demostrado un beneficio a nivel renal y cardiovascular, principalmente los IECA o ARAII, los iSGLT2, la finerenona y los Ar-GLP1. Además, la combinación de estos tratamientos no debería demorarse en el tiempo, ya que esto permitiría la progresión de la ERC, así como el riesgo de presentar complicaciones cardiovasculares, por lo que la instauración de los mismos tendría que hacerse de manera precoz, incluyendo el inicio de la combinación de los diferentes fármacos, de manera individualizada, de acuerdo con las características clínicas de los pacientes38,71-80.
Por otra parte, aunque se recomienda que la albuminuria debe ser evaluada rutinariamente en los pacientes con DM, independientemente de los valores de FGe al menos una vez al año11,12, dicha determinación se encuentra infrautilizada, lo cual lleva a un infradiagnóstico de la ERC7.
Medidas de gran interés y ayuda para mejorar la determinación de la albuminuria en la práctica clínica serían estandarizar el cribado con medición de CAC y FGe en atención primaria, la realización de actividades formativas y educativas específicas, así como el empleo de las nuevas tecnologías80,81. En este sentido, el uso de la app para móviles Nefroconsultor es un sistema de apoyo a la decisión clínica que puede mejorar la derivación adecuada en un 28%, así como aumentar la determinación de albuminuria en el momento de la derivación80,81.
Otra medida importante sería establecer protocolos de actuación conjuntos con las distintas especialidades hospitalarias implicadas en el manejo de esta población (endocrinología, nefrología, medicina interna, cardiología), subrayando la importancia de la continuidad asistencial entre los diferentes niveles asistenciales, donde queden definidos en protocolos claros las funciones de cada profesional y los criterios de derivación a cada una de las especialidades implicadas5,12,82-85.
Finalmente, para mejorar la gestión integral de pacientes con DM2 y ERC con albuminuria, proponemos 10 recomendaciones, las cuales se resumen en la tabla 7.
Recomendaciones para la mejora en la gestión integral de personas con DM2 y ERC con albuminuria
| 1. Importancia de la albuminuria | La albuminuria es un marcador crucial de daño renal y riesgo cardiovascular en personas con diabetes, requiriendo una evaluación y un manejo adecuados para prevenir complicaciones asociadas |
| 2. Diagnóstico temprano | Se recomienda realizar pruebas regulares para detectar albuminuria en personas con diabetes, utilizando el cociente albúmina/creatinina en orina como método estándar de evaluación. El empleo de la app para móviles Nefroconsultor podría resultar de utilidad |
| 3. Enfoque multidisciplinar y criterios de derivación | Se debería fomentar la colaboración entre todos los niveles asistenciales para un adecuado manejo integral, recomendándose que atención primaria actúe como coordinador y gestor de la cronicidad |
| 4. Intervenciones farmacológicas efectivas | Se aconseja el tratamiento integral con IECA/ARAII, inhibidores de SGLT2, agonistas del receptor de GLP1 y finerenona como tratamientos efectivos para reducir la progresión de la enfermedad renal y protección cardiovascular en pacientes con diabetes y enfermedad renal crónica, de acuerdo con las recomendaciones de las guías de práctica clínica |
| 5. Manejo del riesgo vascular | Es fundamental el control de la presión arterial y los lípidos, así como la promoción de hábitos de vida saludables, incluyendo dieta equilibrada y ejercicio regular |
| 6. Educación del paciente | Se deben implementar programas educativos que aborden la diabetes, la salud renal y el uso de fármacos con protección cardiorrenal, empoderando a los pacientes en su autocontrol y manejo de la enfermedad |
| 7. Adherencia al tratamiento | Se debe enfatizar la importancia de fomentar la adherencia a los tratamientos mediante estrategias de autogestión y seguimiento cercano por parte del equipo de salud |
| 8. Evaluación continua | Se deben establecer criterios de éxito para evaluar la efectividad del tratamiento, incluyendo la reducción de la albuminuria y la mejora en la función renal |
| 9. Uso de tecnología | Se recomienda la implementación de tecnologías para la monitorización de la albuminuria, la función renal y la detección temprana de eventos clínicos. Herramientas como dispositivos de monitorización remota y aplicaciones móviles pueden facilitar el seguimiento del paciente y la comunicación con el equipo de salud |
| 10. Investigación y actualización | Se debe alentar a la comunidad médica a promover la investigación continua sobre nuevas terapias y enfoques en el manejo de la diabetes con albuminuria, actualizando las prácticas clínicas en función de los hallazgos recientes |
GLP1: péptido similar al glucagón tipo 1; IECA: inhibidores del enzima convertidor de angiotensina; ARA II: antagonistas de los receptores de angiotensina II; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; SGLT2: cotransportador de sodio-glucosa 2.
La DM es una enfermedad crónica que, cuando se acompaña de albuminuria, incrementa significativamente el riesgo de presentar complicaciones renales, cardiovasculares y metabólicas. Por lo tanto, la detección de albuminuria es un elemento básico desde el inicio del diagnóstico de la DM. El tratamiento holístico, que permita la actuación sobre los distintos factores que intervienen en el desarrollo de la enfermedad renal diabética, es la mejor aproximación para reducir el riesgo de progresión de la enfermedad renal y de desarrollar complicaciones cardiovasculares. El empleo de IECA o ARAII, iSGLT2, finerenona y Ar-GLP1 con beneficio renal demostrado constituye el tratamiento de base de los pacientes con DM2, ERC y albuminuria.
FinanciaciónContent Ed Net proporcionó asistencia editorial en la redacción de este artículo con financiación de Bayer Hispania.
Conflicto de interesesLos autores han participado en un Advisory Board financiado por Bayer, en el cual se discutieron aspectos científicos y clínicos relacionados con el uso de finerenona en el manejo de la enfermedad renal crónica y la insuficiencia cardíaca. Han recibido honorarios de Bayer por su participación en el Advisory Board. Sin embargo, Bayer no ha influido en la redacción, análisis o interpretación del contenido de este manuscrito.
RFO ha participado en consultorías con Novartis, Sanofi, Amgen, Amarin, y ha recibido honorarios por ponencias de Novo Nordisk, Amarin, Novartis, Sanofi, Organon.JCFG ha recibido honorarios por ponencias de Novo Nordisk, Lilly, Boehringer-Ingelheim, Menarini, Esteve, y AstraZeneca.