El sistema del complemento es un entramado bioquímico de proteínas solubles y de membrana implicadas en la respuesta inmune innata. El complemento es esencial para la homeostasis y la defensa frente a patógenos, pero un desequilibrio entre sus procesos de activación y regulación puede causar daño tisular. Un ejemplo relevante es el síndrome hemolítico-urémico atípico (SHUa), que a menudo se asocia con una función anómala del regulador del complemento Factor H (FH). El complemento interacciona con los sistemas de la coagulación, fibrinólisis, renina-angiotensina y calicreína-cinina (SCC). El SCC es una cascada proinflamatoria y procoagulante que se puede activar conformacionalmente o mediante proteólisis, y que incluye a la proteasa precalicreína, a los factores de coagulación FXI y FXII, y al sustrato/cofactor cininógeno de alto peso molecular. «In vitro», el SCC desencadena una serie de interacciones entre FXI, FXII, FH y otras proteínas que provocan la activación directa o indirecta del complemento. Esta capacidad del SCC para activar el complemento afectaría a la coagulación y a la respuesta inmunológica del organismo, pero nunca se han explorado sus posibles consecuencias «in vivo». Esta revisión sintetiza las principales características fisiopatológicas del SCC en el contexto del daño renal mediado por el complemento, en particular en el SHUa.
The complement system is a network of soluble and cell surface proteins primarily involved in innate immune responses. Complement signalling is essential for pathogen defence and homeostasis, but an activation-regulation imbalance can lead to tissue damage. This phenomenon has been implicated in kidney diseases such as atypical Haemolytic Uraemic Syndrome (aHUS), frequently associated with dysfunction of the complement regulator Factor H (FH). Physiologically, complement interacts with the coagulation, fibrinolysis, renin-angiotensin and kallikrein-kinin systems (KKS). The KKS is a proinflammatory and procoagulant cascade comprised of the protease prekallikrein, the coagulation factors XI (FXI) and XII (FXII), and the cofactor/substrate high-molecular-weight kininogen. KKS can be activated conformationally or proteolytically. KKS activation in vitro triggers a number of biochemical interactions between FXI, FXII, FH and other complement proteins that result in direct or secondary complement activation. These functional links point to an overall complement pro-activating role for the KKS that has implications for coagulation and immunity, but whose physiological consequences in vivo remain largely unexplored. This review aims to summarize the main physiopathological events of KKS activation in the context of complement-mediated kidney disease, with particular emphasis in aHUS.
El síndrome hemolítico-urémico atípico (SHUa) es una enfermedad rara (OMIM#235400) que cursa con afectación hematológica y renal, y cuya patogenia se inicia en el endotelio de la microvasculatura1. La lesión anatomopatológica que define el SHUa es una microangiopatía trombótica, con presencia de trombos en la vasculatura renal más pequeña, aunque los resultados de los estudios de coagulación habitualmente realizados en la clínica son normales2.
La investigación realizada en la primera década del siglo xxi en pequeñas cohortes de pacientes con SHUa, la mayoría de origen europeo, supuso un gran avance en el conocimiento de los mecanismos patogénicos, que señalaban al sistema del complemento como un agente de primer orden en el desarrollo de la enfermedad3. Estos hallazgos confluyeron en el tiempo con la disponibilidad de un fármaco biológico, el eculizumab, que bloqueaba el complemento y se utilizaba en el tratamiento de la hemoglobinuria paroxística nocturna. Desde su aprobación para el tratamiento del SHUa4, el eculizumab ha reducido extraordinariamente la morbimortalidad del SHUa y ha estimulado el desarrollo de otros fármacos capaces de inhibir o modular el sistema del complemento a diferentes niveles5.
El complemento es una de las denominadas «cascadas proteolíticas» que operan en el plasma, y cuya función más conocida es la defensa innata e inmediata frente a infecciones. Evolutivamente anterior a las inmunoglobulinas, el complemento es un sistema bioquímicamente complejo en el que participan numerosas proteínas plasmáticas que se activan en presencia de patógenos o de moléculas de distinta naturaleza (fig. 1)6. Una vez activadas, estas proteínas no son capaces de diferenciar la superficie de los patógenos de la superficie de las células propias. Por este motivo, otras proteínas del complemento actúan como «reguladoras» del sistema, evitando que se dañen los tejidos autólogos, como el endotelio de la microvasculatura. Estas características determinan que el correcto funcionamiento del complemento dependa de un equilibrio muy preciso entre sus procesos de activación y regulación; cuando este equilibrio se rompe, se favorece el desarrollo de enfermedades como el SHUa o la glomerulopatía C3 (GC3), entre otras7.
Defectos del complemento en el síndrome hemolítico-urémico atípico (SHUa). Esquema general de funcionamiento del complemento, que puede activarse por 3 vías: alternativa, clásica y lectinas, dependiendo del patógeno o la molécula implicados. Esta activación genera unos complejos enzimáticos denominados C3 convertasas porque activan el componente C3, el más importante para el funcionamiento del complemento. Los componentes activadores, los componentes reguladores y las convertasas de C3 y de C5 se resaltan en colores diferentes. Las convertasas de la vía alternativa se estabilizan por la properdina (P). Las proteínas factor H-related proteins (FHRs) podrían actuar como activadores y/o reguladores del complemento. En muchos pacientes de SHUa el funcionamiento de la vía alternativa está alterado por la existencia de mutaciones en componentes activadores (C3 y Factor B) o reguladores (Factor H, Factor I, membrane cofactor protein [MCP]/CD46), autoanticuerpos anti-FH circulantes, o a consecuencia de reordenamientos genéticos anómalos que implican al Factor H y a las proteínas FHRs. El resultado global es una hiperactivación o una hiporegulación del complemento que permite que se active la vía lítica y dañe directamente a la célula endotelial. C1INH: C1-inhibitor; C4BP: C4b-binding protein; CR1: complement receptor 1; DAF: decay accelerating factor; MBL: Mannan-Binding Lectin; MASP-1: MBL-Associated Serine Protease 1; MASP-2: MBL-Associated Serine Protease 2.
En el SHUa, una de las vías de activación del complemento, denominada vía alternativa (VA), no funciona correctamente (fig. 1). Muchos pacientes tienen variantes genéticas patogénicas (i.e. mutaciones) en proteínas activadoras, como C3 o el Factor B (FB), o en proteínas reguladoras, como el Factor H (FH), el Factor I (FI) o la proteína de membrana MCP/CD468. Otros pacientes forman autoanticuerpos frente al FH que tienen un efecto similar a las mutaciones9. Un tercer grupo de alteraciones, menos frecuentes, son los reordenamientos genéticos anómalos que afectan al FH y a sus proteínas homólogas FHRs10,11. Aunque los estudios funcionales son limitados, se considera que tanto las alteraciones genéticas como los autoanticuerpos provocan un desequilibrio entre la activación y la regulación de la VA del complemento, que acaba así dañando las células y tejidos propios y favoreciendo el desarrollo del SHUa.
Las alteraciones más frecuentes en el SHUa, y con peor pronóstico, son las que afectan al FH, que es el principal regulador de la VA12. Por ello, su identificación temprana es particularmente relevante a la hora de establecer tratamientos que prevengan el deterioro de la función de renal o las recidivas postrasplante. A pesar de las técnicas de secuenciación masiva y otras herramientas de análisis genético actualmente disponibles, la identificación de mutaciones y reordenamientos genéticos que afectan al FH todavía requiere varias semanas. La determinación de autoanticuerpos anti-FH, por otra parte, se puede llevar a cabo de forma inmediata en los primeros días del inicio mediante técnicas inmunológicas clásicas que detectan los inmunocomplejos de FH y anti-FH en plasma; de esta manera, es posible realizar recambios plasmáticos para eliminar rápidamente los autoanticuerpos y, eventualmente, iniciar un tratamiento inmunosupresor13.
Los estudios genéticos en los pacientes han identificado también un segundo grupo de factores de predisposición que estaría relacionado con el mecanismo protrombótico subyacente a la patogenia del SHUa. Así, algunos pacientes presentan variantes patogénicas en el gen que codifica la diacilglicerol quinasa épsilon (DGKE), una enzima intracelular con actividad antitrombótica, y son especialmente frecuentes en niños muy pequeños14. Las variantes identificadas en DGKE suelen ser recesivas y a veces se presentan en combinación con alteraciones en genes del complemento, como el C315. En la misma línea, ciertas variantes patogénicas en el gen que codifica la trombomodulina (THBD) también se han asociado al desarrollo del SHUa16. La trombomodulina es un receptor situado en la membrana endotelial y está implicada en la activación de la proteína C y en la regulación del proceso de trombosis. Un estudio reciente, no obstante, cuestiona la contribución real de las variantes de THBD al SHUa17.
Por otra parte, estudios de secuenciación masiva en cohortes de pacientes SHUa han revelado un exceso de variantes potencialmente patogénicas en el gen del plasminógeno (PLG), y se ha sugerido que una actividad baja de plasminógeno o de plasmina podría reducir la degradación de trombos en el SHUa y actuar como un factor modificador de la enfermedad18. Por último, y aunque los datos son aún escasos, varios estudios en cohortes de pacientes con C3G han observado un exceso de mutaciones heterocigotas en DGKE, y descrito en individuos portadores de variantes en THBD, PLG y el factor de von Willebrand (VWF)18,19.
En conjunto, estos datos sugieren que, aunque los factores de coagulación plasmáticos y los valores hemostáticos sean normales, los pacientes de SHUa podrían sufrir una pérdida de regulación a nivel local que desencadenara una cierta activación de la cascada de la coagulación. En este contexto, la activación del sistema calicreína-cinina (SCC, por sus siglas en español) justificaría la presencia de microtrombos en el tejido renal que se observa en el SHUa, así como la activación secundaria del sistema del complemento. En los siguientes apartados revisaremos el funcionamiento del SCC y su repercusión en la fisiología renal, así como las interacciones entre el SCC y el sistema del complemento que podrían contribuir a situaciones patológicas.
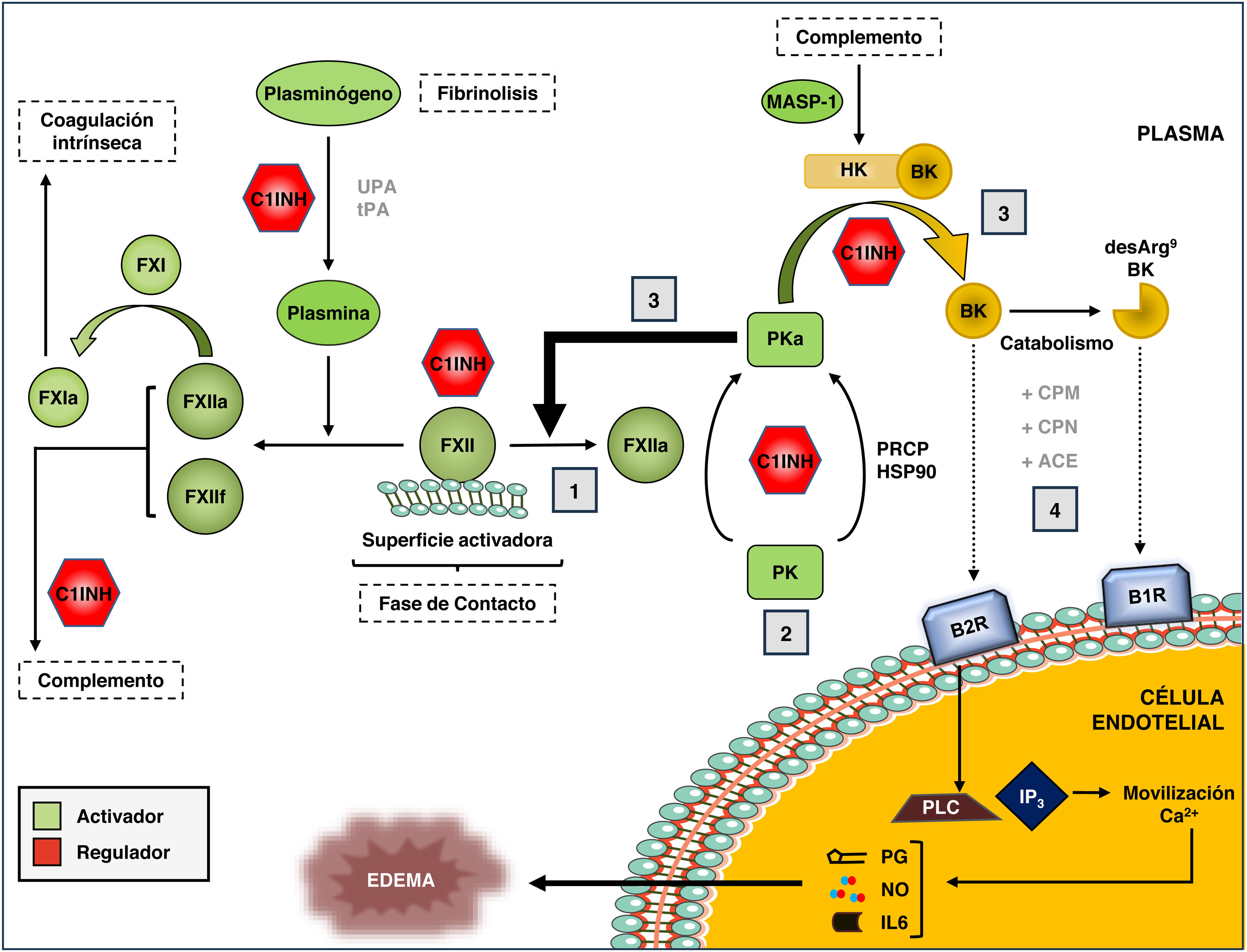
Sistema calicreína-cininaEl SCC es una cascada proteolítica del plasma que se asocia con la activación de rutas proinflamatorias y procoagulantes (fig. 2)20. Está compuesto por los zimógenos factor XI (FXI) y factor XII (FXII) de la coagulación, por la precalicreína (PK), y por el sustrato y cofactor cininógeno de alto peso molecular (HK). El SCC se puede activar a través de la vía de contacto, en la que la unión del FXII a superficies con carga neta negativa promueve cambios conformacionales que resultan en su proteólisis parcial para generar la proteasa FXIIa21,22. La activación por contacto se puede iniciar en respuesta a una variedad de moléculas biológicas (polifosfatos, proteínas agregadas o mal plegadas, péptido β amiloide, etc.) o a superficies artificiales (vidrio, dextrán sulfato, kaolina, etc.).
Sistema calicreína-cinina (SCC) de la coagulación sanguínea.
Se muestran los componentes y las principales vías de activación del SCC, así como su conexión con el proceso de fibrinólisis, la coagulación intrínseca y el sistema del complemento.
(1) La fase de contacto del SCC está mediada por la interacción del Factor XII de la coagulación (FXII) con superficies con carga neta negativa, y la posterior generación del FXII activado (FXIIa). (2) El FXIIa, a su vez, activa la precalicreina (PK) a calicreina activa (PKa), aunque esta también se puede activar de forma no canónica a través de la prolil-carboxipeptidasa P (PRCP) o de la Heat Shock Protein 90 (HSP90). (3) Una vez generada, PKa puede activar más moléculas de FXII (feedback positivo) o actuar sobre el sustrato cininógeno de alto peso molecular (HK), generando las cininas bradicinina (BK) y su derivado, las des-Arg9-BK. (4) La unión de estas cininas a sus receptores específicos (B1R para des-Arg9-BK, y B2R para BK) inicia una cadena de señalización intracelular asociada al desarrollo de edema, con movilización de las reservas de Ca2+, activación de fosfolipasa C (PLC) e inositol trifosfato (IP3), y liberación de los mediadores secundarios prostaglandina (PG), óxido nitroso (NO) e interleucina 6 (IL6). Todas las etapas están controladas por el C1-inhibitor, que también regula el complemento. MASP-1: MBL-Associated Serine Protease 1.
El FXIIa puede proteolizar 2 sustratos distintos dentro del SCC: FXI y PK. La proteólisis de FXI a su forma activa (FXIa) inicia la rama intrínseca de la cascada de la coagulación, por lo que se utiliza en ensayos diagnósticos de la capacidad coagulante, como el tiempo parcial de tromboplastina activada (aPTT). Por otro lado, FXIIa actúa sobre PK y genera calicreína plasmática (PKa). La PKa puede, a su vez, activar más moléculas de FXII a FXIIa, en un bucle de retroalimentación positivo que aumenta significativamente la activación del SCC, o proteolizar HK para liberar la cinina bradicinina (BK), que es un péptido de 9 aminoácidos (Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg)23.
La BK es un autacoide (mediador celular local) con una potente actividad vasodilatadora dependiente de endotelio, que causa edema, enrojecimiento y calor local. La BK ejerce sus efectos biológicos a través de su unión al receptor de membrana B2R, que se expresa de forma constitutiva en células endoteliales, músculo liso, neuronas sensoriales y células epiteliales24. La unión de BK al receptor B2R inicia una cadena de reacciones intracelulares que incluye la activación de fosfolipasa C e inositol trifosfato, la movilización de reservas de calcio y la liberación de mediadores secundarios, como el óxido nítrico, prostaglandinas, interleukina 6 y el activador tisular del plasminógeno. El tejido endotelial tratado con BK experimenta contracción del músculo liso y rotura de las uniones de las caderinas vasculares, provocando extravasación de fluidos y edema local25.
In vivo, BK tiene una vida media corta (∼30 s) y efectos transitorios sobre el endotelio. Por un lado, BK se cataboliza rápidamente en fase fluida por acción de las metaloproteasas carboxipeptidasa M (CPM) y carboxipeptidasa N (CPN, kininasa 1); estas metaloproteasas liberan la arginina en posición C-terminal del BK y generan el octapéptido des-Arg9-BK (Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe), que es posteriormente escindido por la enzima convertidora de angiotensina (ACE, kininasa 2) en péptidos de menor tamaño y sin actividad cinina26. Por otro lado, la estimulación persistente del receptor B2R promueve su desensibilización mediante mecanismos de fosforilación y endocitosis, limitando la señalización intracelular y los efectos vasodilatadores de BK al rango de minutos-horas. El péptido des-Arg9-BK también posee una potente actividad de tipo cinina a través de su unión al receptor inducible B1R27, que se expresa en células endoteliales en respuesta a daño tisular o a la presencia de citoquinas proinflamatorias. A diferencia de B2R, B1R no se fosforila y es relativamente resistente a la desensibilización por unión a su ligando, por lo que tiene una vida media y una capacidad de señalización intracelular relativamente largas, en el rango de horas-días28.
La activación del SCC está controlada por 3 proteínas plasmáticas: C1-inhibidor (C-1INH), alfa-2-macroglobulina (A2M) y antitrombina III (AT)29,30. C1-INH, capaz de regular también la vía clásica del complemento, es el principal regulador plasmático de FXIIa, con una contribución menor de la AT. A su vez, C1-INH y A2M son responsables de más del 90% de la regulación de PKa en plasma. En conjunto, C1-INH ejerce un papel predominante en la regulación del SCC al inhibir simultáneamente a FXIIa, PKa y FXIa31. Por otra parte, aunque la activación mediada por contacto (a través de FXII) es la forma mejor estudiada de activación del SCC, el sistema puede iniciarse por diversas vías no canónicas. Estas incluyen la proteólisis de FXII por plasmina32, la activación de PK por la prolil-carboxipeptidasa P (PRCP)33, la proteólisis de HK por la serín-proteasa asociada a MBL (MASP-1) del sistema del complemento34, y la activación conformacional de FXII por la chaperona heat-shock protein 90 (HSP90)35,36. Sin embargo, la relevancia fisiológica de estas formas alternativas de activación del SCC es prácticamente desconocida.
Evidencias de la implicación del sistema calicreína-cinina en la fisiopatología renalLos componentes proteolíticos del SCC se sintetizan mayoritariamente en el hígado y no hay pruebas de su expresión en tejidos renales en condiciones normales. A pesar de ello, varias líneas de evidencia sugieren que la señalización mediada por cininas juega un papel complejo en el contexto de la biología renal. En primer lugar, los receptores B1R y B2R se expresan notablemente tanto en riñón como en vejiga37, lo que indica su implicación en la función renal. Por otro lado, estudios «in vivo» en modelos caninos han demostrado que la infusión de BK produce diuresis y natriuresis, sin alteración de la tasa de filtración glomerular. Este fenómeno, que va acompañado por la activación de la proteína quinasa C y la liberación de Ca2+ intracelular, está mediado por el receptor B2R y puede reproducirse experimentalmente mediante la administración de inhibidores de ACE (enalapril). Estos datos sugieren que BK participa en la reabsorción de agua por parte de las células proximales del túbulo renal38,39.
En la progresión hacia enfermedad renal terminal (ERT), la interacción BK-B2R reduce la fibrosis túbulo-intersticial inhibiendo la expresión de PAI-1 en células epiteliales tubulares y aumentando en consecuencia la degradación de componentes de la matriz extracelular mediada por plasmina y metaloproteasas40. Además, en estudios familiares sistemáticos de los pacientes con ERT se ha observado un aumento significativo del alelo minoritario de un polimorfismo en el exón 2 de B2R (c.C181T)41, que se ha asociado con una menor edad al inicio42. Los efectos de la interacción BK-B2R contrastan con los que se han observado en la interacción des-Arg9-BK-B1R. Así, en modelos murinos de glomerulonefritis segmentaria y focal (GSF), tanto la sobrexpresión farmacológica de B1R como la administración de des-Arg9-BK se asocian con el progreso de la enfermedad, y se manifiestan por aumento de la albuminuria y el cociente creatinina/proteína total en orina, y por la pérdida de función de los podocitos. En la misma línea, el tratamiento con des-Arg9-[Leu8]-BK, antagonista de B1R, confiere protección frente a la podocitopatía que caracteriza a la GSF43.
El SCC también está implicado en el desarrollo del daño renal en los pacientes con nefropatía diabética, en los que niveles altos de PK en plasma se asocian con un mayor grado de albuminuria44. En modelos murinos de esta enfermedad se ha demostrado que BK modifica el patrón de expresión génica de los podocitos hacia un fenotipo antiapoptótico y proinflamatorio, y que la deficiencia de B2R atenúa el daño glomerular y tubular45,46. Por último, un estudio muy reciente muestra que el SCC está activado o alterado en el plasma de los pacientes de enfermedad renal crónica (ERC), independientemente de si se encuentran o no en tratamiento de diálisis47.
En condiciones fisiológicas, el SCC está en equilibrio con el sistema renina-angiotensina aldosterona (SRAA), ya que ambos tienen efectos antagónicos sobre la presión sanguínea y el balance de electrolitos en el organismo. Ante una situación de hipotensión e hiponatremia, las células yuxtaglomerulares del riñón segregan la hormona renina, que hidroliza el angiotensinógeno plasmático y libera su decapéptido N-terminal, la angiotensina I, iniciando una serie de reacciones enzimáticas que desembocan en la secreción de aldosterona por la corteza suprarrenal, y que tienen un potente efecto vasoconstrictor y de reabsorción de agua y electrolitos. Existen diversas evidencias moleculares de la interacción entre el SCC y el SRAA, que tiene lugar a varios niveles48,49. En primer lugar, la ACE, que degrada la BK generada por el SCC, también es responsable de la formación de la principal molécula efectora del SRAA, la angiotensina II. La PKa, por su parte, puede activar la prerenina y proteolizar el angiotensinógeno, generando directamente angiotensina II. A otro nivel, el receptor BR2 de la BK puede formar heterodímeros con el receptor AT1, al que se unen algunos de los péptidos generados a partir de la angiotensina I, y quizá también con el receptor AT2. Estas y otras observaciones justifican molecularmente la repercusión de determinadas alteraciones del SCC en el normal funcionamiento del SRAA, de manera que la pérdida del equilibrio entre ambos sistemas puede tener consecuencias patológicas a nivel renal, que no son objeto de esta revisión.
Importancia fisiopatológica de la interacción entre el complemento y el sistema calicreína-cininaEl complemento y el SCC comparten una serie de importantes características funcionales. En primer lugar, ambos sistemas se encuentran fisiológicamente en «standby» porque las proteasas que los integran se sintetizan en forma de zimógenos inactivos. La activación conlleva una serie de reacciones proteolíticas que progresan secuencialmente «en cascada» y a través de las cuales se manifiestan sus funciones biológicas. Por otro lado, los zimógenos que participan en el inicio de la cascada de activación del complemento y del SCC tienen cierta capacidad de autoactivarse conformacionalmente en respuesta a determinados estímulos, y adquirir niveles basales de actividad enzimática. Este fenómeno se manifiesta especialmente en la proenzima C1r de la VC del complemento, que experimenta una reorganización conformacional cuando el complejo macromolecular C1 del que forma parte (C1q-C1r2-C1s2) se une a inmunocomplejos o a patrones moleculares asociados a patógenos6. De manera análoga, el FXII, homólogo funcional de C1r en el SCC, sufre un proceso autocatalítico que genera FXIIa cuando interactúa con superficies aniónicas50.
Numerosas investigaciones muestran que existen fenómenos de transactivación entre el complemento, el SCC, la fibrinólisis y la coagulación sanguínea (tabla 1). En este contexto, se ha observado que las condiciones que promueven la liberación de trombina y la subsiguiente activación de la fibrinólisis en los focos de coagulación, pueden facilitar la activación de algunos componentes del sistema del complemento. Así, en modelos in vitro, FIXa, FXa, FXIa, Pka, trombina y plasmina proteolizan C3 y C5 y generan las anafilotoxinas C3a y C5a, que son capaces de inducir respuestas de quimioatracción dosis-dependientes en una línea celular de mastocitos51–53. La actividad de estas proteasas del SCC desempeña por tanto un papel crucial en la activación del complemento, amplificando la respuesta inflamatoria a través de la producción de las anafilotoxinas C3a y C5a.
Efectos del SCC sobre el complemento
| Proteínas del SCC | Proteínas del complemento | Efectos observados | Referencias |
|---|---|---|---|
| FXa, FXIa, PKa, trombina, plasmina | C3 | Generación de C3a y C3b. Aumento de la inflamación y activación de la VA | 49 y 50 |
| FXa, FXIa, PKa, trombina, plasmina | C5 | Generación de C5a y C5b. Aumento de la inflamación y de la lisis por complemento | 48 y 49 |
| PKa y plasmina | Factor B | Generación de Ba y Bb. Aumento de la formación de la convertasa de C3 de la VA | 55 y 56 |
| FXIa | Properdina | Proteólisis de properdina y menor activación de la VA | 58 |
| FXIa, PKa y FXIIa | Factor H | Formación de complejos plasmáticos entre FXIIa y Factor HProteólisis de Factor H, con posible consecuencia funcional | 5960 y 61 |
FXa: FX activado; FXIa: FXI activado; FXIIa: FXII activado; PKa: calicreina activa; VA: vía alternativa.
A otro nivel, tanto la VC del complemento como el SCC están regulados por la proteasa plasmática C1-INH, cuya relevancia fisiológica se manifiesta fundamentalmente en los pacientes con angioedema hereditario por deficiencia de C1-INH (AEH-C1INH; OMIM#106100). El AEH es una enfermedad rara que se caracteriza por la activación local, espontánea y episódica del SCC, el subsiguiente aumento de la permeabilidad vascular con extravasación de plasma y desarrollo de episodios localizados de edema mediado por BK54. Aunque la generación de BK se produce habitualmente por la acción proteolítica de Pka sobre HK, se ha observado que la proteasa MASP-1 de la VL del complemento también puede hidrolizar HK y liberar BK34; de esta forma, el complemento podría contribuir a la regulación local de la permeabilidad vascular y participar en la patogenia de AEH-C1INH55. También se ha demostrado, tanto in vitro como in vivo, que las proteasas MASP-1 y MASP-2 del complemento son capaces de activar la coagulación sanguínea mediante la proteólisis de la protrombina a trombina56,57.
La primera evidencia que respalda la activación de la VA del sistema del complemento a través del SCC se remonta a principios de la década de 1980. En este periodo, 2 estudios independientes demostraron que Pka y plasmina eran capaces de proteolizar el Factor B (FB) en sus fragmentos funcionales Ba y Bb, emulando así la actividad enzimática del Factor D (FD) en la formación de la convertasa de C3 de la VA. Sin embargo, se desconoce la relevancia real de estas interacciones in vivo, ya que, en condiciones fisiológicas, FD es aproximadamente diez veces más eficaz en términos molares que Pka58,59. El SCC también puede tener un efecto modulador sobre la activación de la VA del complemento a través de su interacción con la properdina, que es el único regulador positivo de la VA. La properdina es una glicoproteína plasmática capaz de unirse a la convertasa de C3 e incrementar notablemente su vida media60. La deficiencia de properdina se asocia comúnmente con infecciones meningocócicas recurrentes y con tasas de mortalidad elevadas, debido probablemente a una menor eficacia en la activación de la VA. Recientemente, se ha descrito la interacción de la properdina con FXIa, que puede proteolizarla61. Además, la properdina parece inhibir la autoactivación de FXI sobre superficies con carga negativa, lo que sugiere que ambas proteínas podrían establecer un equilibrio dinámico con implicaciones fisiológicas en el contexto de enfermedades inflamatorias y trombóticas.
Una evidencia mucho más reciente de la interacción entre la VA del complemento y el SCC implica al regulador del complemento FH. La activación del SCC en plasma da lugar a la formación de complejos entre FH y la proteasa FXIIa en los que FXIIa conserva su capacidad proteolítica, aunque se desconoce si la actividad de FH se ve afectada62. Por otro lado, un estudio «in vitro» ha mostrado que Pka y FXIa pueden proteolizar FH en su dominio SCR6, dividiendo la molécula en 2 fragmentos de distinto tamaño que permanecen unidos por enlaces disulfuro, y que, aparentemente, regulan el complemento con menor eficacia63,64. Este proceso proteolítico también podría afectar a la capacidad de FH para unirse a moléculas de glicosaminoglicanos/heparán sulfato de las superficies celulares propias, alterando su capacidad para limitar la activación del complemento sobre las mismas y contribuyendo así al desarrollo del SHUa. FH, por su parte, inhibe directamente la generación de FXIa por trombina y FXIIa, lo que sugiere una conexión adicional entre el sistema del complemento y el SCC.
A pesar de las numerosas evidencias de interacción entre el SCC y el complemento, y entre el SCC y otros sistemas fisiológicos, prácticamente todos los fármacos desarrollados frente al SSC se dirigen al tratamiento del angioedema hereditario. En los últimos años, no obstante, el interés en este campo ha ido creciendo y actualmente hay varias moléculas en fase de estudio clínico o preclínico65. A nivel de enfermedad renal, un ensayo clínico sobre el uso del C1INH en el tratamiento del rechazo agudo mediado por anticuerpos (Takeda, Shire66,67); se interrumpió a los 36 meses al no observarse una mejoría significativa respecto al placebo, aunque un análisis ad hoc a largo plazo mostraba una menor incidencia de la glomerulopatía asociada al injerto. Otro estudio sí observó un efecto beneficioso del C1INH, al disminuir el daño isquemia-perfusión tras el trasplante y el retraso en la función del injerto68. También se está probando una calicreína-1 tisular recombinante (DM199) para el tratamiento de la preeclampsia y en los pacientes diabéticos con ERC, con objeto de enlentecer la progresión de la enfermedad renal y frenar la proteinuria (DiaMedica Therapeutics69,70).
En resumen, el complemento interacciona con el SCC a distintos niveles que aún no se conocen en detalle, pero la activación cruzada entre ambos sistemas podría resultar en una exacerbación de los procesos inflamatorios y trombóticos asociados a algunas enfermedades renales. Aunque la evidencia actual es muy limitada, es posible que en el futuro la modulación farmacológica del SCC abra un horizonte de nuevas posibilidades terapéuticas que permitan reducir las recidivas y mejorar los resultados a largo plazo en los pacientes.
FinanciaciónEl trabajo ha sido financiado por el Instituto de Salud Carlos III (ISCIII) y el Fondo Europeo de Desarrollo Regional (proyecto PI22/00211 a PS-C) y por la Comunidad Autónoma de Madrid (complemento III-CM; P2022/BMD-7278).
F.C. tiene un contrato cofinanciado por la Fundación Senefro (http://www.senefro.org/; Ayudas de Investigación 2022), la Asociación Española de Lipodistrofias (AELIP), y el IdiPAZ (Beca Luis Álvarez 2024).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosAgradecemos a la Dra. Margarita López Trascasa y a Rosario García Sánchez, del grupo IdiPAZ «Alteraciones del Complemento en Patología Humana», la lectura crítica del manuscrito.





![Defectos del complemento en el síndrome hemolítico-urémico atípico (SHUa). Esquema general de funcionamiento del complemento, que puede activarse por 3 vías: alternativa, clásica y lectinas, dependiendo del patógeno o la molécula implicados. Esta activación genera unos complejos enzimáticos denominados C3 convertasas porque activan el componente C3, el más importante para el funcionamiento del complemento. Los componentes activadores, los componentes reguladores y las convertasas de C3 y de C5 se resaltan en colores diferentes. Las convertasas de la vía alternativa se estabilizan por la properdina (P). Las proteínas factor H-related proteins (FHRs) podrían actuar como activadores y/o reguladores del complemento. En muchos pacientes de SHUa el funcionamiento de la vía alternativa está alterado por la existencia de mutaciones en componentes activadores (C3 y Factor B) o reguladores (Factor H, Factor I, membrane cofactor protein [MCP]/CD46), autoanticuerpos anti-FH circulantes, o a consecuencia de reordenamientos genéticos anómalos que implican al Factor H y a las proteínas FHRs. El resultado global es una hiperactivación o una hiporegulación del complemento que permite que se active la vía lítica y dañe directamente a la célula endotelial. C1INH: C1-inhibitor; C4BP: C4b-binding protein; CR1: complement receptor 1; DAF: decay accelerating factor; MBL: Mannan-Binding Lectin; MASP-1: MBL-Associated Serine Protease 1; MASP-2: MBL-Associated Serine Protease 2. Defectos del complemento en el síndrome hemolítico-urémico atípico (SHUa). Esquema general de funcionamiento del complemento, que puede activarse por 3 vías: alternativa, clásica y lectinas, dependiendo del patógeno o la molécula implicados. Esta activación genera unos complejos enzimáticos denominados C3 convertasas porque activan el componente C3, el más importante para el funcionamiento del complemento. Los componentes activadores, los componentes reguladores y las convertasas de C3 y de C5 se resaltan en colores diferentes. Las convertasas de la vía alternativa se estabilizan por la properdina (P). Las proteínas factor H-related proteins (FHRs) podrían actuar como activadores y/o reguladores del complemento. En muchos pacientes de SHUa el funcionamiento de la vía alternativa está alterado por la existencia de mutaciones en componentes activadores (C3 y Factor B) o reguladores (Factor H, Factor I, membrane cofactor protein [MCP]/CD46), autoanticuerpos anti-FH circulantes, o a consecuencia de reordenamientos genéticos anómalos que implican al Factor H y a las proteínas FHRs. El resultado global es una hiperactivación o una hiporegulación del complemento que permite que se active la vía lítica y dañe directamente a la célula endotelial. C1INH: C1-inhibitor; C4BP: C4b-binding protein; CR1: complement receptor 1; DAF: decay accelerating factor; MBL: Mannan-Binding Lectin; MASP-1: MBL-Associated Serine Protease 1; MASP-2: MBL-Associated Serine Protease 2.](https://static.elsevier.es/multimedia/02116995/0000004500000008/v1_202509300436/S0211699525000578/v1_202509300436/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)





