La fluidoterapia intravenosa es un tratamiento ampliamente utilizado en pacientes pediátricos hospitalizados. El objetivo del estudio fue analizar las complicaciones asociadas al uso de sueros isotónicos de mantenimiento en pacientes hospitalizados y comparar la frecuencia de aparición de estas complicaciones con distintos ritmos de administración.
Materiales y métodosSe realizó un estudio observacional y prospectivo, en el que se incluyeron pacientes hospitalizados de entre tres meses y 15 años de edad que recibieron tratamiento con fluidoterapia isotónica 0,9% con glucosa al 5% durante las primeras 24 horas de ingreso. Se dividieron en dos cohortes según el ritmo de fluidoterapia: restringido<100% vs. no restringido cercano al 100% necesidades basales (NNBB), calculadas según la regla de Holliday y Segar. Se recogieron variables clínicas y analíticas en dos tiempos de estudio (T0 al ingreso y T1 a las 24 horas de la fluidoterapia). Se realizó un estudio uni y multivariante para identificar factores de riesgo de complicaciones.
ResultadosSe incluyeron 84 pacientes, de los cuales 33 recibieron fluidoterapia restringida y 51 pacientes con 100% NNBB. Las principales complicaciones desarrolladas en las primeras 24 horas fueron hipercloremia> 110 mEq/L (16,6%) y edemas (19%). La aparición de edemas fue más frecuente en pacientes de menor edad (p <0,01) y la hipercloremia se asoció con el desarrollo de edemas (OR 1,73 [1,0-3,8]), p=0,06.
ConclusionesLa administración de sueros isotónicos no está exenta de complicaciones, probablemente relacionadas con el ritmo de administración y más frecuentes en lactantes. Son necesarios estudios que revisen las necesidades de líquidos en niños hospitalizados.
Maintenance intravenous fluids are frequently used in hospitalised paediatric patients. The aim of the study was to describe the adverse effects of isotonic fluid therapy in hospitalised patients, and its prevalence based on the rate of infusion.
Materials and methodsA prospective clinical observational study was designed. We included hospitalised patients between 3 months-old and 15-years-old were included with 0.9% isotonic solutions with 5% glucose within the first 24h of administration. They were divided into two groups, depending on the quantity of liquid they received (restricted<100% vs. 100% maintenance needs). Clinical data and laboratory findings were recorded in two different times (T0 when they were admitted to hospital and T1 within the first 24h of administration).
ResultsThe study included 84 patients, 33 received <100% maintenance needs and 51 patients received around 100%. The main adverse effects notified in the first 24h of administration were hyperchloremia>110mEq/L (16.6%) and oedema (19%). Oedema was more frequent in patients with lower age (p<0.01). The hyperchloremia at 24h of intravenous fluids was an independent risk factor of developing oedema (OR 1.73 [1.0–3.8], p=0.06).
ConclusionsThe use of isotonic fluids is not free from adverse effects, probably related to the rate of infusion and more likely to appear in infants. It is necessary more studies that review the correct estimation of intravenous fluid needs in hospitalised children.
La fluidoterapia intravenosa es un tratamiento frecuente en las plantas de hospitalización de Pediatría, tanto para rehidratación intravenosa como para el mantenimiento de las necesidades hidroelectrolíticas1,2. Debe utilizarse con precaución y considerarse como un medicamento, en el que tanto la composición del suero (isotónico o hipotónico) como el volumen o ritmo en el que se administra deben ajustarse a las características de cada paciente3. La mayoría de los estudios se centran en recomendar una tonicidad adecuada para los fluidos, pero existen muy pocos artículos que evalúen el adecuado ritmo de administración de los sueros de mantenimiento.
Las guías de práctica clínica de la Academia Americana de Pediatría de 2018 recomiendan para la fluidoterapia de mantenimiento el uso de fluidos isotónicos con los aportes apropiados de potasio y glucosa de forma generalizada en pacientes entre los 28 días y los 18 años de edad, cambiando así el paradigma previo del uso de sueros hipotónicos en pediatría2. El motivo principal de este cambio fue evitar las complicaciones asociadas al uso de los sueros hipotónicos, principalmente la hiponatremia iatrogénica, con riesgo de edema cerebral y morbimortalidad asociados2,4. Sin embargo, existe poca literatura sobre la seguridad del uso de forma generalizada de sueros isotónicos, en las plantas de pediatría, en pacientes estables y no postquirúrgicos5–12.
El objetivo de este estudio fue analizar las complicaciones asociadas al uso de sueros isotónicos de mantenimiento en pacientes que ingresaron en plantas de hospitalización pediátrica y comparar si las complicaciones dependían o no del ritmo de administración.
Materiales y métodosSe diseñó un estudio observacional y prospectivo desde octubre de 2018 a septiembre de 2019. Se incluyeron aquellos pacientes ingresados en la planta de Hospitalización Pediátrica de un hospital terciario que ingresaron con fluidoterapia intravenosa de mantenimiento con suero salino isotónico (0.9%) con glucosa al 5% (suero glucosalino 5%). Este suero contiene 154 mEq/L de cloruro sódico y 50 g/L de glucosa con una osmolaridad teórica de 586 mOsm/L.
Los pacientes se dividieron en dos cohortes en función del ritmo de fluidoterapia: una primera cohorte con pacientes con ritmos restringidos y una segunda cohorte un ritmo no restringidos cercano al 100% de sus NNBB calculadas según la regla de Holliday y Segar13. La decisión del ritmo de fluidoterapia con la que ingresaron los pacientes se tomó según la práctica clínica habitual del médico que atendió al paciente en el momento del ingreso.
Los criterios de inclusión fueron: edad entre tres meses y 15 años, tratamiento con suero glucosalino al 5% sin cambios en el ritmo en las primeras 24 horas y firma del consentimiento informado para la recogida anónima de datos.
Se excluyeron pacientes que presentaban, antes de la fluidoterapia iv, deshidratación secundaria a gastroenteritis aguda, edemas, hipertensión arterial, alteraciones en el sodio en la analítica sanguínea al ingreso, pacientes con patología de base que dificultase el manejo de líquidos (patología cardiaca, renal, hepática, oncológica e insuficiencia adrenal) y pacientes en estado crítico o postoperatorios quirúrgicos. Se excluyeron también pacientes menores de tres meses dado que en estos pacientes algunos autores recomiendan el uso de sueros hipotónicos11,12.
Se registró el diagnóstico con el que ingresó el paciente y la ingesta que presentaba el paciente antes y durante el tiempo que recibía la fluidoterapia.
Se consideraron dos tiempos de estudio: T0 en el momento del ingreso (previo al inicio de la fluidoterapia) y T1 a las 24 horas de la hidratación iv.
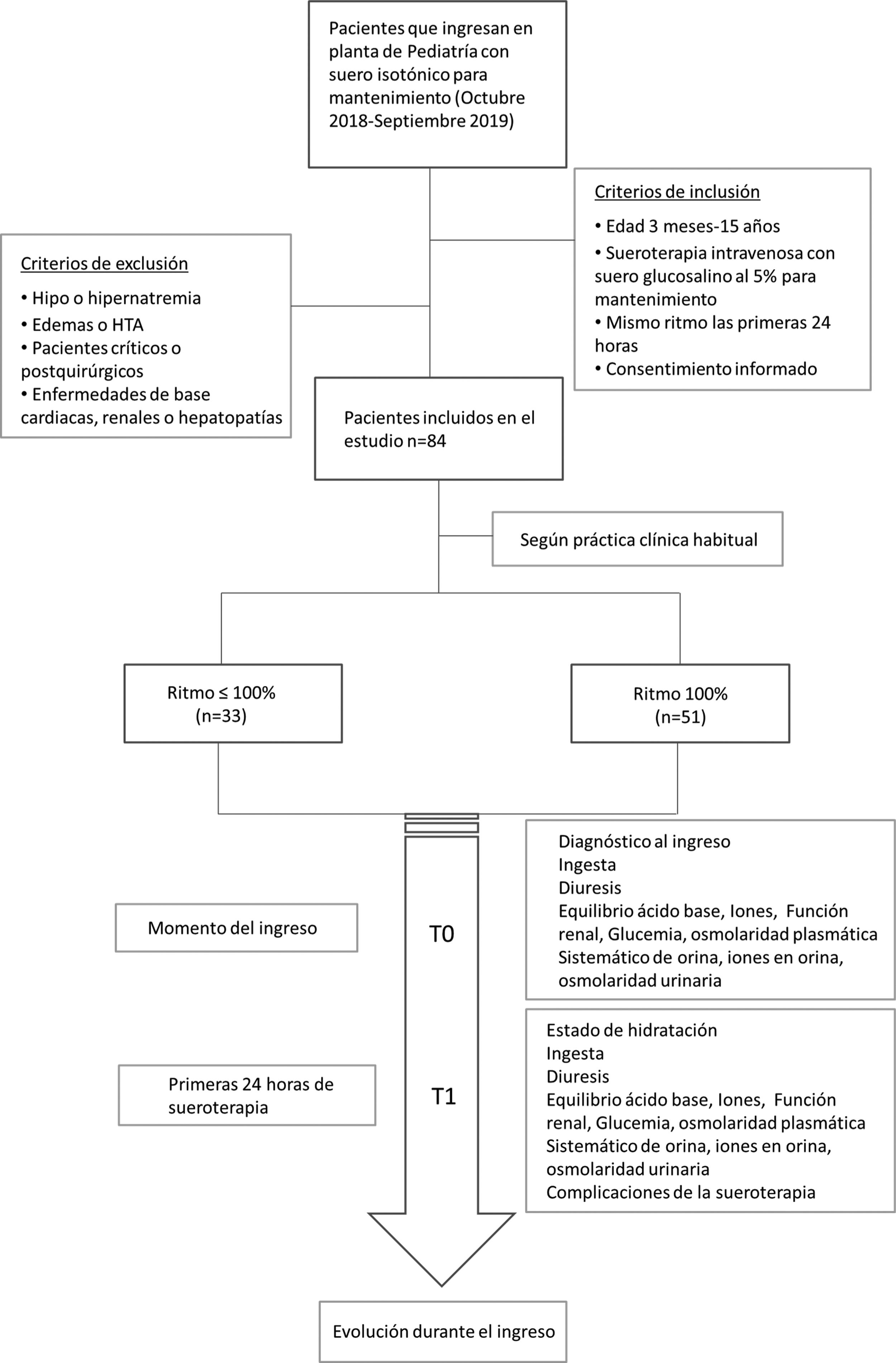
Se registraron variables clínicas (diuresis, ingesta, hidratación, edemas, peso) y variables analíticas en los dos tiempos del estudio: gasometría venosa (pH, bicarbonato), función renal, iones, osmolaridad plasmática, analítica de orina (osmolaridad, iones en orina). La función renal del paciente se valoró según el filtrado glomerular estimado con la fórmula de Schwartz ajustado a la talla14 y se consideró daño renal cuando el paciente presentaba una creatinina mayor de 1,5 veces el valor normal para su edad, según la clasificación de pRIFLE15. Se recogieron las complicaciones presentadas en las primeras 24 horas de la fluidoterapia, así como la evolución del paciente hasta el alta (fig. 1).
El análisis estadístico se realizó mediante el programa estadístico SPSS (IBM SPSS Statistics, Armonk, NY) versión 25.0. Las variables cuantitativas se expresaron como mediana y rango intercuartílico. Las variables cualitativas se expresaron como porcentajes. Para comparar las variables cualitativas se utilizó el test de Fisher y para las variables cuantitativas la U de Mann Whitney y el test de Kruskall Wallis. Para valorar los factores que podrían condicionar la presencia de complicaciones (edemas) se construyeron varios modelos probabilísticos de regresión logística, en los que se incluyeron como covariables todas las variables cercanas a la significación estadística (p<0,2) y las clínicamente relevantes. Los resultados se expresaron en el modelo de regresión logística como OR y CI 95%. Como criterios de selección y comparación entre los modelos de regresión logística se utilizaron los índices de Akaike (AIC) y el Bayesian information criteria (BIC). El modelo elegido fue aquel con menor valor de AIC y BIC.
Para evaluar la presencia de hipercloremia se realizó un estudio de regresión lineal cuya variable dependiente fue la cloremia en T1 y las variables independientes fueron la edad, el ritmo de goteo, el filtrado glomerular y la glucemia al inicio de la fluidoterapia. Los resultados se expresaron como coeficientes t, β y valor de p. Se descartó colinealidad en todos los modelos. Se consideró estadísticamente significativa una p<0,05. El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Gregorio Marañón (Código 266/18) y todos los pacientes o sus familias firmaron el consentimiento informado.
ResultadosAnálisis de la muestra globalAnálisis descriptivo de la muestraDurante el tiempo de estudio se incluyeron a 84 pacientes. La mediana de edad fue de 4,5 (1-13) años y el 56% de los pacientes eran varones. La estancia media fue de 4 (2,2-6,5) días. El 23% de la muestra tenía antecedentes personales de interés, en su mayoría antecedentes neurológicos (parálisis cerebral infantil, retraso psicomotor, etc.). En cuanto al diagnóstico clínico al ingreso, el 31% eran pacientes con patología digestiva que precisaban dieta absoluta (dolores abdominales sin pérdidas digestivas), 31% patología infecciosa y 18% patología respiratoria que impedía la ingesta oral.
Análisis según el ritmo de fluidoterapiaDe los 84 pacientes enrolados, el 39,3% recibieron fluidoterapia restringida a menos 100% de NNBB y el resto (60,7%) tenían ritmos cercanos al 100% de sus NNBB. Los pacientes con <100% de NNBB tenían una mediana de ritmo del 75% (50-80%) de NNBB y el grupo no restringido con mediana 100% (90-100%) de NNBB. La distribución de pacientes según el ritmo se muestra en el gráfico A del material suplementario.
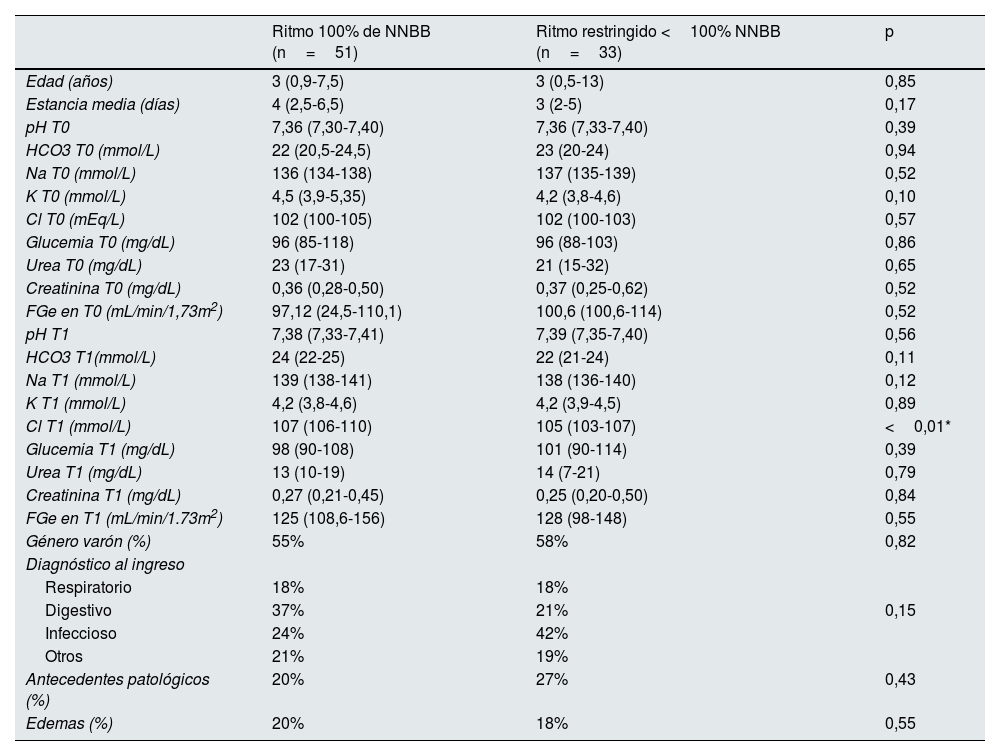
Se compararon las variables clínicas y analíticas de los pacientes según el ritmo de fluidoterapia (tabla 1). Ambos grupos eran comparables en el momento de indicación de la fluidoterapia (T0) en cuanto a la edad, antecedentes personales, diagnóstico al ingreso, función renal y resultados analíticos al ingreso.
Estudio comparativo bivariante de variables clínicas y analíticas de los pacientes en función del ritmo de la sueroterapia intravenosa
| Ritmo 100% de NNBB (n=51) | Ritmo restringido <100% NNBB (n=33) | p | |
|---|---|---|---|
| Edad (años) | 3 (0,9-7,5) | 3 (0,5-13) | 0,85 |
| Estancia media (días) | 4 (2,5-6,5) | 3 (2-5) | 0,17 |
| pH T0 | 7,36 (7,30-7,40) | 7,36 (7,33-7,40) | 0,39 |
| HCO3 T0 (mmol/L) | 22 (20,5-24,5) | 23 (20-24) | 0,94 |
| Na T0 (mmol/L) | 136 (134-138) | 137 (135-139) | 0,52 |
| K T0 (mmol/L) | 4,5 (3,9-5,35) | 4,2 (3,8-4,6) | 0,10 |
| Cl T0 (mEq/L) | 102 (100-105) | 102 (100-103) | 0,57 |
| Glucemia T0 (mg/dL) | 96 (85-118) | 96 (88-103) | 0,86 |
| Urea T0 (mg/dL) | 23 (17-31) | 21 (15-32) | 0,65 |
| Creatinina T0 (mg/dL) | 0,36 (0,28-0,50) | 0,37 (0,25-0,62) | 0,52 |
| FGe en T0 (mL/min/1,73m2) | 97,12 (24,5-110,1) | 100,6 (100,6-114) | 0,52 |
| pH T1 | 7,38 (7,33-7,41) | 7,39 (7,35-7,40) | 0,56 |
| HCO3 T1(mmol/L) | 24 (22-25) | 22 (21-24) | 0,11 |
| Na T1 (mmol/L) | 139 (138-141) | 138 (136-140) | 0,12 |
| K T1 (mmol/L) | 4,2 (3,8-4,6) | 4,2 (3,9-4,5) | 0,89 |
| Cl T1 (mmol/L) | 107 (106-110) | 105 (103-107) | <0,01* |
| Glucemia T1 (mg/dL) | 98 (90-108) | 101 (90-114) | 0,39 |
| Urea T1 (mg/dL) | 13 (10-19) | 14 (7-21) | 0,79 |
| Creatinina T1 (mg/dL) | 0,27 (0,21-0,45) | 0,25 (0,20-0,50) | 0,84 |
| FGe en T1 (mL/min/1.73m2) | 125 (108,6-156) | 128 (98-148) | 0,55 |
| Género varón (%) | 55% | 58% | 0,82 |
| Diagnóstico al ingreso | |||
| Respiratorio | 18% | 18% | |
| Digestivo | 37% | 21% | 0,15 |
| Infeccioso | 24% | 42% | |
| Otros | 21% | 19% | |
| Antecedentes patológicos (%) | 20% | 27% | 0,43 |
| Edemas (%) | 20% | 18% | 0,55 |
NNBB: necesidades basales calculadas según Holliday-Segar.
Los resultados se expresan en medianas con rango intercuantílico (p25-p75)
FGe: filtrado glomerular estimado por ecuación de Schwartz actualizada 2009.
* Valores estadísticamente significativos.
En T1, transcurridas las primeras 24 horas de fluidoterapia, se encontraron diferencias significativas en los dos grupos, con mayores concentraciones plasmáticas mediana de cloro de 107 (106-110) mmol/L vs. 105 (103-107) mmol/L, en los pacientes con sueros no restringidos (100% NNBB), respecto a ritmos restringidos de infusión (p<0,01). (tabla 1).
ComplicacionesLas principales complicaciones de la administración de fluidoterapia isotónica a las 24 horas del ingreso fueron edemas (19%) e hipercloremia en un 16,6%. Ninguno desarrolló hipernatremia>145 mmol/L y sólo un 2,3% hiponatremia leve <135 mmol/L. La hiperglucemia estuvo presente en un 40% y la hiperosmolaridad plasmática (>290 mosm/L) en un 38%.
Un 16,6% de los pacientes presentaron hipercloremia>110 mEq/L (rango 111-119 mEq/L). Un 17,8% tuvieron acidosis (pH<7,35) sin correlación con un descenso del bicarbonato. En T1 existe un menor anion GAP (p=0,04) en probable relación a mayor hipercloremia (p<0,01). (tabla A del material suplementario).
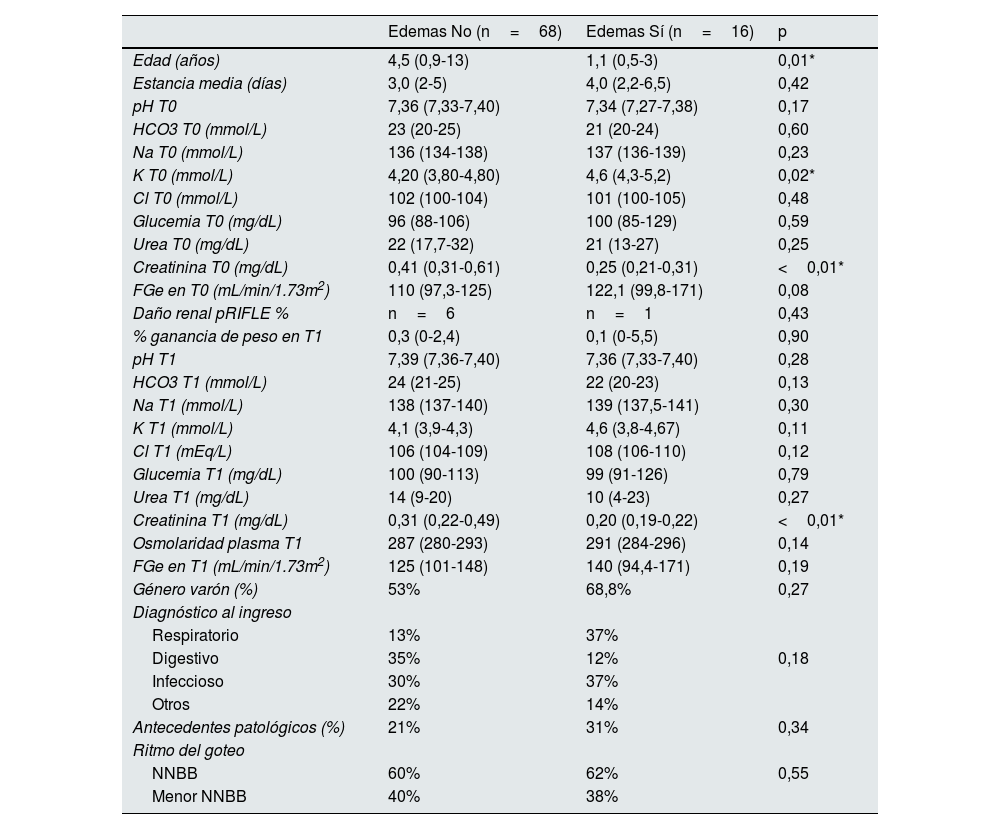
Los pacientes que desarrollaron edemas tenían menor edad comparados con aquellos que no desarrollaron edemas (1,1 vs. 4,5 años [p=0,01]), concentraciones más altas de potasio en T0 (4,6 vs. 4,2 mmol/L, p=0,02) y valores más bajos de creatinina tanto en T0 (0,25 vs. 0,41mg/dL, p<0,01) como en T1 (0,20 vs. 0,31mg/dL, p<0,01). Al analizar el filtrado glomerular estimado (FGe) por talla, se observa que no hay diferencias significativas en la presencia de edemas (tabla 2).
Análisis bivariante de la cohorte general de pacientes en función del desarrollo o no de edemas en las primeras 24 horas de ingreso
| Edemas No (n=68) | Edemas Sí (n=16) | p | |
|---|---|---|---|
| Edad (años) | 4,5 (0,9-13) | 1,1 (0,5-3) | 0,01* |
| Estancia media (días) | 3,0 (2-5) | 4,0 (2,2-6,5) | 0,42 |
| pH T0 | 7,36 (7,33-7,40) | 7,34 (7,27-7,38) | 0,17 |
| HCO3 T0 (mmol/L) | 23 (20-25) | 21 (20-24) | 0,60 |
| Na T0 (mmol/L) | 136 (134-138) | 137 (136-139) | 0,23 |
| K T0 (mmol/L) | 4,20 (3,80-4,80) | 4,6 (4,3-5,2) | 0,02* |
| Cl T0 (mmol/L) | 102 (100-104) | 101 (100-105) | 0,48 |
| Glucemia T0 (mg/dL) | 96 (88-106) | 100 (85-129) | 0,59 |
| Urea T0 (mg/dL) | 22 (17,7-32) | 21 (13-27) | 0,25 |
| Creatinina T0 (mg/dL) | 0,41 (0,31-0,61) | 0,25 (0,21-0,31) | <0,01* |
| FGe en T0 (mL/min/1.73m2) | 110 (97,3-125) | 122,1 (99,8-171) | 0,08 |
| Daño renal pRIFLE % | n=6 | n=1 | 0,43 |
| % ganancia de peso en T1 | 0,3 (0-2,4) | 0,1 (0-5,5) | 0,90 |
| pH T1 | 7,39 (7,36-7,40) | 7,36 (7,33-7,40) | 0,28 |
| HCO3 T1 (mmol/L) | 24 (21-25) | 22 (20-23) | 0,13 |
| Na T1 (mmol/L) | 138 (137-140) | 139 (137,5-141) | 0,30 |
| K T1 (mmol/L) | 4,1 (3,9-4,3) | 4,6 (3,8-4,67) | 0,11 |
| Cl T1 (mEq/L) | 106 (104-109) | 108 (106-110) | 0,12 |
| Glucemia T1 (mg/dL) | 100 (90-113) | 99 (91-126) | 0,79 |
| Urea T1 (mg/dL) | 14 (9-20) | 10 (4-23) | 0,27 |
| Creatinina T1 (mg/dL) | 0,31 (0,22-0,49) | 0,20 (0,19-0,22) | <0,01* |
| Osmolaridad plasma T1 | 287 (280-293) | 291 (284-296) | 0,14 |
| FGe en T1 (mL/min/1.73m2) | 125 (101-148) | 140 (94,4-171) | 0,19 |
| Género varón (%) | 53% | 68,8% | 0,27 |
| Diagnóstico al ingreso | |||
| Respiratorio | 13% | 37% | |
| Digestivo | 35% | 12% | 0,18 |
| Infeccioso | 30% | 37% | |
| Otros | 22% | 14% | |
| Antecedentes patológicos (%) | 21% | 31% | 0,34 |
| Ritmo del goteo | |||
| NNBB | 60% | 62% | 0,55 |
| Menor NNBB | 40% | 38% |
NNBB: necesidades basales calculadas según Holliday-Segar.
FGe: filtrado glomerular estimado por ecuación de Schwartz actualizada 2009.
Los resultados se expresan en medianas con rango intercuantílico (p25-p75)
* Valores estadísticamente significativos.
No hubo diferencias en cuanto a la aparición de edemas, en el porcentaje de niños con daño renal agudo al inicio de la fluidoterapia en ambos grupos, ni diferencias en el cloro, sodio, osmolaridad, glucemia, ingesta del paciente o porcentaje de ganancia de peso a las 24 horas de la fluidoterapia (tabla 2). Los pacientes que tuvieron daño renal tuvieron un promedio de FG de 50,8(mL/min/1,73m2) con rango mínimo de 23 y máximo de 80(mL/min/1,73m2) resuelto en las siguientes 24 horas en probable relación a la situación prerrenal por escasa ingesta oral.
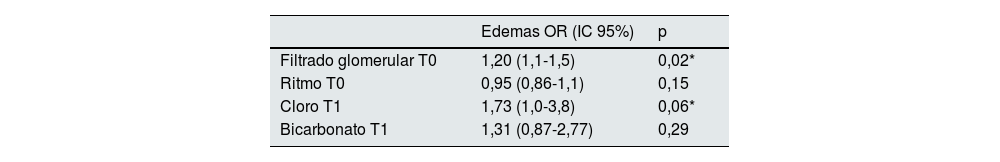
Se realizó un estudio de regresión logística cuya variable dependiente fue el desarrollo de edemas como complicación. Encontramos que valores más elevados de cloro en T1, en las primeras 24 horas de la fluidoterapia se asociaron con el desarrollo de edemas (OR 1,73 [1,0-3,8], p=0,06) (tabla 3), así como valores mayores de FG previo al inicio de fluidoterapia (OR 1,20 [1,1-1,5], p=0,02).
Estudio multivariante para el análisis de factores de riesgo independientes en el desarrollo de edemas en las primeras 24 horas de la sueroterapia. Regresión logística (variable dependiente: edemas)
| Edemas OR (IC 95%) | p | |
|---|---|---|
| Filtrado glomerular T0 | 1,20 (1,1-1,5) | 0,02* |
| Ritmo T0 | 0,95 (0,86-1,1) | 0,15 |
| Cloro T1 | 1,73 (1,0-3,8) | 0,06* |
| Bicarbonato T1 | 1,31 (0,87-2,77) | 0,29 |
R2: 0,66.
* Valores estadísticamente significativos.
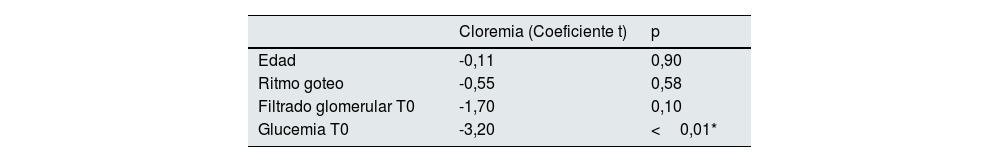
En el análisis de regresión lineal ni el ritmo del goteo ni la edad se asociaron con cifras más elevadas de cloro a las 24 horas de la fluidoterapia (tabla 4).
Estudio multivariante para el análisis de factores de riesgo independientes que influyen en la cloremia analizada a las 24 horas de la sueroterapia. Regresión lineal (variable dependiente: cloremia en T1)
| Cloremia (Coeficiente t) | p | |
|---|---|---|
| Edad | -0,11 | 0,90 |
| Ritmo goteo | -0,55 | 0,58 |
| Filtrado glomerular T0 | -1,70 | 0,10 |
| Glucemia T0 | -3,20 | <0,01* |
R2: 0.30.
Anova del modelo. p<0.01
* Valores estadísticamente significativos.
El principal objetivo de este estudio fue describir las complicaciones asociadas a la utilización generalizada de sueros isotónicos en las plantas de hospitalización de Pediatría en pacientes estables. Casi el 20% de los pacientes que recibieron sueros isotónicos iv de mantenimiento presentaron edemas y un 16.6% hipercloremia, siendo estas cifras muy superiores a las publicadas en estudios previos5. Estas dos principales complicaciones están en probable relación con la administración excesiva de líquidos isotónicos, como se comenta más adelante.
En cuanto a la edad, existe controversia en la literatura acerca de la edad a la que es seguro el uso de sueros isotónicos. En las guías NICE de 20158 se admite su uso desde el nacimiento, pero las guías americanas de pediatría recomiendan su uso a partir del mes de vida2. Otros autores siguen recomendando el uso de sueros hipotónicos en lactantes menores de tres meses o menores de 10kg11,12 en probable relación a una función renal inmadura. En nuestro estudio, los edemas aparecieron con más frecuencia en niños de menor edad. Los valores de creatinina más bajos en pacientes con edemas se correlacionan con la menor edad y no con la función renal, como se confirma en el estudio multivariante.
En lo referente al ritmo de administración de fluidos, la mayoría de los estudios previos en fluidoterapia de mantenimiento no especifican la cantidad de líquidos administrada o usan igualmente la fórmula de Holliday y Segar. Esta fórmula calcula las necesidades de líquidos para metabolizar las calorías diarias cubriendo así las pérdidas insensibles (35%), diuresis (60%) y heces (5%) en condiciones de normalidad, es decir, niños sanos con peso y tallas normales1,13. Durante la hospitalización, todas estas pérdidas pueden variar por lo que esta fórmula podría no reflejar correctamente las necesidades de líquidos de un niño enfermo. No hay estudios previos que evalúen el adecuado ritmo de administración en paciente ingresado por un proceso agudo intercurrente, si bien cada vez hay más autores que cuestionan si la fórmula de Holliday y Segar podría estar sobreestimando las necesidades de líquidos1,16,17.
Un 19% de nuestros pacientes presentaron edemas tras la administración de líquidos isotónicos. La mayoría de los edemas fueron palpebrales y en dorso de las manos, sin mayores consecuencias clínicas en el paciente, resolviéndose en las siguientes 24 horas tras el cambio de composición y ritmo de fluidoterapia. En las guías americanas se hace referencia a la falta de estudios que evalúen la sobrecarga de fluidos, si bien advierten que existe un riesgo de sobrecarga hídrica fundamentalmente en pacientes críticos, con menos estudios en pacientes en plantas de pediatría general2,16,18. Los edemas, por tanto, están poco referenciados en la literatura, con porcentajes de 3,7%5.
A nivel fisiopatológico, los líquidos isotónicos se distribuyen por el compartimento extracelular (plasma e intersticio) por lo que un aporte excesivo produce un aumento del líquido intersticial (edema) o hipertensión arterial1,19–21. Los líquidos hipotónicos, al tener una tonicidad más parecida al agua corporal total (70 mEq/L) se distribuyen por el líquido intersticial, pero también por el compartimento intracelular teniendo más riesgo por tanto de hiponatremia y edema celular1,22,23. En este sentido, si usamos la misma fórmula para el cálculo del ritmo de fluidoterapia pero con líquidos isotónicos, conseguiremos evitar la hiponatremia iatrogénica pero con mayor riesgo de producir edemas e hipercloremia debidos probablemente a una sobrecarga de sodio y cloro.
La hipercloremia secundaria a la administración de líquidos isotónicos se ha documentado en publicaciones previas, fundamentalmente en adultos ingresados en cuidados intensivos24–26. Esta complicación se ha solventado con la utilización de soluciones balanceadas (Plasmalyte®, Ringer®) utilizadas en pacientes quirúrgicos28, pero son necesarios más estudios que analicen su seguridad en pediatría general27,28. La acidosis hiperclorémica tiene riesgo de vasoconstricción renal y disminución de filtrado glomerular, así como aumento de citoquinas proinflamatorias29,30. En nuestro estudio, la hipercloremia a las primeras 24 horas del inicio de la fluidoterapia es un factor de riesgo en el desarrollo de edemas. Los pacientes que presentaron hipercloremia mostraban síntomas clínicos de decaimiento, rechazo de la alimentación y disminución de la diuresis, fundamentalmente, sin evidencia de alteración en el patrón respiratorio o arritmias.
Destaca en nuestra serie el elevado porcentaje de pacientes con hiperglucemia (46%) e hiperosmolaridad (35%) en probable relación a la administración excesiva de glucosa y a la administración de sueros hiperosmolares. Estas complicaciones están relacionadas con la utilización de suero glucosalinos 5% sin poder generalizar a otras soluciones isotónicas como el suero fisiológico 0,9%. La osmolaridad de estos sueros glucosalinos 5% es de 586 mOsm/L, pero teóricamente se debe restar la osmolaridad aportada por la glucosa ya que se metabolizará en los tejidos (especialmente hígado, músculo y tejido graso) por lo que no influiría en la tonicidad según los fabricantes1,2. Sin embargo, este proceso requiere tiempo, y mientras ocurre se produce una liberación osmótica de hormona antidiurética (ADH) que puede justificar la tendencia a ahorrar agua libre y a la aparición de edemas, y además depende del metabolismo del paciente hospitalizado. En nuestro estudio no se ha relacionado la hiperosmolaridad con el riesgo de edemas, pero al menos en teoría, sí podría estar jugando un papel dado que la osmolaridad plasmática es el principal regulador del agua corporal total produciendo una liberación osmótica de ADH que justificaría la aparición de edemas16. Es probable que los pacientes que ingresan, ante la situación de estrés1, tengan menos necesidad de aporte de glucosa por lo que creemos que deberían ajustarse estos aportes no solo a la edad del paciente sino a la situación clínica del mismo.
Otras complicaciones presentes en menor medida fueron las alteraciones del sodio como la hiponatremia (2,3%) en porcentajes similares a estudios previos4,5. En cuanto al riesgo de hiponatremia por el uso de sueros, éste no desaparece del todo por el uso de sueros isotónicos, que podría estar en relación con un aumento de la hormona antidiurética (ADH) secundario a estrés, dolor, problemas respiratorios o infecciones que presentan habitualmente los pacientes durante la hospitalización, por lo que recomendamos nuevamente el uso de sueros isotónicos restringidos de mantenimiento en los ingresos en pediatría general.
Este estudio presenta limitaciones dado que es un estudio unicéntrico, observacional basado en la práctica clínica habitual y no se randomizaron los pacientes, sin embargo, traduce nuestra experiencia real. Otras limitaciones están en relación con la medición de diuresis que se estimó de forma subjetiva por el personal de enfermería. No se recogieron valores de ADH dado que no forma parte de la práctica clínica habitual, por lo que se desconoce el valor de los mismos. Por último, resaltar que las muestras recogidas son venosas, acorde con la práctica clínica en población pediátrica, pero con mayor dispersión en la pCO2, a diferencia de la extracción arterial, por lo que es posible que algunas acidosis sean falsas acidosis respiratorias. Sin embargo, resaltamos que es el primer estudio prospectivo realizado en pacientes ingresados en las plantas de hospitalización pediátrica en nuestro medio.
ConclusionesLa administración de sueros isotónicos no está exenta de complicaciones, probablemente relacionadas con el ritmo de administración. Los niños más pequeños son los que más riesgo de edemas presentan. Es necesaria una monitorización estrecha de los pacientes con fluidoterapia que incluya controles analíticos en las primeras 24 horas y el ajuste del ritmo la ingesta del paciente1,11,12. Son necesarios estudios que revisen las necesidades de líquidos para el cálculo de ritmos en la fluidoterapia de mantenimiento, si bien parece recomendable el uso de ritmos más restringidos cuando se usen sueros isotónicos de mantenimiento, especialmente en lactantes.
- -
Las principales complicaciones de la administración de sueros isotónicos en la fluidoterapia de mantenimiento son los edemas y la hipercloremia.
- -
Estas complicaciones se deben principalmente al ritmo de administración.
- -
Los lactantes son los pacientes con más riesgo de presentar complicaciones asociada al uso de sueros isotónicos.
La realización del presente trabajo no ha contado con fuentes de financiación provenientes de entidades públicas ni privadas, de investigación ni fundaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.