La muestra de referencia para la cuantificación de alfa-1-microglobulina es la orina de 24h, sin embargo, aunque habitualmente se cuantifica en la segunda orina de la mañana, es la orina de primera hora de la mañana la menos influenciada por la tasa de filtración glomerular. Así mismo, existen opiniones contradictorias sobre la influencia de la edad y el sexo en la cuantificación.
Pacientes y métodosSe seleccionaron 434 analíticas de orina, 182 con una tasa de filtrado glomerular entre 4 y 89ml/min/1,73m2 y 252 con un filtrado glomerular >90ml/min/1,73m2. De estas 252, 122 correspondían a orinas de primera hora de la mañana con densidad >1.015 y 130 a orinas de 24h con un volumen de orina entre 400-3.000ml/24h, sin microalbuminuira. De las 122, 30 tuvieron un valor de alfa-1-microglobulina >4,3mg/l y correspondían a pacientes con enfermedades que producen daño tubular. La correlación entre la alfa-1-microglobulina de primera hora de la mañana y de 24h se realizó con 42 orinas, dentro de las 434 seleccionadas, que tenían solicitadas ambas muestras de orina.
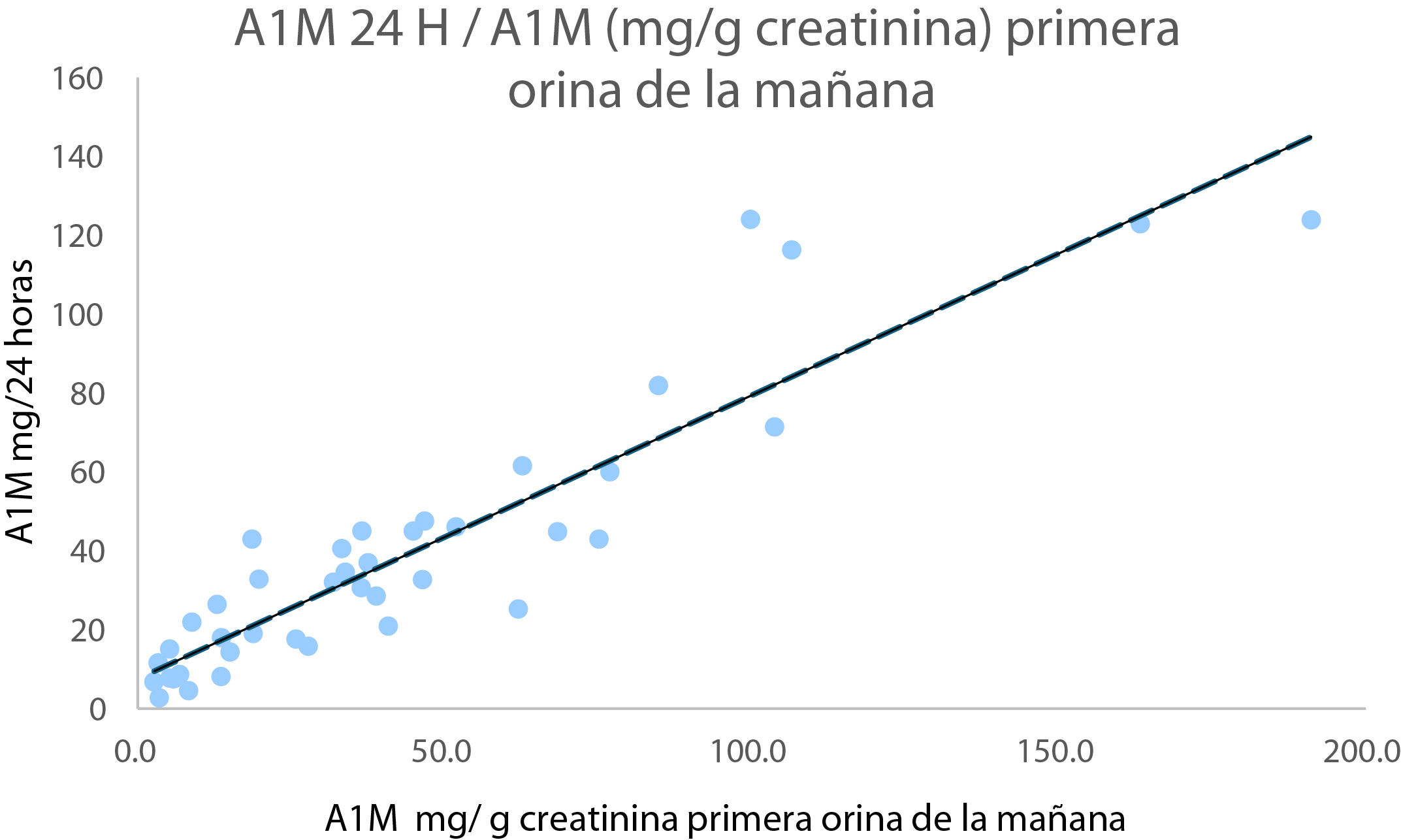
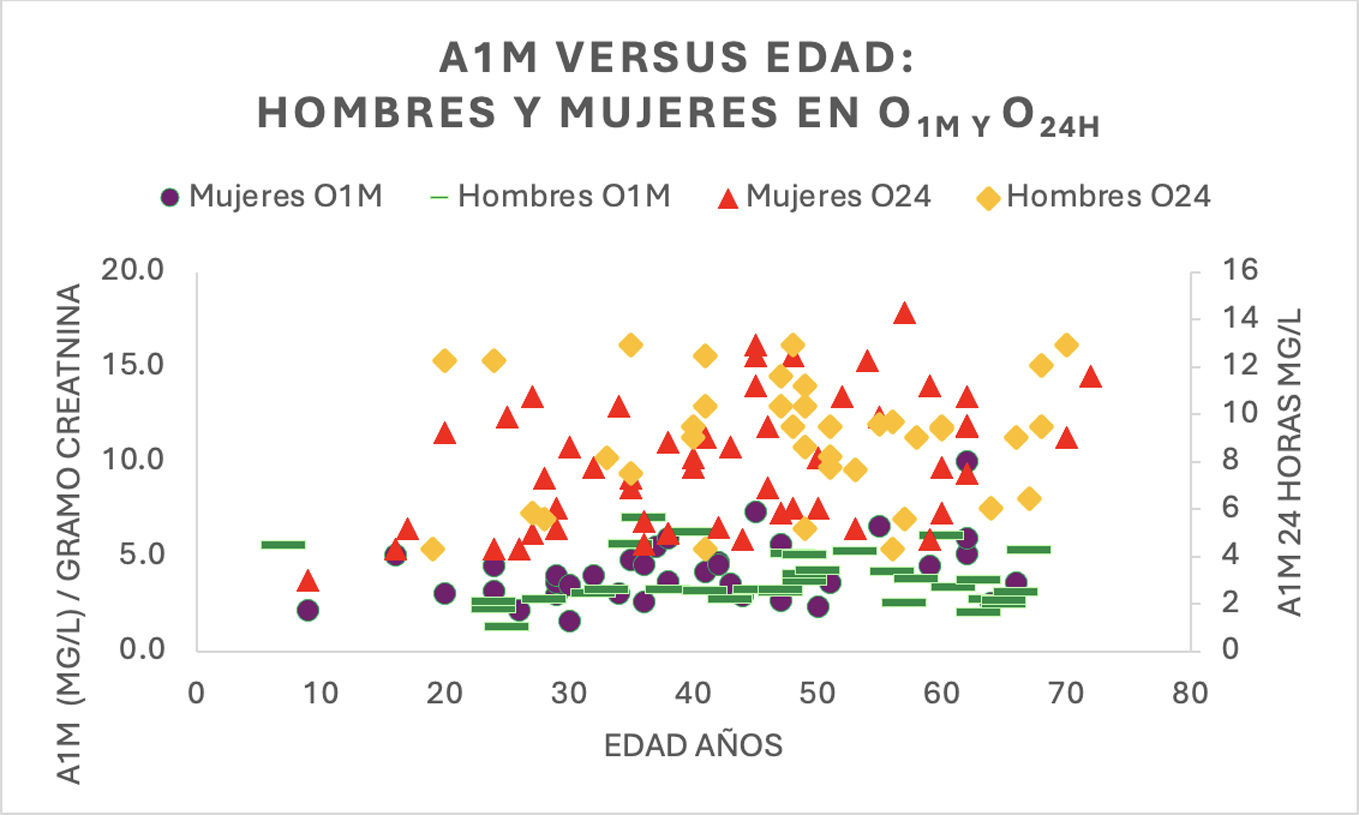
ResultadosLa correlación entre la cuantificación en primera orina de la mañana y de 24h fue de 0,92. No se encontraron diferencias estadísticamente significativas entre alfa-1-microglobulina corregida por creatinina con la edad, ni entre varones y mujeres en las muestras de orina de primera hora de la mañana ni de 24h (p>0,05). El límite superior P97.5 en las personas normales fue de 12,9mg/24h y de 7,08mg/l/g creatinina en primera orina de la mañana. Aproximadamente el 77% de los pacientes con alfa-1-microglobulina corregida por creatinina >7,08 en primera orina de la mañana, sin disminución del filtrado glomerular ni microalbuminuria, eran pacientes con hipertensión o diabetes.
ConclusionesLa primera orina de la mañana es una muestra que se puede utilizar para la cuantificación de alfa-1-microglobulina debido a su buena correlación con la orina de 24h, además de no verse afectada por la edad o el sexo. Una cuantificación >7,08mg/l/g creatinina en primera orina de la mañana nos debe hacer sospechar un inicio de lesión tubular, especialmente en los pacientes hipertensos o diabéticos.
The reference sample for quantifying alpha-1-microglobulin is 24-hour urine. However, although it is usually quantified in the second urine sample of the morning, the first urine sample of the morning is the least influenced by the glomerular filtration rate. Likewise, there are conflicting opinions on the influence of age and gender on quantification.
Patients and methodsA total of 434 urine tests were selected, 182 with a glomerular filtration rate between 4 and 89ml/min/1.73 m2 and 252 with a glomerular filtration rate >90ml/min/1.73 m2. Of these 252, 122 corresponded to first-morning urine samples with a density >1015 and 130 to 24-hour urine samples with a urine volume between 400-3000m/24hours, without microalbuminuria. Of the 122, 30 had an alpha-1-microglobulin value >4.3mg/l and corresponded to patients with diseases that cause tubular damage. The correlation between first morning and 24-hour alpha-1-microglobulin was performed with 42 urine samples, out of the 434 selected, for which both urine samples had been requested.
ResultsThe correlation between the first morning urine and 24-hour urine measurements was 0.92. No statistically significant differences were found between creatinine-corrected alpha-1-microglobulin with age, or between men and women in the first morning urine or 24-hour urine samples (P>.05). The upper limit P97.5 in normal individuals was 12.9mg/24hours and 7.08 mg/l/g creatinine in first morning urine. Approximately 77% of patients with creatinine-corrected alpha-1-microglobulin >7.08 in first morning urine, without decreased glomerular filtration or microalbuminuria, were patients with hypertension or diabetes.
ConclusionThe first urine sample of the morning can be used to quantify alpha-1-microglobulin due to its good correlation with 24-hour urine samples, as well as not being affected by age or gender. A quantification >7.08 mg/l/g creatinine in the first morning urine should raise suspicion of the onset of tubular damage, especially in hypertensive or diabetic patients.
La alfa-1-microglobulina (A1M) es una glicoproteína de 27kDa producida por el hígado1, que se filtra a través del glomérulo y se reabsorbe casi por completo (99%) en los túbulos contorneados proximales, conteniendo la orina muy pequeñas cantidades2. Niveles altos en orina sugieren una lesión tubular proximal3, siendo un evento temprano en la diabetes mellitus, incluso en los pacientes normoalbuminúricos4–7, debido a que el declive de la función renal se correlaciona mejor con el daño del túbulo intersticial que con el de la lesión glomerular8–10.
El método de referencia para cuantificar la proteinuria es en orina de 24h (O24), pero como estas recolecciones resultan engorrosas se utiliza la segunda orina de la mañana. Ahora bien, hay que tener en cuenta que la tasa de filtración gomerular varía a lo largo del día11–13 alterando la concentración de la orina, pero este problema para la A1M puede resolverse relacionándola con la excreción de creatinina11, no obstante, la orina de la primera micción de la mañana (O1M) está menos influenciada por estos factores14 y corrigiéndola con creatinina se correlaciona bien con la cuantificada en O2415.
El valor de normalidad de la A1M en la segunda orina de la mañana que se emplea en la práctica clínica es <12mg/l, independientemente de la edad y el género16,17. Sin embargo, es en esta orina en la que hay una mayor variación entre varones y mujeres14, y la corrección por creatinina tampoco confirma que desaparezcan estas diferencias18–20. Con respecto a la edad sucede lo mismo, hay autores que defienden que es dependiente de la edad18 y otros lo contrario21.
Teniendo en cuenta que de entre las enfermedades que comienzan produciendo daño tubular previo a la insuficiencia renal crónica están la diabetes mellitus (DM) tipo 2 y la hipertensión arterial (HTA), las 2 primeras causas de insuficiencia renal crónica y de entrada en programa de diálisis periódica en España, sería conveniente cuantificar la A1M para poner de manifiesto el daño tubular en una muestra de orina que no se altere su concentración a lo largo del día y sea fácil de recoger por los pacientes.
Es por esto que decidimos evaluar la posibilidad de utilizar la primera orina de la mañana correlacionándola con la orina de 24h, así como estudiar si existen diferencias en los valores de normalidad entre varones y mujeres y con respecto a la edad, establecer unos valores de normalidad para nuestra población y ver si los valores en O1M corregida por creatinina están elevados en enfermedades que producen daño tubular con respecto a personas normales.
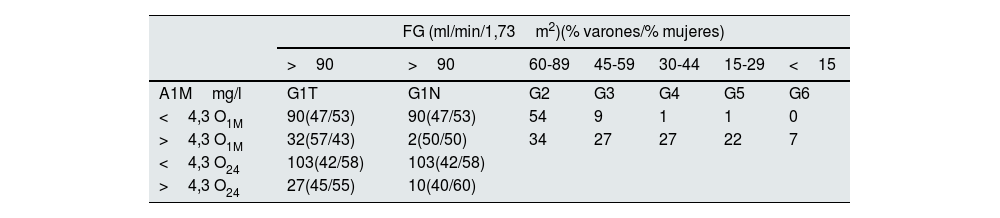
Material y métodosPacientesSe trata de un estudio observacional de tipo analítico donde se recogieron datos de nuestro sistema informático durante los años 2020-2024, seleccionándose 434 analíticas a las que se les había calculado la tasa de filtración glomerular (TFG) y analíticas de O1M y/o O24. Ciento ochenta y dos tuvieron una TFG 4-89ml/min/1,73m2 y A1M cuantificada en O1M. Las 256 restantes presentaban una TFG>90ml/min/1,73m2, se clasificaron en 2 grupos: grupo G1T O1M constituido por 122 analíticas de O1M con un cociente albúmina/creatinina <30 y una densidad >1.015 y grupo G1T O24 constituido por 130 analíticas de O24 con albúmina urinaria <30mg/24h y un volumen entre 400-3.000ml/día.
Dentro de los grupos G1T O1M y G1T O24, se revisaron los diagnósticos de las orinas con valores de A1M>4,3mg/l, y aquellas cuyo diagnostico correspondían a pacientes con enfermedades renales o sistémicas que está demostrado que producen daño tubular, como la DM23–25, HTA26, enfermedades inflamatorias (lupus)27, glomerulonefritis crónica28, obstrucción renal crónica29,30, reflujo vesicouretral asociado a infección del tracto urinario31, pielonefritis crónica32, cálculos renales crónicos33, riñón poliquístico34, nefropatías tubulointersticiales35 o enfermedades por depósito de cadenas ligeras36, se excluyeron de los grupos G1T O1M y G1T O24 (30 y 17 orinas, respectivamente), formando los grupos G1N O1M y G1N O24. Los grupos formados para la realización de este trabajo los observamos en la tabla 1
Grupos según la tasa de filtrado glomerular
| FG (ml/min/1,73m2)(% varones/% mujeres) | |||||||
|---|---|---|---|---|---|---|---|
| >90 | >90 | 60-89 | 45-59 | 30-44 | 15-29 | <15 | |
| A1Mmg/l | G1T | G1N | G2 | G3 | G4 | G5 | G6 |
| <4,3 O1M | 90(47/53) | 90(47/53) | 54 | 9 | 1 | 1 | 0 |
| >4,3 O1M | 32(57/43) | 2(50/50) | 34 | 27 | 27 | 22 | 7 |
| <4,3 O24 | 103(42/58) | 103(42/58) | |||||
| >4,3 O24 | 27(45/55) | 10(40/60) | |||||
A1M: alfa-1-microglobulina orina; FG: filtrado glomerular; G1N: G1T- orinas procedentes de pacientes con enfermedades que pueden producir daño tubular, G2, G3, G4, G5 y G6; O1M: primera orina de la mañana; O24: orina de 24h.
La correlación entre la A1M de primera hora de la mañana y de 24h se realizó con 42 orinas dentro de las 434 seleccionadas que tenían solicitada orina de primera hora de la mañana y de 24h, implementándole a la orina de 24h la A1M.
Selección de variablesLa TFG, albuminuria, densidad en orina, volumen de orina y A1M, se seleccionaron como variables para definir nuestros grupos.
En función de la TFG, se dividieron las orinas con A1M cuantificadas en 6 grupos (tabla 1). La normoalbuminuria fue definida como un cociente albumina/creatinina <30 en la primera orina de la mañana37 o <30mg de albumina en 24h38. La densidad en orina nos refleja la capacidad del riñón para concentrar o diluir la orina, con valores de normalidad de 1.015-1.02039. La oliguria se define como un volumen de orina en 24h<400ml/día40 y la poliuria como un volumen de orina >3.000ml/día41. Asignamos un valor de 4,3mg/l a una concentración de A1M inferior a 4,3mg/l (límite de detección proporcionado por el fabricante, Binding Site), con el objetivo de calcular el valor de la A1M en mg/l corregido por creatinina en g/l o en mg/24h42.
MétodosLas muestras de sangre fueron extraídas entre las 08:00 y las 09:00h de la mañana, después de 12h de ayuno. El suero se obtuvo por centrifugación a 3.000rpm durante 5min. Las orinas tras su recepción se centrifugaron a 2.000g durante 10min. La creatinina se determinó mediante el método de Jaffé, en un autoanalizador Cobas® c702, y la albúmina en orina mediante un método inmunoturbidimetrico (Roche Diagnostics GmbH, Sandhofer Strasse 116, D-68305 Mannheim). Para la estimación de la TFG se utilizó la ecuación MDRD-443. Para determinar la A1M las orinas fueron alicuotadas y almacenadas a 2-8°C, durante un máximo de 7 días, ya que la estabilidad alcanza hasta 21 días a 4°C44. La A1M se determinó mediante un ensayo inmunoturbidimétrico en un analizador Optilite® (Binding Site, Birminghan, UK). La Densidad se realizó en orina de primera orina de la mañana empleando las tiras cobas u pack en el analizador Cobas® u 601 urine analyzer (Roche Diagnostics).
Análisis estadísticoEl análisis estadístico se realizó utilizando el software IBM SPSS® Stadistics versión 27. Se evaluó la distribución de la normalidad de las variables cuantitativas mediante la prueba de Kolmogorov-Smirnov. En función de los resultados, se aplicaron pruebas estadísticas paramétricas o no paramétricas, según correspondiera.
Para la A1M en orina de 24h, los resultados del test de Kolmogorov-Smirnov indicaron que los datos no seguían una distribución normal (p<0,05). Por ello, se utilizó la prueba no paramétrica U de Mann-Whitney para comparar los valores entre varones y mujeres. La asociación entre la A1M en orina de 24h y la edad se evaluó mediante el coeficiente de correlación de Spearman.
En cuanto a la A1M en orina aislada, el test Kolmogorov-Smirnov indicó que los datos seguían una distribución normal (p>0,05). Por lo tanto, se utilizó la prueba t de Student para muestras independientes en la comparación entre sexos. La correlación entre la A1M en orina aislada y la edad se evaluó mediante la correlación de Pearson.
Finalmente, para los diferentes grupos, se utilizó el percentil 97.5 para determinar el límite superior normal de A1M en 24h y A1Mmg/l/g de creatinina en orina en personas normales.
Nuestro estudio se llevó a cabo conforme a los principios éticos establecidos en la Declaración de Helsinki. Revisamos 43 historias clínicas correspondientes a pacientes cuya orina tenía una cuantificación de A1M>4,3mg/l. En estudios observacionales que implican la revisión de la historia clínica de menos de 50 pacientes según el comité ético de nuestro hospital no es necesario solicitar la autorización expresa de los pacientes, por este motivo no se obtuvo consentimiento informado. La información clínica fue tratada de forma anónima, garantizando en todo momento la confidencialidad de los datos.
ResultadosLa correlación entre la A1M O24 y la A1M O1M (mg/l)/creatinina (g/l) en orina de primera hora de la mañana fue de 0,92 (fig. 1).
Dentro grupo G1N O24, no hubo diferencias estadísticamente significativas entre los valores de A1M en O24 entre mujeres y varones (p>0,05). Tampoco se encontraron diferencias en el grupo G1N O1M de los valores de A1M corregidos por creatinina (p>0,05). Con respecto a la edad, no existen diferencias significativas entre los valores de A1M y edad en los grupos G1N O24 y G1N O1M (p>0,05), ni entre los valores de A1M de varones y mujeres con respecto a la edad dentro de estos 2 grupos (fig. 2).
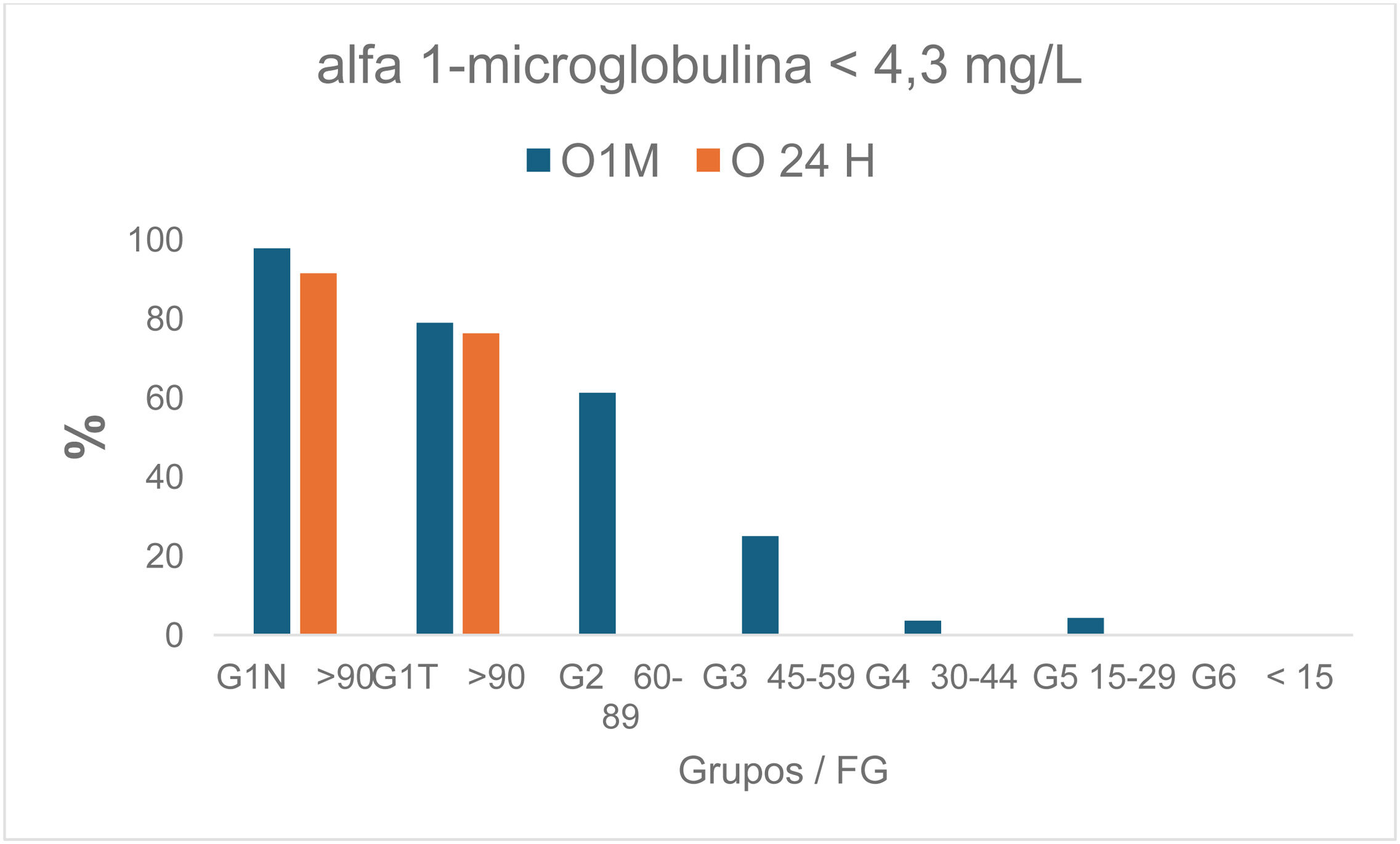
Dentro del grupo G1N, la mayoría de A1M tuvieron un resultado <4,3mg/l (límite inferior de detección proporcionado por el fabricante, Binding Site), un 97,8% las O1M y un 91,5% de las O24 (fig. 3).
El límite superior P97.5, para la A1M en G1N O24 fue de 12,9mg/24h, y para el grupo G1N O1M fue de 7,08A1Mmg/l/g creatinina.
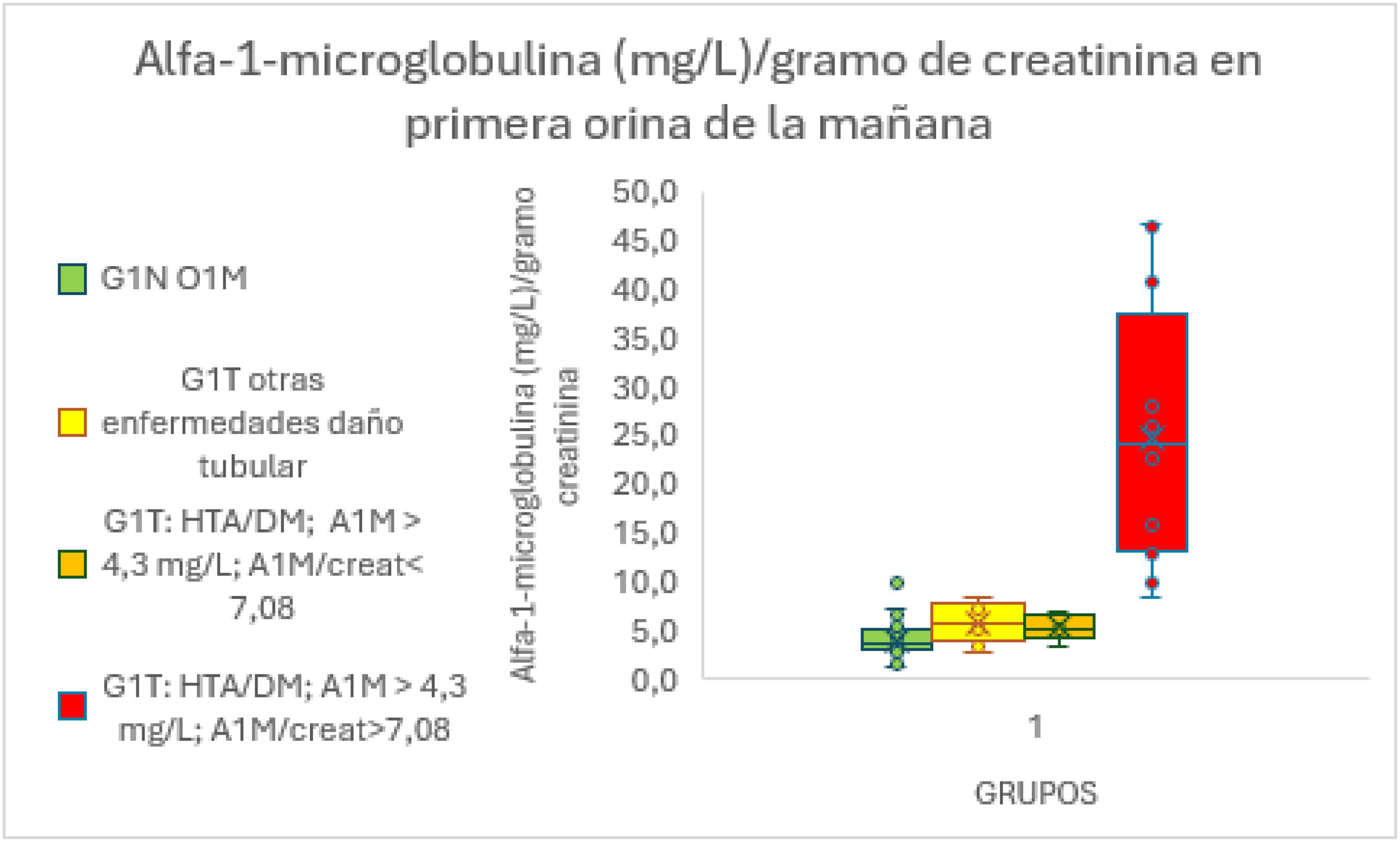
De las 30 orinas dentro del grupo G1T O1M con A1M>4,3mg/l, 19 correspondían a pacientes diagnosticados de HTA y/o DM y 11 a pacientes con otras enfermedades que pueden producir daño tubular. Cuando se corrigieron por creatinina, 18 tuvieron valores >7,08mg/l/g creatinina (14 con HTA y/o DM y 4 pertenecientes a otras enfermedades que producen daño tubular) (fig. 4). Observándose diferencias estadísticamente significativas entre las medias de A1M corregida por creatinina del grupo G1N O1M y estas 18 orinas.
En base a estos resultados, en el grupo G1T podemos afirmar que una A1M>7,08mg/l/g creatinina puede predecir un daño tubular con un valor predictivo positivo (VPP) del 90% y un valor predictivo negativo (VPN) del 88%.
DiscusiónPodemos observar en la figura 1, que existe una fuerte correlación entre A1M en O1M corregida por creatinina y en orina de 24h (r: 0,92). Además, no encontramos diferencias estadísticamente significativas entre los valores de A1M entre varones y mujeres en O24 (grupo G1N O24), ni entre los valores de varones y mujeres de A1M corregida por creatinina en la primera orina de la mañana (grupo G1N O1M).
Con respecto a la edad, tampoco observamos una correlación significativa en el grupo G1N O24, ni entre edad y A1M corregida por creatinina en G1N O1M, ni entre mujeres y varones con respecto a la edad en estos 2 grupos.
Teniendo en cuenta la buena correlación de A1M entre O24 y O1M de los grupos G1N O24 y G1N O1M, y que la O1M está menos influenciada por factores que pueden causar una mayor variabilidad en el resultado como la orina de la segunda micción de la mañana u otra muestra aleatoria diurna15, será más lógico evaluar la función tubular con la muestra de primera orina de la mañana. También debemos de considerar que la primera orina de la mañana se utiliza habitualmente para determinaciones como «la prueba de la tira reactiva», test de embarazo, urocultivo y la cuantificación del cociente albumina/creatinina, por lo que, si utilizamos esta muestra para la determinación de A1M, se le evita al paciente tener que recolectar una segunda muestra innecesaria. Si observamos la figura 3, podemos observar cómo el 97,8% de las A1M cuantificadas en el grupo A1M O1M y el 91,5% de las del grupo A1M O24, tienen un valor <4,3mg/l, es decir están por debajo del límite de detección de la técnica dado por el fabricante (Binding Site), lo que nos indica que a la inmensa mayoría de las personas normales no se les debería de detectar A1M en orina, ya que si los túbulos funcionan correctamente se reabsorbe casi por completo (99%)2. El P97.5 en el grupo G1N O24, fue de 12,9mg/24h, y el P97.5 en el grupo O1N O1M es de 7,08 A1Mmg/l/g creatinina, valores muy parecidos a los que dan Everaert et al.18, de 5,0 (2,4-8,0) A1Mmg/l/g creatinina.
El grupo G1T con una TFG>90FG (ml/min/1,73m2), no microalbuminuria y densidad en orina >1.015, se diferencia del grupo G1N en 30 orinas con un valor de A1M en O1M>4,3mg/l que pertenecen a pacientes con enfermedades que producen daño tubular. De estas 30, 19 corresponden a pacientes con HTA y/o DM con más de 10 años de evolución, al corregirlas por la creatinina urinaria, 14 tienen valores >7,08A1Mmg/l/g creatinina (8,5-40,8A1Mmg/l/g creatinina). Otras 11 orinas pertenecen a pacientes con otras enfermedades que pueden producir daño tubular, al corregirlas por creatinina, 4 tienen valores >7,08A1Mmg/l/g creatinina (7,2-8,3A1Mmg/l/g creatinina). La media de estas 18 orinas con valores de A1M corregidos por creatinina >7,08, difiere significativamente de la media de A1M corregida por creatinina del grupo G1N O1M.
De esta forma una A1M corregida por creatinina >7,08 A1Mmg/l/g creatinina nos puede poner de manifiesto con un VPP del 90% un daño tubular incipiente especialmente en los pacientes diabéticos y/o hipertensos ya que aproximadamente un tercio presenta alteraciones en su función renal, deterioro que se va acentuando a lo largo de los años estando abocados a la nefroesclerosis y la nefropatía diabética22. Por esto es importante considerar la función renal de estos pacientes desde el diagnóstico de su enfermedad implementando la cuantificación de A1M en primera orina de la mañana especialmente en los pacientes con TFG normal y no microalbuminuria, lo que repercutirá en un control más estricto de estos pacientes y una disminución del riesgo de progresar a enfermedad renal crónica, así como de aparición de eventos cardiovasculares.
Limitaciones del estudioEste estudio fue diseñado para obtener los valores de normalidad de A1M en primera orina de la mañana. La relación entre A1M O1M corregida por creatinina y las enfermedades que producen daño tubular necesitarían de un estudio más exhaustivo con mayor número de muestras.
FinanciaciónEste trabajo ha sido financiado en parte por las becas PI18/00745, PI22/00181 y RD21/0005/0031 del Instituto de Salud Carlos III, Madrid (España), financiadas por la Unión Europea-NextGeneration UE, Recovery and Resilience Mechanism; la subvención GR21026 de la Junta de Extremadura, Mérida (España) y el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesLos autores declaran que no existe conflicto de intereses ni de ningún otro tipo.