Sr. Director:
La incidencia de carcinoma urotelial de vejiga en pacientes trasplantados renales con terapia inmunosupresora va desde el 0,08 % al 0,37 %, aunque frecuentemente se presenta en estadios avanzados, en comparación con la población general1.
Los pacientes con carcinoma de células transicionales de alto grado y/o Ca in situ tal vez puedan beneficiarse con instilaciones intravesicales con el bacilo de Calmette-Guérin (BCG). El BCG es un mycobacterium bovis vivo atenuado, que mantiene una acción inmunoestimuladora, pero con una actividad infectiva disminuida2.
El manejo del cáncer de vejiga en pacientes inmunodeprimidos ha sido brevemente descrito en reportes de casos y series retrospectivas. Presentamos el manejo de un paciente trasplantado renal con Ca in situ, con tratamiento inmunosupresor en nuestra institución.
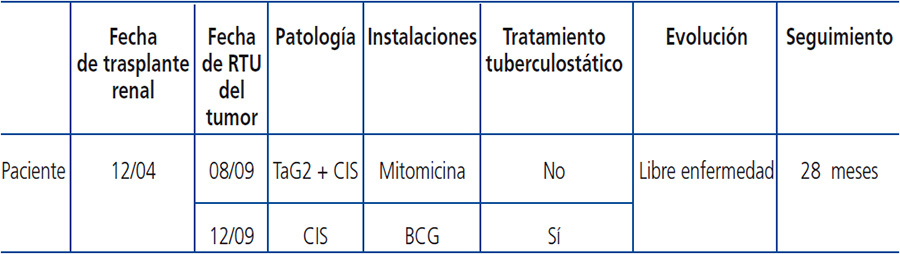
Se trata de un varón de 71 años con enfermedad renal crónica debido a glomerulonefritis IgA, que empezó hemodiálisis en enero de 2004. En diciembre del mismo año se le realizó un trasplante renal de donante cadáver y empezó a recibir tratamiento inmunosupresor con micofenolato mofetilo y tacrolimus.
Cinco años después, acude a consultas por hematuria con coágulos, sin otra sintomatología asociada. La citología de orina fue no concluyente y en la cistoscopia se evidenció una lesión tumoral de 1 cm en fondo vesical. Se realizó resección transuretral de vejiga en agosto de 2009. Anatomía patológica: carcinoma transicional papilar, de alto grado (pTa G2). Ca in situ. Se indicó mitomicina C (MMC) intravesical (6 semanas). En diciembre de 2009, se realizó biopsia múltiple vesical aleatorizada tras MMC. Anatomía patológica: vejiga: Carcinoma in situ (CIS) focal en fondo vesical.
Se presentó el caso en el Comité de Uro-Nefro-Oncología de nuestro hospital y, tres semanas después de la intervención quirúrgica, el paciente recibió 6 instilaciones intravesicales semanales con BCG. Se agregó pauta de profilaxis antituberculosa con isoniacida 150 mg/24 h y rifampicina 300 mg/24 h (iniciado el día previo a la instilación, hasta el día posterior de esta). La dosis de tacrolimus se aumentó de 4 a 8 mg/día. Completa BCG el 25 de marzo de 2010, sin complicaciones.
Los niveles plasmáticos de tacrolimus se mantuvieron entre 5 y 12 ng/ml. La función renal se mantuvo estable en niveles plasmáticos de creatinina de 1,2 mg/dl. El paciente no experimentó efectos adversos y se encuentra libre de enfermedad tras 28 meses de seguimiento (Tabla 1).
DISCUSIÓN
El riesgo de cáncer de vejiga está incrementado aproximadamente 2-3 veces en la población trasplantada3. Comparados con la población general, los pacientes trasplantados con una neoplasia de novo postrasplante son mayoritariamente diagnosticados en estadios avanzados y tienen una supervivencia menor1. El uso de agentes inmunosupresores previene el rechazo al injerto, pero también predispone a los pacientes trasplantados a un incremento en el riesgo de la malignidad4.
El carcinoma de células transicionales (CCT) superficial de vejiga con CIS asociado o CIS primario puede progresar a enfermedad invasiva en un 40 a 80 % de los pacientes. La disminución de la recurrencia y la progresión se ha obtenido con el uso del BCG intravesical, que evita en muchos casos la necesidad de cirugía radical5.
El BCG intravesical estimula a los linfocitos T hellper tipo 1 (Th1) de las células uroteliales, a la producción masiva de citoquinas proinflamatorias, como la interleucina (IL)-1, IL-2, IL-6, IL-8, interferón gamma y factor de necrosis tumoral (FNT)-alfa. El FNT-alfa tiene una acción citotóxica directa en las células tumorales6.
El principal problema en el uso de BCG es la morbilidad asociada. Lamm et al.7 afirman que el 95 % de los pacientes toleran adecuadamente la BCG, mientras que menos del 5 % presentan complicaciones serias. Teóricamente se esperaría que esta morbilidad sea mayor en pacientes que reciben terapia inmunosupresora después del trasplante. Buzzeo et al.8 no recomienda el uso de BCG intravesical en pacientes inmunodeprimidos.
La profilaxis con isoniacida se administra para intentar minimizar la toxicidad inducida por BCG, aunque según algunos autores la frecuencia de cistitis, fiebre y malestar no difieren entre pacientes que reciben BCG intravesical con o sin isoniacida9. Esto sugiere que algunas complicaciones son producidas por la respuesta inflamatoria, y no por efectos directos de la bacteria per se.
Palou et al.10 reportó seguridad en la administración de BCG intravesical con el uso de profilaxis con isoniacida y rifampicina en pacientes trasplantados renales con CCT superficial de vejiga de alto grado. Wang et al.11 también reportan seguridad, pero sin el uso de profilaxis tuberculosa en pacientes similares.
La medicación con tuberculostáticos puede causar efectos adversos e incrementar el metabolismo de algunos bloqueadores de calcineurina. La rifampicina induce el citocromo P450 3A4 e incrementa el metabolismo del tacrolimus, necesitándose ajuste de dosis para mantener estables los niveles de inmunosupresión y evitar el rechazo al injerto10.
En la literatura encontramos 9 casos de pacientes trasplantados renales con CCT superficial de vejiga de alto grado y/o CIS, que recibieron BCG intravesical, presentando una tasa de recurrencia mayor que la población general (44,4 vs. 26 %). No se observó tampoco rechazo al injerto relacionado con el uso de BCG, probablemente por los pocos casos registrados. Un caso de fracaso con la terapia de BCG fue reportado10-13.
Desde el punto de vista inmunológico, existe una situación contradictoria: la inmunosupresión es necesaria para evitar el rechazo al injerto y la acción inmunológica es necesaria para tener un efecto citotóxico en las células tumorales10. La inmunosupresión sistémica en pacientes trasplantados probablemente no lleve a una inmunosupresión local completa; por lo tanto, la respuesta inflamatoria con BCG endovesical podría ser efectiva. La decisión de usar BCG en pacientes trasplantados se debe valorar entre el beneficio del control del tumor contra el potencial riesgo de pérdida del injerto o un inefectivo tratamiento13.
CONCLUSIONES
— El tratamiento con BCG intravesical en nuestro paciente con carcinoma transicional superficial de alto grado de vejiga fue efectivo y no experimentó efectos adversos.
— Es posible que la BCG intravesical en pacientes inmunodeprimidos con Ca in situ sea una opción terapéutica.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características del paciente, tratamiento y seguimiento