La comprensión del complemento en las glomerulopatías ha avanzado notablemente, mostrando que este sistema, más allá de la inmunidad innata, es un mediador clave del daño renal en un amplio espectro de nefropatías, desde las mediadas por inmunocomplejos hasta aquellas debidas a la desregulación primaria de la vía alternativa.
La introducción de inhibidores del complemento, como el bloqueo de C5 con eculizumab, marcó un hito: en el SHUa mejoró de forma significativa la función renal y la supervivencia de los pacientes, y en la hemoglobinuria paroxística nocturna redujo las complicaciones trombóticas, logrando una supervivencia comparable a la población general. Estos avances impulsaron la extensión de este enfoque a otras nefropatías y el desarrollo de nuevos fármacos anti-complemento.
Sin embargo, la heterogeneidad en la desregulación del complemento entre glomerulopatías, e incluso entre los pacientes de una misma enfermedad, limita la aplicación de una estrategia uniforme. Este escenario exige una caracterización más precisa de los mecanismos fisiopatológicos y la identificación de los puntos críticos de intervención en cada contexto clínico.
Actualmente se investigan inhibidores en fases proximales y terminales de la cascada para alcanzar terapias más individualizadas, aunque persisten desafíos como la ausencia de biomarcadores fiables, la duración óptima del tratamiento, la escasez de ensayos específicos, el elevado coste y su integración con la inmunosupresión.
El objetivo de esta revisión es analizar el papel del complemento en las glomerulopatías y revisar los avances terapéuticos actuales y futuros, con especial atención a los retos y oportunidades hacia una medicina más personalizada.
Understanding of the complement system in glomerulopathies has advanced significantly, revealing that this system —beyond its role in innate immunity— is a key mediator of kidney injury across a wide spectrum of nephropathies, from those driven by immune complexes to those caused by primary dysregulation of the alternative pathway.
The introduction of complement inhibitors, such as C5 blockade with eculizumab, marked a milestone: in aHUS it significantly improved renal function and patient survival, and in paroxysmal nocturnal hemoglobinuria it reduced thrombotic complications, achieving survival rates comparable to the general population. These advances have spurred the extension of this approach to other nephropathies and the development of new anti-complement agents.
However, the heterogeneity of complement dysregulation among glomerulopathies —and even among patients with the same disease— limits the application of a uniform therapeutic strategy. This scenario calls for a more precise characterization of the underlying pathophysiological mechanisms and the identification of critical points of intervention in each clinical context.
Currently, inhibitors targeting both proximal and terminal steps of the cascade are being investigated to achieve more individualized therapies, although challenges remain, such as the lack of reliable biomarkers, uncertainty regarding optimal treatment duration, scarcity of disease-specific trials, high costs, and the integration of these agents with immunosuppressive regimens.
The aim of this review is to analyze the role of the complement system in glomerulopathies and to summarize current and future therapeutic advances, with particular emphasis on the challenges and opportunities on the path toward more personalized medicine.
En los últimos años, la comprensión del papel del sistema del complemento en la fisiopatología de las enfermedades glomerulares ha experimentado un avance sustancial. Más allá de su función clásica en la defensa inmunitaria innata, hoy sabemos que puede actuar como un potente mediador de daño renal en un amplio espectro de enfermedades glomerulares, desde su papel como ejecutor del daño en las glomerulonefritis asociadas a inmunocomplejos (LES, nefropatía membranosa…) hasta promotor del daño en enfermedades mediadas predominantemente por la desregulación de la vía alternativa (VA), como en la glomerulopatía C3 (C3G) y el síndrome hemolítico urémico atípico (SHUa). Esta evidencia ha transformado la visión tradicional del complemento, posicionándolo como una diana terapéutica clave.
Esta revisión tiene como objetivo reflexionar sobre las razones científicas y clínicas que justifican considerar diversos tipos de bloqueantes del complemento en la enfermedad glomerular, discutir el estado actual del desarrollo terapéutico en este campo y subrayar los desafíos —tanto conceptuales como logísticos—, que debemos afrontar para lograr una implementación racional, equitativa y basada en la evidencia.
El desarrollo de inhibidores del complemento, particularmente aquellos dirigidos contra el componente terminal C5, ha marcado un hito en el tratamiento de algunas de estas enfermedades, ofreciendo beneficios clínicos tangibles en contextos previamente huérfanos de opciones efectivas. La aparición del eculizumab como inhibidor del complemento terminal demostró mejorar la supervivencia del paciente y su calidad de vida en el SHUa1 y de la hemoglobinuria paroxística nocturna (HPN)2. En el SHUa, el bloqueo del C5, no solo consiguió una respuesta hematológica rápida y sostenida, sino también una respuesta sustancial de la función renal, reduciendo el riesgo de enfermedad renal terminal del 50-60% al 10-15%3. Este hito disparó el interés por la VA del complemento en otras enfermedades renales y en la generación de nuevos fármacos con capacidad de bloquear puntos clave de la cascada del complemento.
Los resultados prometedores previamente descritos, han llevado a plantear el inhibidor de C5 como un tratamiento casi universal en las enfermedades donde esta vía desempeña un papel relevante. Sin embargo, este abordaje presenta limitaciones importantes. La más significativa es la heterogeneidad en la desregulación del complemento entre las distintas enfermedades glomerulares, incluso entre los pacientes con la misma entidad clínica. Cada vez existe más evidencia que apunta a que la activación del complemento presenta patrones diversos en cada enfermedad con matices heterogéneos incluso dentro de cada una de ellas, lo que implica que una estrategia uniforme representa una simplificación excesiva con un posible impacto negativo tanto en términos de eficacia como de seguridad.
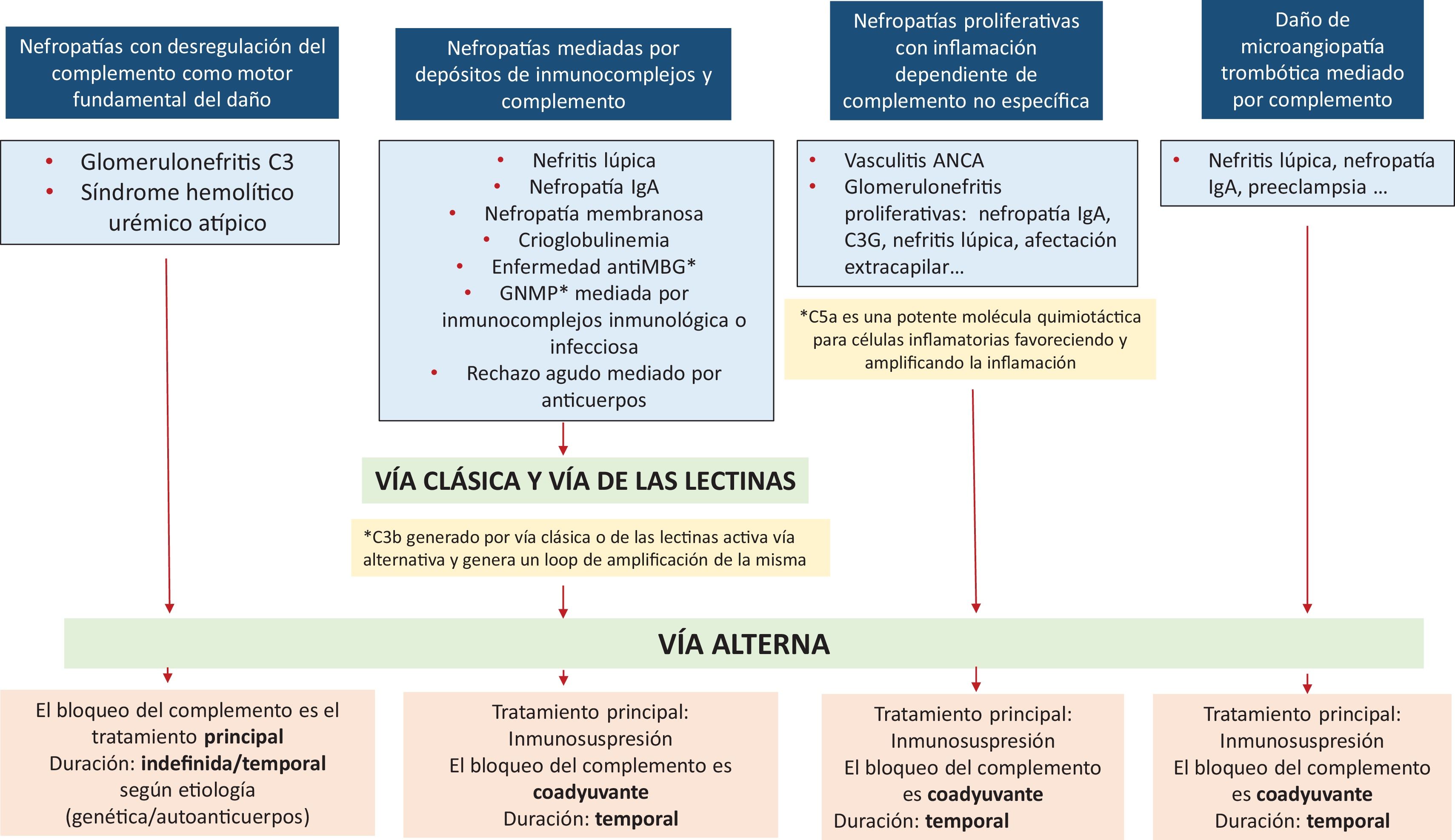
Clasificación de las glomerulopatías según su relación con el complementoEn los últimos años se han desarrollado nuevas moléculas dirigidas a diferentes puntos críticos de la cascada del complemento, lo que abre una oportunidad estratégica a una mayor individualización terapéutica. No obstante, el conocimiento actual de los mecanismos subyacentes sigue siendo incompleto y, actualmente carecemos de biomarcadores fiables de actividad del complemento. En el SHUa, la entidad más estudiada hasta ahora, los marcadores serológicos o urinarios de activación del complemento están elevados solo en el 30-50% de los pacientes en situación de actividad4. Estas limitaciones hacen que, por ahora, el bloqueo del complemento óptimamente personalizado siga siendo un objetivo pendiente.
Con el propósito de poner luz en esta complejidad, Fakhouri et al.5, proponen dividir la enfermedad glomerular en 4 categorías según su relación con el complemento (fig. 1 y tabla 1).
Formas de desregulación del complemento en las distintas enfermedades glomerulares. Principales tratamientos aprobados y en evaluación
| Nefropatías mediadas directamente por desregulación del complemento | |||
|---|---|---|---|
| Enfermedad | Uso racional | Fármacos aprobados | Fármacos en estudio |
| Glomerulonefritis C3 | Depósito predominante de C3. Autoanticuerpos o desregulación intrínseca (genética) de la VAa en la fase fluida34 | Pegcetacoplan (anti-C3)9Iptacopan (anti-factor B)8 | Eculizumab (anti-C5), danicopan (anti-factor D), narsoplimab (inhibidor MASP-2) |
| GNMPb asociada a inmunocomplejos idiopática | Depósito de inmunoglobulinas y complemento tisulares. Datos de activación vía alterna (y menores de la vía clásica) descritos | Pegcetacoplan (anti-C3)5 | Pegcetacoplan (anti-C3), danicopan (anti-factor D) |
| Síndrome hemolítico urémico atípico | Desregulación del complemento por autoanticuerpos o genética de la VA en la superficie celular. Aumento producción C5b9. Daño endotelial35 | Eculizumab (anti-C5)3Ravulizumab (anti-C5) | Avacopan (anti-C5a), iptacopan (anti-factor B), narsoplimab (inhibidor MASP-2) |
| Nefropatías con depósito de inmunocomplejos y complemento. Los inmunocomplejos activan predominantemente la vía clásica y de las lectinas; sin embargo, el C3b generado activa adicionalmente la vía alterna14 | |||
|---|---|---|---|
| Enfermedad | Uso racional | Fármacos aprobados | Fármacos en estudio |
| Nefritis lúpica | Patrón «full house» en la biopsia. Hipocomplementemia C3 y C4. Inmunocomplejos activan C3a y C5a que producen inflamación y reclutan C5b9 provocando daño tisular | Ravulizumab (anti-C5), pegcetacoplan (anti-C3), vemircopan (anti-factor D), narsoplimab (inhibidor MASP-2) | |
| Nefropatía IgA | Codominancia IgA y C3 tisular además de C4, properdina, MBL y C5b9. Activación vía de las lectinas (MASP-2, C4d)36,37. Variantes genéticas del complemento (CFH, CFHR5) o niveles elevados de FHRc asociadas con peor pronóstico38 | Iptacopan (anti-factor B)30 | Eculizumab (anti-C5), ravulizumab (anti-C5), cemdisiran (anti-C5), avacopan (anti-C5a-R), pegcetacoplan (anti-C3), narsoplimab (inhibidor MASP-2), sefaxersen (anti-factor B) |
| Nefropatía membranosa | Fragmentos de C3 y C5b9 colocalizan con IgG en los depósitos subepiteliales39. En modelos experimentales: depleción de C3 previene proteinuria | Pegcetacoplan (anti-C3), iptacopan (anti-factor B), anti-factor D (BCX9930), narsoplimab (inhibidor MASP-2) | |
| Enfermedad anti-MBG | Depósitos de C1q y C3 junto a IgG de forma lineal en la MBG. MBL, C4d, factor B, C5b9 y properdina depositados orientan activación vía clásica y de las lectinas40 | Eculizumab (anti-C5) | |
| Crioglobulinemia | Depósitos de inmunoglobulinas y C3 tisulares. Hipocomplementemia C3 y C4 | ||
| Rechazo agudo humoral | Depósitos de C4d en los capilares peritubulares41 | Eculizumab (anti-C5) | |
| GNMP mediada por inmunocomplejos inmunológica o infecciosa | Depósitos de inmunoglobulinas y complemento caracterizan la enfermedad. Descrita activación de VA | ||
| Nefropatías con inflamación dependiente de complemento no específica | |||
|---|---|---|---|
| Enfermedad | Uso racional | Fármacos aprobados | Fármacos en estudio |
| Glomerulonefritis proliferativas especialmente aquellas con formación de semilunas: vasculitis ANCA, LES, IgA, C3… | C5a es una potente molécula quimiotáctica para células inflamatorias. Niveles elevados de C3a, C5a y C5b9 en suero descritos42. C3 sérico disminuido asocia a peor pronóstico43 | Avacopan (anti-C5a-R)19 | Iptacopan (inhibidor del factor B), vilobelimab/IFX-1 (anti-C5a) |
| Daño de microangiopatía trombótica mediada por complemento asociado a otras glomerulopatías | |||
|---|---|---|---|
| Enfermedad | Uso racional | Fármacos aprobados | Fármacos en estudio |
| Nefritis lúpica, nefropatía IgA, rechazo agudo humoral, síndrome antifosfolípido catastrófico… | 8-20% de las biopsias renales con diagnóstico de nefritis lúpica y en un 2-53% de las biopsias con diagnóstico de nefropatía IgA | Eculizumab en series de casos y en recomendaciones KDIGO para tratamiento de nefritis lúpica con microangiopatía trombótica asociada26 | |
ANCA:; FHR:; GNMP:; LES:; MBG:; VA:.
La primera categoría englobaría aquellas enfermedades en las que la desregulación de la VA del complemento constituye el motor principal y primario del daño renal. En este grupo se incluyen la C3G y el SHUa. Aunque ambas entidades comparten la alteración de la VA del complemento, en concreto desregulando la C3 convertasa, sin embargo, son enfermedades con mecanismos fisiopatológicos distintos, cursos clínicos diferentes y, en consecuencia, con estrategias terapéuticas específicas.
En el SHUa, la activación incontrolada de la C3 convertasa desencadena una lesión endotelial difusa mediada por el complejo de ataque de membrana (C5b-9). El tratamiento actual con inhibidores terminales tales como eculizumab o ravulizumab, ha demostrado reducir el daño endotelial y frenar la progresión de la microangiopatía. No obstante, cabe plantear si los fármacos dirigidos a niveles más proximales de la VA, actuando sobre los reguladores de la C3 convertasa, donde se origina el defecto primario, podrían alcanzar una mayor eficacia terapéutica. Esta hipótesis, ha podido ser demostrada con la experiencia del pegcetacoplan en la HPN6, en la que la inhibición proximal ha mostrado beneficios adicionales respecto al bloqueo terminal. Incluso se ha sugerido que una estrategia combinada, dirigida tanto a fases proximales como terminales de la cascada del complemento, podría ofrecer resultados superiores. Actualmente hay en marcha ensayos clínicos con este propósito7.
Por su parte, la C3G se caracteriza por el depósito glomerular de productos de degradación del complemento (fundamentalmente C3c y C3d) en distintos compartimentos renales, consecuencia de una hiperactivación sostenida de la C3 convertasa. En los últimos años, diversos ensayos clínicos con inhibidores dirigidos contra elementos reguladores de esta enzima —como los bloqueantes del factor B (iptacopan)8 y de la C3 (pegcetacoplan)9 han mostrado una reducción significativa de la proteinuria, de los depósitos tisulares y un enlentecimiento en la pérdida del filtrado glomerular (FG). En contraste, el bloqueo terminal de la vía con el inhibidor del receptor de C5a, avacopan10, no logró modificar ni la actividad histológica ni la proteinuria en estos pacientes. Cada vez se acumula más evidencia de que las denominadas nefropatías membranoproliferativas mediadas por inmunocomplejos (IC) idiopáticas comparten como mecanismo patogénico principal la desregulación del complemento. En consecuencia, estas entidades probablemente deberían abordarse de manera similar a la C3G y considerarse dentro de esta misma categoría nosológica11,12.
La segunda categoría incluye las enfermedades glomerulares mediadas por anticuerpos, entre ellas la nefritis lúpica, la nefropatía membranosa, la nefropatía por IgA (IgAN), la glomerulonefritis antimembrana basal glomerular (MBG), crioglobulinemia y el rechazo humoral del trasplante13, entre otras. Se sabe que los inmunocomplejos, ya sea depositados o formados in situ, pueden activar la vía clásica del complemento y, en cierta medida, la vía de las lectinas, amplificando así el daño celular. Se sabe que el C3b generado por activación de la vía clásica o de las lectinas, puede secundariamente activar la VA amplificando la activación del complemento dentro del tejido. De hecho, experimentos in vitro han demostrado que esta amplificación secundaria a través de la VA aporta la mayor proporción de fragmentos de la activación del complemento generados por IC14. Así, los modelos animales deficientes para la activación de la VA del complemento han mostrado estar protegidos del daño por IC. Estos resultados respaldan la importancia de la VA en la patogénesis de estas enfermedades glomerulares, y su potencial bloqueo como capacidad terapéutica. Algunos ensayos clínicos han mostrado resultados alentadores con la inhibición de la VA del complemento en estas enfermedades, como en la nefropatía por IgA con iptacopan15 y ravulizumab16.
La tercera categoría englobaría aquellas situaciones en las que la desregulación del complemento participando o no, directamente en la fisiopatología de la enfermedad, contribuye adicionalmente a potenciar la inflamación asociada. En este contexto, el bloqueo del complemento no debería considerarse la estrategia terapéutica principal, sino un tratamiento coadyuvante y transitorio, mientras se trata y controla el verdadero mecanismo patogénico subyacente.
Es sabido que las enfermedades glomerulares proliferativas, tanto agudas como crónicas, pueden acompañarse de un grado variable de inflamación celular. Dichos cambios inflamatorios pueden manifestarse como proliferación mesangial, formación de semilunas, necrosis fibrinoide vascular o capilaritis peritubular, y existe evidencia de que podrían estar, al menos en algunos casos, mediados por el componente C5a, una potente molécula quimiotáctica para células inflamatorias17.
De este modo, podemos especular que en formas crescénticas de una IgAN o de una C3G, así como en las vasculitis ANCA, el bloqueo de C5a (o de su receptor) podría representar una alternativa al uso de esteroides a dosis altas durante las primeras semanas de tratamiento, con el objetivo de limitar el daño inflamatorio. En los pacientes con C3G tras un año de tratamiento con eculizumab no se modificaron los depósitos de fragmentos de complemento, pero se redujo la proliferación glomerular y la infiltración de neutrófilos18. Recientemente, un ensayo clínico de fase 3 demostró que el bloqueo del receptor de C5a podría reemplazar el uso de esteroides en los pacientes con vasculitis ANCA no graves19.
La evidencia genética y funcional en vasculitis ANCA apunta a una desregulación proximal del complemento (C3 convertasa), apoyando el desarrollo de terapias con bloqueo más proximal del sistema20.
De manera interesante, este efecto «antiinflamatorio» no se limita a la enfermedad glomerular, sino que puede observarse también en daño tubular. En un modelo en ratón al que inyectaron microcristales de colesterol, el tratamiento con inhibidores de C5a o de C5aR previno la inmunotrombosis, la caída de la tasa de filtrado glomerular y la necrosis isquémica esperada21. Del mismo modo, el bloqueo del complemento evitó el desarrollo de daño tubular por rabdomiólisis22.
Aunque la aplicación de terapias bloqueadoras del complemento con esta indicación resulta muy prometedora —pues podría ser útil en los pacientes con formas más agresivas de enfermedad para limitar la respuesta inflamatoria—, la evidencia actual aún es insuficiente para recomendar su uso clínico de manera rutinaria más allá de las vasculitis ANCA, donde se ha planteado como estrategia para reducir la necesidad de altas dosis de esteroides.
La cuarta categoría, incluiría el daño por microangiopatía trombótica mediada por complemento, concomitante a otras lesiones glomerulares primarias. Se ha descrito la presencia de hallazgos histológicos de MAT en aproximadamente un 820% de las biopsias renales con diagnóstico de nefritis lúpica23 y en un 2-53% de las biopsias con diagnóstico de nefropatía IgA24. En ambas entidades, esta asociación se correlaciona con una presentación clínica más grave y una progresión renal acelerada25. La hipertensión arterial grave es frecuente en este contexto, aunque la MAT también puede manifestarse en los pacientes normotensos.
La evidencia sobre el uso de eculizumab en esta categoría se limita a casos clínicos aislados y a pequeñas series de pacientes. Las guías KDIGO 2024 para la nefritis lúpica recomiendan considerar inhibidores del complemento, como el eculizumab, en aquellos casos de nefritis lúpica asociada a MAT que no responden ni a plasmaféresis ni a tratamiento inmunosupresor convencional26. Sin embargo, las dosis óptimas y la duración del tratamiento permanecen inciertas y deben individualizarse según la evolución clínica de cada paciente, siendo crucial el inicio precoz del tratamiento para optimizar la recuperación renal.
Nuevos fármacos bloqueantes de complemento están en desarrollo, ampliando los potenciales puntos a inhibir dentro de la cascada del complemento y ofreciendo opciones terapéuticas cada vez más específicas según la enfermedad. No obstante, como ya se ha mencionado, la relación entre enfermedad glomerular y complemento es compleja y todavía no se comprende por completo. Identificar qué vías están desreguladas en cada enfermedad, y en qué momento predominan a lo largo de su evolución, será fundamental para individualizar eficazmente el tratamiento.
En cualquier caso, no debemos olvidar abordar la enfermedad glomerular desde una perspectiva holística, prestando atención no solo al complemento, sino también a factores inmunológicos, hemodinámicos, genéticos e inflamatorios presentes en estas enfermedades.
Retos y desafíosA día de hoy el tratamiento con fármacos del complemento plantean múltiples retos y desafíos (tabla 2).
Limitaciones actuales para el uso en la práctica clínica habitual del bloqueo del complemento en la enfermedad glomerular
| Evidencia clínica aún limitada y heterogénea | Pocos ensayos aleatorizados por entidad, tamaños muestrales reducidos, seguimiento corto, con variables de desenlace intermedias … |
| Selección de pacientes no estandarizada | En los ensayos clínicos no se ha realizado preselección según la activación o no del complemento |
| Objetivo terapéutico | Incertidumbre sobre si, además de la respuesta clínica, la regulación del complemento debería un ser objetivo |
| Momento de inicio y duración óptimos desconocidos | No hay consenso sobre cuándo iniciar (fase inflamatoria vs. crónica), ni cuánto tiempo mantener el bloqueo una vez lograda la remisión clínica |
| Seguridad a largo plazo | Mayor susceptibilidad a infecciones. Datos aún escasos sobre efectos inmunológicos y oncológicos a largo plazo |
| Integración con la inmunosupresión estándar | Ausencia de información sobre como combinar el tratamiento anticomplemento con la medicación inmunosupresora. Riesgo de toxicidad acumulada |
| Monitorización y diagnóstico especializado | Disponibilidad limitada y variabilidad interlaboratorio de pruebas de complemento: estudio funcional, autoanticuerpos, estudios genéticos |
| Coste y acceso | Ausencia de evaluaciones fármaco-económicas. Coste elevado |
| Poblaciones especiales con datos escasos | Pediatría, embarazo, pacientes comórbidos o con función renal muy avanzada |
| Posología poco cómoda para el paciente | La mayoría de los fármacos disponibles requieren administración intrahospitalaria, en formulaciones intravenosas o subcutáneas, lo que obliga a acudir al hospital con alta frecuencia |
Es crucial disponer de biomarcadores capaces de predecir la activación del complemento, identificar la vía predominante de activación y monitorizar la respuesta terapéutica en tiempo real. Las pruebas convencionales, como la determinación sérica de C3 y C4 (excepto en el caso de la C3G), suelen presentar una sensibilidad y especificidad limitadas. Del mismo modo, la cuantificación de otras proteínas constituyentes de la cascada del complemento o de sus fragmentos no ha demostrado aportar información clínicamente relevante27.
Se ha planteado la hipótesis de que la activación local del complemento a nivel renal podría tener un papel determinante, lo que explicaría por qué los biomarcadores urinarios podrían reflejar con mayor fidelidad la actividad de la enfermedad que los parámetros séricos. En este sentido, en un análisis realizado en los pacientes incluidos en el ensayo clínico fase 3 con ravulizumab en adultos con síndrome hemolítico urémico atípico, el área bajo la curva (AUC) para predecir actividad fue de 0,72 para los niveles urinarios de C5b-9, frente a 0,52 para los niveles plasmáticos28.
En otras enfermedades glomerulares, algunos estudios sugieren que la detección en orina de fragmentos del sistema del complemento como «Bb» en nefritis lúpica29 o en vasculitis30 podrían reflejar de manera más precisa la actividad inflamatoria intraglomerular. Sin embargo, la evidencia disponible es aún limitada y se requieren más estudios prospectivos y multicéntricos que validen su utilidad diagnóstica y pronóstica, así como su papel en el seguimiento de la respuesta al tratamiento.
Duración y secuencia óptima del tratamientoLa mayoría de los ensayos clínicos disponibles tienen periodos de seguimiento relativamente cortos, por lo que aún se desconoce la duración de la respuesta y el perfil completo de posibles efectos adversos a largo plazo. En enfermedades crónicas como la C3G, caracterizadas por brotes y remisiones, no está claramente establecido si el tratamiento debe mantenerse de forma indefinida o si pueden definirse periodos de suspensión controlada. Ante la tentación de prolongar el bloqueo del complemento de manera crónica tras alcanzar la respuesta clínica, es necesario considerar tanto el riesgo de infecciones graves como el elevado coste de estos fármacos. Por otro lado, la retirada del tratamiento puede conllevar un riesgo significativo de recaída y progresión de la enfermedad.
En algunas entidades, como la HPN, la decisión terapéutica es más sencilla, dado que la discontinuación del bloqueo terminal del complemento se asocia de manera casi invariable a una recaída grave. Sin embargo, en la mayoría de las enfermedades glomerulares esta relación no está tan bien definida. En el SHUa, la presencia de variantes genéticas patogénicas constituye el principal factor predictivo de recaída31. Así, en los pacientes sin variantes genéticas patogénicas la retirada del tratamiento es relativamente segura, con una tasa de recaída inferior al 5%. En cambio, la decisión en casos con variantes de significado incierto resulta más compleja y requiere una valoración individualizada.
Aunque aún no se dispone de suficiente evidencia, podría esperarse un escenario similar en los pocos casos de C3G de origen genético. En las formas mediadas por inmunocomplejos, sin embargo, la información es escasa y no existen datos concluyentes que permitan guiar la práctica clínica.
Tampoco se dispone de evidencia robusta en aquellas situaciones en las que el complemento actúa principalmente como amplificador de la inflamación o como desencadenante de microangiopatía trombótica. En estos contextos, cabe hipotetizar que el tratamiento debería ser transitorio, limitado a un periodo breve —semanas o pocos meses— hasta controlar el episodio agudo, evitando la exposición innecesaria a una terapia crónica.
Diseño de ensayos que aporten información clínica relevanteLa heterogeneidad intrínseca de las enfermedades glomerulares, unida a la rareza de algunas entidades como la C3G, constituye un obstáculo importante para el desarrollo de ensayos clínicos robustos. Esta dificultad metodológica se traduce en criterios de inclusión excesivamente generales y en la utilización de objetivos poco específicos, centrados habitualmente en medidas a corto plazo, que no capturan la evolución de la enfermedad ni la sostenibilidad de la respuesta tras la retirada del tratamiento.
Los ensayos pioneros publicados recientemente representan un avance necesario, pero adolecen de limitaciones que condicionan la interpretación de sus resultados y su aplicabilidad en la práctica clínica real. Es imprescindible que los futuros estudios adopten diseños más precisos y adaptados a la complejidad de estas enfermedades, incorporando objetivos clínicamente relevantes, periodos de seguimiento prolongados y estrategias que permitan estratificar a los pacientes según biomarcadores o características genéticas. Solo de esta forma se podrá generar una evidencia más sólida que oriente decisiones terapéuticas fundamentadas y reduzca la actual incertidumbre en el manejo clínico.
El coste y accesibilidadEstas terapias innovadoras representan un verdadero desafío para los sistemas de salud. Durante años, el eculizumab fue considerado el fármaco más caro del mercado. La introducción de biosimilares y el desarrollo de nuevos agentes han contribuido a reducir su precio, aunque el coste continúa siendo muy elevado y constituye una limitación significativa para la expansión de su uso de manera equitativa en todas las regiones del mundo.
Las moléculas en desarrollo, a diferencia de las actuales que son mayoritariamente anticuerpos, serán péptidos. De forma general los péptidos son preferidos, frente a los anticuerpos, por su menor dificultad y coste de producción, su viabilidad para la administración subcutánea e incluso, potencialmente, por vía oral, así como por un menor riesgo de inmunogenicidad32.
Integración de la terapia anticomplemento con la inmunosupresiónIncluso en aquellas enfermedades glomerulares en las que el daño está directamente mediado por una desregulación del complemento, en ocasiones se plantea la necesidad de asociar tratamiento inmunosupresor. De hecho, en los 2 ensayos clínicos con inhibidores del complemento en C3G se permitió el uso concomitante de prednisona y micofenolato. Es razonable pensar que la eliminación de anticuerpos que prolongan la vida media de la C3 convertasa (C3NEF) podría ejercer un beneficio adicional y sostenido en el curso de la enfermedad33.
En el resto de glomerulopatías, en las que la desregulación del complemento no constituye el mecanismo inicial de daño, la combinación con inmunosupresión sigue siendo imprescindible. No obstante, es previsible que las pautas actuales deban revisarse a medida que se disponga de terapias bloqueantes del complemento. El primer ejemplo de este cambio lo constituye el uso de avacopan en las vasculitis ANCA, donde ha demostrado capacidad para reducir de forma significativa la exposición a corticoides.
En conclusión, el bloqueo del complemento constituye una de las estrategias más prometedoras en la nefrología actual, pero su implementación racional exige superar desafíos críticos que deben ser abordados antes de que estas terapias puedan considerarse de uso generalizado. Solo a través de un enfoque crítico, basado en evidencia sólida y en la individualización terapéutica, será posible traducir estos avances en beneficios clínicos duraderos para los pacientes.
FinanciaciónEste trabajo se ha realizado a partir de los resultados obtenidos en los proyectos financiados por las becas SEN 2019 y 2024. GF-J cuenta con el apoyo del Instituto de Salud Carlos III y del Fondo Europeo de Desarrollo Regional de la Unión Europea (proyecto PI24/01711), así como de la Unión Europea - Next Generation EU, a través del Mecanismo de Recuperación y Resiliencia (MRR), en el marco de la red RICORS (RD24/0004/0014).
Conflicto de interesesGF-J declara tener contratos de consultoría con Alexion y haber recibido honorarios de Sobi y Novartis por su participación en comités asesores científicos.