En la nefropatía membranosa (NM), la presencia de anticuerpos antirreceptor tipo M de fosfolipasa A2 se considera altamente específica para las formas idiopáticas, pero no se ha demostrado que la presencia de dichos anticuerpos se asocie a un determinado perfil clínico.
ObjetivoAnalizar si existe alguna diferencia en cuanto al perfil clínico inicial, evolución y pronóstico entre pacientes con NM idiopática en función de la presencia de anticuerpos anti-PLA2R.
MétodosSe estudió a 85 enfermos con NM idiopática, 55 eran anti-PLA2R positivos y 30 negativos. Se registraron las variables clínicas, bioquímicas y anatomopatológicas al momento del diagnóstico, la frecuencia de remisión espontánea, la incidencia de respuesta al tratamiento de primera línea, la frecuencia y número de recidivas, la supervivencia de la función renal libre de tratamiento sustitutivo renal, la supervivencia de la función renal libre de insuficiencia renal crónica y la frecuencia de aparición de enfermedades neoplásicas, infecciosas o autoinmunes durante el seguimiento.
ResultadosAl momento del diagnóstico, los enfermos anti-PLA2R negativos presentaron significativamente mayor edad y frecuencia de remisión espontánea. No se apreciaron diferencias en la respuesta al tratamiento de primera línea, frecuencia ni número de recidivas, supervivencia de la función renal libre de tratamiento sustitutivo renal ni supervivencia de función renal libre de insuficiencia renal crónica.
ConclusionesLos enfermos con NM idiopática anti-PLA2R negativos presentaron mayor edad, menor filtrado glomerular inicial y mayor frecuencia de remisión espontánea que los enfermos anti-PLA2R positivos. Sin embargo, entre ambos grupos de enfermos, no se observaron diferencias en cuanto a la respuesta y al tratamiento, aparición de recidivas ni pronóstico final.
In membranous nephropathy, the presence of antibodies against M-type phospholipase A2 receptor is considered highly specific for idiopathic forms. However, no specific association to a particular clinical profile has been found for such antibodies.
ObjectiveTo assess potential differences in initial clinical profile, course and prognosis of idiopathic membranous nephropathy depending on the presence of anti-PLA2R antibodies.
MethodsEighty-five patients with idiopathic membranous nephropathy were included (55 anti-PLA2R-positive and 30 anti-PLA2R-negative). Clinical, biochemical and pathological variables were recorded at the time of diagnosis. Frequency of spontaneous remission, incidence of response to first-line therapy, frequency and number of recurrences, survival of renal function free from renal replacement therapy, survival of renal function free from chronic renal insufficiency and frequency of occurrence of malignant, infectious or autoimmune diseases during follow-up were recorded.
ResultsAt the time of diagnosis, anti-PLA2R-negative patients were significantly older and had a higher frequency of spontaneous remission. No differences were noted in the response to first-line treatment, frequency and number of recurrences, survival of renal function free from renal replacement therapy, or survival of renal function free from chronic renal insufficiency.
ConclusionsAnti-PLA2R-negative patients with idiopathic membranous nephropathy were older and experienced spontaneous remission more often than anti-PLA2R-positive patients. No differences in terms of treatment response, recurrences, and final prognosis were observed between both groups of patients.
La nefropatía membranosa (NM) es la primera causa de síndrome nefrótico en el adulto1. Desde una perspectiva clínica, se clasifica en idiopática (NMI) o secundaria en función de si es o no posible identificar una etiología responsable. En ausencia de datos clínicos o bioquímicos que indiquen una etiología concreta, distinguir entre ambas formas puede ser difícil únicamente mediante los datos que proporciona la biopsia renal2,3. Recientemente, en diversos estudios se ha descrito que, alrededor de un 70% de los casos de NMI se asocian a la presencia de anticuerpos frente al receptor tipo M de la fosfolipasa A2 (anti-PLA2R)4. El título de anticuerpos en el momento del diagnóstico se relaciona con la probabilidad de remisión espontánea5 (RE) y con la respuesta al tratamiento5–10. Sin embargo, no se ha demostrado que en enfermos con NMI, la presencia de anticuerpos anti-PLA2R se asocie a un determinado perfil clínico de presentación de la enfermedad o implique diferencias en cuanto al curso clínico, respuesta al tratamiento o pronóstico a largo plazo. Por otra parte, a pesar de que la mayor parte de los estudios realizados coinciden en que la presencia de anticuerpos anti-PLA2R es altamente específica de NM idiopática4,5,7,12–14, hay casos descritos en los que la presencia de dichos anticuerpos coincide con otras posibles etiologías15 y cerca de un 30% de enfermos con NMI son anti-PLA2R negativos. En este último grupo de enfermos, se han descrito anticuerpos frente a otros antígenos podocitarios cuya correlación clínica todavía está siendo investigada16–19 y, por ello, hay mayor incertidumbre acerca de la posible identificación de etiologías secundarias a lo largo del tiempo. Sin embargo, dado que la mayor parte de los estudios realizados han sido transversales, se dispone de poca información acerca del diagnóstico de posibles etiologías responsables de la NM a lo largo del tiempo en enfermos anti-PLA2R positivos y negativos.
El objetivo del presente estudio es analizar si, en enfermos con NMI, existe alguna diferencia en cuanto al perfil clínico inicial, curso clínico, respuesta al tratamiento o pronóstico en función de la presencia o no de anticuerpos anti-PLA2R.
Enfermos y métodosSe realizó un estudio retrospectivo, en el que se incluyó a pacientes mayores de 18 años con síndrome nefrótico secundario a NM, diagnosticado por biopsia renal, entre los años 1985 y 2009, que cumplieron los siguientes criterios: 1) ausencia de etiología responsable de la NM, tras un estudio protocolizado que descartó enfermedades neoplásicas, sistémicas, infecciosas o exposición a fármacos en el momento del diagnóstico y 2) disponibilidad de muestras de tejido renal para el estudio inmunohistoquímico o muestras de suero en el momento del diagnóstico para la medición de los niveles circulantes de anticuerpos anti-PLA2R.
Se registraron las variables clínico-demográficas y bioquímicas en el momento del diagnóstico y durante el seguimiento. La creatinina sérica se determinó mediante un método compensado IDMS trazable (Hitachi Modular P-800 Roche Diagnostics, Berlín, Alemania). El filtrado glomerular (eGFR) se calculó mediante la fórmula CKD-EPI20.
Los pacientes fueron clasificados en 2 grupos en función de la presencia o no de anticuerpos anti-PLA2R demostrados bien por inmunohistoquimia en la biopsia renal, bien por evidencia de niveles circulantes elevados en el momento del diagnóstico.
En todas las biopsias renales, se determinó el porcentaje de esclerosis glomerular y la extensión de las lesiones de fibrosis intersticial, clasificada en 4 categorías: 0: ausente; grado I ≤ 25%; grado II: 26-50% y grado III:>50% En las biopsias en las que se dispuso de material incluido en parafina, se realizaron cortes de 5 μ para tinción con anticuerpos anti-PLA2R (HPA012657 Sigma-Aldrich Co.LLC, Munich, Alemania), mediante inmunohistoquímica (IHQ) según la técnica previamente descrita13.
La medición del nivel circulante de anticuerpos anti-PLA2R se hizo mediante ELISA (Euroimmun, Lübeck, Alemania; linealidad: 6-1500 RU/mL; límite de detección más bajo: 0,6 RU/mL). Un título ≥ 20 RU/ml fue considerado positivo.
Seguimiento y controlesTras el diagnóstico, todos los enfermos pasaron por un período de seguimiento y observación previo al inicio del tratamiento inmunosupresor, durante el cual se prescribió tratamiento sintomático que incluyó dieta hiposódica y, en los enfermos diagnosticados a partir del año 1994, tratamiento con bloqueantes de angiotensina y estatinas. Los enfermos que no presentaron RE tras el período de observación recibieron tratamiento inmunosupresor.
Medidas de resultado1) Porcentaje e incidencia de RE. 2) Incidencia de respuesta (remisión total o parcial) en los 12 meses siguientes al inicio del tratamiento de primera línea. 3) Tiempo entre el inicio del tratamiento y remisión. 4) Porcentaje de enfermos con recidiva, incidencia y número total de recidivas. 5) Supervivencia de la función renal libre de tratamiento sustitutivo renal al final del período de seguimiento. 6) Supervivencia de la función renal libre de insuficiencia renal crónica (IRC) al final del período de seguimiento. 7) Frecuencia de aparición de neoplasias de novo o de otras etiologías potencialmente responsables de la NM durante el período de observación.
DefinicionesRemisión completa: proteinuria<0,3g/día en 2 controles consecutivos. Remisión parcial: proteinuria<3,5g/día y>0,3 g/día en 2 controles consecutivos. RE: remisión completa o parcial sin tratamiento inmunosupresor. Recidiva: proteinuria>3,5 g/día asociada a hipoalbuminemia en 2 controles consecutivos tras la supresión del tratamiento. IRC: eGFR<60ml/min/1,73 m2.
El estudio siguió los parámetros de la Declaración de Helsinki y fue aprobado por el Comité de Bioética del centro.
Análisis estadísticoLos resultados se expresan como media y desviación típica para variables de distribución normal o como mediana y rango intercuartil para las de distribución no normal. Las diferencias de medias entre grupos se analizan mediante la t de Student para datos independientes o la U de Mann-Whitney. Las diferencias entre más de 2 medias se analizan mediante análisis de la varianza (ANOVA). Las diferencias entre proporciones, se analizan mediante la prueba de Chi cuadrado o el test exacto de Fisher. Los predictores independientes de RE se analizaron mediante un modelo de regresión logística paso a paso. Su capacidad discriminativa se analizó mediante el cálculo del área bajo la curva ROC y la calibración por categorías de riesgo, mediante la prueba de Hosmer-Lemshow21. El análisis de las variables independientemente asociadas con las tasas de remisión tras el tratamiento y con la supervivencia global de la función renal al final del período de seguimiento se realizó mediante el método de Kaplan-Meier utilizando la prueba de log-rank para diferenciar entre grupos, seguido de un análisis de regresión de Cox para identificar los predictores independientes. Se consideraron estadísticamente significativos todos los valores de p<0,05. Se utilizó el programa estadístico SPSS v. 20.0.
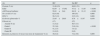
ResultadosEn la tabla 1, se resumen las características clínicas, bioquímicas y anatomopatológicas de los 85 enfermos incluidos en el estudio en función de la presencia o no de anticuerpos anti-PLA2R. El grupo de enfermos anti-PLA2R positivo incluyó a 55 enfermos: en 15 de ellos (27,1%) se detectó la presencia de títulos elevados de anticuerpos anti-PLA2R mediante ELISA, pero no pudo realizarse inmunohistoquimia por ausencia de material suficiente en la biopsia; en 10 enfermos (17,6%) se detectaron depósitos glomerulares por inmunohistoquimia, pero no pudo disponerse de muestra de suero para determinación de título de anticuerpos en el momento del diagnóstico y en 30 (54,5%), se detectó positividad tanto en suero como en biopsia renal.
Características clínicas y anatomopatológicas basales de los enfermos en función de la presencia o ausencia de anticuerpos anti-PLA2R
| Anti-PLA2R | |||
|---|---|---|---|
| Positivo | Negativo | P | |
| Pacientes % (n) | 64,7 (55) | 35,3 (30) | |
| Sexo % (n) | |||
| V | 65,5 (36) | 83,3 (25) | 0,08 |
| M | 34,5 (19) | 16,7 (5) | |
| Edad (años) | 49±16,4 | 57,8±15,7 | 0,019 |
| Colesterol total (mg/dl) | 340,2±85,9 | 326,5±68,4 | 0,461 |
| Albúmina (mg/dl) | 2,39±0,56 | 2,54±0,68 | 0,282 |
| Creatinina (mg/dl) | 1,03±0,3 | 1,48±1,08 | 0,033 |
| Proteinuria (g/24 h) | 10,6±4,6 | 8,6±4,2 | 0,064 |
| Filtrado glomerular (ml/min 71,73 m2) | 81,8±23,65 | 69,11±27,28 | 0,027 |
| Diabetes % (n) | 7,3 (4) | 3,3 (1) | 0,46 |
| Hipertensión arterial % (n) | 34,5 (19) | 20 (6) | 0,16 |
| Bloqueantes de angiotensina ii % (n) | 87,2 (48) | 86,6 (26) | 0,937 |
| Remisión espontánea % (n) | 14,5 (8) | 40 (12) | 0,015 |
| Tratamiento de primera línea (n) | (47) | (18) | |
| Corticoesteroides | 12,8 (6) | 22,2 (4) | |
| Fármacos alquilantes | 25,5 (12) | 11,1 (2) | 0,356 |
| Anticalcineurínicos | 61,7 (29) | 66,7 (12) | |
| Esclerosis glomerular | 14,2±19,1 | 15,9±32,2 | 0,812 |
| Fibrosis (n) | (36) | (16) | |
| Ausente % (n) | 27,8 (10) | 31,2 (5) | |
| Grado I | 47,2 (17) | 43,8 (7) | |
| Grado II | 19,4 (7) | 12,5 (2) | 0,78 |
| Grado III | 5,6 (2) | 12,5 (2) | |
Las negritas resaltan únicamente aquellos valores de “p” menores de 0,05.
Los pacientes anti-PLA2R positivos presentaron significativamente menor edad (0: 0,019), menores cifras de creatinina y mayor eGFR en comparación con los anti-PLA2R negativos (p: 0,033 y 0,027, respectivamente). Analizando la distribución de los valores de creatinina iniciales en ambos grupos, en los pacientes anti-PLA2R negativos se identificó a 3 pacientes que registraron cifras de creatinina excepcionalmente altas en relación con el resto del grupo. Al suprimirse dichos pacientes del análisis, no se observaron diferencias significativas entre los pacientes anti-PLA2R positivos y negativos. No se observaron diferencias en el resto de variables clínicas y anatomopatológicas estudiadas.
El período de observación medio previo al tratamiento fue de 8,34±6,25 meses (mediana 6,5; P25: 6 y P75: 9 meses). Un total de 20 pacientes (23,5%) presentaron RE. La incidencia de RE fue de 0,041 episodios/enfermo/mes. En el análisis univariado, la RE se asoció a menor proteinuria inicial (6,84±3,10 vs. 10,88±4,53 g/24h; p<0,001), mayor albuminemia (2,82±0,65 vs. 2,32±0,54 g/dl; p: 0,001) y negatividad para anticuerpos anti-PLA2R (RE: 12/30 [40%] anti-PLA2R negativos vs. 8/55 [14,5%] en anti-PLA2R positivos; p: 0,015). En el análisis multivariado, la proteinuria y la negatividad para anticuerpos anti-PLA2R fueron los únicos predictores independientes de RE (tabla 2). No hubo diferencias significativas en el tiempo hasta la RE entre enfermos anti-PLA2R positivos y negativos (7,10±2,60 vs. 7,28±2,42 meses; p: 0,893). En los 45 enfermos en los que se midió el título de anticuerpos anti-PLA2R en el momento del diagnóstico, no se apreció asociación entre el título de anticuerpos basal y la frecuencia de RE.
Los 65 enfermos que no presentaron RE recibieron tratamiento inmunosupresor. Diez pacientes (15,6%), recibieron monoterapia con prednisona, 14 (21,8%) recibieron tratamiento con fármacos alquilantes (ciclofosfamida o clorambucilo) asociados a corticoides durante 6 meses, y 41 (63%) fueron tratados con anticalcineurínicos (ciclosporina o tacrolimus) durante un mínimo de 6 y un máximo de 12 meses. No hubo diferencias significativas en cuanto al tipo de fármaco utilizado como primera línea de tratamiento entre enfermos anti-PLA2R positivos y negativos. De los 10 pacientes tratados con corticoides en monoterapia, en 3 (30%) se evidenció remisión parcial durante los 12 meses siguientes al inicio del tratamiento. Dos de ellos presentaron recidiva. El primero recibió tratamiento con ciclofosfamida y presentó remisión parcial. El segundo recibió nuevamente corticoides en monoterapia y entró en remisión parcial. Los 7 enfermos restantes recibieron únicamente tratamiento sintomático. Al final del período de seguimiento, 6 de los 10 enfermos tratado con corticoides (60%) desarrollaron IRC, pero ninguno progresó a ERC estadio v.
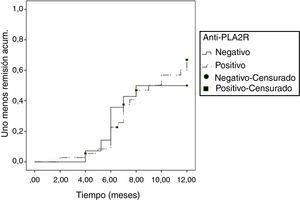
Tras excluir a los enfermos tratados con esteroides en monoterapia del análisis de respuesta, 34/55 enfermos (61,81%) presentaron remisión parcial o total y 21/55 (38,18%) no presentaron respuesta. En la tabla 3 se representan las características clínicas, bioquímicas y anatomopatológicas de los enfermos en función de la respuesta al tratamiento de primera línea, valorada a los 12 meses del inicio. La remisión se asoció a menor proteinuria inicial. Ninguna de las demás variables tuvo asociación significativa con la respuesta al tratamiento inicial durante los primeros 12 meses. La incidencia de remisión durante los primeros 12 meses fue similar en los enfermos anti-PLA2R positivos y negativos (fig. 1; p: 0,780). Tampoco se apreciaron diferencias entre enfermos tratados con fármacos alquilantes y con anticalcineurínicos (p: 0,40).
Características clínicas y anatomopatológicas basales de los enfermos en función de la respuesta al tratamiento de primera línea
| Respuesta | Sin respuesta | p | |
|---|---|---|---|
| Pacientes % (n) | 61,81 (34) | 38,18 (21) | |
| Sexo % (n) | |||
| V | 64,7 (22) | 76,2 (16) | 0,50 |
| M | 35,3 (12) | 23,8 (5) | |
| Edad (años) | 50,7±14,70 | 48,8±18,79 | 0,69 |
| Col tot (mg/dl) | 355,1±82,09 | 346,5±67,56 | 0,69 |
| Albúmina (mg/dl) | 2,35±0,58 | 2,18±0,47 | 0,27 |
| Creatinina (mg/dl) | 1,09±0,60 | 1,36±0,96 | 0,19 |
| eGFR (ml/min) | 82,24±26,89 | 71,21±25,8 | 0,09 |
| Proteinuria (g/24 h) | 11±4,38 | 13,67±2,73 | 0,018 |
| Anti-PLA2R | |||
| Positivo % (n) | 79,41 (27) | 66,7 (14) | 0,37 |
| Negativo | 20,6 (7) | 33,3 (7) | |
| Esclerosis glomerular | 13±17,6 | 10,99±21,7 | 0,74 |
| Fibrosis (n) | (20) | (15) | |
| Ausente % (n) | 25 (5) | 33,3 (5) | |
| Grado I | 55 (11) | 53,3 (8) | 0,80 |
| Grado II | 20 (4) | 13,3 (2) | |
| Grado III | 0 (0) | 0 (0) | |
Col tot: colesterolemia total media.
Los 21 enfermos que no respondieron al tratamiento de primera línea fueron tratados con esquemas de inmunosupresión alternativos. Un total de 9 (90,47%) recibieron anticalcineurínicos y 2 (9,52%), anticalcineurínicos asociados a rituximab, con evidencia de remisión total o parcial en todos los casos.
El tiempo de seguimiento medio fue de 75,3±49 meses (mediana: 62; P25: 39; P75: 105 meses). Durante este período, recidivaron 32 de los 54 enfermos que entraron en remisión (59,2%), incluyendo 6 de los 20 enfermos que presentaron RE (30%) y 26 de los 34 enfermos que entraron en remisión tras el tratamiento (76,4%). El número medio de recidivas fue de 1,59±1,25 (intervalo 0-5). La incidencia de recidiva fue de 0,033 episodios/paciente/año. No se observaron diferencias estadísticamente significativas entre la frecuencia o incidencia de recidiva y ninguna de las variables analizadas. No se apreciaron diferencias significativas en el número de recidivas entre enfermos anti-PLA2R positivos (1,32±0,56) y negativos (1,94±1,74; p: 0,07). Tampoco se apreciaron diferencias significativas en el número de recidivas entre pacientes tratados con anticalcineurínicos y enfermos tratados con agentes alquilantes como tratamiento de primera línea.
Veintiséis (81,2%) de los enfermos que recidivaron fueron tratados con anticalcineurínicos y 6 (18,8%) con agentes alquilantes, consiguiendo remisión total o parcial del síndrome nefrótico en el 93,7% de los casos (n: 30). En 10 enfermos que experimentaron más de 3 recidivas, se mantuvo tratamiento con anticalcineurínicos durante un período medio de 47,8±20,8 meses (rango 22-83). Estos enfermos fueron posteriomente tratados con rituximab, consiguiendo la supresión del tratamiento con anticalcineurínicos en todos los casos22.
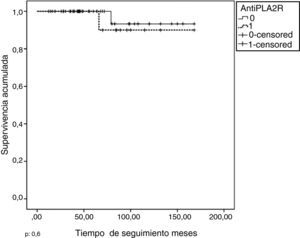
Al final del período de seguimiento, la supervivencia libre de tratamiento renal sustitutivo fue del 95,2%. En la figura 2, se representa la supervivencia de la función renal libre de tratamiento renal sustitutivo en función de la presencia o no de anticuerpos anti-PLA2R. No se apreciaron diferencias significativas entre ambos grupos. La supervivencia de la función renal libre de IRC fue del 70%. En la tabla 4, se resumen las variables asociadas al desarrollo de IRC en el análisis univariado (A) y en el análisis multivariado (B). En este último, solo la edad, la función renal inicial y la evidencia de remisión dentro del primer año tras haber iniciado un tratamiento inmunosupresor fueron predictores independientes del desarrollo de IR.
Variables asociadas a ERC en el análisis univariado (A) y multivariado (B)
| (A) | IRC | Sin IRC | p |
|---|---|---|---|
| Paciente % (n) | 31,08 (23) | 68,91 (51) | |
| Edad | 62,65±17,052 | 47,12±13,85 | < 0,001 |
| eGFR inicial (ml/min) | 59,91±24,8 | 68,19±21,12 | < 0,001 |
| Tto con ECA % (n) | 82,6 (19) | 100 (51) | 0,008 |
| HTA % | 56,5 (13) | 23,5 (12) | 0,008 |
| Esclerosis glomerular % | 23,05±28,63 | 8,78±15,97 | 0,039 |
| Fibrosis (n) | (17) | (27) | |
| Ausente % (n) | 11,8 (2) | 40,7 (11) | |
| Grado I | 35,3 (6) | 51,9 (14) | < 0,001 |
| Grado II | 41,2 (7) | 7,4 (2) | |
| Grado III | 11,8 (2) | 0 (0) | |
| Remisión en primeros 12 meses tras inicio de tratamiento % (n) | 30,8 (4) | 73,2 (30) | 0,009 |
| (B) | B | Wald | OR | IC (95%) | p |
|---|---|---|---|---|---|
| Edad | 0,083 | 6,172 | 1,087 | 1,018-1,161 | 0,013 |
| eGFR inicial | −0,05 | 7,558 | 0,95 | 0,918-0,986 | 0,006 |
| Remisión durante los 12 meses de iniciado tratamiento inmunosupresor % (n) | −2,90 | 4,37 | 0,055 | 0,004-0,834 | 0,036 |
Dos pacientes, uno anti-PLA2R positivo y otro negativo, presentaron neoplasias de novo durante el seguimiento. En ambos casos, se trató de adenocarcinomas de próstata. El tiempo entre el diagnóstico de NM y la presentación de la neoplasia fuede 3,5 años. Dentro del período de observación se produjo la muerte de un paciente varón, anti-PLA2R negativo, que se hallaba en remisión parcial y que falleció por un síndrome coronario agudo 48 meses tras el diagnóstico de NM.
DiscusiónNuestros datos indican que los enfermos con NMI, exceptuando la edad, presentan un perfil bioquímico y anatomopatológico similar en el momento del diagnóstico, indiferente de la presencia de anticuerpos anti-PLA2R. La probabilidad de RE fue significativamente superior en los enfermos anti-PLA2R negativos tras ajustar por la proteinuria y la función renal basal. Estos datos concuerdan con los descritos en algunos estudios recientes14, pero difieren de otros7,11, en los que no se observaron diferencias significativas entre enfermos anti-PLA2R positivos y negativos. La frecuencia de RE observada fue algo inferior a la descrita en estudios previos23-25 y, a diferencia de ellos, no se observó asociación con el tratamiento con bloqueantes del sistema renina-angiotensina-aldosterona ni con la función renal basal. La ausencia de relación con el uso de bloqueadores de angiotensina ii puede explicarse por el hecho de que en la mayor parte de los enfermos que fueron diagnosticados antes del año 1994 no se indicaba de forma sistemática este tipo de fármacos tras el diagnóstico. Este hecho podría también explicar en parte la menor frecuencia de RE observada en nuestra cohorte. Por otra parte, dado que la frecuencia de RE aumenta a lo largo del tiempo25, es probable que períodos de observación más prolongados hubieran resultado en una mayor frecuencia de la misma. La ausencia de relación con la función renal basal puede explicarse por el hecho de que la mayor parte de los enfermos presentaban función renal normal inicial. Los valores de creatinina y eGFR medios basales fueron peores en el grupo de pacientes anti-PLA2R negativos. Se esperaría que en este grupo la probabilidad de RE fuera menor, sin embargo, esto no se observó ni en el análisis univariado ni en el multivariado. La explicación de este hallazgo se halla en el hecho de que en este grupo hubo 3 pacientes con valores de creatinina extremos que influyeron en la magnitud de la media. Tras ser suprimidos del análisis y volver a realizar la comparación, no se observaron diferencias significativas. La negatividad para anti-PLA2R se comportó como variable independiente, asociándose a una mayor probabilidad de RE. De estos resultados podría plantearse que, en los pacientes con NMI anti-PLA2R negativos, el tiempo de observación antes de iniciar tratamiento inmunosupresor activo podría prolongarse, siempre que no se observe exacerbación de la función renal o la proteinuria. No obstante, este hallazgo debe confirmarse por otros estudios, antes de considerar el planteamiento anterior como definitivo.
La evolución tras el inicio del tratamiento, la respuesta al tratamiento de primera línea, recidivas y supervivencia de la función renal fueron similares en enfermos anti-PLA2R positivos y negativos. Estos datos están en concordancia con otros estudios recientementre publicados7,9,10,23. En el análisis multivariado la presencia de anticuerpos anti-PLA2R no fue predictor independiente de la supervivencia de la función renal a largo plazo.
Un último punto destacable de nuestros datos es la evidencia de que, independientemente de la presencia o no de anticuerpos anti-PLA2R, en ninguno de los enfermos que inicialmente fueron clasificados como NMI se diagnosticaron enfermedades potencialmente relacionables con ella tras un seguimiento prolongado, lo que indica que la probabilidad de hallar una etiología secundaria es baja, tanto en enfermos anti-PLA2R positivos como en negativos, si esta no es evidenciable en el momento del diagnóstico.
Al tratarse de una cohorte retrospectiva, nuestro estudio presenta algunas limitaciones y puede estar bajo el efecto de sesgos causados por la influencia de variables no medidas. En primer lugar, aunque en todos los enfermos clasificados como anti-PLA2R positivos hay constancia indudable de la presencia de dichos anticuerpos, la identificación debió realizarse mediante la combinación de técnicas inmunohistoquímicas y serológicas ya que, en algunos enfermos, no pudo disponerse de ambos datos a la vez. Por ello, el análisis de la asociación entre el nivel de anti-PLA2R y la probabilidad de RE pudo analizarse solo en una parte del grupo de enfermos, lo que resta poder estadístico a los resultados. En segundo lugar, el estudio incluye enfermos diagnosticados y tratados durante un período de tiempo muy amplio en el que los protocolos de estudio, seguimiento y tratamiento fueron distintos y no siempre regidos por guías con definiciones explícitas. Este hecho, aunque permite un análisis acorde con la práctica clínica real en cada momento del tiempo, dificulta la comparación de los datos y puede explicar algunas de las diferencias observadas con relación a otras series de enfermos publicadas en las que las decisiones se hayan tomado en función de los criterios definidos en distintos protocolos o guías. A este respecto, debe destacarse que 10 de los 64 enfermos que no presentaron RE recibieron monoterapia con corticoesteroides. Todos ellos fueron tratados antes de la publicación de las distintos estudios en los que se demostraba la ineficacia de dicho tratamiento para modificar el curso clínico de la NMI y, por este motivo, su evolución se describe por separado, siendo excluidos del análisis de eficacia en cuanto a respuesta al tratamiento de primera línea.
En conclusión, nuestros datos indican que los enfermos con NMI asociada a anticuerpos anti-PLA2R presentan mayor edad en el momento del diagnóstico y mayor frecuencia de RE que los enfermos anti-PLA2R positivos. Sin embargo, entre ambos grupos de enfermos, no hemos observado diferencias en cuanto a la respuesta al tratamiento de primera línea, el tiempo hasta la remisión, la frecuencia y número de recidivas, el diagnóstico de posibles etiologías relacionables con la NM, ni el pronóstico al final del período de observación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.