Mantener niveles adecuados de fósforo sérico en el paciente con enfermedad renal crónica es fundamental para su correcto manejo clínico. Sin embargo resulta difícil su control de forma aislada porque normalmente se asocian con aumentos séricos de hormona paratiroidea (PTH). En el presente estudio se analizaron los efectos de la hiperfosfatemia aislada, en presencia de PTH elevada y normal, sobre la inflamación, hipertrofia y fibrosis cardíaca en un modelo de insuficiencia renal experimental.
Materiales y métodosSe formaron cuatro grupos de ratas. A dos grupos se les realizó paratiroidectomía total (PTx). A las ratas con Ca < 7,5 mg/dL y PTH < 50 pg/mL se les realizó nefrectomía 7/8 (IRC) y se les colocó un pellet subcutáneo que libera PTH 1-34 (5 μg/kg/día). Un grupo recibió dieta con P normal (PN) (grupo IRC + PTx + rPTH + PN) y otro dieta con P alto (0,9% PA) (grupo IRC + PTx + rPTH + PA). Otros dos grupos que solo tenían IRC recibieron dieta PN (IRC + PN) y PA (IRC + PA). Se añadió también un grupo SHAM para nefrectomía y paratiroidectomía. Tras 14 semanas las ratas fueron sacrificadas.
ResultadosLos grupos con dieta alta en fósforo (IRC + PA e IRC + PTx + rPTH + PA) tuvieron una reducción significativa del aclaramiento de creatinina y también del peso corporal, con un aumento del fósforo sérico independientemente de la paratiroidectomía, pero no así con los niveles séricos de calcio, FGF23 y de calcitriol que fueron 2-3 veces superiores en el grupo con hiperparatiroidismo secundario (IRC + PA).
El diámetro de los cardiomiocitos fue superior en el grupo IRC + PA, mientras la paratiroidectomía (IRC + PTx + rPTH + PA) los redujo significativamente, a pesar de los elevados y similares valores de fósforo sérico. El TNF-α, Adam17 y la fibrosis cardíaca a nivel histológico y molecular mostraron un patrón similar con aumentos en el grupo con hiperparatiroidismo secundario severo (IRC + PA).
ConclusionesLa hiperfosfatemia confirmó su importancia en la génesis del hiperparatiroidismo secundario, pero también del daño renal que fue independiente de los niveles de PTH. Sin embargo, la inflamación, fibrosis y crecimiento de cardiomiocitos guardaron una mayor relación con los niveles de PTH ya que en presencia de hiperfosfatemia severa similar, la paratiroidectomía redujo los valores de los parámetros inflamatorios, de hipertrofia y fibrosis cardíaca.
Adequate serum phosphorus levels in patients with chronic kidney disease is essential for their clinical management. However, the control of hyperphosphatemia is difficult because is normally associated with increases in serum PTH. In the present study, the effects of hyperphosphatemia, in the presence of elevated and normal PTH, on cardiac inflammation, hypertrophy and fibrosis in an experimental renal failure model were analyzed.
Materials and methodsFour groups of rats were formed. Two groups underwent total parathyroidectomy (PTx). Rats with Ca < 7.5 mg/dL and PTH < 50 pg/mL underwent 7/8 nephrectomy (CRF) and a subcutaneous pellet was placed that releases PTH 1-34 (5 μg/kg/day). One group received a diet with normal P (NP) (CRF + PTx + rPTH + NP group) and another with a high P diet (0.9% HP) (CRF + PTx + rPTH + HP group). Other two groups that only had CRF received NP (CRF + NP) and HP (CRF + HP) diet. A SHAM group for nephrectomy and parathyroidectomy was also added. After 14 weeks the rats were sacrificed.
ResultsThe groups with a diet high in phosphorus (CRF + H A and CRF + PTx + rPTH + HP) had a significant reduction in creatinine clearance and also in body weight with an increase in serum phosphorus regardless of parathyroidectomy, but not serum levels of calcium, FGF23 and calcitriol that were 2-3 times higher in the group with secondary hyperparathyroidism (CRF + HP).
The diameter of the cardiomyocytes was greater in the CRF + HP group, while parathyroidectomy (CRF + PTx + rPTH + HP) significantly reduced them, despite the high and similar serum phosphorus values. TNF-α, Adam17 and cardiac fibrosis at the histological and molecular level showed a similar pattern with increases in the group with severe secondary hyperparathyroidism (CRF + HP).
ConclusionsHyperphosphatemia confirmed its importance in the genesis of secondary hyperparathyroidism, but also of kidney damage that was independent of PTH levels. However, inflammation, fibrosis, and cardiomyocyte growth were more closely related to PTH levels, since in the presence of similar severe hyperphosphatemia, parathyroidectomy reduced the values of inflammatory parameters, cardiac hypertrophy, and fibrosis.
El control de los niveles de fósforo sérico ha sido siempre reconocido como pieza clave en el manejo clínico de pacientes con enfermedad renal crónica (ERC)1. En la ERC avanzada, la excreción renal de fósforo es insuficiente para eliminar la cantidad de fósforo que se absorbe diariamente por la dieta, como consecuencia, la hiperfosfatemia es frecuente2. Las alteraciones en el metabolismo del fósforo se asocian con consecuencias adversas importantes como progresión del hiperparatiroidismo secundario, mayor progresión de la enfermedad renal crónica y aumentos en la mortalidad2-4.
Dado que hiperfosfatemia e hiperparatiroidismo suelen coincidir, resulta difícil evaluar de forma aislada el efecto del incremento de cada uno de estos dos factores. La hiperfosfatemia se ha asociado con pericarditis, hipertensión e hipertrofia ventricular izquierda5 y en ratas con insuficiencia renal crónica se ha asociado con hipertrofia y apoptosis de cardiomiocitos, aumento de la fibrosis miocárdica6,7 e inflamación8.
Del mismo modo, los niveles elevados de PTH han mostrado un efecto hipertrófico directo en cardiomiocitos aislados de ratas adultas9. Existen varios estudios sobre la asociación entre hiperparatiroidismo secundario e hipertrofia ventricular izquierda en pacientes con enfermedad renal crónica avanzada10,11. También el hiperparatiroidismo secundario se ha asociado con el desarrollo de fibrosis cardíaca12, si bien existen pocos datos en relación con el papel que tendrían los niveles elevados de PTH en el desarrollo del proceso inflamatorio que podría preceder a la fibrosis.
Por otro lado, la paratiroidectomía se ha asociado con una regresión de la hipertrofia ventricular y mejora en la contracción cardíaca en pacientes en hemodiálisis13. En ratas con insuficiencia renal crónica, la paratiroidectomía previno la hipertrofia, fibrosis y apoptosis cardíacas14.
En el presente estudio se analizarán los efectos de la hiperfosfatemia aislada en presencia de PTH elevada y normal, sobre la inflamación, hipertrofia y fibrosis cardíaca.
Material y métodosModelo experimentalPara el estudio se utilizaron 30 ratas Wistar macho de cuatro meses (peso 399 ± 46 gramos) procedentes del Bioterio de la Universidad de Oviedo siguiendo el esquema de la figura 1. Se realizó paratiroidectomía (PTx) en un grupo de ratas. Aquellos animales con niveles de calcio sérico total (Ca) < 7,5 mg/dL y PTH (PTH1-84) < 50 pg/mL fueron consideradas óptimos para continuar en el estudio. Trascurridos 10 días de la paratiroidectomía, se indujo insuficiencia renal crónica (IRC) mediante nefrectomía parcial, consistente en la extirpación total del riñón derecho y sección de los polos inferior y superior y de parte del parénquima renal, dejando aproximadamente 1/8 de masa renal15. Simultáneamente a la nefrectomía, en los grupos con PTx, fueron implantados por vía subcutánea pellets para una continua infusión fisiológica de 5 μg/kg/día de PTH 1-34 (rPTH) (Innovative Research of America®, FL, USA). Esta dosis se eligió con base en otros trabajos previos para conseguir un reemplazo fisiológico de PTH tras la paratiroidectomía12,16. En el grupo de ratas con nefrectomía, sin paratiroidectomía, también se administraron pellets subcutáneos con vehículo (Sigma-Aldrich®, MO, USA). Se añadió también como grupo de comparación un grupo SHAM para nefrectomía y paratiroidectomía simuladas, alimentadas con una dieta con contenido normal en fósforo, a los que se les administraron sendos pellets subcutáneos con vehículo (Sigma-Aldrich®).
Todas las ratas con IRC (con o sin PTx) fueron divididas en función de la dieta administrada: dieta normal en fósforo (PN) (0,6% P y 0,6% Ca) (Panlab, Spain) y dieta alta en fósforo (PA) (0,9% P y 0,6% Ca) (Panlab) y estabuladas en jaulas recibiendo comida y agua ad libitum. Después de 14 semanas, las ratas se pasaron a jaulas metabólicas durante 24 horas antes del sacrificio para la recolección de orina.
El sacrificio se realizó por exanguinación usando anestesia con isofluorano y se tomaron muestras de suero para análisis. Se extrajo el corazón que fue lavado dos veces con solución salina para eliminar los coágulos que pudiesen quedar tras la exanguinación, secado concienzudamente con un papel filtrante y pesado y procesado para estudios histológicos y extracción de ARN.
Marcadores bioquímicosSe determinaron calcio total, fósforo, proteínas totales, urea y creatinina en suero y orina mediante el uso de un analizador automático multicanal (Hitachi 717®, Boehringer Mannheim, Alemania). La PTH sérica intacta (1-84) y el FGF23 intacto se midieron mediante un sándwich ELISA (Immunotopics®, USA y Kainos Laboratories®, Japón) y la PTH (1-34) se midió mediante mediante un inmunoanálisis por RIA (Phoenix Pharmaceutical® Inc, USA).
Cambios morfológicos e histológicos y cuantificación de colágeno 1Se utilizó tinción de tricrómico de Masson en tejido cardíaco con el que se resaltan en azul las fibras de colágeno 1 del tejido conjuntivo, tiñendo además el resto de estructuras tisulares. El contenido total de colágeno 1 del miocardio se determinó midiendo el área de colágeno teñida obtenida mediante una imagen semiautomática que se obtuvo con un microscopio Leica DMRXA2 (Leica), con una cámara acoplada de Leica DFC7000T (Leica). Las mediciones fueron ciegas y los resultados se expresaron como porcentajes de área teñida de azul en relación al área total del miocardio. Las imágenes capturadas se analizaron mediante un análisis de imagen (Leica Q500IW®, Leica Microsystems) y software específico (Leica QWIN® versión estándar 2.3, Leica Microsystems).
Grosor de pared y septo ventricular y tamaño de cardiomiocitosPara realizar estas determinaciones se utilizó tinción de hematoxilina-eosina con las que se cuantificó el grosor de la pared, septo y diámetro de cardiomiocitos del ventrículo izquierdo, usando el mismo sistema óptico que el descrito anteriormente en secciones desparafinadas y teñidas con hematoxilina-eosina. Las imágenes capturadas se analizaron mediante el mismo sistema de imagen mencionado anteriormente.
El diámetro medio del cardiomiocito se determinó midiendo de forma aleatoria en 20 cardiomiocitos el ancho del cardiomiocito a la altura del centro del núcleo, como ha sido descrito por otros autores17,18. Se seleccionó con el menor aumento del microscopio siempre la misma zona del ventrículo izquierdo, seleccionado aquellos que estuvieran en un mismo plano, con su núcleo centrado. Para cuantificar el grosor de la pared y septo se utilizó un software de diseño previo que agrupa y analiza un conjunto de al menos 50 mediciones desde los pilares del ventrículo izquierdo al borde exterior, en el caso de la pared, y el borde entre ventrículo izquierdo y derecho en caso del septo.
Marcadores moleculares de inflamación y fibrosisComo marcadores moleculares de inflamación se analizó la expresión génica de factor de necrisis tumoral alfa (TNF-α) y dominio 17 de la metalopeptidasa Adam (Adam17); y para el estudio de los marcadores moleculares de fibrosis cardíaca se analizó la expresión génica de colágeno tipo 1, del factor de necrosis tumoral beta 1 (TGF-β1), fibronectina y factor de crecimiento del tejido conectivo (CTGF). Para realizar estos estudios se procedió a la extracción de ARN y al estudio de la expresión génica por PCR cuantitativa a tiempo real (qPCR). Se homogeneizó un fragmento del corazón (ventrículo izquierdo) de las ratas en un ultraturrax (OmniHT) en reactivo TRI (Sigma-Aldrich, USA), siguiendo las instrucciones del fabricante. La concentración total de ARN y la pureza se cuantificaron por espectrofotometría UV-Vis (NanoDrop Technologies®) midiendo su absorbancia a 260 y 280 nm. La obtención del ADN copia (ADNc) se realizó con un kit de transcripción inversa de ADNc de alta capacidad (Applied Biosystems®, USA) siguiendo las instrucciones del fabricante. La expresión génica se midió por qPCR usando un equipo Stratagene Mx 3005 P® (Agilent Technologies). La amplificación por PCR en tiempo real se hizo mediante sondas TaqMan, se realizó con cebadores específicos de genes (ensayos de expresión génica de Applied Biosystems®). Como gen constitutivo se utilizó la GAPDH. La evaluación cuantitativa relativa de los genes diana se realizó mediante la comparación de los ciclos de umbral utilizando el método ΔΔCt19. Los resultados se representaron como unidades relativas (U.R.) respecto al grupo 1 (IRC + PN) que se ajustó a la unidad. El protocolo fue aprobado por el Comité de Ética en la Investigación de la Universidad de Oviedo.
Análisis estadísticoSe utilizó el test no paramétrico Kruskal Wallis con análisis post-hoc de Bonferroni para la comparación de muestras independientes. Los resultados fueron expresados como mediana y rango intercuartil. Se consideraron diferencias significativas cuando p < 0,05. El programa estadístico utilizado fue R 3.5.0.
ResultadosMarcadores bioquímicos, morfológicos e histológicosA nivel bioquímico (tabla 1), los grupos 2 y 3 con dieta alta en fósforo (IRC + PA e IRC + PTx + rPTH + PA) tuvieron una reducción significativa del aclaramiento de creatinina independientemente de la paratiroidectomía (grupos 3 y 4). En ambos grupos, los niveles de fósforo no difirieron significativamente, sin embargo sí lo hizo el calcio sérico total. A pesar de no haber diferencias significativas en la hiperfosfatemia, los niveles séricos de FGF23 y de calcitriol fueron tres veces superiores en el grupo con hiperparatiroidismo secundario (IRC + PA, grupo 2). Los grupos paratiroidectomizados (grupos 3 y 4) mostraron unos niveles séricos de PTH 1-34 similares a los del grupo uno, pero ligeramente más bajos, aunque no significativamente, que los del grupo con hiperparatiroidismo secundario severo (grupo 2). No se observaron diferencias en el peso inicial entre ninguno de los cuatro grupos, sin embargo, sí hubo diferencias en el peso final. En las ratas alimentadas con fósforo alto (grupos 2 y 3), se observó, además de la hiperfosfatemia, una reducción de peso comparado con grupo control (grupo 1) y con el grupo con dieta normal (grupo 4), estas variaciones fueron independientes de la paratiroidectomía20.
Parámetros bioquímicos en ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en fósforo (0,6% PN) o con alto contenido en fósforo (0,9% PA) con y sin paratiroidectomía
| IRC + PN Grupo 1 (n = 8) Mediana [IQR] | IRC + PA Grupo 2 (n = 6) Mediana [IQR] | IRC + PTx + rPTH + PA Grupo 3(n = 8)Mediana[IQR] | IRC + PTx + rPTH + PN Grupo 4(n = 8)Mediana [IQR] | SHAM Grupo 5 (n = 8) Mediana [IQR] | |
|---|---|---|---|---|---|
| Aclaramiento creatinina (mL/min) | 1,0 [0,9-1,1]a | 0,6 [0,2-0,7] | 0,5 [0,3-0,6]c | 0,9 [0,8-1,1] | 2,7 [2,3-3,2] |
| Urea (mg/dL) | 81,0 [67,8-100] | 132 [70,5-379] | 135 [97,7-211] | 84,5 [77,7-89,0]b | 30,5 [29,2-33,2] |
| Creatinina (mg/dL) | 0,9 [0,9-1,1]a | 2,0 [1,1-4,2] | 1,9 [1,3-3,2] | 1,0 [0,9-1.0]b | 0,4 [0,4-0,5] |
| Calcio total (mg/dL) | 10,5 [10,2-10,7]a | 9,5 [8,7-9,9] | 5,6 [52-5,9]a | 8,1 [7,0-8,5]b | 10,1 [9,9-10,3] |
| Fósforo (mg/dL) | 4,6 [4,3-4,9]a | 10,3 [5,1-21,2] | 12,0 [9,7-17,2] | 9,2 [8,5-10,7]b | 4,6 [4,3-4,9] |
| Proteínas (mg/dL) | 56,7 [52,3-59,0] | 58,0 [51,2-60,1] | 56,6 [52,3-59,6]c | 63,1 [62,2-64,0]b | 63,0 [62,7-64,7] |
| PTH 1-84 (pg/mL) | 1.014 [782-1.658]a | 15.176 [4.064-17.210] | No detectable | No detectable | 761 [372-1350] |
| PTH 1-34 (pg/mL) | 33,0 [27,2-58,4]a | 84,6 [72,8-120,5] | 37,3 [31,4-75,5]a | 39,5 [15,8-88,5] | 27,0 [25,2-41,2] |
| FGF23 (pg/mL) | 424 [299-465]a | 1.176 [1.072-1.200] | 447 [220-1.125]a,c | 729 [484-898]b | 289 [225-443] |
| Calcitriol (ng/mL) | 48,4 [21,5-79,9] | 25,7 [7,3-52,7] | 8,4 [5,8-10,7]c | 12,9 [9,9-39,4] | 48,6 [23,2-59,9] |
| Peso inicial (g) | 394 [369-411] | 373 [336-420] | 381 [355-385] | 388 [359-425] | 390 [364-414] |
| Peso final (g) | 427 [395-446]a | 365 [295-404] | 362 [314-379]c | 412 [3892-4570] | 476 [459-540] |
IRC + PN (grupo 1), nefrectomía 7/8 con dieta normal en fósforo; IRC + PA (grupo 2), nefrectomía 7/8 con dieta alta en fósforo; IRC + PTx + rPTH + PA (grupo 3), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta normal en fósforo; IRC + PTx + rPTH + PN (grupo 4), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta alta en fósforo; SHAM (grupo 5), intervención simulada para nefrectomía y paratiroidectomía.
Los datos se representan con la mediana y el rango intercuartil [IQR].
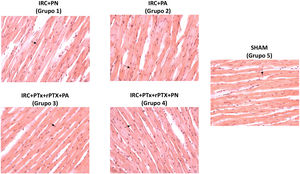
El peso del corazón referido al peso corporal fue significativamente superior en ratas sin paratiroidectomía que recibieron una dieta con alto contenido en fósforo (IRC + PA) (grupo 2) comparados con su grupo control (IRC + PN) (grupo 1). El grosor de la pared y septo no mostró diferencias significativas entre los grupos, pero sí el diámetro de los cardiomiocitos. Los valores más elevados se observaron en el grupo 2 (IRC + PA). La paratiroidectomía (IRC + PTx + rPTH + PA) redujo significativamente ambas cifras (tabla 2 y fig. 2). No hubo diferencias en ningún marcador de hipertrofia cardíaca entre los grupos IRC + PN e IRC + PTx + rPTH + PN (grupos 3 y 4).
Parámetros de hipertrofia cardiaca en el corazón de las ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en fósforo (0,6% PN) o con alto contenido en fósforo (0,9% PA) con y sin paratiroidectomía
| IRC + PN Grupo 1 (n = 8) Mediana [IQR] | IRC + PA Grupo 2 (n = 6) Mediana [IQR] | IRC + PTx + rPTH + PA Grupo 3(n = 8)Mediana[IQR] | IRC + PTx + rPTH + PN Grupo 4(n = 8)Mediana [IQR] | SHAM Grupo 5 (n = 8) Mediana [IQR] | |
|---|---|---|---|---|---|
| Peso corazón/peso corporal (mg/g) | 2,3 [2,3-2,7]a | 3,1 [2,6-4,6] | 3,5 [3,1-4,0] | 2,8 [2,7-3,1] | 2,5 [2,3-2,5]a,b |
| Grosor pared (μm) | 2.542 [2.400- 2.769] | 2.540 [2.426-2.751] | 2.443 [2.401-2.590] | 2.426 [2.165-2.521] | 2.333 [2.142-2.476]a |
| Grosor septo (μm) | 2.156 [2.134- 2.397] | 2.524 [24.345-2.759] | 2.201 [1.899- 2.517] | 2.088 [2.039-2.339] | 1.785 [1.521-1.955]a,b |
| Diámetro cardiomiocitos (μm) | 11,0 [9,7-12,4] | 13,4 [11,6-19,1] | 9,7 [9,3-12,4]a | 10,5 [9,7-11,6] | 9,8 [8,0-10,0]a,b |
IRC + PN (grupo 1), nefrectomía 7/8 con dieta normal en fósforo; IRC + PA (grupo 2), nefrectomía 7/8 con dieta alta en fósforo; IRC + PTx + rPTH + PA (grupo 3), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta alta en fósforo; IRC + PTx + rPTH + PN (grupo 4), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta normal en fósforo; SHAM (grupo 5), intervención simulada para nefrectomía y paratiroidectomía.
Los datos se representan con la mediana y rango intercuartil [IQR].
Imágenes representativas de la tinción de hematoxilina-eosina de los cardiomiocitos en cada grupo (aumentos 40x).
IRC + PN (grupo 1), nefrectomía 7/8 con dieta normal en fósforo; IRC + PA (grupo 2), nefrectomía 7/8 con dieta alta en fósforo; IRC + PTxX + rPTH + PA (grupo 3), nefrectomía 7/8 con paratiroidectomía y dieta alta en fósforo; IRC + PTxX + rPTH + PA (grupo 4), nefrectomía 7/8 con paratiroidectomía y dieta normal en fósforo; SHAM (grupo 5), intervención simulada para nefrectomía y paratiroidectomía.
El análisis de las correlaciones entre parámetros bioquímicos como PTH, FGF23 y calcitriol con los marcadores de hipertrofia cardíaca muestran que el grosor del septo se correlacionó con los niveles séricos de PTH intacta (r = 0,649, p < 0,001) y FGF23 (r = 0,516, p = 0,008). El diámetro de cardiomiocitos también se correlacionó con los niveles de PTH intacta (r = 0,707, p < 0,001).
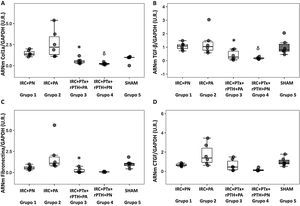
Marcadores moleculares de inflamación y fibrosisEl TNF-α siguió un patrón muy semejante al observado en cardiomiocitos, el grupo 2 (IRC + PA) mostró los valores más elevados en relación con el grupo 3 (IRC + PTx + rPTH + PA). Adam17 mostró un patrón en el mismo sentido. La paratiroidectomía redujo significativamente TNF-α y Adam17 a pesar de los elevados valores de fósforo observados en el grupo 3 (fig. 3, tabla 1).
Marcadores moleculares de inflamación. Gráfico box plot. A) ARNm TNF- α (U.R.), B) ARNm Adam17 (U.R.) en el corazón de las ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en fósforo (0,6% PN) o con alto contenido en fósforo (0,9% PA) con y sin paratiroidectomía.
IRC + PN (grupo 1), nefrectomía 7/8 con dieta normal en fósforo; IRC + PA (grupo 2), nefrectomía 7/8 con dieta alta en fósforo; IRC + PTx + rPTH + PA (grupo 3), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta alta en fósforo; IRC + PTx + rPTH + PN (grupo 4), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta normal en fósforo; SHAM (grupo 5), intervención simulada para nefrectomía y paratiroidectomía.
Los datos se representan con la mediana y el rango intercuartil.
*p < 0,05 vs. IRC + PA
δp < 0,05 vs. IRC + PN.
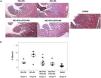
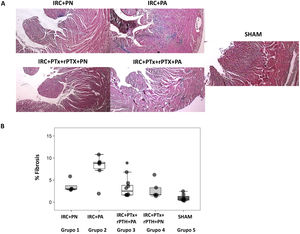
El patrón anterior se repitió en el análisis de la fibrosis cardíaca. El valor más elevado se observó en el grupo 2 (IRC + PA) que mostró un aumento significativo de la fibrosis cardíaca respecto al grupo 3 (IRC + PTx + rPTH + PA) (fig. 4 A y B). Los marcadores moleculares de fibrosis (colágeno tipo 1, fibronectina, TGF-β1 y CTGF) mostraron un patrón similar al de los cambios morfológicos e histológicos (fig. 5). El grupo 2 (IRC + PA) mostró los valores más elevados y la paratiroidectomía (grupo 3) los redujo (pese a la hiperfosfatemia). La misma tendencia se observó al comparar las ratas con dieta normal en fósforo (grupos 1 y 4) en las que con la paratiroidectomía se observaron los valores más bajos.
Fibrosis cardiaca intersticial. A) Imágenes representativas de la tinción de tricrómico de Masson en cada grupo (aumentos 10x). B) Gráfico box plot de la fibrosis cardiaca intersticial medida por la tinción de tricrómico de Masson en el corazón de las ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en fósforo (0,6% PN) o con alto contenido en fósforo (0,9% PA) con y sin paratiroidectomía.
IRC + PN (grupo 1), nefrectomía 7/8 con dieta normal en fósforo; IRC + PA (grupo 2), nefrectomía 7/8 con dieta alta en fósforo; IRC + PTx + rPTH + PA (grupo 3), nefrectomía 7/8 con paratiroidectomía y dieta alta en fósforo; IRC + PTx + rPTH + PA (grupo 4), nefrectomía 7/8 con paratiroidectomía y dieta normal en fósforo; SHAM (grupo 5), intervención simulada para nefrectomía y paratiroidectomía.
Los datos se representan con la mediana y el rango intercuartil.
*p < 0,05 vs. IRC + PA.
Marcadores moleculares de fibrosis cardiaca. Gráfico box plot A) ARNm colágeno 1 (U.R.), B) ARNm TGF-β1 (U.R.), C) ARNm fibronectina (U.R.), D) ARNm CTGF (U.R.) en el corazón de las ratas con nefrectomía 7/8 alimentadas con dieta con contenido normal en fósforo (0,6% PN) o con alto contenido en fósforo (0,9% PA) con y sin paratiroidectomía.
IRC + PN (grupo 1), nefrectomía 7/8 con dieta normal en fósforo; IRC + PA (grupo 2), nefrectomía 7/8 con dieta alta en fósforo; IRC + PTx + rPTH + PA (grupo 3), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta alta en fósforo; IRC + PTx + rPTH + PN (grupo 4), nefrectomía 7/8 con paratiroidectomía + PTH 1-34 y dieta normal en fósforo; SHAM (grupo 5), intervención simulada para nefrectomía y paratiroidectomía.
Los datos se representan con la mediana y el rango intercuartil.
*p < 0,05 vs. IRC + PA
¿ p < 0,05 vs. IRC + PN.
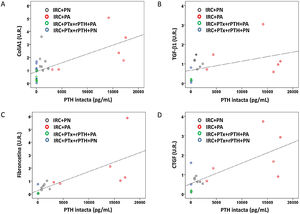
El análisis de las correlaciones entre parámetros bioquímicos como PTH, FGF23 y calcitriol con los marcadores de fibrosis cardíaca muestran que solo los niveles séricos de PTH intacta se asociaron de forma positiva y significativa con la fibrosis cardíaca (r = 0,590, p = 0,006). También se asociaron significativamente con el resto de marcadores moleculares de fibrosis cardíaca (fig. 6): colágeno tipo 1 (r = 0,660, p < 0,001); TGF-β1 (r = 0,436, p = 0,048); fibronectina (r = 0,757, p = 0,001) y CTGF (r = 0,718, p = 0,001).
Correlaciones entre marcadores moleculares de fibrosis cardiaca y niveles séricos de PTH intacta. Gráfico de dispersión simple de las correlaciones de los niveles séricos de PTH intacta con A) ARNm colágeno 1 (U.R.), B) ARNm TGF-βI (U.R.), ARNm fibronectina (U.R.), D) ARNm CTGF (U.R.) en el corazón de ratas de todos los grupos de tratamiento.
Los niveles de ARNm del receptor del canal de calcio TRCP6 mostraron un aumento en el grupo IRC + PA respecto al grupo IRC + PTx + rPTH + PA (1,75 [1,19-2,09] respecto 0,82 [0,12-1,08], p<0,05). Los grupos con contenido normal en fósforo no mostraron diferencias significativas, si bien el grupo paratiroidectomizado tuvo los niveles más bajos (IRC + PN: 1,06 [0,81-1,88]; IRC + PTx + rPTH + PN: 0,58 [0,06-1,10]).
DiscusiónEn este estudio se observó que la dieta alta en fósforo contribuyó al descenso del aclaramiento de creatinina independientemente de la PTH20,21. A pesar de un grado similar de función renal y niveles séricos de fósforo (datos publicados recientemente)20, la presencia de hiperparatiroidismo secundario severo (IRC + PA), pero no así el hiperparatiroidismo secundario moderado (IRC + PN), fue el factor que más pareció influir sobre la hipertrofia cardíaca. Además, la presencia de hiperparatiroidismo secundario severo (IRC + PA) mostró no solo un aumento de la fibrosis cardíaca intersticial sino también de los marcadores moleculares de fibrosis. Si bien el hiperparatiroidismo secundario moderado (IRC + PN) no incrementó significativamente la fibrosis cardíaca intersticial, sí lo hizo con alguno de los marcadores moleculares de fibrosis. Los resultados moleculares de este estudio sugieren que parte de estos efectos se podrían atribuir al aumento en el grado de inflamación. La paratiroidectomía fue capaz de atenuar la hipertrofia y fibrosis cardíaca y los marcadores moleculares de inflamación.
En un modelo similar al nuestro no se observó incremento de hipertrofia miocárdica en las ratas paratiroidectomizadas con dieta alta en fósforo (IRC + PTx + rPTH + PA) cuantificado como relación entre peso del corazón y peso corporal12. Sin embargo, si se analizan otros parámetros más sensibles que el peso del corazón corregido por el peso corporal, como el diámetro de los cardiomiocitos utilizados en el análisis de nuestro estudio, la paratiroidectomía sí que redujo la hipertrofia cardíaca, hallazgo que indicaría que la determinación de hipertrofia cardíaca mediante el estudio de la relación peso del corazón corregida por peso corporal es poco específica. Como factor de corrección otros autores sugieren que la relación peso corazón y longitud de la tibia es preferible si coexiste pérdida de peso corporal22. Un análisis secundario mediante el test estadístico de la U de Mann-Whitney mostró que el desarrollo de hiperparatiroidismo secundario moderado (IRC + PN) incrementó de modo significativo respecto al grupo SHAM varios parámetros de hipertrofia cardíaca (peso en el corazón referido al peso corporal, p = 0,001; grosor del septo, p = 0,001; diámetro de los cardiomiocitos, p = 0,005)
Tampoco podemos descartar que otros factores contribuyan además del hiperparatiroidismo secundario al desarrollo de la hipertrofia cardíaca. De hecho FGF23 ha mostrado su efecto aislado e independiente sobre el desarrollo de hipertrofia cardíaca23, observando en nuestro estudio un efecto sobre el aumento del grosor del septo, como también lo hace la PTH intacta, marcador este último que también se asoció con un mayor diámetro de los cardiomiocitos.
No hay datos en la literatura que relacionen el aumento de fibrosis cardíaca que se observa en presencia de niveles elevados de PTH con incrementos de la inflamación sistémica. En este estudio se ha constatado que la paratiroidectomía, tanto con dieta normal o elevada en fósforo, atenuó la expresión génica de TNF-α y Adam17. Esta disminución sugiere que estos mediadores de inflamación estarían involucrados en el proceso de fibrosis promovido por la presencia de PTH elevadas24. De hecho, este estudio muestra que en presencia de insuficiencia renal crónica, la reducción de PTH, tanto con estímulo hiperfosfatémico o sin ese estímulo, jugarían un papel importante en la reducción de la fibrosis cardíaca intersticial observada en la ERC, hecho observado por otros autores6,7 que indican que el desarrollo de hiperparatiroidismo secundario es un importante factor de riesgo para el desarrollo de fibrosis miocárdica y que esta podría revertirse con la paratiroidectomía25.
El análisis de la expresión génica de marcadores moleculares relacionados con fibrosis apoya el importante papel que juega el incremento de PTH en la génesis de la fibrosis cardíaca. Al comparar los dos grupos de animales alimentados con la dieta alta en fósforo (IRC + PA e IRC + PTx + rPTH + PA) en el primero (grupo 2), se observó un aumento significativo en la expresión génica de colágeno tipo 1 y de fibronectina, dos de las proteínas más representativas de la matriz extracelular, y de TGF-β1, probablemente reflejo de lo observado a nivel de la fibrosis cardíaca intersticial con el tricrómico de Masson. Otros autores, en un modelo de ratas paratiroidectomizadas, analizando algunas proteínas implicadas en el remodelado cardíaco encontraron que la expresión proteica de TGF-β también se encuentra muy influenciada por los niveles de PTH26. Se ha postulado la hipótesis que a través de la PTH se activarían la proteína cinasa C y otras proteínas, como TGF-β1, que a su vez, estimularían la proliferación de fibroblastos, síntesis de colágeno y fibrosis, favoreciendo la fibrosis cardíaca27. De los marcadores moleculares estudiados, el CTGF fue el único que no siguió el mismo patrón y la paratiroidectomía, si bien mostró una tendencia (p = 0,09), no atenuó su aumento en el grupo de animales alimentados con dieta con fósforo alto. Estos resultados apoyan el importante papel que tendría el hiperparatiroidismo secundario en el desarrollo de hipertrofia y fibrosis cardíaca26.
Sin embargo, a pesar del posible efecto que los niveles elevados de PTH intacta puedan tener en el desarrollo de fibrosis cardíaca, no podemos descartar otros factores como FGF23, muy elevado en el grupo IRC + PA, como consecuencia del alto contenido en fósforo. El menor grado de fibrosis cardíaca observado en el grupo paratiroidectomizado con dieta alta en fósforo podría ser atribuible al drástico descenso en PTH intacta, pero también al menor nivel de FGF23 alcanzado en este grupo.
Este efecto se observó con mayor intensidad con el estímulo de la dieta rica en fósforo, pero también se observó en aquellos animales alimentados con dieta normal (grupo 1), en los que la paratiroidectomía (IRC + PTX + PN) atenuó los aumentos de algunos de los marcadores moleculares de fibrosis observados en el grupo no paratiroidectomizado (IRC + PN), grupo que mostró un claro aumento de la fibrosis cardíaca intersticial respecto al grupo SHAM (p = 0,002, resultados no mostrados). A diferencia de la posible implicación de la PTH, pero también del FGF23, en el desarrollo de la fibrosis cardíaca en los animales con dieta con alto contenido en fósforo, en el caso de los animales con dieta normal en fósforo la menor fibrosis cardíaca en algunos de los marcadores moleculares no puede atribuirse al elevado FGF23 donde los niveles del grupo paratiroidectomizado eran incluso superiores. En este caso parece claro que la PTH sea el factor determinante.
La confirmación del papel de la PTH como principal determinante del desarrollo de fibrosis cardíaca parece corroborarse por la importante asociación encontrada entre los niveles de PTH intacta y la fibrosis cardíaca, tanto a nivel histológico como con el resto de marcadores moleculares analizados. FGF23 por el contrario, no mostró asociaciones con ninguno de los parámetros utilizados para cuantificar la fibrosis cardíaca.
Se postula que parte del efecto negativo que tiene el incremento de PTH en la génesis de fibrosis cardíaca sería debido a incrementos de la aldosterona que podría atenuarse o prevenirse con la paratiroidectomía, probablemente a través de evitar aumento del calcio intracelular promovido por las elevaciones de PTH14. Este importante efecto de la PTH mediado por calcio se ve apoyado por los resultados de nuestro estudio en los que se observó que la expresión génica del canal de calcio TCRP6 a nivel cardíaco se atenuó con la paratiroidectomía, disminuyendo más de un 60%, tanto en el grupo con dieta normal (p = 0,036) como alta en fósforo (p = 0,010) (datos no mostrados). Este hecho sugiere que al menos parte de las complicaciones cardíacas podrían estar mediadas por efectos directos de la PTH a través de la activación de los canales de calcio y la movilización secundaria de este elemento desde el retículo sarcoplásmico al citoplasma de los cardiomiocitos28.
Como posibles limitaciones de este estudio podemos destacar que a pesar de utilizar una dosis de reemplazo de PTH 1-34, similar a la descrita por otros autores para alcanzar un reemplazo fisiológico en los grupos paratiroidectomizados16, éste no se alcanzó completamente como lo demuestra la hipocalcemia observada que fue más marcada en los animales con dieta con alto contenido en fósforo, un hecho que también han mostrado otros autores utilizando una dosis de PTH 1-34 similar12.
Otra posible limitación es que no pudimos descartar que otros factores, además del hiperparatiroidismo, pudieran contribuir al desarrollo de la hipertrofia y fibrosis cardíaca como el FGF23, la hipocalcemia o el déficit de calcitriol. De hecho hay autores que encuentran un efecto negativo e independiente del FGF23 sobre el desarrollo de fibrosis cardíaca29,30. No obstante, la ausencia de correlaciones de FGF23 y calcitriol con la fibrosis cardíaca y marcadores moleculares de fibrosis y la importante correlación existente entre PTH intacta con los marcadores de fibrosis cardíaca son indicadores del destacado papel del hiperparatiroidismo secundario en el desarrollo de la fibrosis cardíaca por encima de los otros factores mencionados anteriormente.
En resumen, el presente estudio confirma el importante efecto que tiene la hiperfosfatemia en la génesis del hiperparatiroidismo secundario y del daño renal manifestado por una importante caída del aclaramiento de creatinina en las ratas con PTH elevada, reducción que es independiente de los niveles de PTH. El estudio también muestra que los parámetros de inflamación, fibrosis y crecimiento de cardiomiocitos guardan una relación fundamental con los niveles de PTH, dado que en presencia de hiperfosfatemia severa similar, la paratiroidectomía redujo los valores de los parámetros inflamatorios y de hipertrofia y fibrosis cardíaca.
FinanciaciónEste trabajo ha sido posible gracias a una ayuda a la investigación en nefrología del año 2016 sobre «Búsqueda de nuevas terapias que reduzcan la morbimortalidad asociada a la enfermedad renal crónica». Este estudio también ha sido financiado por el Instituto de Salud Carlos III (ISCIII) - Fondo de Investigación Sanitaria (PI 07/0893, PI 10/00896, PI 13/00014, PI 16/00637, PI 17/00715 y PI19/00532), Fondo Europeo de Desarrollo Regional (FEDER), Plan de Ciencia, Tecnología e Innovación 2013-2017 y 2018-2022 del Principado de Asturias (GRUPIN14-028, IDI-2018-000152), Fundación Renal Íñigo Álvarez de Toledo (FRIAT) y Retic REDinREN de ISCIII (RD06/0016/1013, RD12/0021/0023, RD16/0009/0017, RD12/0021/0006 y RD16/0009/0018). Laura Martinez-Arias ha sido financiada por ISCIII-FINBA (PI 16/00637 y PI 17/00384); Sara Panizo-García por FINBA-REDinREN e IDI-2018- 000152; Natalia Carrillo-López por GRUPIN14-028 e IDI-2018-000152; Sara Fernández-Villabrille por IDI-2018-000152 y PI 17/00715; Julia Martín-Vírgala por una beca de la Universidad de Oviedo y Beatriz Martín-Carro por ISCIII-FINBA (PI17/00384). y por una beca Severo Ochoa, programa BP19-057, del Principado de Asturias.
Autoría/colaboradores
LMA y SPG tuvieron igual contribución como primeros autores; NCL y MND como últimos firmantes; y JBCA y MND como autores de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.