La ecografía renal es una herramienta fundamental en la práctica nefrológica por su carácter no invasivo, accesible y bajo coste. Aunque es ampliamente utilizada para el diagnóstico inicial de patologías renales, su uso como método de seguimiento en la enfermedad renal crónica (ERC) es menos frecuente.
Este trabajo revisa la correlación entre los parámetros ecográficos y la progresión de ERC, considerando que estos pueden reflejar los cambios morfoestructurales del riñón.
Se analizan diferentes parámetros ecográficos: la longitud renal corregida por estatura y el grosor parenquimatoso corregido se asocian significativamente con el filtrado glomerular estimado (FGe). Por el contrario, el grosor cortical y el ancho renal presentan limitaciones y escasa correlación con el FGe.
La ecogenicidad renal, evaluada frente al hígado y bazo, se relaciona con daño renal irreversible, y con cambios histológicos como atrofia tubular y esclerosis glomerular, siendo uno de los mejores predictores ecográficos de progresión de la ERC.
Destaca la puntuación ecográfica de ERC propuesto por Yaprak, que integra: longitud renal, grosor y ecogenicidad parenquimatosa. Esta puntuación ha demostrado una alta capacidad predictiva para identificar un FGe <60mL/min, con un área bajo la curva (AUC) de 0,829, sensibilidad del 81% y valor predictivo positivo del 92%.
Finalmente, se describen los parámetros del Doppler intrarrenal. El índice de resistencia (IR) y la velocidad sistólica máxima (VSM) se correlacionan con el daño histológico renal.
En conclusión, la ecografía renal, correctamente utilizada y contextualizada, puede aportar información valiosa para una evaluación más completa en la progresión de la ERC.
Renal ultrasound is a fundamental tool in nephrological practice due to its non-invasive nature, accessibility, and low cost. Although it is widely used for the initial diagnosis of kidney diseases, its role as a follow-up method in chronic kidney disease (CKD) is less frequent.
This review explores the correlation between ultrasound parameters and CKD progression, considering that these may reflect kidney morphostructural changes.
Several ultrasound parameters are analyzed: renal length adjusted for height and corrected parenchymal thickness show a significant association with estimated glomerular filtration rate (eGFR). In contrast, cortical thickness and renal width present limitations and show poor correlation with eGFR.
Renal echogenicity, assessed against the liver and spleen, is related to irreversible renal damage and histological changes such as tubular atrophy and glomerulosclerosis, being one of the best ultrasound predictors of CKD progression. Of particular note is the CKD ultrasound score proposed by Yaprak, which integrates renal length, parenchymal thickness, and parenchymal echogenicity. This score has demonstrated high predictive ability to identify eGFR <60mL/min, with an area under the curve of 0.829, sensitivity of 81%, and positive predictive value of 92%.
Finally, intrarenal Doppler parameters are described. The resistive index (RI) and peak systolic velocity (PSV) correlate with renal histological damage.
In conclusion, when appropriately applied and interpreted, renal ultrasound can provide valuable information for a more comprehensive assessment of CKD progression.
La ecografía renal es una herramienta fundamental en la práctica nefrológica por su disponibilidad, bajo coste y carácter no invasivo. Se emplea de forma rutinaria para evaluar la morfología renal y detectar enfermedades del parénquima y del tracto urinario, siendo un estudio de primera línea en la valoración inicial del paciente renal. Sin embargo, posiblemente no se utilice con la misma frecuencia para monitorizar la evolución de la enfermedad renal crónica (ERC)1.
En pacientes con ERC, los parámetros ecográficos son de gran utilidad al proporcionar información indirecta de los cambios morfoestructurales que ocurren en el riñón con daño renal crónico2.
La ecografía renal podría complementar a los parámetros de laboratorio que se realizan en el seguimiento de los pacientes con ERC para conseguir una evaluación más completa e individualizada.
En los estudios más importantes donde se aborda esta revisión, definen progresión de ERC como el descenso de filtrado glomerular estimado (FGe) en>10% en un año o duplicación de la creatinina sérica.
Los estudios que hablan de la correlación entre ERC y ecografía no estudian otros factores clínicos como pueden ser la proteinuria y/o albuminuria entre otros, se centran en comparar parámetros ecográficos con el filtrado glomerular.
Combinar información funcional y morfoestructural es algo que no se realiza en la práctica diaria de Nefrología, posiblemente poque la fiabilidad de la ecografía renal se cuestiona debido a que los parámetros ecográficos dependen del operador y las dimensiones renales dependen, en parte, de variables antropométricas1,2.
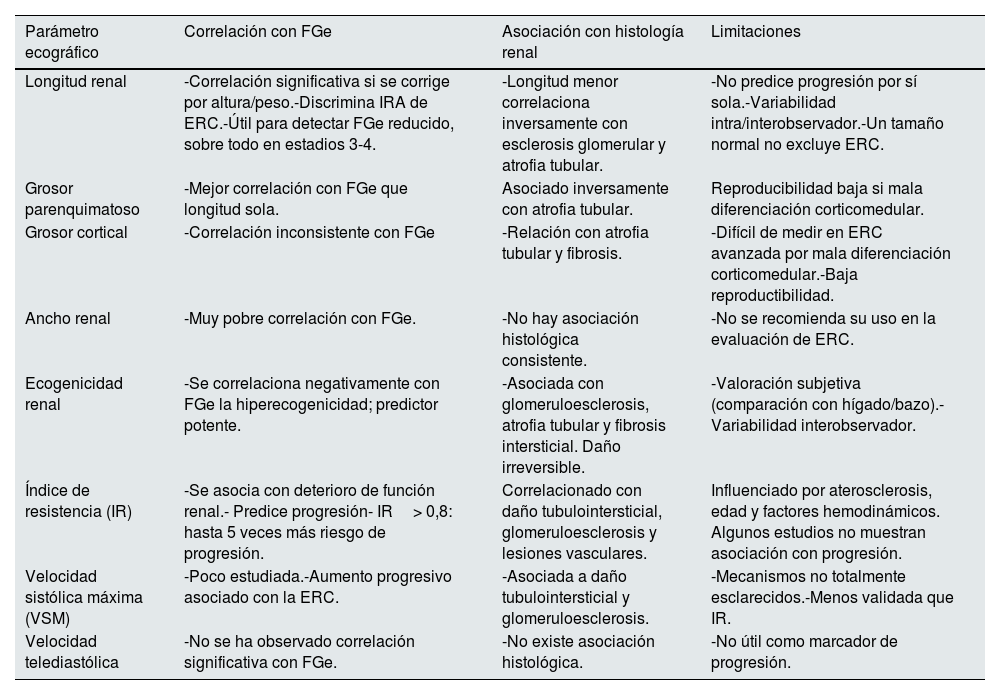
En este texto se describen por apartados las alteraciones estructurales del riñón y qué correlación tienen con la función renal y/o histología renal, con las limitaciones propias de cada parámetro (tabla 1).
Correlación de parámetros ecográficos con filtrado glomerular, histología y sus limitaciones
| Parámetro ecográfico | Correlación con FGe | Asociación con histología renal | Limitaciones |
|---|---|---|---|
| Longitud renal | -Correlación significativa si se corrige por altura/peso.-Discrimina IRA de ERC.-Útil para detectar FGe reducido, sobre todo en estadios 3-4. | -Longitud menor correlaciona inversamente con esclerosis glomerular y atrofia tubular. | -No predice progresión por sí sola.-Variabilidad intra/interobservador.-Un tamaño normal no excluye ERC. |
| Grosor parenquimatoso | -Mejor correlación con FGe que longitud sola. | Asociado inversamente con atrofia tubular. | Reproducibilidad baja si mala diferenciación corticomedular. |
| Grosor cortical | -Correlación inconsistente con FGe | -Relación con atrofia tubular y fibrosis. | -Difícil de medir en ERC avanzada por mala diferenciación corticomedular.-Baja reproductibilidad. |
| Ancho renal | -Muy pobre correlación con FGe. | -No hay asociación histológica consistente. | -No se recomienda su uso en la evaluación de ERC. |
| Ecogenicidad renal | -Se correlaciona negativamente con FGe la hiperecogenicidad; predictor potente. | -Asociada con glomeruloesclerosis, atrofia tubular y fibrosis intersticial. Daño irreversible. | -Valoración subjetiva (comparación con hígado/bazo).-Variabilidad interobservador. |
| Índice de resistencia (IR) | -Se asocia con deterioro de función renal.- Predice progresión- IR> 0,8: hasta 5 veces más riesgo de progresión. | Correlacionado con daño tubulointersticial, glomeruloesclerosis y lesiones vasculares. | Influenciado por aterosclerosis, edad y factores hemodinámicos. Algunos estudios no muestran asociación con progresión. |
| Velocidad sistólica máxima (VSM) | -Poco estudiada.-Aumento progresivo asociado con la ERC. | -Asociada a daño tubulointersticial y glomeruloesclerosis. | -Mecanismos no totalmente esclarecidos.-Menos validada que IR. |
| Velocidad telediastólica | -No se ha observado correlación significativa con FGe. | -No existe asociación histológica. | -No útil como marcador de progresión. |
Esta revisión tiene como objetivo identificar los parámetros ecográficos que mejor se correlacionan con el FGe así como identificar parámetros ecográficos relacionados con la progresión de la ERC.
LongitudSe considera un tamaño renal normal el comprendido entre 9 y12cm. Longitudes por debajo de 9cm sugieren daño crónico avanzado, mientras que la asimetría>1,5cm indica patología unilateral. No obstante, un tamaño normal no excluye enfermedad renal3.
Existen numerosos estudios que correlacionan las dimensiones renales con datos funcionales como el FGe. La longitud del riñón es útil para discriminar la insuficiencia renal aguda (IRA) de la ERC: en la IRA el tamaño renal suele ser normal, mientras que en la ERC se observa una reducción del mismo2,4.
Lucisano et al.1 encontraron diferencias significativas entre la longitud del riñón no corregida y la longitud del riñón corregida por parámetros antropométricos en el rango con FGe 30-90mL/min, y confirma que los cambios más importantes en el riñón suceden en el estadio 2 y 3 de la ERC, teniendo que corregirse la longitud renal siempre por altura y peso.
La longitud corregida es el mejor parámetro del modo B medido y presenta más sensibilidad (S:82,4%) y especificidad (E:75,8%) si se compara como parámetros aislados con el grosor del parénquima y corteza renal1. Existen varias fórmulas para calcular el FG a partir de la longitud renal junto al sexo, la estatura, la superficie corporal, etc., pero son poco útiles porque requieren múltiples medidas de la longitud del riñón dada la variabilidad intra e inter observador3,5,6.
La longitud renal corregida por peso y altura, según la fórmula propuesta por Harmse7, es el parámetro en modo B que mejor discrimina la presencia de un FGe moderadamente reducido, superando al grosor parenquimatoso y cortical cuando se analizan de forma aislada1. No obstante, la longitud renal por sí sola no predice la progresión de la ERC; para adquirir valor pronóstico debe acompañarse de otros indicadores ecográficos de cronicidad, como adelgazamiento del parénquima o aumento de la ecogenicidad, que analizaremos posteriormente6.
Fórmula de tamaño renal (mm) corregida por altura y peso:
=49,18 + 0,20605 × peso (kg) + 0,27360 × altura (cm)
Varios estudios han detectado diferencias en los hallazgos ecográficos entre pacientes con y sin diabetes mellitus (DM)8,9. Ham et al.8 comprobaron mediante un estudio longitudinal de 3,8 años en 162 pacientes con DM diagnosticada por biopsia renal, que los pacientes con DM tienen un mayor volumen y longitud renal que los pacientes sin DM, además, la ecogenicidad cortical renal es mayor en pacientes con DM en etapa temprana que en aquellos sin DM9,10. En este mismo estudio se confirmó que la asociación de longitud, grosor parenquimatoso y ecogenicidad renal aumentada se asocia a progresión de la ERC.
En un estudio retrospectivo sobre pacientes sometidos a biopsia renal se mostró que una menor longitud renal se asocia de forma significativa con mayor presencia de esclerosis glomerular y atrofia tubular11. Otro estudio encontró que el tamaño renal estaba inversamente correlacionado con la extensión de la esclerosis glomerular y la atrofia tubular12 evidenciando que la reducción del tamaño renal refleja un daño estructural avanzado.
Por último, hay que destacar que un riñón de pequeño tamaño junto con un parénquima renal adelgazado ofrece una mayor discriminación que cada valor aislado para determinar un deterioro de función renal.
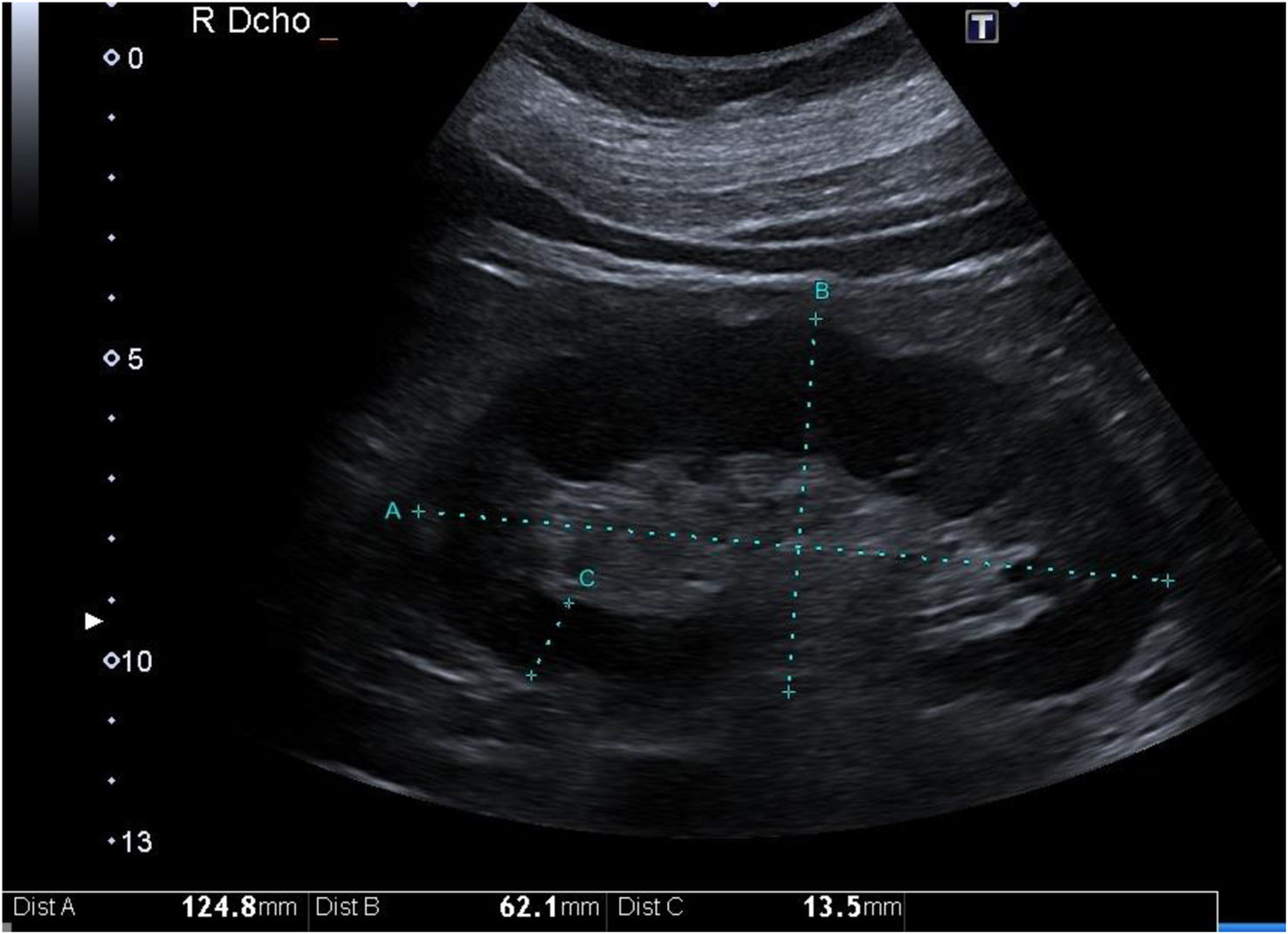
Grosor parenquimatoso, grosor cortical y ancho renalExiste correlación del grosor parenquimatoso con el grado de ERC mejorando estadísticamente esta asociación si se corrige por altura corporal1. Se ha asociado inversamente con el grado de atrofia tubular. Sin embargo, no es así con el espesor cortical11 (fig. 1).
El espesor parenquimatoso corregido fue el único parámetro de modo B (excluido la ecogenicidad parenquimatosa) que se redujo de forma progresiva conforme disminuía el FGe. Este parámetro demostró tener mayor especificidad según la curva ROC para distinguir un FGe inferior a 60mL/min comparado con las curvas ROC de la longitud, cortical y ancho renal. Sin embargo, presentó un área bajo la curva (AUC) inferior en comparación con la ecogenicidad del parénquima renal1,12.
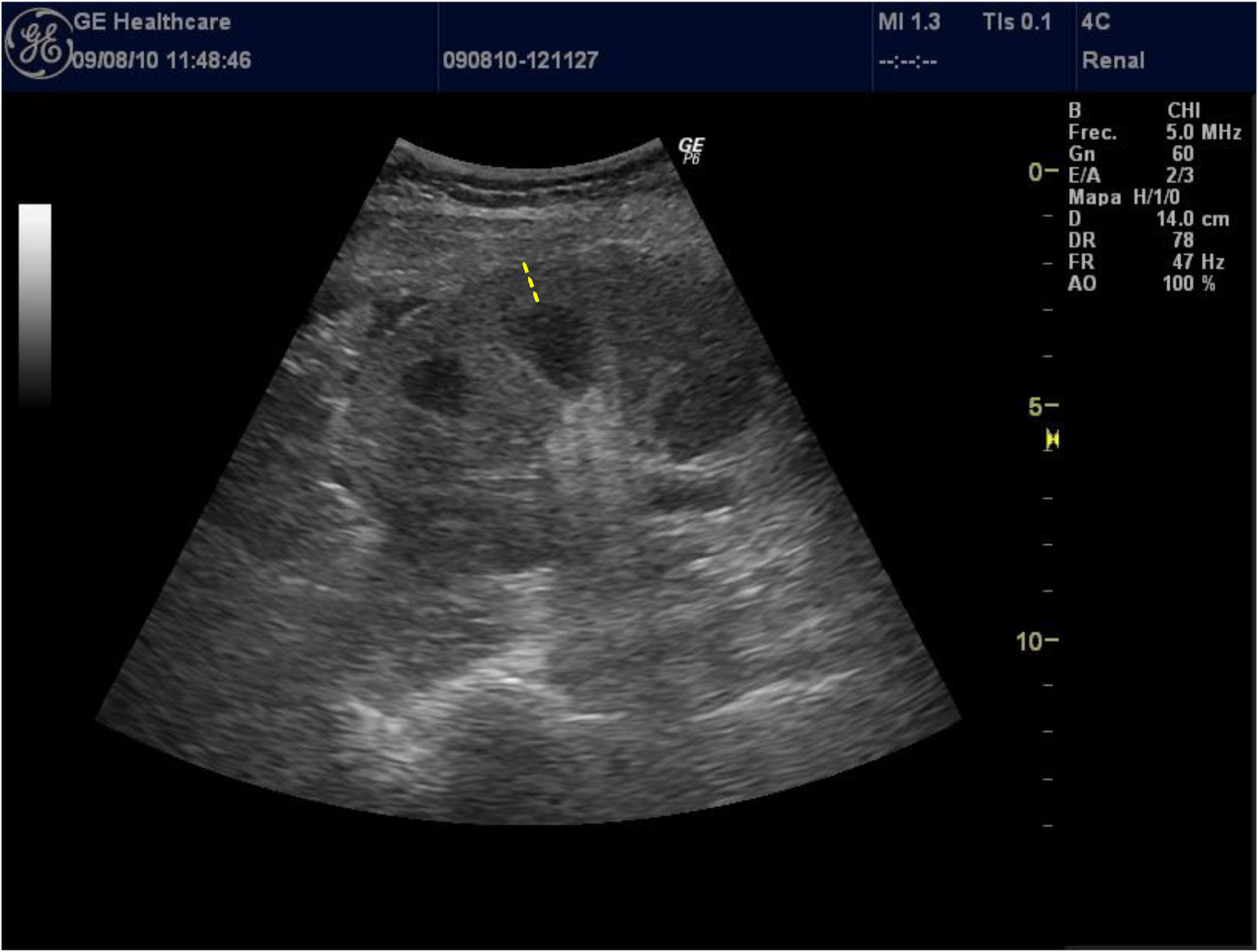
El parámetro del grosor de la corteza renal es poco utilizado por los investigadores por la dificultad de medición en pacientes con mala diferenciación coticomedular, hallazgo que se observa más frecuentemente en paciente con ERC avanzada. Al presentar una interfaz difícil de identificar, la reproductibilidad es baja, por este motivo pocos estudios lo utilizan y esto se traduce en que no haya datos consistentes acerca de la asociación de grosor de la corteza renal y deterioro de función renal. Asimismo, Beland et al.13 demostraron que el grosor de la cortical estaba estrechamente correlacionado con el FGe (fig. 2).
El ancho del riñón es un parámetro con peor correlación, incluso corregido por altura, por lo que es un parámetro que no se debería considerar en la evaluación de riñones con ERC1,14.
Por lo descrito anteriormente, los estudios encuentran que los parámetros que mejor se correlacionan con el FGe son la longitud renal y espesor parenquimatoso corregido por la altura corporal y peso1,12.
Ecogenicidad del parénquima renalUna elevada ecogenicidad parenquimatosa del riñón es un aumento en la capacidad del parénquima para reflejar las ondas de ultrasonido en la ecografía. La ecogenicidad únicamente se evalúa en comparación con otras estructuras adyacentes como son el hígado y el bazo. La medición de la ecogenicidad renal podría ayudar a evaluar el estado inicial y el pronóstico renal.
O’Neill et al. demostraron que una corteza delgada y elevada ecogenicidad indica un daño irreversible15. Libório et al. señalaron que una mayor ecogenicidad renal comparándolo con hígado y bazo puede identificar aquellos pacientes con ERC avanzada irreversible sobre todo en aquellos pacientes con un tamaño renal normal16.
En el estudio de Ham et al.8 de 2023, que incluyó 252 pacientes con parámetros ecográficos y analíticos, observaron una correlación negativa entre la ecogenicidad renal y el FGe, además, demostró que una mayor ecogenicidad renal se asoció de forma significativa con un mayor riesgo de progresión de la ERC6.
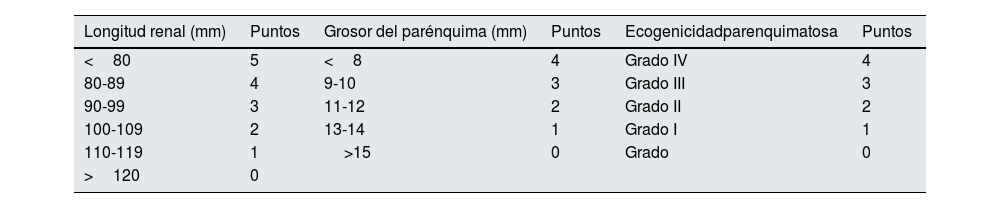
El grupo de trabajo de Yaprak et al.12 investigaron si existía asociación entre FGe y la puntuación de ERC a través de ecografía (tabla 2). En este estudio de 2016 con 120 pacientes, desarrollaron y validaron una puntuación ecográfica para la ERC, basada en tres parámetros: longitud renal, grosor parenquimatoso y ecogenicidad cortical. observaron que esta puntuación se correlacionaba de forma inversa con el FGe. El análisis de la curva ROC para identificar un FGe <60mL/min mostró que una puntuación> 4,75 (media de la suma de las puntuaciones de ambos riñones) fue el mejor parámetro con el AUC más alto (0,829), presentando sensibilidad del 81%, especificidad del 65% y un valor predictivo positivo del 92%12.
Sistema de puntuación de ERC a través de parámetros ecográficos
| Longitud renal (mm) | Puntos | Grosor del parénquima (mm) | Puntos | Ecogenicidadparenquimatosa | Puntos |
|---|---|---|---|---|---|
| <80 | 5 | <8 | 4 | Grado IV | 4 |
| 80-89 | 4 | 9-10 | 3 | Grado III | 3 |
| 90-99 | 3 | 11-12 | 2 | Grado II | 2 |
| 100-109 | 2 | 13-14 | 1 | Grado I | 1 |
| 110-119 | 1 | >15 | 0 | Grado | 0 |
| >120 | 0 |
La correlación fue aún más notable en pacientes diabéticos, lo que sugiere que esta puntuación ecográfica podría ser especialmente útil en la evaluación de ERC en este grupo. Además, dentro de los componentes de la puntuación, la ecogenicidad parenquimatosa fue el parámetro con mayor fuerza de asociación con el FGe12.
Por otro lado, Siddappa et al. también observaron una asociación entre el aumento de la ecogenicidad renal y niveles más elevados de creatinina sérica, lo que respalda su relación con el deterioro funcional17. No obstante, persisten discrepancias en la literatura acerca de cuál es el parámetro ecográfico más fiable para evaluar la ERC.
En un estudio con biopsia renal han demostrado que la hiperecogenicidad cortical se correlaciona con glomeruloesclerosis (GS), fibrosis intersticial y atrofia tubular, hallazgos que indican un daño renal irreversible18. Los mecanismos propuestos por los cuales la atrofia tubular podría aumentar la ecogenicidad cortical renal incluyen el engrosamiento de las membranas basales tubulares o la dilatación luminal de los túbulos restantes18.
En resumen, ninguno de los parámetros ecográficos en modo B ha demostrado por sí solo un valor suficiente como marcador de progresión de la ERC, dado que la mayoría de los estudios disponibles presentan un diseño transversal. Entre los parámetros individuales, la ecogenicidad parenquimatosa es el que muestra una correlación más fuerte con el FGe, seguida del grosor parenquimatoso y, finalmente, de la longitud renal, siempre ajustada a peso y altura. Sin embargo, la combinación de estos parámetros ofrece una mayor potencia diagnóstica y predice la progresión de ERC. Así lo evidencian los estudios de Yaprak et al.12 y Ham et al.8, donde una puntuación ecográfica superior a 4,75 se asoció con un FGe <60mL/min, con una sensibilidad del 81%, especificidad del 65% y un valor predictivo positivo del 92%.
Doppler renalEs importante conocer el papel de la ecografía Doppler intrarrenal o parenquimatoso para la evaluación de la patología renal de pacientes con ERC. Sus parámetros permiten evaluar alteraciones vasculares y tubulointersticiales (TI) que no son visibles en modo B.
La velocidad sistólica máxima (VSM) es uno de los parámetros menos estudiados para la evaluación de la ERC. VSM es un indicador semicuantitativo del flujo sanguíneo renal depende de la distensibilidad de las arteriolas renales, estando asociada con la compliancia vascular renal y la resistencia vascular19.
El estudio retrospectivo de 992 pacientes de Chen et al.20 evaluó la correlación de los parámetros Doppler (índice de resistencia (IR), VSM y la velocidad telediastólica) con cambios histopatológicos.
A continuación, mostramos la fórmula para calcular el IR, aunque todos los parámetros los calcula el equipo de ecografía de forma automática:
IR=(velocidad sistólica máxima – velocidad diastólica final) / velocidad sistólica máxima
Tanto el IR como la VSM se correlacionaron con el deterioro del FGe y con mayor puntuación de daño histológico. En particular, una VSM elevada en arterias interlobulares se asoció con GS y daño túbulo-intersticial, aunque los mecanismos fisiopatológicos que explican esta relación aún no se conocen completamente20.
El IR es un indicador de la resistencia vascular renal causada habitualmente por la ateroesclerosis siendo esta medida muy utilizada pues es independiente del ángulo de insonación y presenta baja variabilidad interobservacional.
En varios estudios se observó asociación independiente entre IR y deterioro de función renal, no así con la progresión de la ERC21–24. Sin embargo, en el estudio de Chen et al. no vieron asociación de un IR aumentado y disminución de la función renal, pero sí demostraron una correlación fuerte entre un IR elevado y presencia de daño TI20. Otros estudios han informado que un IR aumentado se relaciona con GS, daño TI y lesiones vasculares25,26.
En un estudio longitudinal de cinco años, Petersen et al.24 con 64 pacientes, mostraron que un IR> 0,8 se asociaba con un riesgo hasta cinco veces mayor de progresión a tratamiento renal sustitutivo25. Otros autores como Hanamura et al.22 con seguimiento de dos años y Sugiura et al.23 con 3,5 años de observación corroboran la asociación descrita previamente por Petersen et al.24, de hecho Surgiura et al.23 expone que el IR es un factor independiente de reducción de filtrado glomerular o necesidad de terapia renal sustitutiva.
En cuanto a la velocidad telediastólica no demostró una relación constante con el FGe y no se recomienda como marcador de progresión20,21.
En resumen, tanto el IR como la VSM interlobular son parámetros útiles para identificar disfunción renal y daño histológico relevante. La VSM aumenta de forma progresiva a medida que avanza la ERC y se ha asociado con GS y lesión túbulo-intersticial, por lo que podría actuar como marcador de progresión. El IR, por su parte, se relaciona de manera consistente con alteraciones estructurales renales; no obstante, la evidencia sobre su capacidad para predecir el deterioro del FGe es heterogénea. Por ello, se necesitan estudios prospectivos con metodologías más robustas que confirmen su valor pronóstico y su utilidad en la toma de decisiones clínicas.
ConclusionesLa ecografía renal es una herramienta infravalorada en la evaluación de la ERC y su progresión. La ERC suele estratificarse según los niveles de FGe, sin embargo, que los niveles de FGe están influenciados por factores funcionales y farmacológicos que alteran la hemodinámica sistémica o renal, no reflejan con precisión el grado de ERC. Por tanto, en una correcta evaluación de pacientes con ERC es importante que el nefrólogo conozca si las modificaciones en la función renal van acompañadas de cambios morfoestructurales. Finalmente, la ecografía podría ser de utilidad para diferenciar proceso agudo o crónico en los pacientes en los que desconocemos su historia nefrológica.
FinanciaciónLos autores declaran que no han recibido financiación para la realización de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.