INTRODUCCIÓN
El diagnóstico y el tratamiento del rechazo mediado por anticuerpos antidonante, o rechazo humoral (RH), es una de las principales discusiones que lidera actualmente el ámbito del trasplante renal. La búsqueda de marcadores histopatológicos que nos permitan hacer un diagnóstico de RH, contrariamente a la expresión histológica del rechazo celular o túbulo-intersticial, ha sido más problemática. Si bien la relación entre anticuerpos antidonante postrasplante y el pronóstico del injerto ha sido un tema clásico de discusión, liderado principalmente por P. Terasaki1,2, fue a principios de los años noventa cuando el grupo de P. Halloran3,4 profundizó en el estudio de los mecanismos humorales del rechazo. Feutch5, en el año 1993, describe la importancia de los depósitos de C4d, como marcador que manifiesta un mecanismo humoral de rechazo del injerto. Como resultado de los múltiples estudios realizados el grupo de consenso de Banff estableció el año 20036 unos criterios histopatológicos diagnósticos del rechazo agudo humoral (RAH) que han sido modificados ligeramente en las posteriores reuniones del grupo. Asimismo, en 2005 este mismo grupo de trabajo profundizó en los mecanismos fisiopatológicos causantes del fracaso crónico del injerto, y se establecieron los criterios que definen el rechazo crónico humoral7. En esta revisión intentamos actualizar los criterios histopatológicos de utilidad para el diagnóstico del RH, tanto en la fase aguda como en el estadio crónico.
RECHAZO AGUDO HUMORAL
La distinción entre rechazo agudo humoral (RAH) y rechazo agudo túbulo-intersticial (RATI) es importante desde el punto de vista etiopatogénico, clínico y terapéutico, ya que el RAH conlleva un peor pronóstico y un mayor porcentaje de corticorresistencia8-10. Si bien el RATI presenta unos criterios histológicos bien caracterizados y graduados por consenso internacional según el grupo de expertos de Banff6,7,11-15, la identificación de RAH en la biopsia renal es más problemática, por tres razones fundamentales. En primer lugar, no existen alteraciones histopatológicas específicas; en segundo lugar, las alteraciones pueden no ser representativas y de mínima intensidad y, en tercer lugar, pueden coexistir con un RATI.
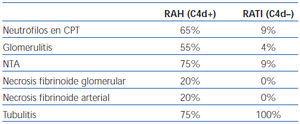
Halloran, et al.3,4, a principios de 1990, describieron la tríada disfunción del injerto, neutrófilos en capilares peritubulares y presencia de anticuerpos antidonante de tipo HLA tipo I, que definía una entidad nueva distinta al rechazo celular agudo clásico y al rechazo hiperagudo. Posteriormente, Trpkov, et al.16 describen una serie de marcadores histológicos, entre los que destacan la vasculitis severa, que incluye necrosis fibrinoide, glomerulitis, trombos en capilares, infartos y presencia de polimorfonucleares neutrófilos (PMN) en capilares peritubulares (CPT) que, junto con la presencia de anticuerpos antidonante anti-HLA clase I, definen como específicos de rechazo mediado por anticuerpos. Estudios publicados más recientemente por el grupo de Colvin10,17 confirman y amplían estas características histológicas que definen al RAH (tabla 1). Entre estos marcadores histológicos cabe destacar la necrosis fibrinoide, tanto glomerular como arterial, ya que su presencia es casi patognomónica, a pesar de su baja incidencia en la biopsia17 y, además, indica un peor pronóstico del RAH. Mauiyyedi, et al. observan un 40% de pérdidas del injerto en el primer año en los casos con necrosis fibrinoide frente al 27% en las biopsias sin necrosis10.
Sin embargo, el diagnóstico histológico de RAH sigue siendo problemático, sobre todo en los casos poco expresivos. Los estudios con inmunofluorescencia para detección de inmunoglobulinas (IgG, IgM e IgA), factores del complemento (C3,C4 y C1q) y fibrina han resultado ser poco específicos. Feucht, et al.5 fueron los primeros investigadores que utilizaron como prueba diagnóstica el anticuerpo anti-C4d. Éste es un producto de degradación del factor del complemento C4, que se activa normalmente en la vía clásica y que forma una unión covalente con los elementos titulares en el lugar de activación que es estable y duradera, características por las cuales es útil como marcador diagnóstico. Estos autores comprobaron que la supervivencia del injerto a un año era notablemente inferior en los casos que expresan C4d (57% frente al 90%)5.
Collins, et al.17, posteriormente, encuentran una correlación entre depósitos de C4d intensos y difusos (superior al 50%) en CPT, anticuerpos antidonante circulantes y hallazgos histológicos indicativos de RAH (tabla 1), y es más útil la presencia de neutrófilos en CPT. Mauiyyedi, et al.10 demuestran una sensibilidad del 95% y una especificidad del 96% para el C4d, siempre y cuando se incluya la presencia de anticuerpos antidonante como criterio diagnóstico de RAH. Sin embargo, existen otros autores que encuentran una sensibilidad mucho más baja (entre el 23 y el 31%), pero mantienen una especificidad muy alta (93%), en relación con la presencia de anticuerpos antidonante anti-HLA9,18. Estas discrepancias pueden justificarse por la diferente sensibilidad de las técnicas empleadas para la detección de anticuerpos antidonante circulantes, así como por el tipo de técnica (inmunohistoquímica o inmunofluorescencia) y el tipo de anticuerpo utilizado para detectar el C4d (monoclonal o policlonal). Debido a la alta especificidad se puede concluir con estos hallazgos que un resultado positivo, siempre y cuando el depósito de C4d en CPT sea difuso e intenso, indica rechazo mediado por anticuerpos, pero un resultado negativo o de tinción focal no lo descarta.
Criterios de Banff para rechazo humoral agudo
Con todos estos datos expuestos previamente en la Séptima Conferencia de Banff celebrada en junio de 2003 en Aberdeen, se establecieron los criterios para el diagnóstico de RAH o mediado por anticuerpos6,13, que incluyen tres aspectos fundamentales (tabla 2):
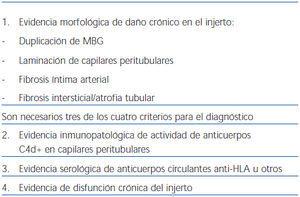
1. Evidencia morfológica de daño agudo tisular en el órgano trasplantado.
a. Daño tubular agudo.
b. Neutrófilos y/o células mononucleares en capilares peritubulares y/o glomérulos, y/o trombosis capilar (figura 1).
c. Arteritis intimal/necrosis fibrinoide/inflamación intramural o transmural en arterias.
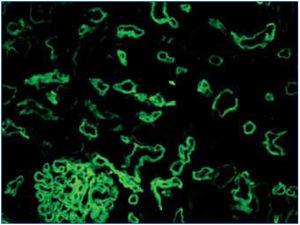
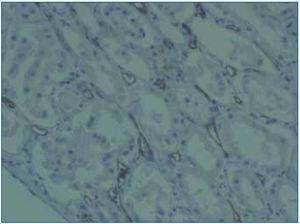
2. Evidencia inmunopatológica de actividad de anticuerpos: C4d y/o (raramente) inmunoglobulinas en capilares peritubulares. El depósito de C4d debe ser intenso y difuso (>50%) (figura 2 y figura 3).
3. Evidencia serológica de anticuerpos circulantes contra antígenos HLA u otros antígenos antiendotelio del donante.
Son necesarios los tres criterios para hacer un diagnóstico definitivo de RAH. Si existen criterios morfológicos indicativos y C4d+, pero falta la demostración de anticuerpos antidonante debe informarse como «sospechoso de RAH»6. En el caso de presentar signos histológicos sospechosos y evidencia de anticuerpos circulantes, pero ausencia de depósitos de C4d, debe considerarse como «sospechoso» o «consistente» con RAH6.
Es importante tener en cuenta que el RAH no siempre aparece como una entidad aislada, sino que puede coexistir con otras entidades, lo cual dificulta su diagnóstico. La clasificación de Banff incluye al RAH dentro de la categoría 2 (rechazo mediado por anticuerpos), pero considera que puede coincidir con otras tres categorías (rechazo bordeline, rechazo agudo celular y nefropatía crónica del injerto)6 (tabla 2). Además, puede haber casos con muy poca expresión histológica, que pueden mostrar únicamente necrosis tubular aguda. Por ello se recomienda realizar técnicas de C4d en todos los casos de disfunción aguda del injerto, incluso en casos sin signos histológicos de rechazo humoral.
Valoración de los depósitos de C4d
Para el diagnóstico de rechazo humoral los depósitos de C4d en capilares peritubulares deben de ser intensos y difusos (>50%). Un aspecto controvertido es el significado de los depósitos focales y no intensos de C4d. Estos depósitos focales podrían ser la traducción de un rechazo mediado de anticuerpos de intensidad menor, o bien ser el reflejo de un proceso dinámico, y estos depósitos corresponderían a una fase precoz del proceso o a una fase tardía en la que parte de los depósitos ya hayan sido eliminados. En relación con este hecho, Mengel19, en un estudio realizado en biopsias de protocolo, ha revisado los criterios usados para la graduación del C4d, y ha observado que los depósitos focales de C4d (depósitos entre el 10 y el 50% de capilares peritubulares) se asociaban con capilaritis y con glomerulitis. Dos estudios recientes observan anticuerpos antidonante en el 38% y en el 69%, respectivamente, de los casos con depósitos focales15,20,21. Otros autores sugieren que los casos con C4d focal muestran un pronóstico intermedio entre los casos difusos y los negativos22-24. Basándose en estos estudios, se han establecido los criterios para graduar los depósitos de C4d (tabla 3)14,15.
Se puede concluir que el depósito focal o poco intenso no es suficiente para el diagnóstico de RAH, pero obliga a realizar pruebas para detección de anticuerpos antidonante y a hacer un seguimiento estrecho y cuidadoso del paciente.
Otros puntos que deben valorarse en la biopsia con respecto al C4d son los siguientes: la positividad en capilares peritubulares es más intensa en la corteza que en la médula renal; los depósitos de C4d en arteriolas, íntima arterial y membranas basales de túbulos, así como en glomérulos se consideran inespecíficos.
Métodos de detección de C4d
Existen dos métodos de detección de C4d: inmunofluorescencia indirecta (figura 2) e inmunohistoquímica (figura 3).
1. La inmunofluorescencia indirecta (en dos o tres pasos), con anticuerpo monoclonal anti-C4d, es un método sensible, reproducible y sencillo de interpretar. Sin embargo, presenta una serie de inconvenientes: no funciona en material fijado en formol e incluido en parafina, por lo que es necesario disponer de material congelado y, además, no es permanente y se deteriora con el paso del tiempo. En nuestra experiencia, la inmunofluorescencia es el método gold standard para la detección de C4d.
2. La inmunohistoquímica con anticuerpo policlonal ofrece, como principal ventaja sobre la inmunofluorescencia, el hecho de realizarse sobre material incluido en parafina, por lo que no es preciso disponer de material congelado. Por el contrario, es una técnica menos reproducible y más difícil de interpretar, sobre todo en los casos de intensidad débil o focal. En nuestra opinión, debe realizarse sólo en los casos en los que no es posible llevar a cabo inmunofluorescencia, bien por no disponer de esta técnica o bien por carecer de material en congelación.
Estudios realizados por Mihatsch25 y Nadasdy26, al comparar ambos métodos de análisis de C4d, han demostrado que la técnica de inmunohistoquímica es menos sensible que la inmunofluorescencia. Estos resultados han llevado al grupo de Banff a establecer un cuadro básico para la interpretación de los resultados de C4d con ambos métodos (tabla 4)14,15.
Capilaritis peritubular
La presencia y marginación de celularidad inflamatoria en los capilares peritubulares es uno de los marcadores histológicos definidos dentro del rechazo humoral y la marginación de polimorfonucleares neutrófilos es lo más específico, aunque tanto la presencia de neutrófilos como de células mononucleares se ha asociado con depósitos de C4d en CPT10,15,16. El grupo de Banff, en su reunión del año 200714, ha incluido un sistema de graduación de la capilaritis peritubular basándose en los estudios de Gibson27 (tabla 5). Varios estudios han confirmado la aplicabilidad de este sistema y la asociación entre grados altos de capilaritis y rechazo mediado por anticuerpos28,29. La gradación debe realizarse en la corteza renal, no valorando las áreas medulares. Tampoco deben valorarse las áreas de pielonefritis, áreas adyacentes a infartos ni los vasos alrededor de agregados nodulares linfoides. Debe indicarse el tipo de células presentes (sólo células mononucleares, minoría o mayoría de neutrófilos) y la extensión de la capilaritis (> o <50%).
Celularidad inflamatoria en el rechazo humoral
Además de los polimorfonucleares neutrófilos y linfocitos, otro tipo de células inflamatorias pueden estar presentes en el RAH. Magil y Tinckam30, en una revisión de 23 biopsias con RAH, y posteriormente Colvin31, observan una asociación entre la presencia de monocitos/macrófagos en glomérulos y/o en el componente intersticial y depósitos de C4d, por lo que sugieren que debe incluirse también en el protocolo de los resultados de la biopsia. Otros autores han demostrado que los rechazos ricos en células plasmáticas también se asocian con un mecanismo de rechazo mediado por anticuerpos y con depósitos de C4d32-36.
C4d+ sin evidencia morfológica de rechazo humoral activo
Recientemente, la clasificación de Banff14,15 ha incluido una nueva subcategoría dentro del RAH, los «depósitos de C4d sin evidencia morfológica de rechazo activo», que se define como presencia de depósitos de C4d en capilares peritubulares y anticuerpos antidonante, sin criterios histológicos de rechazo humoral o celular, ni glomerulitis, ni datos de glomerulopatía del trasplante, ni capilaritis, sin laminación de capilares peritubulares y sin datos de necrosis tubular aguda. Si existe inflamación bordeline(i1), el diagnóstico es indeterminado (tabla 2).
La inclusión de esta nueva categoría se basa en estudios realizados en biopsias de protocolo en los que se observan C4d en CPT en el 25-80% de los trasplantes ABO incompatibles, y se observa evidencia de RAH sólo en el 4-12%37,38. Por otro lado, otros autores han observado depósitos de C4d en el 2-26% de biopsias de injerto ABO compatibles con histología normal37,39. Estos depósitos incidentales de C4d, según los expertos de Banff, no presagian necesariamente la presencia de un RAH14.
Hass15,40,41, en estudios realizados en biopsias de trasplantes renales ABO incompatibles, observa con relativa frecuencia depósitos de C4d sin signos histológicos de RAH y llega a la conclusión de que que esto puede ser un indicador de acomodación estable del injerto, al menos en los trasplantes ABO incompatibles. En la clasificación de Banff, para esta condición no se emplea intencionadamente el término acomodación, ya que el significado de estos hallazgos y la evolución de los injertos a largo plazo es desconocida14.
RECHAZO CRÓNICO HUMORAL
El abordaje diagnóstico del fracaso crónico del injerto (FCI) se complica al existir múltiples factores implicados que se pueden agrupar en dos grupos: los hegemonizados por mecanismos inmunológicos (celulares o humorales) y otros no inmunológicos, entre los que deben destacarse senilidad del donante, isquemia crónica, toxicidad medicamentosa, hipertensión, arteriosclerosis y diabetes42-45. Es importante, para el pronóstico y para la adecuación terapéutica, distinguir entre el rechazo crónico (RC), que se debe limitar al fracaso crónico por causas inmunológicas, y la disfunción crónica del injerto por causas no inmunológicas. Esta distinción es compleja en muchas ocasiones, ya que las características histopatológicas de las biopsias en este período crónico, fibrosis intersticial, atrofia tubular y glomeruloesclerosis, son inespecíficas y pueden ser causadas tanto por mecanismos inmunológicos como por mecanismos no inmunológicos. Determinar las características histopatológicas que definen el RC y sus connotaciones pronósticas es, por lo tanto, un aspecto importante. Los hallazgos histológicos definidos como más característicos de RC son la vasculopatía crónica del injerto, la glomerulopatía del trasplante (GT) y la multilaminación de capilares peritubulares46-55.
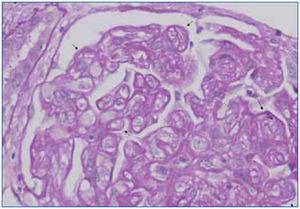
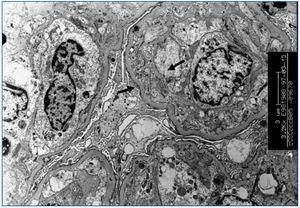
La GT es una entidad morfológica definida por Maryniak49, en 1985, como una lesión glomerular heterogénea cuyas características principales consisten en presencia de dobles contornos en las paredes capilares glomerulares (figura 4), con especiales características ultraestructurales entre las que destacan áreas electrolúcidas subendoteliales, multilaminación de la membrana basal glomerular y mesangiólisis (figura 5). La utilización del microscopio electrónico es fundamental en su diagnóstico y su uso sistemático puede permitir el diagnóstico de la GT en fases muy iniciales. Estudios realizados en biopsias de protocolo han demostrado la existencia de cambios ultraestructurales de GT en biopsias tomadas un mes después del trasplante15,56 . Oculta su etiopatogenia durante tiempo, su similitud tanto en el estudio óptico como en el microscopio electrónico con la microangiopatía trombótica (MAT) ha sido un camino para demostrar que la célula endotelial es el elemento «diana» de ambos procesos. La célula endotelial sería el punto de ataque directo de los anticuerpos circulantes antidonante en la GT. En ambos procesos, se desencadenan alteraciones similares no sólo en el microscopio óptico sino también en el plano ultraestructural, en donde comparten alteraciones superponibles, como son el edema o «rarefacción» de la vertiente subendotelial de la membrana basal glomerular, formación de dobles contornos e, incluso, la «mesangiólisis». Cada vez existen más pruebas de que tanto la MAT como la GT son similares formas de expresión del glomérulo ante una lesión endotelial, aunque con formas de presentación clínica diferentes, ya que en la GT no existe un síndrome hemolítico urémico manifiesto50. En nuestra experiencia, una vez revisadas 1.110 biopsias de trasplante renal, la GT hegemoniza la patología glomerular con 42 casos, lo que supone el 36,8% de las glomerulopatías en el injerto y el 3,7% de toda la patología del injerto. Es importante resaltar su mal pronóstico, ya que en nuestra experiencia el 97% de los casos pierden el injerto.
La vasculopatía crónica del injerto (VCI) sigue siendo un marcador histológico objetivo y específico de rechazo crónico y, si bien su patogenia es debatida, parecen existir indicios de un mecanismo inmunológico mediado por anticuerpos51. Las características histopatológicas consisten en una reducción del calibre de la luz vascular a expensas de una proliferación miointimal concéntrica, acompañada habitualmente por celularidad inflamatoria en la fase aguda, constituida preferentemente por linfocitos CD3, macrófagos e histiocitos espumosos52. Esta lesión progresa y se hace más esclerosante, y en esta fase evolucionada se observan un mayor grado de oclusión del calibre de la luz y signos de esclerosis de la íntima. La clave histológica útil para diferenciar la VCI de la vasculopatía secundaria a arteriosclerosis y/o vasculopatía hipertensiva es la existencia de una reduplicación concéntrica o segmentaria de la lámina elástica interna en casos de arteriosclerosis y/o vasculopatía hipertensiva, hecho que no se produce cuando la lesión vascular es consecuencia de una VCI, en la que la elástica interna permanece intacta53.
La multilaminación de capilares peritubulares (capiloropatía del trasplante) (figura 6), cuyo diagnóstico ha de ser muy preciso48 y exige un estudio ultraestructural, es otro de los hallazgos histológicos diagnósticos de rechazo crónico54,55. Monga, et al.46,47 describieron la asociación entre GT y multilaminación de la membrana basal de los capilares peritibulares (CPT). Drachenberg, et al.57 han demostrado que la GT se asocia con una multilaminación grave de CPT (más de seis láminas), mientras que grados más leves de laminación (dos-tres láminas) también pueden observarse en otro tipo de glomerulopatías, tanto en el riñón nativo como en el injerto.
El papel que desempeñan los mecanismos humorales en el RC es una discusión actual, aunque cada vez existen más evidencias de su implicación en la fisiopatología del FCI. Actualmente existen teorías que sugieren la existencia de cuatro fases sucesivas en la evolución del rechazo mediado por anticuerpos, en las que el RC sería el estadio final58. Varios estudios han demostrado la relación entre los marcadores histológicos o ultraestructurales de RC y mecanismos humorales de rechazo59-63. Regele, et al.59, en una revisión de 213 biopsias de trasplantes con más de 12 meses de evolución, observan una relación estadísticamente significativa entre positividad para C4d y glomerulopatía del trasplante, laminación de membrana basal de CPT y presencia de células mononucleares en CPT. Por otra parte, Mauyyedi, et al60 observan una positividad para C4d en el 61% de los casos de RC frente a un 2% en los casos control. Además, en el 88% de los casos C4d+ demuestran la presencia de anticuerpos anti-HLA, mientras que ningún caso C4d- mostraba anticuerpos60.
Esta asociación entre depósitos de C4d, anticuerpos antidonante circulantes y hallazgos histológicos de RC sugiere la intervención de mecanismos humorales en su etiopatogenia. Estas evidencias han llevado a incluir en la clasificación de Banff, en la revisión del año 20057, una nueva categoría: RC o rechazo tardío activo mediado por anticuerpos (tabla 6). El término crónico o tardío indica que se trata de un proceso lento, pero activo, que se extiende en el tiempo7. Los depósitos de C4d en CPT son la evidencia de un proceso inmunológico humoral activo.
No obstante, hay que tener en cuenta que, en contradicción con lo expuesto anteriormente, existen varios estudios recientes que no encuentran correlación entre GT y depósitos de C4d64-66 y alguno de estos estudios sugieren que existen mecanismos celulares u otros mecanismos implicados en su desarrollo. Banu Sis, et al.15,67 demuestran que sólo el 53% de las GT con anticuerpos anti-HLA tienen depósitos de C4d, y sugieren que este marcador tiene una baja sensibilidad en el diagnóstico de rechazo crónico humoral. Por ello, para el diagnóstico definitivo de rechazo crónico mediado por anticuerpos según los criterios de Banff son necesarios criterios histológicos, depósitos de C4d y demostración de anticuerpos antidonante. Si existen hallazgos morfológicos indicativos de RC y depósitos de C4d sin evidencia de anticuerpos antidonante, o anticuerpos sin evidencia de depósitos de C4d el diagnóstico debe ser «sugestivo de rechazo crónico mediado por anticuerpos»7. Es importante especificar en la biopsia si existen signos histológicos que pueden acompañar al rechazo tardío mediado por anticuerpos como son glomerulitis68, agregación de células mononucleares en capilares peritubulares59, infiltrado inflamatorio intersticial y presencia de células plasmáticas24.
Con todo ello podemos concluir que los mecanismos implicados en la patología crónica del injerto siguen sin conocerse ni comprenderse en su totalidad y serán necesarios nuevos estudios futuros que delimiten mejor la implicación de los mecanismos humorales en su patogenia. Sin embargo, hay indicios suficientes para aseverar que la presencia de vasculopatía del trasplante, la GT y la capiloropatía con multilaminación de la membrana basal de CPT son marcadores histopatológicos útiles para el diagnóstico del RC, y son indicadores muy sugestivos de un mecanismo de rechazo humoral mediado por anticuerpos antidonante.
AVANCES EN EL DIAGNÓSTICO DE RECHAZO HUMORAL
Estudios recientes liderados fundamentalmente por el grupo de Halloran han introducido la posibilidad de realizar estudios moleculares en el diagnóstico del rechazo humoral (RH). En estudios de microarrays han identificado una serie de genes de actividad endotelial que se expresan en el RH y además predicen un mal pronóstico15,69. Asimismo, según estos autores, el incremento de la transcripción de estos genes endoteliales es más sensible que el C4d para predecir la pérdida del injerto, aunque menos específico15,69. En casos de GT han demostrado que los casos con incremento de expresión de genes endoteliales muestran un peor pronóstico y una pérdida acelerada del injerto en comparación con los casos de GT sin expresión de estos genes, independientemente del estado del C4d15,70.
La expresión de genes endoteliales en la biopsia del injerto puede ser útil como un método sensible y específico en el diagnóstico del RH, pero son necesarias una validación y una estandarización de la técnica con nuevos estudios15,69.
CONCLUSIONES
1. El RH, tanto agudo como crónico, es actualmente uno de los principales problemas en el trasplante renal.
2. Los estudios realizados en los últimos años han permitido identificar una serie de lesiones histológicas sugestivas de rechazo mediado por anticuerpos tales como capilaritis, glomerulitis o necrosis fibrinoide, en el caso del rechazo agudo, y glomerulopatía del trasplante, vasculopatía crónica y multilaminación de membrana basal de capilares peritubulares para el rechazo crónico.
3. El avance más importante en el diagnóstico del RH ha sido el descubrimiento de la correlación entre depósitos de C4d, factor de degradación del complemento C4, en capilares peritubulares, y la presencia de anticuerpos antidonante, lo que ha convertido a este marcador en clave para el diagnóstico.
4. El desarrollo de métodos cada vez más sensibles ha aumentado la capacidad de identificación de anticuerpos antidonante.
5. El estudio ultraestructural con microscopio electrónico es fundamental, sobre todo en las lesiones crónicas.
6. El grupo de consenso de Banff ha establecido unos criterios diagnósticos de rechazo mediado por anticuerpos agudo y crónico que conjugan criterios histológicos, inmunopatológicos y serológicos.
7. La expresión de genes endoteliales en la biopsia del injerto puede ser un método útil en el diagnóstico del RH, pero son necesarios estudios multicéntricos para su validación y estandarización.
8. Futuros estudios probablemente ayuden a definir mejor los criterios diagnósticos de RH.
Figura 1. Congestión y presencia de celularidad inflamatoria en capilares peritubulares
Figura 2. Depósitos de C4d. Inmunofluorecencia.
Figura 3. Depósitos de C4d. Inmunohistoquímica.
Figura 4. Glomerulopatía del trasplante.
Figura 5. Glomerulopatía del trasplante.
Figura 6. Capiloropatía del trasplante.
Tabla 2. Banff 97. Categorías de diagnóstico de la biopsia del injerto renal Banff 09 actualización
Tabla 1. Comparativa de Hallazgos Morfológicos entre rechazo agudo humoral y rechazo agudo túbulo-intersticial
Tabla 3. Scoring de depósitos de C4d (porcentaje de la biopsia o en cinco campos de gran aumento)
Tabla 4. Scoring de C4d en capilares peritubulares
Tabla 5. Criterios de capilaritis peritubular
Tabla 6. Criterios diagnósticos de rechazo crónico activo mediado por anticuerpos