Sarcopenia y dinapenia son dos términos asociados al envejecimiento que definen respectivamente la pérdida de masa y de fuerza muscular. En el año 2019, el European Working Groupon Sarcopenia in Older People (EWGSOP) introdujo el algoritmo diagnóstico EWGSOP2 de sarcopenia, que integra ambos conceptos. Consiste en cuatro pasos secuenciales: cribado de sarcopenia, exploración de la fuerza muscular, evaluación de la masa muscular y de su rendimiento físico; dependiendo de estos tres últimos aspectos la sarcopenia se categoriza como probable, confirmada y grave, respectivamente. A falta de validación del algoritmo EWGSOP2 en diversos contextos clínicos, su utilización en hemodiálisis (HD) plantea diversas limitaciones: a) poca sensibilidad del cribado, b) las técnicas que evalúan la masa muscular son poco accesibles, fiables o seguras en la rutina clínica asistencial y c) el uso secuencial de las magnitudes que evalúan la dinapenia y la masa muscular no parecen reflejar adecuadamente la patología muscular del paciente geriátrico en diálisis. Reflexionamos sobre la definición de sarcopenia y la utilización de términos más precisos como «miopenia» (sustituyendo al concepto clásico de sarcopenia para designar la pérdida de masa muscular), dinapenia y kratopenia. Se propone la evaluación prospectiva del EWGSOP2 y su comparación con alternativas (p. ej. evaluación exclusiva de kratopenia y dinapenia; pasos 2 y 4) en cuanto a su aplicabilidad en la rutina clínica, consumo de recursos, identificación de personas en riesgo e impacto sobre eventos.
Sarcopenia and dynapenia are two terms associated with ageing that respectively define the loss of muscle mass and strength. In 2018, the European Working Group on Sarcopenia in Older People (EWGSOP) introduced the EWGSOP2 diagnostic algorithm for sarcopenia, which integrates both concepts. It consists of four sequential steps: screening for sarcopenia, examination of muscle strength, assessment of muscle mass and physical performance; depending on these last three aspects sarcopenia is categorised as probable, confirmed, and severe respectively. In the absence of validation of the EWGSOP2 algorithm in various clinical contexts, its use in haemodialysis poses several limitations: (a) low sensitivity of the screening, (b) the techniques that assess muscle mass are not very accessible, reliable, or safe in routine clinical care, (c) the sequential use of the magnitudes that assess dynapenia and muscle mass do not seem to adequately reflect the muscular pathology of the elderly person on dialysis. We reflect on the definition of sarcopenia and the use of more precise terms such as “myopenia” (replacing the classic concept of sarcopenia to designate loss of muscle mass), dynapenia and kratopenia. Prospective evaluation of EWGSOP2 and its comparison with alternatives (i.e. assessment of kratopenia and dynapenia only; steps 2 and 4) is proposed in terms of its applicability in clinical routine, resource consumption, identification of at-risk individuals and impact on events.
Aunque el término sarcopenia se introdujo hace bastantes años, en este momento está en boga, debido a su implicación clínica con la fragilidad y dependencia, especialmente en el paciente geriátrico o inflamado. Sin embargo, sigue siendo un término confuso y poco claro en el que convergen conceptos superpuestos.
Definición y evolución del concepto de sarcopeniaLa palabra sarcopenia deriva del griego y significa escasez (penia) de carne (sarx). Rosenberg utilizó el término sarcopenia por primera vez en 1988, para identificar una condición clínica caracterizada por la pérdida de la masa muscular esquelética en el contexto del envejecimiento1. El concepto de sarcopenia se refiere exclusivamente al músculo esquelético, no incluyendo los otros tres tipos de tejido muscular: liso, miocardio y mioepitelio de ciertas glándulas. Es importante recordar que cada fibra de músculo esquelético es un sincitio donde muchos núcleos comparten un mismo citoplasma, como resultado de la fusión de diversos mioblastos. Por ello, pierde la capacidad de división y, una vez formada, la fibra muscular esquelética no puede reproducirse, aunque puede aumentar (hipertrofia) o disminuir (atrofia) de tamaño o volumen.
DinapeniaPosteriormente, se ha visto la necesidad de evaluar la disminución de fuerza, adicionalmente a la pérdida de masa muscular, así como su relación con la pérdida de función física, mortalidad, calidad de vida y discapacidad2–4. Clark et al. introducen el término de dinapenia, como pérdida de masa muscular, argumentando que es un concepto independiente al de sarcopenia y cuya patogenia podría no deberse únicamente a la disminución de masa muscular5,6. Desde entonces, diversos grupos y asociaciones han intentado conseguir una definición consensuada de sarcopenia7–11; todas ellas incluyen siempre la masa muscular, algunas la fuerza y la mayoría el rendimiento físico.
MiopeniaMiopenia es la pérdida de masa muscular. Se mide por bioimpedancia (BIA), absorciometría radiológica de doble energía (DEXA) o resonancia magnética (RM) y tomografía computarizada (TC).
KratopeniaKratopenia o déficit de potencia muscular es otro concepto importante relacionado con la sarcopenia, que debería integrarse en la definición, con el fin de comprender mejor el defecto atribuido al músculo. Se ha definido la kratopenia como la pérdida de capacidad de contracción muscular medida con dinamometría o con test de contracciones isotónicas (tabla 1).
Definiciones de los conceptos incluidos en las alteraciones del músculo esquelético
| Sarcopenia = enfermedad del músculo esquelético que cursa con pérdida de masa y fuerza muscular. |
| Kratopenia = déficit de potencia muscular. Se mide con dinamometría o con test de contracciones isotónicas. |
| Miopenia = Pérdida de masa muscular. Se mide por bioimpedancia (BIA), absorciometría radiológica de doble energía (DEXA) o resonancia magnética (RM) y tomografía computarizada (TC). |
| Dinapenia = Pérdida de fuerza muscular. Se mide por test de velocidad de marcha, de distancia o de levantarse de una silla. |
La sarcopenia es un síndrome asociado fundamentalmente a la vejez12, y de hecho, en 2016 fue incluida como enfermedad en la clasificación internacional de enfermedades (CIE-10, en su versión MC [Modificación Clínica]) con el código M62.8413,14, mientras que la dinapenia no está incorporada.
Evolución del algoritmo diagnóstico EWGSOP1 a EWGSOP2El grupo más activo y reconocido en el estudio de la sarcopenia es el European Working Group on Sarcopenia in Older People (EWGSOP) que en 201012 propone los siguientes criterios para diagnosticarla:
- -
Criterio 1: Baja masa muscular (criterio obligatorio).
- -
Criterio 2: Fuerza muscular reducida.
- -
Criterio 3: Bajo rendimiento físico.
Estos criterios permiten establecer una clasificación de sarcopenia de acuerdo con su grado de severidad como:
- -
Sarcopenia leve o pre-sarcopenia: presencia de criterio 1 (baja masa muscular).
- -
Sarcopenia moderada: presencia de criterio 1 además del 2 o del 3 (baja masa muscular + fuerza muscular reducida o rendimiento físico disminuido).
- -
Sarcopenia grave: presencia de los tres criterios (baja masa muscular + fuerza muscular reducida o rendimiento físico disminuido).
En enero de 2019, el EWGSOP revisó y actualizó su definición de sarcopenia15. Las novedades que aporta el nuevo consenso (EWGSOP2) son:
- A)
La sarcopenia deja de considerarse un síndrome geriátrico para abordarse más bien como una enfermedad del músculo esquelético (insuficiencia muscular) no siempre asociada con el envejecimiento, ya que puede aparecer en personas más jóvenes16 y obedecer a causas distintas al propio envejecimiento17,18.
- B)
Se introduce el concepto de calidad del músculo, de modo que la disminución de fuerza cobra importancia en el diagnóstico19–21. Este enfoque hace que se presente la fuerza de prensión como primer elemento del diagnóstico de sarcopenia. El paciente con baja fuerza muscular se cataloga como probable sarcopénico, confirmándose el diagnóstico posteriormente con la medida de la masa muscular.
- C)
La afectación del rendimiento físico o la capacidad funcional se considera ahora un criterio de gravedad de la enfermedad. Puede medirse mediante pruebas como la velocidad de marcha (VM), la capacidad de levantarse de una silla, caminar y volver a sentarse o la batería de pruebas en las que se incluye una valoración del equilibrio4,22–24.
- D)
Se reconoce que la sarcopenia es una situación infradiagnosticada y, por lo tanto, poco tratada25, posiblemente por los variados criterios diagnósticos y los distintos puntos de corte. Buscando una utilidad clínica del algoritmo diagnóstico, se presentan nuevos puntos de corte bien definidos y se propone el estudio clínico de los mismos en poblaciones especiales.
De acuerdo con el nuevo consenso EWGSOP2 (tabla 2), cuando se detecta una baja fuerza muscular (criterio 1), la sarcopenia es probable; el diagnóstico se confirma si se constata poca masa muscular (criterio 2) y se considera sarcopenia severa o grave si, además, la función o rendimiento físico están disminuidos (criterio 3). En cualquier caso, no se especifican términos diferentes para definir la pérdida de fuerza o la de masa muscular, y se denomina a todos sarcopenia con matices (probable, confirmada o grave).
Definición de sarcopenia según EWGSOP2
| Sarcopenia probable: cumple el criterio 1 |
| Sarcopenia confirmada: cumple criterios 1 y 2 |
| Sarcopenia grave: cumple criterios 1, 2 y 3 |
| (1) Fuerza muscular baja |
| (2) Baja masa muscular |
| (3) Rendimiento físico bajo |
Modificado de Cruz-Jentoft et al.15
EWGSOP2: nuevo consenso de la European Working Groupon Sarcopenia in Older People
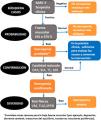
El nuevo algoritmo EWGSOP2 para la detección y el diagnóstico de la sarcopenia comprende cuatro fases o etapas (fig. 1)15.
- 1.
Búsqueda de casos: encuesta Strength, Assistance walking, Rise from a chair, Climb stairs, and Falls (SARC-F) usada en todas las clasificaciones como test de detección de sarcopenia26.
- 2.
Evaluación de probabilidad: determinación de la fuerza.
- 3.
Confirmación: medida de masa muscular.
- 4.
Establecimiento de gravedad: desempeño de prueba físicas27,28 (fig. 1).
Modificada de Cruz-Jentoft et al.15 AMS: masa muscular apendicular; HG: fuerza de agarre con dinamometría; SARC-F: Encuesta de despistaje de sarcopenia; SPPB: Short Physical Performance Battery; STS-5: test sit to stand to sit 5; TUG: The Timed-Up and Go test; VM: velocidad de marcha.
- 1.
Se recomienda hacer el cribado para establecer la sospecha clínica, mediante el cuestionario SARC-F que evalúa la aparición de síntomas como debilidad, lentitud, caídas o dificultad para realizar las actividades diarias habituales26. Se trata de una encuesta muy fácil de aplicar y que valora la dificultad o no que presenta un sujeto para cargar un peso, caminar por una habitación, levantarse de una cama o una silla y subir un tramo de 10 escaleras, así como el número de caídas que ha sufrido en el último año. La puntuación total puede variar de 0 a 10 (ninguna a máxima dificultad) y cada dominio puntúa de cero a dos puntos. Una puntuación total ≥ 4 predice sarcopenia. Esta encuesta tiene una baja sensibilidad, pero una excelente especificidad29,30. Sin embargo, es sorprendente que para el cribado se use una herramienta de baja sensibilidad: las pruebas de screening suelen enfatizar la sensibilidad, porque las posteriores confirmatorias del diagnóstico aportarán la especificidad.
- 2.
La determinación de la fuerza muscular puede realizarse en el tren superior mediante el uso de dinamometría manual (HG) o en el tren inferior mediante la realización del test sit to stand to sit 5(STS-5).
- -
Test de HG: esta prueba valora la fuerza de prensión manual mediante un dinamómetro. Para realizarlo, el paciente debe estar en bipedestación, con el brazo ligeramente separado y a lo largo del cuerpo. La prueba se efectúa dos veces con cada brazo, considerándose la máxima puntuación obtenida.
- -
STS-5: estas pruebas tienen por objetivo valorar la fuerza de las extremidades inferiores. El STS-5 consiste en contabilizar el tiempo que tarda el paciente en realizar cinco repeticiones de levantarse y sentarse en una silla.
- 3.
Para medir la masa muscular se han propuesto diversos métodos:DEXA: se trata de un método muy empleado y recomendado31. Presenta una mínima exposición a radiación, pero al no ser un equipo portátil, su uso se ve limitado en centros no hospitalarios.RM y TC: se considera el estándar de oro en la medida de masa muscular no invasiva. Sin embargo, su alto coste y falta de portabilidad reducen su uso. Además, requiere personal altamente capacitado para el empleo del equipo, los puntos de corte que establecen una baja masa muscular aún no están bien definidos32, el acceso a RM es limitado en algunos ambientes y la TC expone a los pacientes a radiación.
- -
BIA: a diferencia del método anterior, se trata de una técnica barata, fácil y portátil, pudiéndose realizar a pie de cama o en pacientes ambulatorios. Su inconveniente es que no mide la masa muscular directamente, sino que la estima desde la conductividad eléctrica de todo el cuerpo y las mediciones pueden verse influenciadas por el estado de hidratación del sujeto y otras circunstancias28,33.
- 4.
Cuando la masa muscular es baja, EWGSOP2 recomienda la realización de pruebas funcionales para evaluar su gravedad, entre ellas, la medida de VM, la prueba The Timed-Up and Go test(TUG) o la Short Physical Performance Battery(SPPB)27.
- -
VM: medida como el tiempo necesario para caminar cuatro metros y expresado en metros por segundo, teniendo en cuenta si se requirió ayuda para mantener el equilibrio durante la caminata (bastón, andador, otro mano).
- -
SPPB o test de Guralnik: consta de cinco pruebas físicas, tres de equilibrio, una de VM y otra de fuerza del tren inferior.
- -
TUG: este test valora la agilidad y el equilibrio dinámico. En esta prueba, el paciente debe levantarse de una silla, recorrer una distancia de tres metros, dar la vuelta a un cono y volver a sentarse. Esto se efectúa a la máxima velocidad a la que pueda andar. La prueba se realiza en tres intentos, quedando, como resultado final, el de menor tiempo.
Los puntos de corte de los diferentes parámetros definidos por el EWGSOP2 se ven en la tabla 3.
Puntos de corte marcados para el diagnóstico de sarcopenia
| Fases del diagnóstico | Prueba | Corte ♂ | Corte ♀ |
|---|---|---|---|
| Detección | SARC-F(pts.)26 | ≥ 4 puntos | ≥4 puntos |
| Evaluación | Superior: HG (kg)18 | < 27 kg | < 16 kg |
| Inferior: STS5 (s)34 | > 15 s por 5 subidas | > 15 s por 5 subidas | |
| Confirmación | AMS (kg)11 | < 20 kg | < 15 kg |
| Gravedad | VM (m/s)4,11 | ≤ 0,8 m/s | ≤ 0,8 m/s |
| TUG (s)22 | ≥ 20 segundos | ≥ 20 segundos | |
| SPPB (pts.)23,24 | ≤ 8 puntos | ≤ 8 puntos |
AMS: masa muscular; HG: fuerza de agarre con dinamometría; TUG: The Timed-Up and Go test; SARC-F: encuesta despistaje sarcopenia; SPPB: Short Physical Performance Batter; STS-5: test sit to stand to sit 5; VM: velocidad de marcha.
En la práctica clínica el EWGSOP2 propone clasificar la sarcopenia en función de su etiología, distinguiendo entre:
- -
Sarcopenia primaria, relacionada con la edad, cuando no se determina ninguna otra causa que no sea el propio envejecimiento.
- -
Sarcopenia secundaria, cuando se observan otras causas distintas a la edad. Puede aparecer secundariamente en el contexto de diversas enfermedades sistémicas, en la insuficiencia cardiaca o respiratoria, en la enfermedad renal, y especialmente en aquellas patologías que cursan con procesos inflamatorios. La inactividad física constituye un factor que también contribuye al desarrollo de la sarcopenia, bien por un estilo de vida sedentario o debido a la inmovilidad o discapacidad relacionada con la enfermedad35,36. Del mismo modo, puede ser causa de sarcopenia una ingesta inadecuada de energía o proteínas, como resultado de una anorexia, malabsorción, acceso limitado a alimentos saludables o una capacidad limitada para comer.
La enfermedad renal crónica (ERC) es un problema creciente en la sanidad mundial. Se define como la pérdida, durante al menos tres meses, de la función renal, establecida por una reducción del filtrado glomerular inferior a 60 mL/min/1,73 m2 o por la presencia de lesión renal verificada de forma directa mediante biopsia renal o, indirectamente por la presencia de albuminuria, alteración en el sedimento de orina o con técnicas de imagen37.
En España, la incidencia de ERC está aumentando principalmente por el envejecimiento de la población y el incremento de las patologías consideradas factores de riesgo como la diabetes mellitus, la enfermedad cardiovascular o la obesidad38,39. Según el Registro Español de Enfermos Renales (REER)40, la incidencia de enfermos renales que comienzan tratamiento renal sustitutivo ha aumentado de 121,1 a 141,4 por millón de población (pmp) en los últimos 10 años. De las 5.817 muertes en 2020, registradas en el REER, 44% corresponde a mayores de 75 años. La ERC se asocia con un mayor riesgo de mortalidad cardiovascular y/o por todas las causas en todas las edades41, siendo la sarcopenia un indicador de mortalidad42.
La prevalencia de sarcopenia en la ERC varía dependiendo de los criterios diagnósticos usados y las características de los pacientes estudiados. Esta variabilidad también se ha visto en los sujetos en hemodiálisis (HD), oscilando desde 4 a 64%43–45. Aun así, es una patología frecuente en el enfermo renal y su prevalencia aumenta notablemente conforme disminuye la función renal46. Nosotros observamos una prevalencia según EWGSOP2 de 20% en pacientes en HD ancianos que es de 75-95% cuando se valora el desempeño muscular sin tener en cuenta la masa30.
Las causas de la sarcopenia en el paciente con ERC son diversas y su consecuencia es el desequilibrio entre la síntesis y el catabolismo muscular. Se ha acuñado incluso el término de sarcopenia urémica para definir esta situación de los pacientes renales47–49. El aumento de la edad de los sujetos con enfermedad renal favorece la presencia de comorbilidades asociadas que ocasionan inactividad28,30 y hospitalización50. Contribuyen también otros factores de riesgo como la desnutrición, por el descenso de la ingesta debido a las grandes restricciones dietéticas o el uso de medicamentos que reducen el apetito, y el incremento de las pérdidas de nutrientes durante la propia diálisis51. La acidosis metabólica, el acúmulo de toxinas urémicas y citoquinas proinflamatorias, y el procedimiento de diálisis en sí aceleran el catabolismo de proteínas y la pérdida de masa magra52. La resistencia a la insulina, el desequilibrio hormonal, la deficiencia de vitamina D y el estrés oxidativo del enfermo renal, potencian la incidencia de sarcopenia53–55. Simultáneamente, el hipogonadismo56 y el acúmulo de toxinas urémicas que alteran la función mitocondrial del músculo57 afectan a la regeneración muscular favoreciendo la pérdida de fuerza muscular en la ERC.
Junto a la disminución en la cantidad de músculo, el deterioro de la función renal se asocia a cambios selectivos en la estructura muscular con una reducción significativa de la fuerza muscular58,59. Esto es importante ya que no siempre existe una relación lineal entre masa y fuerza muscular. La fuerza, la potencia y el rendimiento muscular resultan de la integración de componentes, incluido el tamaño, el tipo de fibra, la calidad y la inervación. Por lo tanto, incluso en ausencia de sarcopenia definida como pérdida de masa muscular, es posible tener dinapenia, establecida como debilidad muscular que limita las actividades de la vida diaria. El diagnóstico de dinapenia se centraría en identificar una pérdida de fuerza o potencia muscular, independientemente del tamaño del músculo60. Nuestros estudios demuestran que el ejercicio mejora tanto la fuerza como la masa muscular, aunque es más relevante en la fuerza de los miembros inferiores como se corresponde al tipo de ejercicio realizado28.
Nuestro grupo ha observado que en pacientes geriátricos en HD, puede haber una masa muscular normal, con una pérdida de fuerza30, cumpliendo solo en parte los criterios EWGSOP2 de sarcopenia.
La definición EWGSOP2 de sarcopenia incluye los conceptos de miopenia y dinapeniaLa definición EWGSOP2 de sarcopenia es la enfermedad del músculo esquelético que cursa con pérdida de masa muscular y de fuerza. Este concepto integra bajo el término de sarcopenia el concepto inicial de esta (pérdida de masa muscular) y de dinapenia (reducción de fuerza) sin aclarar si se puede aceptar como sarcopenia un músculo de masa normal, pero con escasa fuerza. Es decir, la enfermedad del músculo y la pérdida de masa muscular se identifican bajo el mismo nombre de sarcopenia, no siendo el mismo concepto. Para resolver el problema, se ha propuesto denominar miopenia al déficit de masa muscular61. Es importante utilizar un lenguaje preciso que permita intercambiar información e identificar si se trata de pérdida de fuerza, de masa muscular o de ambas. Por lo tanto, sarcopenia sería igual a miopenia (déficit de masa muscular) + dinapenia (disminución de fuerza muscular). En nuestra experiencia, el paciente renal puede tener una masa muscular aceptable, con una pérdida de fuerza28,30,62 por lo que la definición EWGSOP2 de sarcopenia no recoge adecuadamente su patología muscular.
KratopeniaKratopenia o déficit de potencia muscular es otro concepto importante relacionado con la sarcopenia, que debería integrarse en la definición, con el fin de comprender mejor el defecto atribuido al músculo. Como se ha comentado, se ha definido la kratopenia como la pérdida de capacidad de contracción muscular medida con dinamometría o con test de contracciones isotónicas (incluida como probabilidad de sarcopenia según EWGSOP2), mientras que la dinapenia sería la pérdida de fuerza medida por test de VM, SPPB o de test de levantarse de una silla (incluida en el concepto de gravedad de EWGSOP2)15 (tabla 2). La integración del término kratopenia permitiría definir la sarcopenia como la presencia simultanea de miopenia (déficit de masa muscular) + dinapenia (disminución de fuerza muscular) + kratopenia (reducción de potencia) (tabla 4). Aunque, según EWGSOP2, la sarcopenia sería miopenia + kratopenia exclusivamente, y se catalogaría como grave cuando existe dinapenia.
La definición de sarcopenia de EWGSOP2 incluye los conceptos de kratopenia, miopenia y dinapenia, aunque no lo explicita así
| Sarcopenia grave = kratopenia (pérdida de potencia muscular) + miopenia (pérdida de masa muscular) + dinapenia (pérdida de fuerza muscular) |
EWGSOP2: nuevo consenso de la European Working Groupon Sarcopenia in Older People
La sarcopenia según EWGSOP2 es la enfermedad del músculo esquelético entendida como masa y fuerza muscular. Sin embargo, puede existir solo pérdida de masa o de fuerza muscular y hay términos que permiten definir diferentes componentes incluidos en el concepto EWGSOP2 de sarcopenia: kratopenia es la pérdida de potencia, miopenia es el déficit de masa muscular y dinapenia es la disminución de fuerza. Por lo tanto, sarcopenia sería la suma de kratopenia y miopenia, y la sarcopenia grave añadiría además la dinapenia. Proponemos reflexionar sobre la definición de sarcopenia. Se debe considerar aumentar la precisión en el lenguaje incorporando los conceptos de miopenia (pérdida de masa muscular, sustituiría al concepto original de sarcopenia), kratopenia y dinapenia. Además, la EWGSOP2 debería ser valorada prospectivamente y comparada con alternativas (por ejemplo, evaluación solo de kratopenia y dinapenia, y usando los pasos 2 y 4) en cuanto a su aplicabilidad en la rutina clínica, consumo de recursos, identificación de personas en riesgo e impacto sobre los desenlaces. El paciente renal puede tener una masa muscular normal, con una pérdida de fuerza e incluso potencia ocasionada por múltiples factores. Por ello, si los resultados de estos estudios prospectivos difirieran para los sujetos con ERC en HD de otras poblaciones, habría que considerar remplazar el término sarcopenia por otro que reflejara la peculiaridad de la enfermedad muscular de la ERC, como «miopatía urémica».
FinanciaciónLos autores no han tenido ningún tipo de financiación en el presente escrito. Los autores declaran tener en la actualidad las siguientes becas estatales. Los grupos de investigación de E.G.P., S.M.F. y A.O. son financiados por el Ministerio de Economia, Industria y competitividad: FIS/Fondos FEDER (PI21/01430, PI16/01298, PI18/01386, PI19/00588, PI19/00815, PI20/00487, PI21/01240 y DTS18/00032), ERA-PerMed-JTC2018 (KIDNEY ATTACK AC18/00064, PERSTIGAN AC18/00071 and ISCIII-RETIC REDinREN RD016/0009) y Sociedad Española de Nefrología, Comunidad de Madrid en Biomedicina B2017/BMD-3686 CIFRA2-CM.
Conflictos de interésA. Ortíz ha recibido subvenciones de Sanofi y honorarios de consultoría o de conferenciante o apoyo para viajes de Advicciene, Astellas, AstraZeneca, Amicus, Amgen, Fresenius Medical Care, GSK, Bayer, Sanofi-Genzyme, Menarini, Mundipharma, Kyowa Kirin, Alexion, Freeline, Idorsia, Chiesi, Otsuka, Novo-Nordisk y Vifor Fresenius Medical Care Renal Pharma y es director de la Catedra Mundipharma-UAM de enfermedad renal diabética y de la Catedra AstraZeneca-UAM de enfermedad renal crónica y electrolitos. A. Ortíz es el editor jefe de CKJ (hasta el 21 de mayo de 2022). El resto de los autores no presenta conflictos de interés