El riesgo de desarrollar enfermedad renal crónica a los 5 años de un trasplante de órgano sólido no renal varía entre un 7-21%1; dentro de los mecanismos implicados se incluye una disfunción crónica del órgano trasplantado, un fracaso renal agudo previo con una recuperación incompleta de la función renal, así como la nefrotoxicidad directa de los anticalcineurínicos. Este último sigue siendo el mecanismo más relevante, así como otros factores derivados de su uso que favorecen la progresión de la enfermedad renal crónica2–4.
Se estima que el 29% de esta población progresará a enfermedad renal crónica avanzada, con necesidad de terapia renal sustitutiva2,4,5. El uso de diálisis peritoneal (DP) ha estado limitado en estos pacientes por temor a una mayor incidencia de complicaciones infecciosas y no infecciosas, debido a la inmunosupresión, además de una posible peritoneotoxicidad por anticalcineurínicos. La toxicidad sobre la membrana peritoneal implicaría alteraciones en su morfología (neoangiogénesis, hialinosis vascular, cambios profibróticos), sin repercusión significativa en el transporte peritoneal (demostrado solo en modelos animales)4–6.
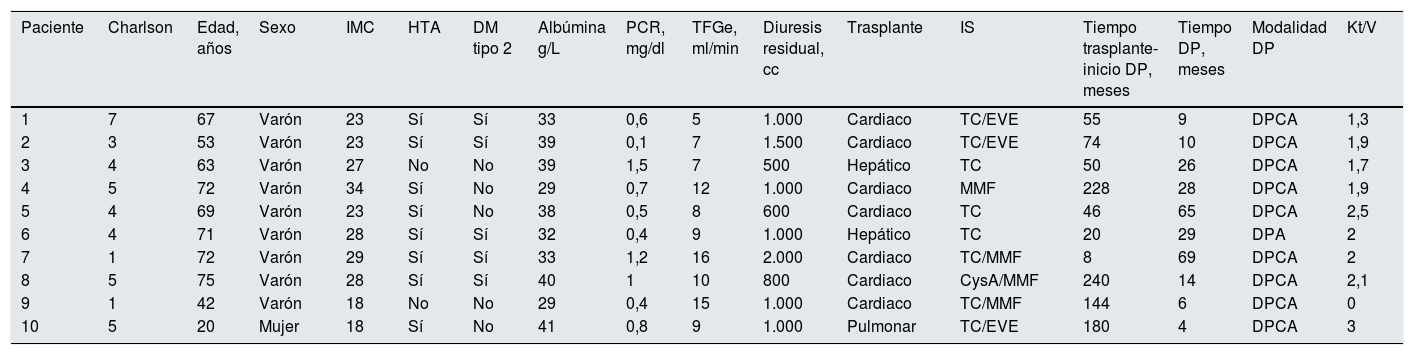
A continuación describimos la experiencia en nuestro centro con este grupo de pacientes en DP. Se trata de un estudio descriptivo observacional que incluye a todos los pacientes portadores de un trasplante de órgano sólido no renal que iniciaron DP desde enero de 2012 hasta octubre de 2019. El grupo de estudio consta de 10 pacientes: 2 trasplantados hepáticos, un trasplantado bipulmonar y 7 trasplantados cardiacos, cuyas características se recogen en la tabla 1; ningún caso fue excluido una vez iniciada la técnica. Los pacientes fueron derivados por el equipo médico de trasplante de cada especialidad a nuestra unidad, donde se informaron de las diferentes técnicas de terapia renal sustitutiva, decantándose por la DP. No se les realizó prueba de imagen abdominal de rutina antes del inicio de la técnica, aunque los pacientes trasplantados hepáticos disponían de estos estudios previamente como parte de su control habitual.
Características clínico-epidemiológicas basales de pacientes trasplantados de órgano sólido no renal
| Paciente | Charlson | Edad, años | Sexo | IMC | HTA | DM tipo 2 | Albúmina g/L | PCR, mg/dl | TFGe, ml/min | Diuresis residual, cc | Trasplante | IS | Tiempo trasplante-inicio DP, meses | Tiempo DP, meses | Modalidad DP | Kt/V |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 7 | 67 | Varón | 23 | Sí | Sí | 33 | 0,6 | 5 | 1.000 | Cardiaco | TC/EVE | 55 | 9 | DPCA | 1,3 |
| 2 | 3 | 53 | Varón | 23 | Sí | Sí | 39 | 0,1 | 7 | 1.500 | Cardiaco | TC/EVE | 74 | 10 | DPCA | 1,9 |
| 3 | 4 | 63 | Varón | 27 | No | No | 39 | 1,5 | 7 | 500 | Hepático | TC | 50 | 26 | DPCA | 1,7 |
| 4 | 5 | 72 | Varón | 34 | Sí | No | 29 | 0,7 | 12 | 1.000 | Cardiaco | MMF | 228 | 28 | DPCA | 1,9 |
| 5 | 4 | 69 | Varón | 23 | Sí | No | 38 | 0,5 | 8 | 600 | Cardiaco | TC | 46 | 65 | DPCA | 2,5 |
| 6 | 4 | 71 | Varón | 28 | Sí | Sí | 32 | 0,4 | 9 | 1.000 | Hepático | TC | 20 | 29 | DPA | 2 |
| 7 | 1 | 72 | Varón | 29 | Sí | Sí | 33 | 1,2 | 16 | 2.000 | Cardiaco | TC/MMF | 8 | 69 | DPCA | 2 |
| 8 | 5 | 75 | Varón | 28 | Sí | Sí | 40 | 1 | 10 | 800 | Cardiaco | CysA/MMF | 240 | 14 | DPCA | 2,1 |
| 9 | 1 | 42 | Varón | 18 | No | No | 29 | 0,4 | 15 | 1.000 | Cardiaco | TC/MMF | 144 | 6 | DPCA | 0 |
| 10 | 5 | 20 | Mujer | 18 | Sí | No | 41 | 0,8 | 9 | 1.000 | Pulmonar | TC/EVE | 180 | 4 | DPCA | 3 |
CysA: ciclosporina A; DM: diabetes mellitus; DP: diálisis peritoneal; DPA: diálisis peritoneal automática; DPCA: diálisis peritoneal continua ambulatoria; EVE: everolimus; HTA: hipertensión arterial; IMC: índice de masa corporal; IS: inmunosupresión; MMF: micofenolato de mofetilo; PCR: proteína C reactiva; TC: tacrolimus; TFGe: tasa de filtrado glomerular estimado.
El 80% de los pacientes presentó un peso dentro de la normalidad y el 20% un bajo peso según su índice de masa corporal; si bien la albúmina no es el mejor marcador de nutrición, el 30% presentó hipoalbuminemia basal. El tiempo medio transcurrido entre el trasplante y el inicio de la DP fue de 7,2 años (86,4 meses). La mayoría (un 90%) tenía un anticalcineurínico al inicio de la técnica y no se observaron diferencias significativas en la pauta de inmunosupresión entre los diferentes órganos trasplantados.
En cuanto a la prueba de equilibrio peritoneal basal en estos pacientes, el 44% eran transportadores rápidos, el 33% medio rápidos y un 11% medio lentos; no presentaron cambios significativos en la prueba de equilibrio peritoneal al año respecto a su basal. Creemos que la mayoría de estos pacientes son transportadores rápidos debido a un mayor estado inflamatorio crónico, con aumento de la superficie peritoneal. Aunque no disponemos de la medición de citocinas inflamatorias, observamos una tendencia a presentar una proteína C reactiva elevada.
En comparación con el resto de la población en DP de nuestro centro (38% transportadores rápidos, 41% medio rápidos, 13% medio lentos, 1% lentos), no hubo diferencias significativas.
En lo que respecta a las complicaciones infecciosas, observamos 4 peritonitis por Staphylococcus aureus en un mismo paciente y 3 infecciones del orificio de salida: 2 por Staphylococcus aureus y uno por Serratia marcescens. No hubo infecciones fúngicas. Actualmente, en nuestro centro, la tasa de peritonitis de la población en DP corresponde a una ratio de 0,38 episodios-paciente-año, y la ratio en el grupo de trasplantados de órgano sólido fue de 0,1 episodios-paciente-año, lo que apunta a que no presenta una relación directa con la inmunosupresión.
Un paciente trasplantado cardiaco presentó una hernia inguinoescrotal al mes del inicio de la técnica, precisando una transferencia temporal a hemodiálisis; después de 4 semanas tras su corrección quirúrgica, reinició la técnica sin incidencias. No hubo otro tipo de complicaciones no infecciosas.
Durante el seguimiento, 4 pacientes salieron del programa: 2 recibieron un trasplante renal y 2 fallecieron. Las causas de la muerte fueron por complicaciones no relacionadas con la técnica.
En la actualidad la DP se considera una técnica equiparable a la hemodiálisis en términos de supervivencia, pudiendo tener incluso ventajas sobre esta por la mejor preservación de la función renal residual y menor estrés hemodinámico3,4. Esto podría hacer que incluso estuviese especialmente indicada en este grupo de pacientes, en los que la preservación de esta función renal residual pueda ser complicada en la práctica clínica.
En conclusión, en nuestra experiencia, con la limitación del pequeño tamaño de la muestra, los pacientes con trasplante de órgano sólido no renal presentan una evolución favorable en DP sin un riesgo añadido de complicaciones infecciosas o no infecciosas, con buenos resultados en lo referente a seguridad y adecuación de la diálisis, sin diferencias en el transporte peritoneal independientemente del órgano trasplantado.