La enfermedad cardiovascular es la principal causa de muerte en niños con enfermedad renal crónica. La inflamación y la disfunción endotelial se presenta en la mayoría de estos pacientes y son factores asociados a enfermedad cardiovascular. La dilatación mediada por flujo (DMF)<7% es un marcador subrogado validado en la evaluación de la disfunción endotelial. Nuestro objetivo fue identificar los factores de riesgo asociados a disfunción endotelial en niños con enfermedad renal crónica.
Materiales y métodosSe estudió a niños de 2-16 años de edad. Se recopiló su información clínica y variables bioquímicas, incluidos hormona paratiroidea intacta (iPTH), interleucinas 6 y 1β, proteína C reactiva de alta sensibilidad (hsCRP), glutatión reducido, óxido nítrico, malondialdehído y homocisteína. Se consideró DMF alterada<7%.
ResultadosSe incluyó a 129 pacientes con edad de 13,1±2,6 años. Tuvieron DMF<7% 69 (52,7%). Los pacientes con DMF<7% tuvieron niveles más altos de triglicéridos y de hsCRP que aquellos con DMF≥7% (145,5 vs. 120,0mg/dl, p=0,042, y 1,24 vs. 0,55U/l, p=0,007, respectivamente), así como una mayor frecuencia de iPTH baja (19,1 vs. 4,9%, p=0,036). Los niveles de hsCRP se correlacionaron significativamente con la DMF (Rho=−0,28, p=0,003). Los pacientes con iPTH baja (OR 4,41, IC 95% 1,13-17,27, p=0,033) y con hsCRP incrementada (OR 2,89, IC 95% 1,16-7,17, p=0,022) tuvieron un riesgo ajustado mayor de DMF<7%.
ConclusionesLa hipertrigliceridemia, la inflamación y una iPTH baja se asociaron significativamente a una DMF alterada. Son factores de riesgo de enfermedad cardiovascular frecuentes y tratables.
Cardiovascular disease is the main cause of death in children with chronic kidney disease. Inflammation and endothelial dysfunction are found in the majority of these patients and are factors associated to cardiovascular disease. Flow mediated dilatation (FMD) is a surrogate marker validated for evaluating endothelial dysfunction. Our objective was to identify risk factors associated to endothelial dysfunction in children with chronic kidney disease.
Materials and methodsChildren 2-16 years of age were studied. Clinical information and biochemical variables were gathered, including intact parathyroid hormone (iPTH), interleukins 6 and 1β, high sensitivity C reactive protein (hsCRP), reduced glutathione, nitric oxide, malondialdehyde and homocysteine. FMD was measured, and considered altered if<7%.
ResultsIncluded were 129 patients aged 13.1±2.6 years. FMD<7% was found in 69 (52.7%). Patients with altered FMD had higher levels of triglycerides and hsCRP than those with normal FMD (145.5 vs. 120.0mg/dL, P=.042, and 1.24 vs. 0.55U/L, P=.007, respectively), as well as higher frequency of low iPTH (19.1 vs. 4.9%, P=.036). Levels of hsCRP correlated significantly with FMD (Rho=−0.28, P=.003). Patients with low iPTH (OR 4.41, 95% CI 1.13-17.27, P=.033) and increased hsCRP (OR 2.89, 95% CI 1.16-7.17, P=.022) had higher adjusted risk of having FMD<7%.
ConclusionsHypertriglyceridemia, inflammation and low iPTH associated significantly with altered FMD. They are frequent, treatable risk factors for cardiovascular disease.
Según datos del United States Renal Data System, la prevalencia puntual de enfermedad renal crónica (ERC) en niños y adolescentes era de 9.721 (99,1 por millón de habitantes) a 31 de diciembre de 20161. Durante el periodo 2011-2015, la mortalidad ajustada por todas las causas fue de 39 por cada 1.000 pacientes-año. La causa de muerte más frecuentemente reportada en la Forma de Notificación de Muerte fue atribuida a causas cardiacas. Durante ese periodo, la mortalidad ajustada por enfermedad cardiovascular (ECV) fue de 8 por 1.000 pacientes-año. La tasa de hospitalizaciones por ECV en el primer año para niños menores de 22 años de edad incidentes de ERC terminal fue de 55 por cada 1.000 pacientes-año de 2006-2010, y de 41 para el periodo 2011-2015. Los mayores índices de hospitalización en pacientes incidentes se observaron en los niños de 5-9 y de 18-21 años y en los niños tratados con diálisis1.
Los niños con ERC tienen un alto riesgo cardiovascular que puede no hacerse evidente sino hasta el inicio de la vida adulta. Existe una evidencia creciente de que los niños con ERC tienen, a su vez, una alta frecuencia de factores de riesgo cardiovascular y desarrollan, desde etapas tempranas de su enfermedad, alteraciones cardiacas y vasculares que son marcadores subrogados de ECV temprana, que incluyen hipertrofia del ventrículo izquierdo, disfunción ventricular izquierda, aterosclerosis, calcificaciones con rigidez aórtica, engrosamiento de la íntima de las arterias carótidas y disfunción endotelial (DE)2.
La DE representa una manifestación temprana y persistente de ECV en ERC y ha demostrado ser un cambio temprano en el proceso de aterosclerosis. La fisiología y la bioquímica de la DE han sido estudiadas previamente en niños con ERC. Numerosos factores pueden contribuir a la presencia de DE en la ERC, como la dislipidemia, los medicamentos empleados para el tratamiento mismo de la enfermedad y sus complicaciones, el incremento en el estrés oxidativo y otras consecuencias metabólicas como las alteraciones del metabolismo calcio-fósforo y de la hormona paratiroidea.
La DE en la ERC involucra anormalidades en la producción y el metabolismo del óxido nítrico (NO). Una disminución de la síntesis de este puede deberse a la presencia de niveles altos de análogos de L-arginina, como la dimetilarginina asimétrica y la dimetilarginina simétrica, que se incrementan de manera proporcional a la severidad de la ERC y que antagonizan competitivamente con la sintetasa de NO3–5. Además, se ha demostrado que incrementan el tono vascular y favorecen la aterogénesis6. Adicionalmente, los niveles de L-arginina se encuentran reducidos. Una inactivación incrementada del NO puede deberse también al estrés oxidativo y al incremento en la concentración de radicales libres5.
En los pacientes con ERC, como en otros grupos de alto riesgo para ECV, tales como los pacientes con diabetes mellitus tipo 1, los niveles de lípidos incluso en límites normales altos pueden tener un impacto en la función endotelial. Además, los niveles habitualmente altos de triglicéridos de los pacientes con ERC en tratamiento con diálisis peritoneal pueden tener un papel en la DE, aunque su influencia en el desarrollo de aterogénesis es aún controversial7–9.
Las alteraciones en el metabolismo calcio-fósforo son también universales en estos pacientes y son determinantes importantes de la ECV en la ERC. La dilatación mediada por flujo (DMF), un marcador subrogado validado de DE, se ha correlacionado de manera positiva con las concentraciones de calcio en sangre y de manera negativa con las de fosfatasa alcalina en niños con ERC estadio 410. En contraste, un estudio de 80 pacientes prediálisis no encontró una asociación significativa entre variables clínicas (edad, sexo, hipertensión arterial, score z de índice de masa corporal [IMC]) y bioquímicas (hemoglobina, producto calcio-fósforo [CaxP] y perfil de lípidos) con el grosor íntima-media de las carótidas (cIMT) ni con la DMF11.
En pacientes en tratamiento sustitutivo con hemodiálisis (HD), un estudio que comparó a 10 pacientes con esta modalidad de tratamiento frente a 10 controles sanos demostró una disminución de la DMF en los niños con HD12.
Existen muy pocos estudios respecto al papel de los factores de riesgo cardiovascular tanto tradicionales como no tradicionales sobre la función endotelial en niños con ERC y ninguno, hasta donde sabemos, que haya incluido un análisis completo de ellos, en niños con estadios desde 2 a 5 de ERC. Nuestro objetivo fue identificar los factores de riesgo asociados a DE en niños con ERC tanto prediálisis como en tratamiento sustitutivo con diálisis peritoneal automatizada (DPA) o con HD.
Material y métodosPrevia autorización por el Comité de Ética en Investigación y el Comité Nacional de Investigación Científica del Instituto Mexicano del Seguro Social, se invitó a participar a niños de 2 a 16 años de edad con diagnóstico de ERC en estadios 2 a 5 que eran tratados en los servicios de Nefrología Pediátrica de los 2 hospitales de tercer nivel de atención del Instituto Mexicano del Seguro Social en la Ciudad de México: el Hospital de Pediatría del Centro Médico Nacional Siglo XXI y el Hospital General del Centro Médico Nacional La Raza. Se incluyó a pacientes con diagnóstico establecido de ERC con al menos un mes de anterioridad y, en el caso de los pacientes en estadio 5, que habían permanecido en el tratamiento sustitutivo actual: DPA o HD, al menos en los 3 meses previos, y cuyos padres otorgaron su consentimiento informado para participar, así como los niños mismos su asentimiento informado en caso de ser mayores de 8 años y estar en condiciones de hacerlo. No se incluyeron pacientes que padecían ERC como consecuencia de alguna enfermedad reumática que condicionara vasculitis, como lupus eritematoso generalizado, poliarteritis nudosa, púrpura vascular aguda, granulomatosis de Wegener, etc.; aquellos que presentaran evidencia clínica, a criterio de los investigadores, de algún foco infeccioso en el momento del estudio o en la semana previa a la toma de las muestras de laboratorio y/o del ultrasonido vascular, a los portadores de hiperlipidemia familiar conocida, a los que tomaran algún inmunosupresor, ni a los pacientes que se previera que no cooperarían para la realización de los estudios.
El día antes de la medición de la DMF se recabaron de la historia clínica: edad, peso, talla (el IMC fue calculado como el cociente de los kilogramos de peso entre el cuadrado de la talla en metros, así como su score z), tensión arterial, biometría hemática y química sanguínea con perfil de lípidos, pruebas de función hepática y electrólitos. El colesterol total, el colesterol ligado a lipoproteínas de alta densidad, los triglicéridos, la albúmina, el calcio y el fósforo fueron medidos con un analizador Synchron CX® (Beckman Systems, Fullerton, CA, EE. UU.) de acuerdo con las indicaciones del fabricante. El coeficiente de variación para el colesterol total y el ligado a lipoproteínas de alta densidad fue del 3,3 y el 2,5%, respectivamente.
La medición de la DMF fue realizada en todos los pacientes por el mismo médico cardiólogo especialista en imagen, con ultrasonido de alta resolución (MicroMaxx® Fuji Film Sonosite Inc., Tokio, Japón) con modo B (tiempo real), Doppler color y Doppler dúplex espectral equipado con transductor lineal de 7-12MHz. A los pacientes tratados con HD se les hizo el estudio en el día, entre una sesión y otra. Antes del estudio los pacientes se habían abstenido de practicar ejercicio (≥12h), ingerir cafeína (≥12h) e ingerir medicamentos (≥4 vidas medias del medicamento), incluidos antiinflamatorios (no esteroideos por un día y ácido acetil salicílico por 3 días), y estaban en ayuno (≥12h). El estudio se llevó a cabo en posición supina, con reposo del paciente en una habitación tranquila, y con la temperatura controlada (entre 22 y 24̊C) por lo menos durante los 20min previos13. El diámetro basal de la arteria braquial fue medido en el brazo no dominante, o en el lado opuesto si es que el primero tenía una fístula arteriovenosa. Se obtuvo hiperemia reactiva insuflando el manguito del esfigmógrafo por encima de la tensión arterial sistólica del paciente durante al menos 5min; posteriormente, la presión fue liberada de forma súbita y se midió el diámetro arterial nuevamente. La DMF fue el producto del (diámetro postisquemia reactiva−diámetro preisquemia reactiva)/diámetro preisquemia reactiva×100, y se expresó como un porcentaje. Si este porcentaje era igual o mayor al 7% se consideró normal, y si era menor del 7% se consideró alterado, indicando DE.
El mismo día de la medición de la DMF, previo ayuno de 12h, se realizó la toma de la muestra para la determinación de las concentraciones en sangre de proteína C reactiva de alta sensibilidad (hsCRP) y el perfil de citocinas. Las interleucinas 6 y 1β, así como el factor de necrosis tumoral alfa, se midieron mediante ensayo de inmunoabsorción ligada a enzimas (ELISA; Quantikine® HS Human Immunoassay Kits, R&D Systems, Minneapolis, MN, EE. UU.). Así mismo, la hsCRP se midió usando un kit de ELISA para hsCRP (Alpha Diagnostic, San Antonio, TX, EE. UU.), y los resultados fueron leídos por lector de ELISA Sunrise® (Tecan US, Inc., Durham, NC, EE. UU). El glutatión reducido fue medido con espectrofotómetro Lambda® 25 (Perkin Elmer, Waltham, MA, EE. UU.). El NO fue medido con ELISA KontroLab EliRead (RT-2100C®) usando el método de Griess. La homocisteína se midió mediante quimioluminiscencia en equipo Immulite® 1000 (Siemens, Múnich, Alemania).
El tiempo de evolución de la enfermedad se refirió al tiempo desde el diagnóstico de ERC hasta la realización de la medición de DMF. En relación con el estado nutricional, los pacientes se consideraron desnutridos cuando su score z de talla fue<214, y con sobrepeso u obesidad de acuerdo a los criterios del International Obesity Task Force15. Se consideraron hipertensos los pacientes que tuvieran en la última semana al menos 2 registros superiores al percentil 95 para su talla, sexo y edad en su libreta personal de registros, de acuerdo con la Guía de Práctica Clínica para la búsqueda y manejo de la hipertensión en niños y adolescentes, de la Academia Americana de Pediatría16. Los pacientes tuvieron anemia si sus niveles de hemoglobina eran menores del límite inferior de los recomendados por la Organización Mundial de la Salud según su edad y sexo17. Para definir si los niveles de hormona paratiroidea intacta (iPTH) eran normales, bajos o altos para la edad y el estadio de ERC, se siguieron las Guías de la Kidney Disease Outcomes Quality Initiative18 y de la Kidney Disease: Improving Global Outcomes19.
Para la estadística descriptiva se usaron frecuencias simples y proporciones, así como medias con desviación estándar o medianas y rangos intercuartílicos. Para el análisis inferencial univariado se usaron la prueba t de Student o la U de Mann-Whitney y la Chi2 o la exacta de Fisher, así como la r de Pearson o la Rho de Spearman, las pruebas de ANOVA y Kruskal-Wallis, según fuera necesario. Para el análisis multivariado se usó el modelo de regresión logística para identificar los factores de riesgo asociados a DMF alterada, todo con el paquete estadístico SPSS® v20.0 y considerando significativos valores de p<0,05.
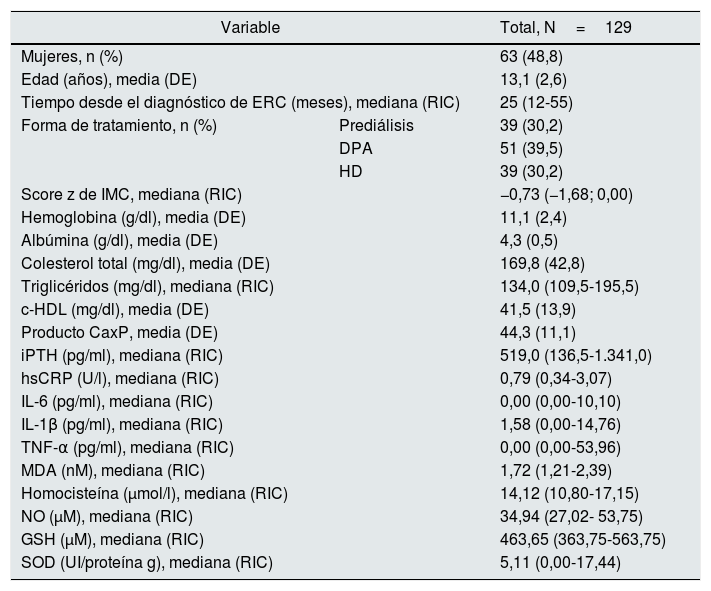
ResultadosSe incluyeron 129 pacientes: 63 mujeres (48,8%) y 66 hombres (51,2%). La edad fue de 13,1±2,6 años, con una mediana de tiempo desde el diagnóstico de ERC de 25 meses (rango intercuartílico 12-55). Tuvieron un adecuado estado nutricional 36 pacientes (27,9%), obesidad o sobrepeso 12 (9,3%) y desnutrición 81 (62,8%). Sesenta y tres (48,8%) tuvieron hipertensión, 78 (60,5%) anemia, 36 (27,9%) albúmina<4g/dl, 63 (48,8%) hipercolesterolemia, 97 (75,2%) hipertrigliceridemia, 57 (44,2%) colesterol ligado a lipoproteínas de alta densidad disminuido, 12 (9,3%) producto CaxP elevado, 51 (39,5%) niveles normales de iPTH para el estadio de la ERC y la edad, 62 (48,1%) iPTH elevada y 16 (12,4%) iPTH baja. La tabla 1 muestra las características bioquímicas de todos los pacientes estudiados.
Características clínicas y bioquímicas de los pacientes
| Variable | Total, N=129 | |
|---|---|---|
| Mujeres, n (%) | 63 (48,8) | |
| Edad (años), media (DE) | 13,1 (2,6) | |
| Tiempo desde el diagnóstico de ERC (meses), mediana (RIC) | 25 (12-55) | |
| Forma de tratamiento, n (%) | Prediálisis | 39 (30,2) |
| DPA | 51 (39,5) | |
| HD | 39 (30,2) | |
| Score z de IMC, mediana (RIC) | −0,73 (−1,68; 0,00) | |
| Hemoglobina (g/dl), media (DE) | 11,1 (2,4) | |
| Albúmina (g/dl), media (DE) | 4,3 (0,5) | |
| Colesterol total (mg/dl), media (DE) | 169,8 (42,8) | |
| Triglicéridos (mg/dl), mediana (RIC) | 134,0 (109,5-195,5) | |
| c-HDL (mg/dl), media (DE) | 41,5 (13,9) | |
| Producto CaxP, media (DE) | 44,3 (11,1) | |
| iPTH (pg/ml), mediana (RIC) | 519,0 (136,5-1.341,0) | |
| hsCRP (U/l), mediana (RIC) | 0,79 (0,34-3,07) | |
| IL-6 (pg/ml), mediana (RIC) | 0,00 (0,00-10,10) | |
| IL-1β (pg/ml), mediana (RIC) | 1,58 (0,00-14,76) | |
| TNF-α (pg/ml), mediana (RIC) | 0,00 (0,00-53,96) | |
| MDA (nM), mediana (RIC) | 1,72 (1,21-2,39) | |
| Homocisteína (μmol/l), mediana (RIC) | 14,12 (10,80-17,15) | |
| NO (μM), mediana (RIC) | 34,94 (27,02- 53,75) | |
| GSH (μM), mediana (RIC) | 463,65 (363,75-563,75) | |
| SOD (UI/proteína g), mediana (RIC) | 5,11 (0,00-17,44) | |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; DPA: diálisis peritoneal automatizada; ERC: enfermedad renal crónica; GSH: glutatión reducido; HD: hemodiálisis; hsCRP: proteína C reactiva de alta sensibilidad; IL: interleucina; IMC: índice de masa corporal; iPTH: hormona paratiroidea intacta; MDA: malondialdehído; NO: óxido nítrico; RIC: rango intercuartílico; SOD: superóxido dismutasa; TNF-α: factor de necrosis tumoral alfa.
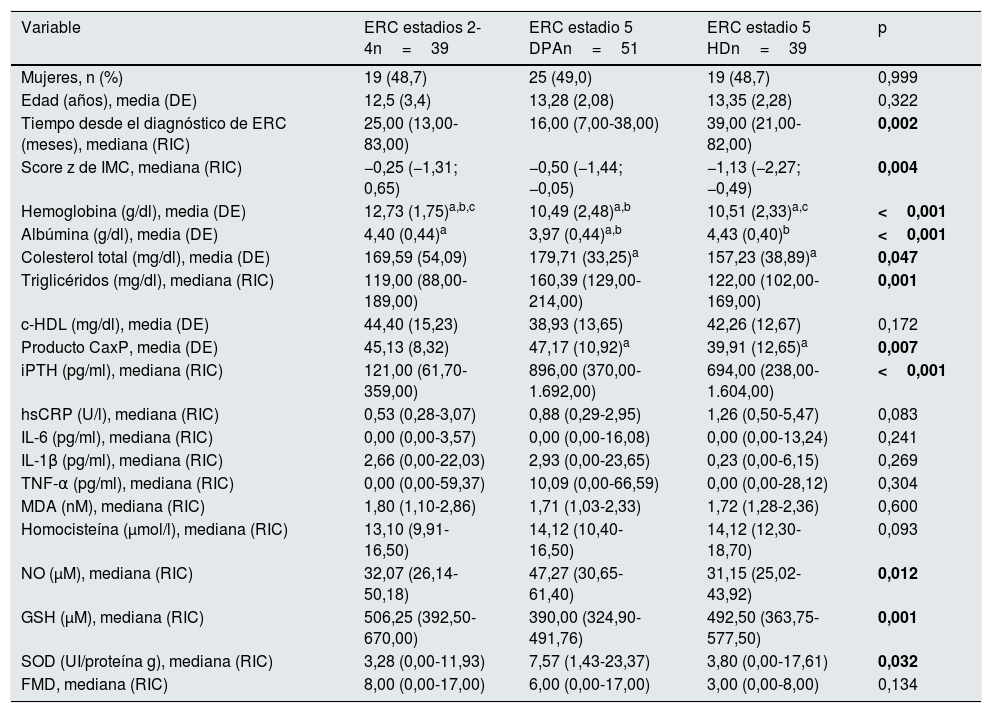
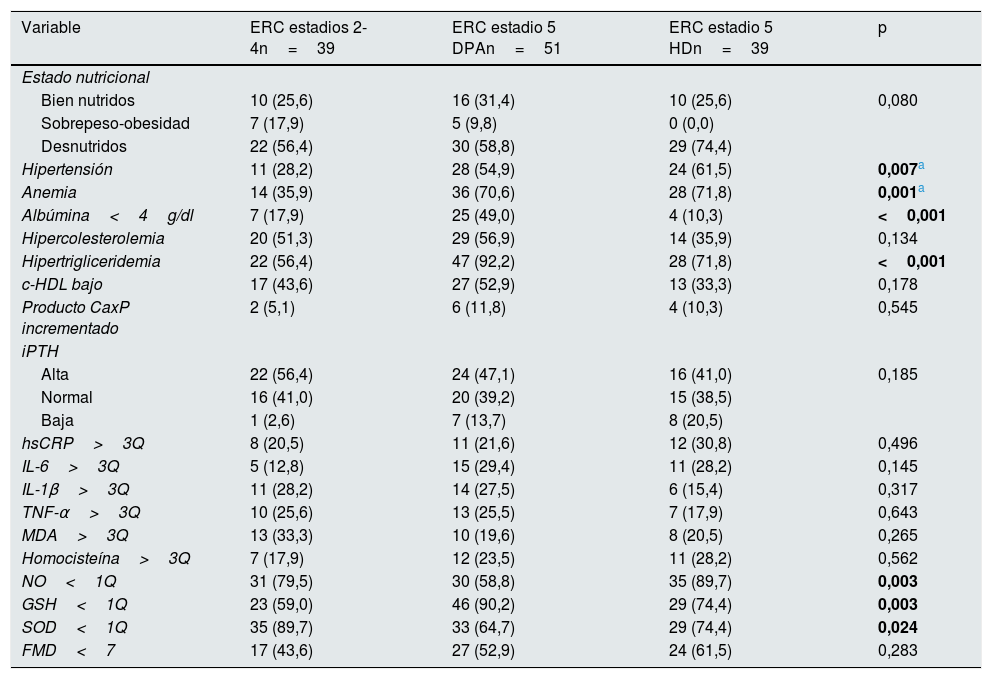
Treinta y nueve pacientes se encontraban en estadio 2 a 4 de ERC y 90 en estadio 5, de los cuales 51 tenían tratamiento con DPA y 39 con HD. Los pacientes en estadios 2-4 tuvieron mayores concentraciones de hemoglobina y de glutatión reducido, y menores concentraciones de iPTH, así como una menor frecuencia de anemia y de glutatión reducido bajo cuartil 1. Los pacientes en diálisis peritoneal tuvieron concentraciones menores de albúmina y mayores de colesterol y triglicéridos; fueron los que presentaron con mayor frecuencia hipoalbuminemia e hipertrigliceridemia. Los pacientes en HD tuvieron mayor tiempo de evolución desde el diagnóstico de la enfermedad, así como menores scores z de IMC, productos CaxP y concentraciones de NO; tuvieron mayor frecuencia de hipertensión arterial y de NO bajo cuartil 1. La mediana de DMF fue mayor en los pacientes en estadios 2-4 y menor en los pacientes tratados con HD, mientras que la proporción de pacientes que tuvieron una DMF disminuida (<7%) fue mayor en los pacientes en estadio 5 tratados con HD y menor en los pacientes en estadios 2-4; sin embargo, estas diferencias no fueron estadísticamente significativas (tablas 2 y 3).
Características clínicas y bioquímicas de los pacientes según el estadio de enfermedad renal crónica
| Variable | ERC estadios 2-4n=39 | ERC estadio 5 DPAn=51 | ERC estadio 5 HDn=39 | p |
|---|---|---|---|---|
| Mujeres, n (%) | 19 (48,7) | 25 (49,0) | 19 (48,7) | 0,999 |
| Edad (años), media (DE) | 12,5 (3,4) | 13,28 (2,08) | 13,35 (2,28) | 0,322 |
| Tiempo desde el diagnóstico de ERC (meses), mediana (RIC) | 25,00 (13,00-83,00) | 16,00 (7,00-38,00) | 39,00 (21,00-82,00) | 0,002 |
| Score z de IMC, mediana (RIC) | −0,25 (−1,31; 0,65) | −0,50 (−1,44; −0,05) | −1,13 (−2,27; −0,49) | 0,004 |
| Hemoglobina (g/dl), media (DE) | 12,73 (1,75)a,b,c | 10,49 (2,48)a,b | 10,51 (2,33)a,c | <0,001 |
| Albúmina (g/dl), media (DE) | 4,40 (0,44)a | 3,97 (0,44)a,b | 4,43 (0,40)b | <0,001 |
| Colesterol total (mg/dl), media (DE) | 169,59 (54,09) | 179,71 (33,25)a | 157,23 (38,89)a | 0,047 |
| Triglicéridos (mg/dl), mediana (RIC) | 119,00 (88,00-189,00) | 160,39 (129,00-214,00) | 122,00 (102,00-169,00) | 0,001 |
| c-HDL (mg/dl), media (DE) | 44,40 (15,23) | 38,93 (13,65) | 42,26 (12,67) | 0,172 |
| Producto CaxP, media (DE) | 45,13 (8,32) | 47,17 (10,92)a | 39,91 (12,65)a | 0,007 |
| iPTH (pg/ml), mediana (RIC) | 121,00 (61,70-359,00) | 896,00 (370,00-1.692,00) | 694,00 (238,00-1.604,00) | <0,001 |
| hsCRP (U/l), mediana (RIC) | 0,53 (0,28-3,07) | 0,88 (0,29-2,95) | 1,26 (0,50-5,47) | 0,083 |
| IL-6 (pg/ml), mediana (RIC) | 0,00 (0,00-3,57) | 0,00 (0,00-16,08) | 0,00 (0,00-13,24) | 0,241 |
| IL-1β (pg/ml), mediana (RIC) | 2,66 (0,00-22,03) | 2,93 (0,00-23,65) | 0,23 (0,00-6,15) | 0,269 |
| TNF-α (pg/ml), mediana (RIC) | 0,00 (0,00-59,37) | 10,09 (0,00-66,59) | 0,00 (0,00-28,12) | 0,304 |
| MDA (nM), mediana (RIC) | 1,80 (1,10-2,86) | 1,71 (1,03-2,33) | 1,72 (1,28-2,36) | 0,600 |
| Homocisteína (μmol/l), mediana (RIC) | 13,10 (9,91-16,50) | 14,12 (10,40-16,50) | 14,12 (12,30-18,70) | 0,093 |
| NO (μM), mediana (RIC) | 32,07 (26,14-50,18) | 47,27 (30,65-61,40) | 31,15 (25,02-43,92) | 0,012 |
| GSH (μM), mediana (RIC) | 506,25 (392,50-670,00) | 390,00 (324,90-491,76) | 492,50 (363,75-577,50) | 0,001 |
| SOD (UI/proteína g), mediana (RIC) | 3,28 (0,00-11,93) | 7,57 (1,43-23,37) | 3,80 (0,00-17,61) | 0,032 |
| FMD, mediana (RIC) | 8,00 (0,00-17,00) | 6,00 (0,00-17,00) | 3,00 (0,00-8,00) | 0,134 |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; DPA: diálisis peritoneal automatizada; ERC: enfermedad renal crónica; FMD: dilatación mediada por flujo; GSH: glutatión reducido; HD: hemodiálisis; hsCRP: proteína C reactiva de alta sensibilidad; IL: interleucina; IMC: índice de masa corporal; iPTH: hormona paratiroidea intacta; MDA: malondialdehído; NO: óxido nítrico; RIC: rango intercuartílico; SOD: superóxido dismutasa; TNF-α: factor de necrosis tumoral alfa.
Para las frecuencias y proporciones se usó Chi2 para las comparaciones.
Para las medias con desviaciones estándar se usó la prueba de ANOVA de una vía.
Para las medianas con intervalos intercuartiles se usó la prueba de Kruskal-Wallis. Los datos en negrita muestran los valores de p que fueron significativos.
a, b, c Muestran las diferencias entre los grupos obtenidas con la prueba pos hoc de Bonferroni en la ANOVA.
Características clínicas y bioquímicas de los pacientes según el estadio de enfermedad renal crónica
| Variable | ERC estadios 2-4n=39 | ERC estadio 5 DPAn=51 | ERC estadio 5 HDn=39 | p |
|---|---|---|---|---|
| Estado nutricional | ||||
| Bien nutridos | 10 (25,6) | 16 (31,4) | 10 (25,6) | 0,080 |
| Sobrepeso-obesidad | 7 (17,9) | 5 (9,8) | 0 (0,0) | |
| Desnutridos | 22 (56,4) | 30 (58,8) | 29 (74,4) | |
| Hipertensión | 11 (28,2) | 28 (54,9) | 24 (61,5) | 0,007a |
| Anemia | 14 (35,9) | 36 (70,6) | 28 (71,8) | 0,001a |
| Albúmina<4g/dl | 7 (17,9) | 25 (49,0) | 4 (10,3) | <0,001 |
| Hipercolesterolemia | 20 (51,3) | 29 (56,9) | 14 (35,9) | 0,134 |
| Hipertrigliceridemia | 22 (56,4) | 47 (92,2) | 28 (71,8) | <0,001 |
| c-HDL bajo | 17 (43,6) | 27 (52,9) | 13 (33,3) | 0,178 |
| Producto CaxP incrementado | 2 (5,1) | 6 (11,8) | 4 (10,3) | 0,545 |
| iPTH | ||||
| Alta | 22 (56,4) | 24 (47,1) | 16 (41,0) | 0,185 |
| Normal | 16 (41,0) | 20 (39,2) | 15 (38,5) | |
| Baja | 1 (2,6) | 7 (13,7) | 8 (20,5) | |
| hsCRP>3Q | 8 (20,5) | 11 (21,6) | 12 (30,8) | 0,496 |
| IL-6>3Q | 5 (12,8) | 15 (29,4) | 11 (28,2) | 0,145 |
| IL-1β>3Q | 11 (28,2) | 14 (27,5) | 6 (15,4) | 0,317 |
| TNF-α>3Q | 10 (25,6) | 13 (25,5) | 7 (17,9) | 0,643 |
| MDA>3Q | 13 (33,3) | 10 (19,6) | 8 (20,5) | 0,265 |
| Homocisteína>3Q | 7 (17,9) | 12 (23,5) | 11 (28,2) | 0,562 |
| NO<1Q | 31 (79,5) | 30 (58,8) | 35 (89,7) | 0,003 |
| GSH<1Q | 23 (59,0) | 46 (90,2) | 29 (74,4) | 0,003 |
| SOD<1Q | 35 (89,7) | 33 (64,7) | 29 (74,4) | 0,024 |
| FMD<7 | 17 (43,6) | 27 (52,9) | 24 (61,5) | 0,283 |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; DPA: diálisis peritoneal automatizada; ERC: enfermedad renal crónica; FMD: dilatación mediada por flujo; GSH: glutatión reducido; HD: hemodiálisis; hsCRP: proteína C reactiva de alta sensibilidad; IL: interleucina; iPTH: hormona paratiroidea intacta; MDA: malondialdehído; NO: óxido nítrico; SOD: superóxido dismutasa; TNF-α: factor de necrosis tumoral alfa; 1Q: primer cuartil; 3Q: tercer cuartil.
Se reportan frecuencias y porcentajes; se usó la prueba de Chi2.
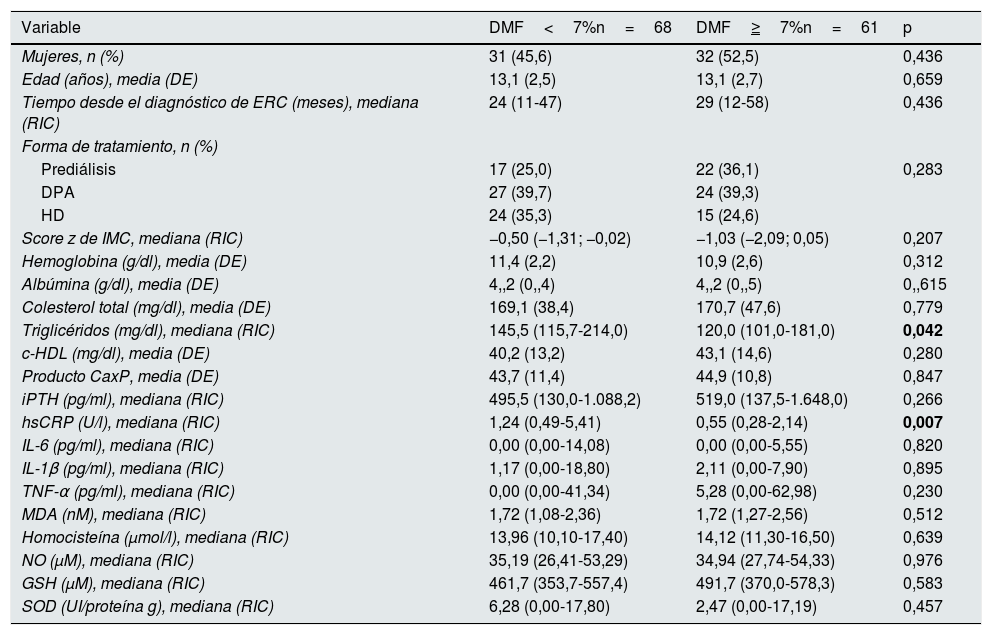
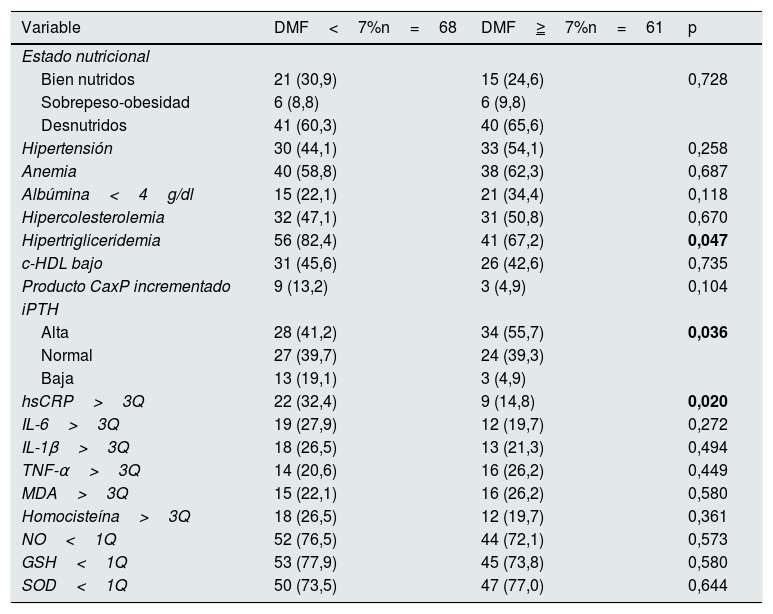
Sesenta y ocho pacientes (52,7%) tuvieron una DMF<7% y 61 (47,3%) una DMF≥7%. En los pacientes con DMF<7% las concentraciones de triglicéridos y de hsCRP fueron significativamente mayores que en los pacientes con DMF≥7%; de igual forma, la proporción de pacientes con hipertrigliceridemia, con concentraciones bajas de iPTH y que tuvieron hsCRP por encima del tercer cuartil fueron significativamente mayores en el primer grupo. No hubo diferencias significativas en alguna de las otras variables comparadas (tablas 4 y 5).
Características clínicas y bioquímicas de los pacientes según la dilatación medida por flujo
| Variable | DMF<7%n=68 | DMF≥7%n=61 | p |
|---|---|---|---|
| Mujeres, n (%) | 31 (45,6) | 32 (52,5) | 0,436 |
| Edad (años), media (DE) | 13,1 (2,5) | 13,1 (2,7) | 0,659 |
| Tiempo desde el diagnóstico de ERC (meses), mediana (RIC) | 24 (11-47) | 29 (12-58) | 0,436 |
| Forma de tratamiento, n (%) | |||
| Prediálisis | 17 (25,0) | 22 (36,1) | 0,283 |
| DPA | 27 (39,7) | 24 (39,3) | |
| HD | 24 (35,3) | 15 (24,6) | |
| Score z de IMC, mediana (RIC) | −0,50 (−1,31; −0,02) | −1,03 (−2,09; 0,05) | 0,207 |
| Hemoglobina (g/dl), media (DE) | 11,4 (2,2) | 10,9 (2,6) | 0,312 |
| Albúmina (g/dl), media (DE) | 4,,2 (0,,4) | 4,,2 (0,,5) | 0,,615 |
| Colesterol total (mg/dl), media (DE) | 169,1 (38,4) | 170,7 (47,6) | 0,779 |
| Triglicéridos (mg/dl), mediana (RIC) | 145,5 (115,7-214,0) | 120,0 (101,0-181,0) | 0,042 |
| c-HDL (mg/dl), media (DE) | 40,2 (13,2) | 43,1 (14,6) | 0,280 |
| Producto CaxP, media (DE) | 43,7 (11,4) | 44,9 (10,8) | 0,847 |
| iPTH (pg/ml), mediana (RIC) | 495,5 (130,0-1.088,2) | 519,0 (137,5-1.648,0) | 0,266 |
| hsCRP (U/l), mediana (RIC) | 1,24 (0,49-5,41) | 0,55 (0,28-2,14) | 0,007 |
| IL-6 (pg/ml), mediana (RIC) | 0,00 (0,00-14,08) | 0,00 (0,00-5,55) | 0,820 |
| IL-1β (pg/ml), mediana (RIC) | 1,17 (0,00-18,80) | 2,11 (0,00-7,90) | 0,895 |
| TNF-α (pg/ml), mediana (RIC) | 0,00 (0,00-41,34) | 5,28 (0,00-62,98) | 0,230 |
| MDA (nM), mediana (RIC) | 1,72 (1,08-2,36) | 1,72 (1,27-2,56) | 0,512 |
| Homocisteína (μmol/l), mediana (RIC) | 13,96 (10,10-17,40) | 14,12 (11,30-16,50) | 0,639 |
| NO (μM), mediana (RIC) | 35,19 (26,41-53,29) | 34,94 (27,74-54,33) | 0,976 |
| GSH (μM), mediana (RIC) | 461,7 (353,7-557,4) | 491,7 (370,0-578,3) | 0,583 |
| SOD (UI/proteína g), mediana (RIC) | 6,28 (0,00-17,80) | 2,47 (0,00-17,19) | 0,457 |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; DE: desviación estándar; DMF: dilatación mediada por flujo; DPA: diálisis peritoneal automatizada; GSH: glutatión reducido; HD: hemodiálisis; hsCRP: proteína C reactiva de alta sensibilidad; IL: interleucina; IMC: índice de masa corporal; iPTH: hormona paratiroidea intacta; MDA: malondialdehído; NO: óxido nítrico; RIC: rango intercuartílico; SOD: superóxido dismutasa; TNF-α: factor de necrosis tumoral alfa.
Para las frecuencias y proporciones se usó la Chi2 para las comparaciones.
Para las medias con desviaciones estándar se usó la t de Student para las comparaciones.
Para las medianas con rangos intercuartiles se usó la prueba U de Mann-Whitney para las comparaciones.
Los datos en negrita muestran los valores de p que fueron son significativos.
Características clínicas y bioquímicas de los pacientes según la dilatación mediada por flujo
| Variable | DMF<7%n=68 | DMF≥7%n=61 | p |
|---|---|---|---|
| Estado nutricional | |||
| Bien nutridos | 21 (30,9) | 15 (24,6) | 0,728 |
| Sobrepeso-obesidad | 6 (8,8) | 6 (9,8) | |
| Desnutridos | 41 (60,3) | 40 (65,6) | |
| Hipertensión | 30 (44,1) | 33 (54,1) | 0,258 |
| Anemia | 40 (58,8) | 38 (62,3) | 0,687 |
| Albúmina<4g/dl | 15 (22,1) | 21 (34,4) | 0,118 |
| Hipercolesterolemia | 32 (47,1) | 31 (50,8) | 0,670 |
| Hipertrigliceridemia | 56 (82,4) | 41 (67,2) | 0,047 |
| c-HDL bajo | 31 (45,6) | 26 (42,6) | 0,735 |
| Producto CaxP incrementado | 9 (13,2) | 3 (4,9) | 0,104 |
| iPTH | |||
| Alta | 28 (41,2) | 34 (55,7) | 0,036 |
| Normal | 27 (39,7) | 24 (39,3) | |
| Baja | 13 (19,1) | 3 (4,9) | |
| hsCRP>3Q | 22 (32,4) | 9 (14,8) | 0,020 |
| IL-6>3Q | 19 (27,9) | 12 (19,7) | 0,272 |
| IL-1β>3Q | 18 (26,5) | 13 (21,3) | 0,494 |
| TNF-α>3Q | 14 (20,6) | 16 (26,2) | 0,449 |
| MDA>3Q | 15 (22,1) | 16 (26,2) | 0,580 |
| Homocisteína>3Q | 18 (26,5) | 12 (19,7) | 0,361 |
| NO<1Q | 52 (76,5) | 44 (72,1) | 0,573 |
| GSH<1Q | 53 (77,9) | 45 (73,8) | 0,580 |
| SOD<1Q | 50 (73,5) | 47 (77,0) | 0,644 |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; DMF: dilatación mediada por flujo; GSH: glutatión reducido; hsCRP: proteína C reactiva de alta sensibilidad; IL: interleucina; iPTH: hormona paratiroidea intacta; MDA: malondialdehído; NO: óxido nítrico; SOD: superóxido dismutasa; TNF-α: factor de necrosis tumoral alfa; 1Q: primer cuartil; 3Q: tercer cuartil..
Se reportan frecuencias y porcentajes; se usó la prueba de Chi2.
Los datos en negrita muestran los valores de p que fueron son significativos.
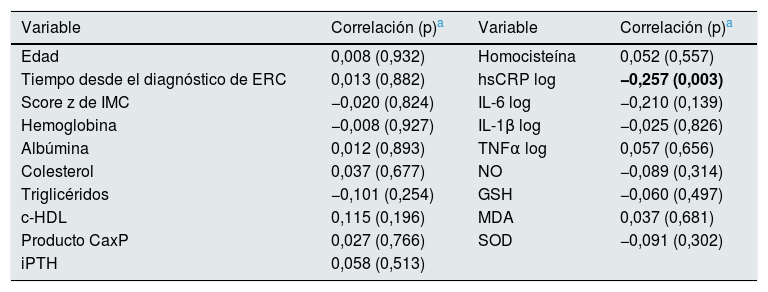
En el análisis de correlación, solamente las concentraciones en sangre de hsCRP se correlacionaron de manera significativa (negativa) con DMF (Rho=−0,25, p=0,003), como se muestra en la tabla 6.
Análisis de correlación de dilatación mediada por flujo con las variables clínicas y bioquímicas
| Variable | Correlación (p)a | Variable | Correlación (p)a |
|---|---|---|---|
| Edad | 0,008 (0,932) | Homocisteína | 0,052 (0,557) |
| Tiempo desde el diagnóstico de ERC | 0,013 (0,882) | hsCRP log | −0,257 (0,003) |
| Score z de IMC | −0,020 (0,824) | IL-6 log | −0,210 (0,139) |
| Hemoglobina | −0,008 (0,927) | IL-1β log | −0,025 (0,826) |
| Albúmina | 0,012 (0,893) | TNFα log | 0,057 (0,656) |
| Colesterol | 0,037 (0,677) | NO | −0,089 (0,314) |
| Triglicéridos | −0,101 (0,254) | GSH | −0,060 (0,497) |
| c-HDL | 0,115 (0,196) | MDA | 0,037 (0,681) |
| Producto CaxP | 0,027 (0,766) | SOD | −0,091 (0,302) |
| iPTH | 0,058 (0,513) |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; GSH: glutatión reducido; hsCRP: proteína C reactiva de alta sensibilidad; IL: interleucina; IMC: índice de masa corporal; iPTH: hormona paratiroidea intacta; MDA: malondialdehído; NO: óxido nítrico; SOD: superóxido dismutasa; TNF-α: factor de necrosis tumoral alfa.
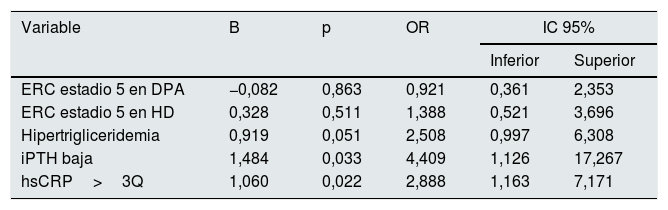
En el modelo de regresión logística, que incluyó las variables que demostraron una asociación significativa con DMF en el análisis univariado, así como el estadio de la ERC y la forma de tratamiento (estadios 2-4 vs. estadio 5 en DP vs. estadio 5 en HD), se encontró que los pacientes con iPTH baja para su edad y estadio de ERC (OR 4,41, IC 95% 1,13-17,27, p=0,033) y con niveles de hsCRP por encima del tercer cuartil (OR 2,89, IC 95% 1,16-7,17, p=0,022) tuvieron una probabilidad mayor de tener DMF<7%, independientemente de las demás variables incluidas (tabla 7).
Modelo de regresión logística para la probabilidad de tener una dilatación mediada por flujo<7%
| Variable | B | p | OR | IC 95% | |
|---|---|---|---|---|---|
| Inferior | Superior | ||||
| ERC estadio 5 en DPA | −0,082 | 0,863 | 0,921 | 0,361 | 2,353 |
| ERC estadio 5 en HD | 0,328 | 0,511 | 1,388 | 0,521 | 3,696 |
| Hipertrigliceridemia | 0,919 | 0,051 | 2,508 | 0,997 | 6,308 |
| iPTH baja | 1,484 | 0,033 | 4,409 | 1,126 | 17,267 |
| hsCRP>3Q | 1,060 | 0,022 | 2,888 | 1,163 | 7,171 |
DPA: diálisis peritoneal automatizada; ERC: enfermedad renal crónica; HD: hemodiálisis; hsCRP: proteína C reactiva de alta sensibilidad; iPTH: hormona paratiroidea intacta; 3Q: tercer cuartil.
Variables incluidas en el modelo: estadio de ERC y forma de tratamiento (ERC estadio 2-4 es la categoría basal), hipertrigliceridemia, iPTH baja, hsCRP>3Q.
La ECV es la principal causa de muerte en niños con ERC y es producto de una combinación letal de varios factores de riesgo tradicionales y no tradicionales, y de sus efectos sobre la estructura y la función cardiaca y vascular. La DE es una manifestación temprana y persistente de ECV y sus factores de riesgo han sido estudiados previamente de manera extensa en adultos en varias enfermedades caracterizadas por su alto riesgo cardiovascular; sin embargo, existen muy pocos estudios en niños con ERC y no identificamos, a la fecha, ninguno que incluyera pacientes en estadios 2 a 4 junto con pacientes en estadio 5 en tratamiento en diálisis peritoneal y HD, y menos aún en un abordaje multivariado que considerara tanto factores de riesgo tradicionales como no tradicionales.
La DMF ha demostrado ser un marcador subrogado confiable de DE. En este estudio poco más de la mitad de los pacientes tuvo DMF disminuida (<7%) y los pacientes en tratamiento con HD tuvieron DMF menor que aquellos en tratamiento con DPA, y estos, a su vez, menor que los pacientes en prediálisis. Al igual que otros autores, encontramos que la DE fue más frecuente en los niños en HD y DPA, aunque estuvo presente incluso en niños desde estadios prediálisis11,20. Estudios recientes han demostrado DE incluso en niños con síndrome nefrótico21.
Respecto a la asociación encontrada entre hipertrigliceridemia y DMF alterada, ya anteriormente se había intentado demostrar, aunque en estudios con otros diseños y en poblaciones más limitadas. Khandelwal et al. evaluaron, en 80 niños prediálisis, el efecto de variables clínicas (edad, sexo, hipertensión, IMC) y bioquímicas (hemoglobina, producto CaxP y perfil de lípidos) sobre el cIMT y sobre la DMF, encontrando una asociación significativa entre colesterol ligado a lipoproteínas de baja densidad y cIMT, aunque ninguna asociación de estas variables con DMF11. De igual forma, un estudio reciente de Kosmeri et al. demostró también una asociación significativa entre alteraciones de los lípidos en sangre con cIMT, pero no con DMF22. Hussein et al. demostraron, en 34 niños con estadio 4 de ERC, una correlación positiva entre la DMF y el calcio en sangre; sin embargo, no encontraron asociación alguna con la duración de la enfermedad, la filtración glomerular estimada ni la tensión arterial10. Lilien et al. estudiaron, en niños trasplantados de riñón, la asociación de la DMF con la edad, el sexo, el IMC, la tensión arterial, el perfil de lípidos, el filtrado glomerular y el uso de ciclosporina y de medicamentos antihipertensivos, encontrando una asociación significativa entre la necesidad de usar antihipertensivos y el diámetro vascular basal únicamente23. La frecuencia de hipertrigliceridemia fue mayor en los pacientes con ERC tratados con diálisis peritoneal, lo cual es esperado dada la alta carga de glucosa que reciben en cada cambio de diálisis y el hiperinsulinismo secundario que ello provoca; sin embargo, la hipertrigliceridemia no fue exclusiva de este grupo de pacientes y también es un factor de riesgo que merece particular atención, independientemente de la forma de tratamiento.
Otro hallazgo relevante del estudio fue la asociación entre DMF y concentraciones bajas de iPTH. Los efectos adversos de la enfermedad ósea de tipo adinámico de la ERC sobre el sistema cardiovascular incluyen al daño vascular, usualmente manifestado como calcificaciones vasculares (CV). Mediante el uso de biopsias óseas, Tomiyama et al. encontraron una asociación significativa entre la presencia de CV y un volumen trabecular óseo disminuido, así como con un ritmo de formación ósea bajo en pacientes prediálisis24. London et al. reportaron una asociación significativa entre la dosis de quelantes de fósforo basados en calcio, la actividad ósea, la CV y la rigidez aórtica. La carga de calcio ha demostrado tener un impacto importante en la CV y la rigidez aórtica en pacientes con enfermedad ósea de tipo adinámico cuando son comparados con pacientes con un metabolismo óseo más activo25. Barreto et al. reportaron, en un estudio prospectivo, una correlación negativa entre calcificaciones coronarias y el volumen óseo; y un estado de bajo intercambio óseo fue el único factor de riesgo independiente predictor de progresión de calcificaciones coronarias en pacientes tratados con HD26. Nosotros hemos reportado previamente que las concentraciones altas de iPTH estuvieron asociadas de manera independiente como un factor de riesgo de rigidez aórtica, pero también lo estuvieron las concentraciones bajas de iPTH27. Hasta donde sabemos, este es el primer estudio que demuestra una asociación entre iPTH baja y alteraciones de la DMF y que puede contribuir a confirmar que la enfermedad ósea de tipo adinámico puede estar asociada a daño vascular incluso en estadios tempranos de ERC, antes incluso de que las CV sean evidentes. Será un área de oportunidad para estudios posteriores buscar la asociación entre los niveles de vitamina D, el factor de crecimiento de fibroblastos 23 (FGF-23) y klotho con alteraciones en DMF en niños con ERC, debido a que están estrechamente relacionados con el control renal de fósforo. Se ha demostrado anteriormente que el incremento de FGF-23 reduce las concentraciones de calcio en sangre incrementando la iPTH. La ERC disminuye la expresión de α-klotho, el correceptor para FGF-23. Una actividad reducida de klotho puede llevar a resistencia a FGF-2328. Se ha evidenciado que klotho afecta la función endotelial incrementando las células de músculo liso y mediante la generación de NO29. La función endotelial puede ser también mejorada por la vitamina D y los agonistas del receptor de vitamina D30–32. FGF-23 tiene varios efectos, incluidos aquellos sobre el sistema renina-angiotensina-aldosterona, mediadores de inflamación y como un agonista de la vitamina D33. Un estudio reciente ha asociado FGF-23 junto con iPTH y los desórdenes del metabolismo mineral en ERC34.
En este estudio encontramos una asociación consistente tanto en el análisis univariado como en el análisis multivariado entre las concentraciones de hsCRP en sangre y la DMF. Hasta donde sabemos, esta asociación no había sido descrita previamente en niños con ERC, a pesar de que la inflamación es prácticamente constante en los pacientes con esta enfermedad. La inflamación es un mecanismo central de la DE y existe abundante evidencia acerca de la asociación entre inflamación y estrés oxidativo. El endotelio disfuncional promueve la generación de especies reactivas de oxígeno que agravan la inflamación vascular. El estrés oxidativo puede amplificar la inflamación vascular, y el incremento de las células inflamatorias aumenta, a su vez, la producción de superóxidos35. Se ha demostrado una estrecha relación entre DE, evaluada mediante DMF, e inflamación vascular en sujetos con factores de riesgo cardiovascular incluso bajo36. La hsCRP contribuye a la aterosclerosis en etapas tempranas de ECV, incrementando su depósito en la íntima vascular incluso antes de la aparición de monocitos37. Esto afecta la biodisponibilidad de NO y lleva a la hiperplasia de la íntima de los vasos. Parece que la hsCRP actúa sobre la lipoproteína de baja densidad oxidada, que juega un papel central en la DE inducida por lipoproteínas de baja densidad oxidada en las células endoteliales38. Este ambiente proinflamatorio es exacerbado también por la sobreexpresión de factor de necrosis tumoral alfa e interleucina 1β, que promueven la migración y adhesión leucocitarias39. Estas quimiocinas inducen a las células endoteliales y a los leucocitos a expresar moléculas de adhesión de células vasculares y moléculas de adhesión intercelulares, proteína quimiotáctica de monocitos 1, E-selectina y P-selectina, que retroalimentan el empeoramiento de la DE40.
La DE es una manifestación multifactorial, temprana y permanente de ECV. En niños con ERC, no había sido estudiada previamente la asociación de los distintos factores de riesgo, tanto tradicionales como no tradicionales, en pacientes en estadios 2 a 5 en tratamiento tanto médico como con DPA o HD, y con un enfoque de análisis multivariado. Nuestros resultados confirman el efecto perjudicial de la inflamación y de la hipertrigliceridemia sobre la función endotelial y apuntan a la necesidad de prestar más atención a la EOA, que puede ser consecuencia de un tratamiento a veces excesivo de la enfermedad ósea metabólica, como causante de DE.
Una limitación de nuestro estudio, pero área de oportunidad para estudios posteriores, fue el estudio incompleto del metabolismo óseo de los pacientes.
ConclusionesLa hipertrigliceridemia, el aumento de hsCRP y las concentraciones bajas de iPTH estuvieron significativamente asociados a DMF alterada en los niños con ERC estadios 2-5 incluidos en nuestro estudio. Se trata de factores de riesgo para ECV frecuentes y potencialmente prevenibles y tratables.
FinanciaciónEl presente trabajo ha sido financiado por el Fondo de Investigación en Salud del Instituto Mexicano del Seguro Social, México (beca número FIS/IMSS/PROT/G11/932).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la ayuda de Susan Drier-Jonas con el manuscrito.