La glomerulonefritis (GN) membranoproliferativa puede asociarse patogénicamente con la infección por el virus de la hepatitis C (VHC), como numerosos casos clínicos han mostrado. La posible relación entre VHC y GN IgA, por el contrario, ha sido sugerida solamente en casos aislados. La nefropatía IgA recurre hasta en un 50 % de los casos tras el trasplante renal, pero es poco frecuente que aparezca como una GN de novo. Presentamos el caso de un paciente con infección crónica por VHC y hepatopatía, que desarrolla dos patologías glomerulares diferentes a lo largo de su evolución: GN membranoproliferativa en sus riñones nativos, proceso que causó una insuficiencia renal terminal, y GN IgA de novo en el riñón trasplantado. Se discute la posible relación patogénica de ambos procesos glomerulares con la infección por VHC.
Membranoproliferative glomerulonephritis (GN) may be pathogenically associated with infection due to the hepatitis C virus (HCV) as many clinical cases have shown. The potential relationship between the HCV and IgA GN, by contrast, has been suggested only in isolated cases. IgA nephropathy recurs in up to 50% of cases after renal transplantation, but it is uncommon for it to appear as a de novo GN. We report the case of a patient with chronic infection due to the HCV and liver disease, who developed two different glomerular diseases during its progression: membranoproliferative GN in his native kidneys, a process that caused terminal renal failure and de novo IgA GN in the transplanted kidney. The potential pathogenic relationship of both glomerular processes with infection due to the HCV is discussed.
INTRODUCCIÓN
Las glomerulonefritis (GN) de novo se definen como aquella enfermedad glomerular que aparece tras la realización de un trasplante renal y es distinta de la nefropatía primaria. Las GN de novo más frecuentes son la nefropatía membranosa, la glomeruloesclerosis focal y segmentaria, la GN membranoproliferativa (GNMP) y la microangiopatía trombótica secundaria a fármacos. Otras entidades, como la GN IgA de novo, son poco frecuentes1,2.
En las últimas décadas se han descrito GN asociadas a la presencia de virus de la hepatitis C (VHC), fundamentalmente GNMP y GN membranosa2-6. La relación de la GN IgA con dicho virus ha sido descrita recientemente7-12.
A continuación presentamos el caso de un paciente con VHC positivo y desarrollo de dos procesos glomerulares diferentes, en los riñones nativos y en el trasplante renal, relacionados ambos casos con dicho virus2,7-13.
EXPOSICIÓN DEL CASO CLÍNICO
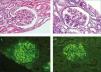
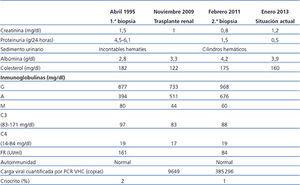
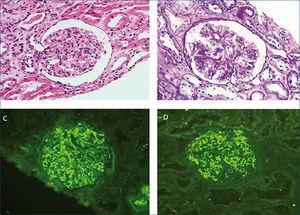
Varón de 56 años, con antecedentes personales de hepatitis alcohólica, que en 1995 ingresó para estudio de síndrome nefrótico, microhematuria e insuficiencia renal (creatinina 1,5 mg/dl). En la exploración física destacaba la presencia de edemas, hepatomegalia y lesiones purpúricas en los miembros inferiores. En el estudio realizado (tabla 1) se observó serología positiva para VHC, resto de las serologías negativas y crioglobulinas positivas. Se realizó una biopsia renal que mostró un parénquima renal con siete glomérulos con una afectación difusa, aumento de la celularidad y matriz mesangial de aspecto lobulillar, membranas basales con imágenes de doble contorno, engrosamientos irregulares de las paredes capilares y fibrosis intersticial. La inmunofluorescencia directa evidenció depósitos glomerulares parietales granulares de C3 y la microscopía electrónica mostró depósitos subendoteliales, endotelios tumefactos y ampliación mesangial (figura 1). El paciente fue diagnosticado de GNMP asociada al VHC con crioglobulinas positivas.
Se remitió al paciente a la Consulta de Aparato Digestivo para valorar de forma conjunta el tratamiento del VHC. Se realizó una biopsia hepática que evidenció una cirrosis hepática (P-3, L-2, F-3). Con estos resultados, se instauró tratamiento con interferón alfa, inicialmente sin lograr respuesta viral sostenida, y posteriormente en su forma pegilada durante 48 semanas logrando negativización de la carga viral. Cuatro meses tras la finalización del tratamiento, presentó un episodio de pericarditis aguda con presencia de VHC en el líquido pericárdico coincidiendo con un nuevo incremento de carga viral. El paciente había tenido mala tolerancia clínica a ambos tratamientos previos y se decidió no iniciar nuevas terapias. Como otras complicaciones presentó artritis inflamatoria de grandes articulaciones.
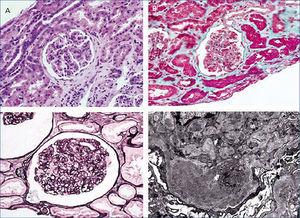
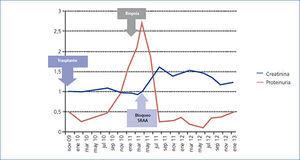
Desde el punto de vista renal se instauró tratamiento antiproteinúrico con bloqueo del sistema renina-angiotensina-aldosterona, a pesar de lo cual el paciente desarrolló insuficiencia renal progresiva y finalmente inició hemodiálisis en 2007. En noviembre de 2009 recibió su primer trasplante renal de donante fallecido por una hemorragia cerebral espontánea. El donante tenía un tipaje HLA: DR1, DRX, B14, B35, A11, A30 y antecedente de enolismo, con creatinina en el momento de la extracción de 1 mg/dl y proteinuria negativa. Se realizó inmunosupresión con corticoides, ácido micofenólico y tacrolimus. La evolución renal fue excelente y presentó función renal inmediata. Trece meses después del trasplante, el paciente desarrolló proteinuria no nefrótica y microhematuria con cilindros hemáticos, pero manteniendo función renal normal. Se realizó estudio de autoinmunidad (tabla 1), anticuerpos donante específicos, así como antigenemia para citomegalovirus y PCR (reacción en cadena de enzima polimerasa) sérica para el virus BK, que fueron negativas, y el eco-Doppler renal fue normal. Ante la sospecha de recidiva de su enfermedad de base, se decidió realizar biopsia renal. En la microscopía óptica se observó un parénquima renal con diez glomérulos con marcada ampliación mesangial, leve fibrosis y atrofia tubular. La inmunofluorescencia observó depósitos mesangiales granulares de IgA y C3, y la microscopía electrónica mostró ampliación mesangial de células y matriz con abundantes depósitos electrodensos homogéneos. Las técnicas de inmunohistoquímica para C4d resultaron negativas (figura 2). Se diagnosticó de GN mesangial IgA de novo en el injerto, incrementándose la dosis de corticoides y de ácido micofenólico sin mejoría clínico-bioquímica. Tras el inicio de tratamiento antiproteinúrico, con bloqueo del sistema renina-angiotensina-aldosterona mediante un antagonista del receptor de angiotesina II (ARA II) y la asociación posterior de espironolactona, se consiguió la negativización de la proteinuria, aunque con un discreto deterioro de la función renal, actualmente estabilizada (figura 3).
DISCUSIÓN
Las GN de novo en el injerto renal se definen como la enfermedad glomerular que aparece tras la realización de un trasplante renal distinta de la nefropatía primaria y representan la tercera causa de pérdida del injerto a los 10 años del trasplante renal. Su prevalencia en las publicaciones es muy variable debido a: los distintos criterios y protocolos para la realización de biopsias renales; el hecho de disponer en algunos casos únicamente de microscopía óptica, sin inmunofluorescencia ni microscopía electrónica, no pudiendo realizar con seguridad el diagnóstico diferencial con otras entidades; el recuento conjunto de GN de novo y recidivas de la enfermedad de base y la presencia de una enfermedad renal de base no filiada. Las entidades más frecuentes son la nefropatía membranosa, la glomeruloesclerosis focal y segmentaria, la GNMP, la microangiopatía trombótica secundaria a fármacos y la nefritis por anticuerpos antimembrana basal asociada a síndrome de Alport1,2. La presencia de GN IgA de novo es poco frecuente14-19. Respecto al curso clínico, las GN de novo presentan una aparición tardía, normalmente a partir del primer año del trasplante, en contraposición con las recurrencias, que se suelen presentar en las primeras semanas postrasplante1. La supervivencia del injerto, tanto en las recidivas como en las GN denovo, es claramente inferior respecto a aquellos pacientes que no desarrollan ningún proceso glomerular20.
Presentamos el caso de un paciente con un síndrome nefrótico, en cuyo estudio destaca una serología positiva para VHC y crioglobulinas positivas. La biopsia renal muestra una GNMP asociada a la infección crónica por VHC. Esta entidad puede presentarse como forma primaria (idiopática) o secundaria al depósito o formación in situ de inmunocomplejos en el glomérulo provocado por enfermedades con activación crónica del sistema inmune (como infecciones por virus de la hepatitis B y C), enfermedades autoinmunes, incapacidad de eliminar inmunocomplejos y algunos tumores21.
Tras recibir su primer trasplante renal, el paciente presentó proteinuria y microhematuria con cilindros hemáticos, sospechándose inicialmente una recidiva de su enfermedad de base, que ocurre entre el 20-30 % de los casos1,2, pero el estudio histopatológico reveló la presencia de una GN IgA de novo. La etiología de la segunda GN es incierta. Inicialmente se podría relacionar con la presencia de hepatopatía crónica del receptor13. En segundo lugar, se plantea la posibilidad de que el donante presentara una GN IgA no diagnosticada sin proteinuria en el momento del trasplante. El donante tenía antecedentes de enolismo y era portador de HLA B35, factores asociados a esta glomerulopatía13,22, aunque desconocemos si previamente había presentado alteración de la función renal o del sedimento urinario. No se realizó biopsia renal del injerto antes de la realización del trasplante y el riñón contralateral no se implantó por presentar un quiste renal. Esta posibilidad nos parece más remota, dado que lo que se describe en la literatura sugiere que los depósitos de IgA en el riñón trasplantado desaparecen de forma precoz tras el trasplante23.
El VHC es un ARN virus pequeño (30-38 nm) con una envoltura lipídica perteneciente a la familia Flaviviridae. Este virus puede inducir la aparición de algunas enfermedades renales. Por otro lado, los pacientes con enfermedad renal presentan un mayor riesgo de infectarse por el VHC porque tienen un mayor contacto directo o indirecto con sangre de otros pacientes (transfusiones, hemodiálisis, trasplante). En Estados Unidos se ha descrito en los centros de hemodiálisis una prevalencia de infectados por VHC del 8-10 % y una incidencia del 1-3 % casos nuevos por año. Se ha relacionado con diferentes enfermedades renales, aunque las más frecuentes son la GNMP tipo I asociada a crioglobulinemia mixta tipo II, y en menor grado la GNMP no crioglobulinémica y la GN membranosa. También se han descrito pequeñas series y casos aislados que asocian la infección por VHC con otros procesos tanto glomerulares (glomeruloesclerosis focal y segmentaria, glomerulopatía fibrilar inmunotactoide, GN aguda posinfecciosa y GN IgA7-12) como no glomerulares (nefritis tubulointersticial y microangiopatía trombótica)3,11.
Estos antecedentes podrían sugerir que ambos procesos glomerulares en nuestro paciente están asociados a la infección por VHC. En la primera GN, la GNMP, la asociación con el virus está bien documentada y avalada por múltiples estudios epidemiológicos, casos clínicos, ensayos y trabajos experimentales3,24. La relación del VHC con el segundo proceso glomerular, la GN IgA de novo, es más inusual. A comienzos de la década de 1990 no se conocía la asociación del VHC con esta GN, aunque sí con la presencia de hepatopatía crónica y enólica25,26, pero con el transcurso de los años fueron describiéndose casos aislados7-10 y series de casos11 de GN IgA sobre riñones nativos. Además, hay casos de pacientes en los que, tras completar el tratamiento antiviral con interferón y ribavirina y alcanzar una respuesta viral sostenida, se normaliza el perfil hepático y el sedimento urinario7,27. La prevalencia de GN IgA en pacientes con VHC oscila entre 0-6 % según la series, aunque en otras áreas geográficas como Arabia Saudí o Japón presentan frecuencias mayores10,11,28. Sansonno et al. han confirmado la presencia de ARN viral en los glomérulos y partículas virales del core tanto en glomérulos como en túbulos de pacientes con GN IgA, aunque en menor porcentaje que en otras glomerulopatías como GNMP y GN membranosa. Estos datos sugieren un papel del VHC en la patogenia de la GN IgA en estos pacientes29.
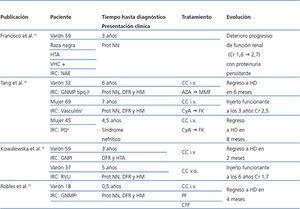
Varias enfermedades renales se han descrito en pacientes portadores del VHC tras recibir un trasplante renal (GNMP, GN membranosa, cambios mínimos, microangiopatía trombótica, rechazo agudo, rechazo crónico). Respecto a las GN de novo, el VHC se ha asociado con la GN membranosa y la GNMP3-5. Su posible papel etiológico en la GN IgA de novo es desconocido. Mostramos los casos descritos en la literatura de GN IgA junto con su evolución en la tabla 2. Destaca el caso descrito por Francisco et al. de un paciente de raza negra con insuficiencia renal crónica atribuida a nefroangioesclerosis secundaria a hipertensión arterial no biopsiada, sin hematuria. El paciente adquiere la infección por VHC tras recibir varias transfusiones cuando se encontraba en tratamiento renal sustitutivo en forma de hemodiálisis, desarrollando hepatopatía crónica. Finalmente recibe un injerto renal de donante fallecido. Se realiza una biopsia renal a las dos semanas del trasplante que muestra un rechazo agudo sin lesiones ni depósitos sugestivos de GN IgA. A los tres años desarrolla proteinuria en rango no nefrótico, realizándose una biopsia renal con diagnóstico de GN IgA15. En los otros casos descritos de GN IgA de novo no tenemos datos de la serología del VHC del receptor. En nuestro caso, el diagnóstico de GN IgA de novo coincide con un incremento de la carga viral del VHC, indicando replicación activa. Este hecho, junto con el efecto de la inmunosupresión y el propio virus, podría modular la respuesta de los linfocitos y la producción de anticuerpos generando un desequilibrio entre antígenos y anticuerpos que, junto con la susceptibilidad del injerto renal, predispondría a largo plazo a la génesis de la GN de novo5.
Finalmente, queremos destacar la buena evolución que ha presentado nuestro paciente, similar a la presentada en otros casos de GN IgA de novo sin semilunas en la biopsia renal, marcador de mal pronóstico en las recidivas en el injerto renal14-19. Nuestro paciente no presentaba semilunas, pero sí era VHC positivo, descrito como factor de riesgo para el desarrollo de proteinuria, rechazo crónico, lesiones glomerulares, infecciones y disminución de la supervivencia tanto del injerto como del receptor5,6. La GN IgA de novo apareció mientras se encontraba en tratamiento con triple terapia inmunosupresora (corticoides, ácido micofenólico y tacrolimus), sin lograrse control de la proteinuria a pesar del incremento de la dosis de esteroides y ácido micofenólico. Finalmente se inició bloqueo del sistema renina-angiotensina-aldosterona mediante ARA II y espironolactona, con disminución de la proteinuria y un leve deterioro de función renal, actualmente estabilizada. El paciente está en tratamiento con ácido micofenólico como parte de su tratamiento inmunosupresor, si bien la utilidad del ácido micofenólico en el tratamiento de la nefropatía IgA es aún controvertida30.
En resumen, el VHC está relacionado en la patogénesis de distintas patologías renales, entre ellas la GNMP y la GN IgA. En nuestro caso, pensamos que la infección por VHC podría haber contribuido a la patogénesis de ambos procesos glomerulares, aunque no podemos descartar que la GN IgA de novo pudiera ser secundaria a la hepatopatía crónica.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Evolución analítica y pruebas complementarias
Tabla 2. Revisión de casos de glomerulonefritis IgA de novo en pacientes trasplantados renales
Figura 1. Biopsia de riñón nativo
Figura 2. Biopsia del trasplante renal
Figura 3. Evolución de función renal y proteinuria