Introducción y objetivos: El hiperparatiroidismo secundario es una complicación habitual en pacientes con insuficiencia renal crónica. El tratamiento con paricalcitiol, activador selectivo del receptor de vitamina D, ha demostrado tener beneficios en el tratamiento de estos pacientes al disminuir adecuadamente la hormona paratiroidea (PTH) con mínimas variaciones del calcio y fósforo séricos. El objetivo de este estudio es evaluar la efectividad y la seguridad del paricalcitol en el tratamiento de pacientes con insuficiencia renal crónica (ERC 3 y 4). Métodos: Se llevó a cabo un análisis de datos de nuestra experiencia, en condiciones de práctica clínica habitual, en 92 pacientes de más de 18 años con diagnóstico de ERC de grado 3 y 4. Los pacientes incluidos en el mismo fueron tratados con paricalcitol y evaluados mediante controles periódicos cada tres meses. Como medida principal de efectividad se estableció la obtención de dos disminuciones en visitas consecutivas ≥del 30% de la hormona paratiroidea intacta (PTHi) respecto a las cifras basales. Se analizaron como objetivos secundarios el cumplimiento de los objetivos de acuerdo con las guías de la Sociedad Española de Nefrología (S.E.N.) y Kidney Diseases Outcome Quality Initiatives (K/DOQI), y, también, la relación entre la efectividad del tratamiento y las diferentes variables registradas de los pacientes. La variable principal de seguridad estudiada fue la aparición de hipercalcemia. Resultados: El objetivo principal del estudio lo cumplieron el 54,3% de los pacientes. Adicionalmente, en otro 16,3% de los pacientes disminuyó la PTHi más del 30% al llegar a la tercera visita (a los seis meses). En conjunto, un 70,6% de los pacientes habían conseguido reducir más del 30% los niveles de PTHi a los seis meses con el tratamiento con paricalcitol. La relación entre el éxito del tratamiento y el grado de filtrado glomerular fue significativa, así como su relación con el índice de masa corporal. Apenas hubo efectos adversos; se halló hipercalcemia en un 2,1% de los pacientes. Conclusiones: El tratamiento con paricalcitol presenta una buena efectividad en el control del hiperparatiroidismo secundario en pacientes no en diálisis, bajo condiciones de práctica clínica habitual con un alto grado de seguridad.
Purpose: Secondary hyperparathyroidism is a common complication in patients with chronic kidney disease. Treatment with paricalcitol, a selective vitamin D receptor (VDR) activator, has shown benefits in these patients by adequately reducing PTH levels with minimal changes in serum calcium and phosphorus. The aim of this study was to assess the effectiveness and safety of paricalcitol in chronic renal disease patients (CKD grades 3 and 4). Methods: A study of our experience with paricalcitol was conducted in normal clinical practice in patients over 18 years diagnosed with grade 3 or 4 chronic kidney disease. Patients were periodically evaluated every 3 months. The primary endpoint of effectiveness was to obtain two consecutive decreases of ≥30% in iPTH with respect to baseline values. The secondary endpoints were fulfilment of the objectives in accordance with the Spanish Society of Nephrology (SEN) and Kidney Disease Outcomes Quality Initiative (K/DOQI) guidelines, as well as the relationship between the effectiveness of the treatment and different patient variables. Safety was studied by means of hypercalcaemia events. Results: The primary study endpoint was achieved in 54.3% of patients. In addition, another 16.3% of patients had reduced iPTH by more than 30% at the 3rd visit. Therefore, 70.6% of patients reduced their iPTH levels by more than 30% in 6 months. The relationship between treatment success and both glomerular filtration rate and body mass index was significant. There were few adverse events, although hypercalcaemia was found in 5.4% of patients. Conclusions: Treatment with paricalcitol is effective in controlling secondary hyperparathyroidism in non-dialysed patients with a wide safety margin.
INTRODUCCIÓN
El hiperparatiroidismo secundario (HPTS) es una complicación frecuente y precoz de los pacientes con enfermedad renal crónica (ERC), caracterizado por el aumento de los niveles de hormona paratiroidea (PTH), que se acompaña normalmente de hiplerplasia de las glándulas paratiroides y que da como resultado una elevada morbilidad1,2.
Las alteraciones metabólicas de este trastorno se deben a la pérdida progresiva de la masa renal y el declive del filtrado glomerular (FG). Durante la insuficiencia renal progresiva, la PTH aumenta de manera inversamente proporcional a la disminución del FG3.
Desde hace tiempo se atribuye la patogenia del HPTS a tres factores principales: déficit de calcitriol, hiperfosfatemia e hipocalcemia.
De acuerdo con algunas observaciones, en niveles iniciales de ERC, (FG >70 ml/min), un aumento de la fosforemia que sólo se detecta tras sobrecarga de fósforo después de la ingesta, explicaría la aparición precoz del HPTS4. Pero, aunque la disminución de calcio y los aumentos puntuales del fósforo tienen un indudable papel en el estímulo de las glándulas paratiroideas, lo que observamos regularmente en la práctica clínica es que los niveles de calcio y fósforo sérico se encuentran dentro de los rangos de la normalidad hasta fases relativamente avanzadas de la ERC3-6.
Además, se ha descubierto un nuevo factor patogénico en los últimos años, el FGF-23 (Fibroblast Growth Factor 23) y, aunque se desconocen muchos detalles de su mecanismo de acción, esta fosfatonina, que se sintetiza principalmente en el hueso, serviría para eliminar una hipotética sobrecarga de fósforo mediante su acción fosfatúrica a la vez que disminuye la síntesis de calcitriol7,8.
El HPTS y las alteraciones del metabolismo mineral producen dos tipos principales de consecuencias clínicas: unas, en el sistema musculoesquelético y otras, en el sistema cardiovascular. Las primeras debidas al aumento en el remodelado óseo, cuya lesión habitual la osteítis fibrosa, con pérdida de masa ósea e integridad estructural de los huesos9,10. Estas lesiones de osteodistrofia renal han sido documentadas por biopsias óseas en estadios muy precoces de ERC11,12. Las segundas se asocian con el riesgo aumentado de calcificación cardiovascular, en la que la toxicidad vascular del fósforo ocupa un papel relevante9,10,13,14.
El tratamiento usual del HPTS comprende restricción de fósforo en la dieta, captores del fósforo y la administración de activadores del receptor de la vitamina D. Más recientemente se ha añadido a nuestro arsenal terapéutico el calcimimético cinacalcet, que activa el receptor del calcio e inhibe la secreción de PTH, además de poseer otros efectos.
El análogo de la vitamina D más usado es el calcitriol, pero de los datos disponibles se deduce que tiene una importante limitación, ya que aumenta la absorción de calcio y fósforo, con el consiguiente riesgo de hipercalcemia, lo que podría causar, en determinadas circunstancias, un aumento de las calcificaciones vasculares y del riesgo de mortalidad cardiovascular15.
Por este motivo se han desarrollado nuevos fármacos que activan el receptor de la vitamina D pero con menor efecto en la absorción intestinal del calcio y el fósforo. El paricalcitol es un fármaco de tercera generación que activa los receptores de la vitamina D (AsRVD) de forma selectiva dependiendo del tejido16.
Experimentalmente se ha comprobado que suprime la secreción de la PTH, pero con cambios mínimos en la calcemia y en la fosforemia17-19. Además, existen evidencias en modelos animales que muestran que el tratamiento con paricalcitol no aumenta la expresión de marcadores procalcificantes en las células del músculo liso vascular, a diferencia de lo que ocurre con los análogos de la vitamina D, que sí sobreexpresan algunos de estos marcadores aumentando la calcificación vascular. Este efecto protector de la calcificación vascular propio del paricalcitol es independiente de los niveles séricos de calcio, fósforo y PTH20,21.
Diversos ensayos clínicos y estudios postautorización han demostrado que el paricalcitol es capaz de controlar el HPTS con menores efectos de hipercalcemia e hiperfosfatemia que el calcitriol en pacientes en hemodiálisis14-26. Es muy relevante el hecho encontrado en un conocido trabajo, referido a pacientes en hemodiálisis, a los que se cambió el calcitriol por paricalcitol, observándose en un seguimiento a dos años un aumento en su supervivencia23.
Por otra parte, existe poca experiencia clínica recogida en pacientes no en diálisis, con hiperparatiroidismo precoz, tratados con paricalcitol, lo que constituyó la motivación para realizar este trabajo.
PACIENTES Y MÉTODOS
Selección de pacientes
Se incluyeron pacientes de más de 18 años, estables, sin enfermedad grave concomitante, con un diagnóstico de ERC establecida en estadios 3 y 4 que fueron remitidos por primera vez a la Consulta de Nefrología del Hospital Clínico San Cecilio de Granada desde atención primaria u otra consulta de nuestro hospital, entre octubre de 2008 y junio de 2010.
El criterio de inclusión fue presentar HPTS con valores de hormona paratiroidea intacta (PTHi) >70 pg/ml en pacientes ERC 3 y PTHi >110 pg/ml y en ERC 4. Los pacientes fueron excluidos si tenían calcio sérico total >9,5 mg/dl o si habían recibido tratamiento con vitamina D o análogos de la vitamina D, o con captores del fósforo con sales de calcio o con fármacos que pudieran alterar el metabolismo del calcio o del hueso como bifosfonatos y/o calcitonina en los seis meses previos. Asimismo, se excluyeron pacientes con comorbilidades importantes o con incapacidad para seguir el tratamiento.
Objetivos y parámetros de valoración
El objetivo del estudio fue establecer la efectividad y la seguridad de la administración de paricalcitol oral en pacientes con ERC 3 y 4 (filtrado glomerular estimado [FGe] por MDRD 59-30 ml/min/1,73 m² y FGe por MDRD 29-15 ml/min/1,73 m²), en las condiciones habituales de práctica clínica en nuestro centro. Se analizó retrospectivamente nuestra experiencia clínica, considerando como principal variable del análisis, siguiendo lo descrito previamente22, la efectividad de paricalcitol oral, para conseguir dos disminuciones consecutivas respecto a las cifras basales de la PTHi del 30% o superiores.
Se analizaron como variables secundarias de efectividad el porcentaje de pacientes que cumplió los criterios de las guías de la Socviedad Española de Nefrología (S.E.N.) y las Kidney Foundation Disease Outcomes Quality Initiative (K/DOQI), incluyendo la PTHi <70 pg/ml (ERC 3) y la PTHi <110 pg/ml (ERC 4), el calcio en rango (8,4-9,5 mg/dl) y el fósforo en rango (2,7-4,6 mg/dl).
Además, se analizó la relación entre el éxito del tratamiento y diferentes variables de los pacientes.
La principal variable de seguridad del estudio fue el seguimiento de los valores de calcio total para detectar la presencia de una hipercalcemia con calcio total >10,5 mg/dl.
Procedimientos de seguimiento y medicación
Se analizó retrospectivamente el seguimiento del tratamiento durante seis meses, comparando los datos de la visita basal (V1) con dos controles sucesivos con intervalos de tres meses, (V2) segunda visita y (V3) tercera visita. A los seis meses de seguimiento se hizo un análisis retrospectivo de los datos. El diagnóstico, la prescripción y el seguimiento fueron llevados a cabo por un solo médico.
La dosis inicial de paricalcitol se determinó según las concentraciones basales de PTHi en función de lo descrito en otro estudio22. Se eligió una pauta de administración diaria, administrándose, como dosis inicial, 1 µg una vez al día, cuando la PTHi era inferior o igual a 500 pg/ml, y 2 µg una vez al día cuando la PTHi era superior a 500 pg/ml22.
En las siguientes visitas trimestrales, se fue modificando la dosis según la respuesta de la PTHi siguiendo la pauta habitual en nuestra consulta. Si la reducción de PTHi es <15 % se aumenta la dosis al doble, si la reducción es del 30 al 60 % se mantiene y si la reducción es >60% se disminuye la dosis a la mitad. Si el calcio sérico es >10,2 mg/dl se disminuye la dosis y si es >10,5 mg/dl se suspende temporalmente, haciéndose determinaciones quincenales de calcio y reiniciándose el tratamiento tras la normalización de la calcemia.
Los datos clínicos de los pacientes figuraban en su historia clínica informatizada y centralizada del hospital. De ella se extrajeron los analizados en el estudio que se volcaron en una ficha de tratamiento estadístico, incluyendo, edad, sexo, índice de masa corporal (IMC), etiología de la ERC, tratamientos concomitantes, niveles de calcio sérico, fósforo sérico, colesterol total, colesterol HDL, colesterol LDL, triglicéridos, hemoglobina, aclaramiento de creatinina calculado, FGe por Cockroft-Gault, FGe por MDRD y niveles de calcidiol (25-OH vitamina D). Previamente se pidió a los pacientes autorización para el uso informático de sus datos para el análisis con compromiso de confidencialidad.
Métodos de laboratorio
Los niveles séricos de calcio total y de fósforo, así como el resto de parámetros analíticos, se midieron con autoanalizador siguiendo los procedimientos del laboratorio del hospital. Los valores de calcio referidos en el presente estudio se expresan como calcio total sin corregir con los niveles de proteínas o albúmina séricas. La determinación de la PTH se llevó a cabo mediante electroquimioluminiscencia (EQL Elecsys PTH de Roche) y se corrigieron los resultados con el coeficiente 0,97 para expresarlas como IRMA NICHOLS según las guías K/DOQI.
Análisis estadístico
Se llevó a cabo un análisis descriptivo de las variables categóricas calculando la frecuencia de cada una de ellas. En las variables cuantitativas, se calcularon la media y la desviación típica cuando seguían una distribución normal, y la mediana y el rango intercuartílico cuando no tenían una distribución normal. Algunas variables cuantitativas fueron categorizadas.
La significación estadística se evaluó mediante la chi-cuadrado (variables categóricas), la t de Student o la prueba no paramétrica de Wilcoxon según procediera (variables cuantitativas). El análisis de asociación univariante se realizó mediante el test de la chi-cuadrado, el de la t de Student o el de la U de Mann-Whitney.
Se analizó la relación entre el éxito del tratamiento y diferentes variables mediante regresión logística de forma univariante o multivariante. La bondad de ajuste del modelo se estudió mediante el test de Hosmer y Lemeshow24.
Para evaluar la seguridad del tratamiento se midieron los niveles de calcio y fósforo analizando la aparición hipercalcemia e hiperfosfatemia. La calcemia fue categorizada en cuatro intervalos de la siguiente forma: ≤8,5 mg/dl, >8,5 a ≤9,5 mg/dl, >9,5 a ≤10,5 mg/dl y >10,5 mg/dl. Se estudió la distribución de los pacientes en cada categoría; además, se analizó especialmente la presentación de hipercalcemia moderada (porcentaje de pacientes con un valor >10,2 mg/dl en al menos una visita) que obligaba disminuir la dosis, y de hipercalcemia significativa (porcentaje de pacientes con un valor >10,5 mg/dl) que obligaba a suspensión temporal del tratamiento.
RESULTADOS
Características demográficas y parámetros basales
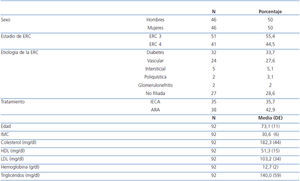
Inicialmente se seleccionaron 99 pacientes que cumplían los criterios de inclusión; de ellos, siete pacientes no tenían datos completos a los seis meses (uno porque abandonó el tratamiento por propia iniciativa y en seis se perdió el seguimiento antes de la tercera visita). Así, en el análisis final se incluyeron 92 pacientes que habían completado el tratamiento de seis meses.
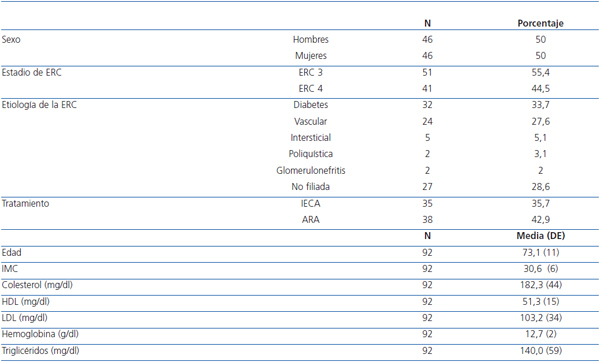
Eran mujeres el 50% y la edad media fue de 73 ± 11 años. Hubo una mayor frecuencia del grado moderado de ERC (55,4% en ERC 3) que del grave (44,5% en ERC 4). La etiología de la ERC más frecuente fue la diabetes (33,7%), seguida de la vascular (27,6%), intersticial (5,1%) y poliquistosis renal (3,1%). Un 28,6% de los casos tenían etiología no filiada. La media del índice de masa corporal (IMC) fue de 30,6 ± 6, lo que indica una población con sobrepeso. La media de colesterol total 182,3 ± 44 mg/dl, de colesterol HDL 51,3 ± 15 mg/dl y de colesterol LDL 103,2 ± 33 mg/dl; presentan un perfil lipídico relativamente controlado en la mayoría de los pacientes. El 35,7% de los pacientes se encontraba bajo tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA) y el 42,9% con antagonistas de los receptores de la angiotensina II (ARA II) por hipertensión arterial asociada (HTA) asociada (tabla 1).
Análisis de la efectividad del tratamiento
La secuencia de revisiones prevista era trimestral, pero el tiempo medio real transcurrido fue el siguiente: la segunda visita (V2) a las 11,7 ± 3 semanas y la tercera vista (V3) a las 25,6 ± 6 semanas.
Las dosis medias de paricalcitol administradas en los tres momentos del estudio fueron las siguientes: en la vista basal se prescribieron 7,4 ± 2,4 µg/semana, en la segunda visita 6,8 ± 2,4 µg/semana y en la visita final 5,2 ± 3,2 µg/semana.
La principal variable analizada del estudio se cumplió en el 54,3% de los pacientes, en quienes se logró una disminución igual o superior al 30% en los niveles de la PTHi, en la segunda visita a los tres meses (V2) y que se mantuvo en la tercera visita a los seis meses (V3). Adicionalmente, otro 16,3% de los pacientes lograron una disminución igual o mayor del 30% en los niveles de PTHi en la tercera visita (V3), con lo que el 70,6% de todos los pacientes disminuyeron su PTHi en más de un 30%, respecto a los valores basales, a los seis meses.
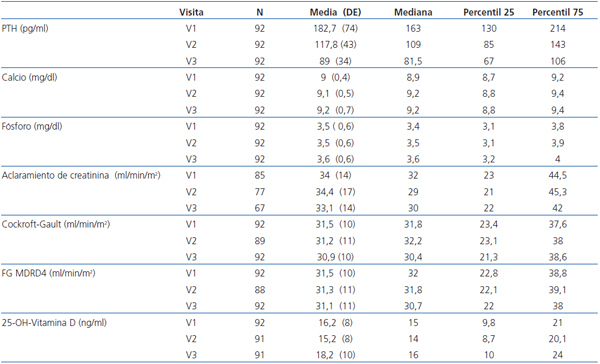
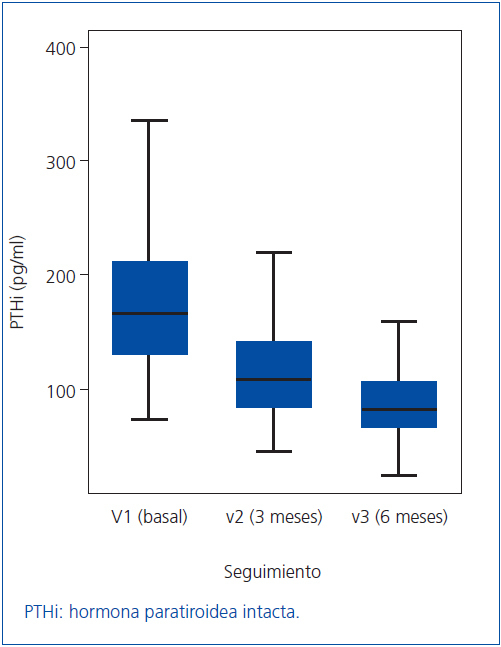
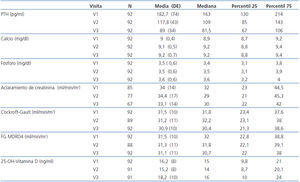
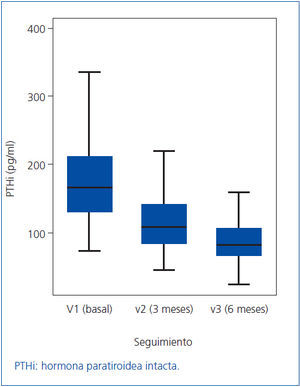
Como los valores de PTHi no siguen una distribución normal, los cambios en la misma los expresamos como mediana y rango intercuartílico (figura 1). En la mediana de la PTHi, se observó un cambio estadísticamente significativo entre la visita basal (V1) y la segunda visita (V2), pasando de 163 a 109 pg/ml (p = 0,001), lo que representa una disminución del 33,1%; también se observó un cambio estadísticamente significativo entre la segunda visita (V2) y la tercera (V3) pasando de 109 a 81,5 pg/ml (p = 0,001), lo que supone otra disminución adicional del 25,2%. En conjunto, para la totalidad de los pacientes, a lo largo de los seis meses del estudio, la mediana de la PTHi disminuyó significativamente desde 163 hasta 81,5 pg/ml (p = 0,001) (tabla 2 y figura 1), lo que supone una disminución del 50,0%.
Es interesante señalar que la disminución conseguida en la PTHi permitió disminuir proporcionalmente las dosis de paricalcitol, desde 7,4 ± 2,4 hasta 6,8±3,08µg/semana(V2)y5,2±3,2µg/semana(V3).
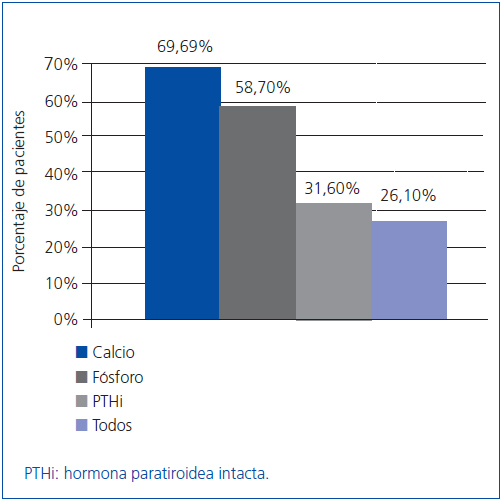
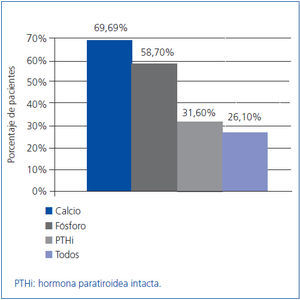
Como objetivo secundario, se analizó también la efectividad del tratamiento según el cumplimiento de las guías K/DOQI, que tienen en cuenta, además de la PTH, los valores de calcio y de fósforo. Nuestros pacientes cumplieron los niveles objetivo de las guías: la PTHi en un 31,6%, el calcio en un 69,6% y el fósforo en un 58,7% de los pacientes a los seis meses, aunque sólo en un 26,1% de los pacientes se lograron los objetivos simultáneamente en los niveles de los tres parámetros (figura 2).
Las variaciones del calcio sérico total (niveles basales de 9,0 ± 0,5 mg/dl y finales de 9,2 ± 0,7 mg/dl) no fueron estadísticamente significativas (p = 0,12). De forma análoga, los cambios del fósforo sérico (basal de 3,5 ± 0,6 mg/dl y final de 3,6 ± 0,6 mg/dl) tampoco fueron estadísticamente significativos (p = 0,2) (tabla 2).
Tampoco fueron significativos los cambios en la función renal calculada con la diuresis (p = 0,6) o el FGe por Cockroft-Gault (p = 0,6) y por MDRD (p = 0,7) (tabla 2).
Además, pudimos observar pequeñas variaciones de los niveles de calcidiol, que debido a los distintos momentos del año en que se analizaron, es probable que reflejen cambios estacionales. Sus valores medios aumentaron ligeramente de 16,2 ± 8 ng/ml a 18,2 ± 10 ng/ml, sin significación estadística (p = 0,13) (tabla 2).
Relación entre efectividad del tratamiento y diabetes y grado de enfermedad renal crónica
No hubo diferencias significativas, en cuanto al objetivo principal del estudio, entre pacientes diabéticos y no diabéticos; dicho objetivo se alcanzó en el 56,2% de los diabéticos y en el 53,3% de los no diabéticos.
Cuando se analizó la relación entre la efectividad y el grado de ERC, se detectaron diferencias significativas, ya que se alcanzó el objetivo primario del estudio en el 67% de los pacientes con ERC 4 frente al 44% de los que tenían ERC 3 (p = 0,05).
Otros factores asociados con la efectividad: asociaciones univariantes y multivariantes
En el análisis de regresión logística univariante se encontró una asociación significativa positiva entre la variable principal de eficacia (probabilidad de éxito del tratamiento) y la mayor afectación renal (ERC 4 frente a ERC 3) (odds ratio [OR]: 2,52; intervalo de confianza [IC] 95%: 1,07-5,97) y los mayores niveles basales de PTHi (OR: 1,02; IC 95%: 1,01-1,03). Además, a mayor IMC (OR: 0,87; IC 95%: 0,79-0,95), a mayor aclaramiento de creatinina (OR: 0,97; IC 95%: 0,93-0,99) o con mayor estimación de FGe por fórmula de de Cockroft-Gault (OR: 0,95; IC 95%: 0,91-0,99), la probabilidad de éxito del tratamiento fue menor.
En el análisis de regresión logística multivariante se eligió la PTHi basal como variable explicativa por ser la que mostró la más alta significación estadística en el estudio de su asociación con el logro del objetivo del estudio. Se incluyó, además, en el modelo multivariante el IMC como variable adicional y se ajustó la ecuación por las variables de sexo y edad. El modelo resultante presentó un buen ajuste. Se obtuvo como resultado un aumento del 2% del éxito del tratamiento por cada unidad de aumento de la PTHi basal (OR: 1,02; IC 95%: 1,01-1,03) y una disminución del 17% por cada unidad que aumenta el valor del IMC (OR: 0,83; IC 95%: 0,75-0,93). En ambos casos los resultados son independientes de la edad o del sexo de los pacientes.
Seguridad del tratamiento
La mayoría de los pacientes presentaron niveles de calcemia entre 8,5 y 9,5 mg/dl durante el seguimiento: un 72,4% en el segundo control (V2) y un 69,6% en el tercer control (V3). Sólo dos pacientes presentaron valores de calcio superiores a 10,5 mg/dl, lo que representó un 2,1% de los pacientes. Por otra parte, en cinco pacientes se observaron niveles de calcio superiores a 10,2 mg/dl (un caso en la V2 y cuatro en la V3), lo que representó el 5,4% de los pacientes.
También se observaron valores de calcio inferiores a 8,5 mg/dl en el 9,2% de los pacientes en V2 y en el 8,7% de los pacientes en V3.
Las variaciones de las medias de calcio y de fósforo a lo largo del estudio no fueron estadísticamente significativas.
Otros efectos adversos
En tres pacientes (3,06%), que recibían numerosos medicamentos, aparecieron síntomas pasajeros de náuseas y/o vómitos que atribuyeron al fármaco, pero, por su carácter transitorio, no fue preciso suspender la medicación.
Un paciente, también con numerosos fármacos administrados de forma simultánea, abandonó el tratamiento (1,02%) en el tercer control por decisión propia.
DISCUSIÓN
Los datos recogidos en este trabajo, procedentes de la práctica de nuestra consulta, y a los que retrospectivamente se les aplicaron criterios de análisis similares a los descritos en la literatura, muestran una alta efectividad del paricalcitol cuando se administra en régimen diario para el control del HPTS en pacientes con ERC en estadios 3 y 4 con cambios no significativos en la calcemia y en la fosforemia.
En nuestros pacientes hubo una considerable disminución de la mediana de la PTHi desde los valores basales (163 pg/ml) hasta el final del estudio (81,5 pg/ml) (p = 0,001), lo que representó una disminución del 50,0%. Esta apreciable disminución cuantitativa permitió que se cumpliera el objetivo principal del estudio en el 54,3% de los pacientes, quienes lograron bajar los niveles de la PTHi ≥30% a los tres meses y mantuvieron esta disminución a los seis meses, es decir, tuvieron dos disminuciones consecutivas respecto a los valores basales. Nuestros resultados son comparativamente de menor magnitud que los mostrados en el estudio de Coyne, en el cual el 90% de los pacientes alcanzó un objetivo similar22. Creemos que estas diferencias pueden explicarse porque las condiciones de ambos estudios son distintas. El estudio de Coyne es un ensayo clínico controlado, con un objetivo primario fijado prospectivamente, mientras que el nuestro tiene la limitación de realizarse en las condiciones de una consulta clínica hospitalaria normal y los datos se estudiaron de forma retrospectiva. Además, en el citado estudio se partía de mayores niveles de PTH que en el nuestro y, por esta razón, los pacientes recibieron dosis medias de paricalcitol mayores que los nuestros. Finalmente, los intervalos de tiempo del estudio de Coyne y el tiempo de seguimiento eran diferentes a los nuestros.
Otro aspecto observado en nuestros pacientes es que hubo una disminución de la PTHi mayor entre la visita basal (V1) y la segunda visita (V2) (del 35,5%) que entre la segunda visita (V2) y la tercera (V3) (del 24,4%). Esto coincide con estudios previos en los que se han observado descensos en los niveles de la PTHi del 30% en los dos primeros meses con descensos menores y progresivos en los meses siguientes18,22,25. En total, observamos una disminución de la mediana de la PTHi desde sus niveles basales hasta el final del estudio de un 50,0% (V1 frente a V3). Esto permitió que un 70,6% de los pacientes lograran reducir su PTHi más de un 30% a los seis meses.
Esta reducción permite ser comparada con otros estudios similares. En un estudio abierto multicéntrico de larga duración con paricalcitol oral se observó una disminución progresiva de la PTHi hasta el mes decimotercero de tratamiento25. En otros estudios los efectos de paricalcitol han sido comparados con calcitriol, un análogo de la vitamina D no selectivo, observándose disminuciones en la PTHi significativamente mayores y más rápidas con paricalcitol que con calcitriol26,27. En otro estudio reciente llevado a cabo con pacientes en hemodiálisis que recibían cinacalcet asociado a paricalcitol, en el 40,5% de ellos se produjo una disminución de la PTHi del 50%, de magnitud comparable a la de nuestros pacientes que sólo recibían paricalcitol28.
Por otra parte, las importantes disminuciones de la PTHi en nuestros pacientes permitieron ir reduciendo paulatinamente las dosis de paricalcitol desde una media semanal al comienzo de 7,4 µg a una media de 5,2 µg al final, con el máximo grado de control de la PTHi. Esto supone reducir las dosis un 29,7% en el período de seis meses que duró el estudio, como refieren otros autores. En un estudio prospectivo, abierto y de larga duración la dosis de paricalcitol pudo ser reducida significativamente a lo largo del estudio manteniéndose la supresión de la PTHi26.
Otra forma de analizar los efectos del tratamiento sobre los trastornos del metabolismo mineral es evaluar el cumplimiento de los valores considerados óptimos por distintas guías de práctica clínica como la K/DOQI propuesta por la National Kidney Foundation americana29 y las guías de la S.E.N.30. Al final del período estudiado, y según ambas guías, el 31,6% de nuestros pacientes se encontraron dentro del rango para la PTHi, el 66,9% dentro del rango para la calcemia y el 58,7% dentro del rango para la fosforemia. Y en el 26,1% de los pacientes se lograron los objetivos simultáneamente en los niveles de los tres parámetros. Debe destacarse que el algoritmo de tratamiento de nuestros pacientes según los niveles de PTHi no se diseñó de manera prospectiva para alcanzar los márgenes propuestos por estas guías.
Desde hace tiempo se conocen las dificultades de alcanzar los criterios de las K/DOQI que literalmente se describen como una «batalla penosa» o «cuesta arriba». Y apenas publicadas estas guías se comprobó que eran pocos los pacientes que las cumplían; en uno de los primeros estudios en pacientes en hemodiálisis las cumplía para la PTHi un 20%, y sólo un 8% para los tres parámetros de manera simultánea31. En el estudio multicéntrico español de la S.E.N. conocido como OSERCE II, que incluyó a pacientes con ERC no en diálisis de 39 centros, se observó que estaban dentro del rango de las guías K/DOQI un 30% para la PTHi, un 35,6% para el calcio y un 76,5% para el fósforo. En este estudio se resaltó la dificultad de disminuir la PTH, sobre todo al compararlo con otro similar de los mismos autores, hecho tres años antes, y en el que se consiguió una disminución de la PTHi similar32. De igual manera, en otro estudio de nuestro grupo se recogieron los datos del Sistema de Información de Coordinación Autonómica de Trasplante Andaluza (SICATA) de los años 2007, 2008 y 2009 referentes al control de la PTHi de acuerdo con las K/DOQI en pacientes en hemodiálisis, encontrándose dentro del rango de PTHi el 32,4% (años 2007 y 2008) y el 35% (año 2009). Debe destacarse también que los tres parámetros, calcio, fósforo y PTHi, sólo se encontraron en rango simultáneamente entre un 13,5 y un 15%33. Finalmente, en otro estudio multicéntrico italiano (The Italian FARO Survey) en el que participaron 2.637 pacientes de 28 centros de hemodiálisis, también se muestra la dificultad de alcanzar los rangos de las K/DOQI, ya que el 26,8% de los pacientes tenían la PTHi en rango, en los datos basales y el 32% a los 18 meses34. Así pues, tanto en diálisis como en ERC no en diálisis, es difícil alcanzar los objetivos de las guías como muestran estos trabajos.
Además, en nuestro estudio y de forma complementaria, también evaluamos los distintos factores que podían tener que ver en la respuesta al tratamiento. En cuanto a la consecución de la disminución ≥30% de la PTHi no hubo diferencias entre pacientes diabéticos (56,2% de éxito) y no diabéticos (53,3% de éxito).
Sin embargo, hubo una mayor efectividad del tratamiento en pacientes con ERC 4 respecto a los de ERC 3, tanto en el objetivo principal del estudio como en medidas secundarias (disminución de la PTHi en al menos una visita). Además, los resultados obtenidos mediante regresión logística confirman una asociación entre la efectividad del tratamiento y el grado de ERC (mayor efectividad en ERC 4, o menor aclaramiento de creatinina, o menor estimación de Cockroft o menor MDRD). Una explicación posible es que resulte más difícil hacer descender la PTHi hasta su rango normal cuanto más cerca esté de él, y más fácil cuanto más alejada esté del mismo, al menos en hiperparatiroidismo precoz donde no haya más que hiperplasia difusa de las glándulas paratiroides y éstas sean suficientemente sensibles a la activación de los receptores de la vitamina D (RVD).
La asociación con el IMC mostró que cuanto mayor era este índice la probabilidad de éxito del tratamiento era menor. Otros autores, en un trabajo reciente, también observan que el IMC condiciona una peor respuesta al paricalcitol oral en la insuficiencia renal antes de la diálisis, y que la obesidad es un factor de mala respuesta al tratamiento como vimos en nuestros pacientes35.
El análisis mediante un modelo multivariante mostró similares resultados, es decir, que la efectividad del tratamiento aumentaba a mayor nivel de la PTHi basal y disminuía al aumentar el IMC.
Finalmente, los riesgos más frecuentes de los tratamientos con análogos de la vitamina D en los pacientes con ERC en estadios 3 y 4 son los de producir hipercalcemia, hiperfosforemia y aumento del producto Ca x P. Se sabe que la activación selectiva de los RVD, como lo hace el paricalcitol, producen menor absorción intestinal de estos iones disminuyendo notablemente estos riesgos como se vio en el trabajo de Coyne22. Es un dato relevante de nuestro estudio, que el tratamiento con paricalcitol, además de su efectividad, permitió un manejo del fármaco seguro, ya que sólo aparecieron cinco casos hipercalcemia moderada >10,2 mg/dl (5,4% de los pacientes) y que representó el 2,6% de todas las determinaciones analíticas en los seis meses de seguimiento. Además, en dos casos (2,1% de los pacientes) observamos una hipercalcemia grave >10,5 mg/dl que obligó a suspensión transitoria del fármaco. De manera similar a lo referido en otros estudios22, se observó un ligero incremento medio en los niveles de calcio de 0,1-0,2 mg/dl que no fueron estadísticamente significativos. No se observaron cambios significativos en los niveles de fósforo, ni ninguna determinación con hiperfosfatemia. Nuestros datos son comparables a los de otros estudios en los que la incidencia de efectos adversos, hipercalcemia, hiperfosfatemia y elevaciones del producto calcio-fósforo fue similar entre pacientes en el grupo del paricalcitol o del placebo14,22,25,26. Es interesante señalar que, dada la especial relevancia que está adquiriendo la activación selectiva de los RVD, tanto en la protección de la calcificación vascular36 como por sus potenciales efectos pleiotrópicos37,38 creemos que nuestra experiencia con este fármaco, en lo que se refiere a efectividad y seguridad, podría ser de especial utilidad.
El otro problema que debe tenerse en cuenta con los tratamientos es la tolerancia global a estas sustancias. En nuestro trabajo se pudo observar que el paricalcitol fue muy bien tolerado, ya que la incidencia de efectos adversos, principalmente de tipo gastrointestinal, también fue muy escasa y de intensidad leve; se resolvieron sin suspender el tratamiento en pocas semanas, apareciendo en sólo tres pacientes (el 3,06%). Un solo paciente (el 1,02%), que tomaba abundante medicación, abandonó el tratamiento por decisión propia refiriendo sensación de malestar general y náuseas, pero no vómitos. Ninguno de los controles analíticos mostró alguna alteración que explicara los síntomas que el paciente refirió. Datos semejantes se encuentran en otros trabajos14,22.
En conclusión, nuestros datos sugieren que en las condiciones de práctica clínica habitual en nuestras consultas, el paricalcitol oral puede utilizarse como tratamiento de elección en el hiperparatiroidismo precoz de pacientes con ERC en estadios 3 y 4, con suficiente grado de eficiencia, seguridad y tolerancia, pudiendo esperarse unos resultados clínicos comparables a los de los ensayos controlados que se han publicado.
El principal esfuerzo de este estudio ha sido intentar aplicar a la práctica clínica usual los conocimientos de las investigaciones rigurosas, prospectivas y con grupo control, por lo que se reconocen como limitaciones del mismo, en primer lugar, la dificultad de validación de nuestros datos por los escasos estudios previos en condiciones de práctica clínica similar al nuestro; en segundo lugar, el número escaso de pacientes tratados y, en tercer lugar, la falta de un seguimiento a más largo plazo.
Tabla 1. Características demográficas y parámetros basales
Tabla 2. Cambios en las variables principales en las tres visitas
Figura 1. Valores de PTHi (expresados como mediana y rango intercuartílico)
Figura 2. Porcentaje de pacientes que tras los seis meses de tratamiento cumplieron con los valores recomendados por las guías K/DOQI para los valores de calcio, fósforo y PTHi