INTRODUCCIÓN
La hiperfosforemia es un desorden mineral común en la enfermedad renal crónica (ERC); la retención renal de fosfatos se detecta precozmente desde que la tasa de filtración glomerular (TFG) se hace menor de 70 mL/minuto, y es el resultado de la incapacidad renal para eliminar por filtración glomerular la carga nutricional diaria de fosfato que es alrededor de 1.000-1.800 miligramos, siendo absorbida principalmente en el intestino delgado. Cuando la TFG cae a un valor por debajo de 25 ml/minuto los mecanismos compensadores que permiten adaptarse y excretar la carga diaria de fosfatos se agotan apareciendo hiperfosforemia, la cual se detecta en el 50% de los pacientes en hemodiálisis1.
Las consecuencias de la hiperfosforemia son: a- disminución del calcio sérico por precipitarse con el a nivel periférico b- disminución en la producción renal de la forma activa de la Vitamina D3, y c- estimulación directa de la glándula paratiroides para sintetizar y secretar paratohormona1-3, mecanismos responsables del hiperparatiroidismo secundario que frecuentemente se observa en la ERC.
Después de recomendar una dieta baja en fosfato, la administración de quelantes de fosfato vía oral es la segunda herramienta para reducir los niveles de fósforo sérico; desafortunadamente cada uno de ellos tienen sus inconvenientes: el hidróxido de aluminio genera alteraciones neurológicas, osteomalacia y anemia; las sales de calcio elevan el producto calcio fósforo con su respectiva precipitación en tejidos blandos, y tanto el Sevelamer como el carbonato de Lantano son medicamentos de alto costo4.
Los desórdenes lipídicos son también muy comunes en la ERC, con predominio de elevación de los triglicéridos en pacientes sometidos a hemodiálisis, y elevación del colesterol total y LDL con reducción en las HDL en pacientes en diálisis peritoneal5. La asociación hiperlipidemia con hiperfosforemia le imprime al paciente con ERC un altísimo riesgo de complicaciones cardiovasculares con reducción significativa en su expectativa de vida6.
El ácido nicotínico es un medicamento antiguo utilizado principalmente para el tratamiento de la hiperlipidemia, pero recientemente se descubrió que tiene la capacidad de inhibir la absorción intestinal de fósforo en parte por disminuir la expresión de la proteína NaPi-2b7encargada del cotransporte sodio-fosfato a nivel intestinal8-10. Las anteriores observaciones fueron por lo tanto el motivo para animarnos a utilizar este producto en un grupo de pacientes que cumplieran con las características de compartir hiperlipidemia e hiperfosforemia con ERC, de tal manera que se esperaba lograr un doble beneficio y a un muy bajo costo.
MATERIALES Y MÉTODOS
En el proceso de revisión mensual de paraclínicos de los pacientes que asisten regularmente a su terapia dialítica en la unidad renal de RTS Ltda. Sucursal Caldas en el Hospital Santa Sofía (Manizales, Caldas, Colombia), se procedió a reconocer los pacientes que durante los últimos tres meses presentaban alteraciones en el perfil lipídico, identificando aquellos en los cuales persistían elevados los lípidos (cualquiera de los siguientes: colesterol total mayor a 200 mg/dL, LDL mayor a 100 mg/dL, triglicéridos mayor a 300 mg/dL) no obstante el uso de estatina (lovastatina) o fibrato (gemfibrozilo) en forma ininterrumpida en los últimos 4 meses (nunca se combinó estos dos medicamentos). En ellos también se determinó si presentaban hiperfosforemia (fósforo sérico mayor a 5,5 mg/dL) a pesar de haber recibido recomendaciones nutricionales y un quelante de fosfato vía oral por 3 meses. Este último podría haber sido hidróxido de aluminio por máximo 4 semanas seguido por sevelamer por 8 semanas a dosis máxima de 2 tabletas con cada comida cuando el producto Ca x P fuese mayor a 55 o los niveles de calcio sérico mayores a 10,2. Si el producto era inferior a 55 y el calcio sérico inferior a 9,5 se utilizó sales de calcio (carbonato de calcio) a una dosis máxima de 600 mg de calcio elemental con cada comida. Si el paciente cumplía con los requisitos de presentar las dos alteraciones (hiperlipidemia e hiperfosforemia refractarias) fue considerado candidato para la administración diaria de ácido nicotínico (Niaspan®- tabletas de liberación prolongada por 500, 750 y 1.000 mg) 500 mg por noche inicialmente, y si el paciente lo toleraba se aumentaba progresivamente llegando hasta una dosis máxima de 1.000 miligramos a los 3 meses de su inicio, precedidos en 1 hora siempre en forma protocolizada por 100 mg de ácido acetilsalicílico. Durante el tiempo que los pacientes recibieron el ácido nicotínico se suspendió cualquier forma de quelante de fosfato oral, y nos aseguramos que no hubiesen recibido Vitamina D en meses recientes, la cual está contraindicada en presencia de hiperfosforemia; ellos además continuaron recibiendo la estatina oral o el gemfibrozilo, los cuales fueron combinados con el ácido nicotínico. Se excluyeron pacientes con enfermedad hepática, úlcera peptica, neoplasias y gota o hiperuricemia.
La droga fue administrada durante un periodo de 8 meses en cada paciente, registrándose la aparición de efectos secundarios, y se solicitaron exámenes predialíticos mensuales, o en periodos de 2,3, ó 4 meses según los controles habituales establecidos en la unidad renal, siendo determinados por los métodos de laboratorio rutinarios. En vista de que la alteración de mayor riesgo cardiovascular para el paciente la constituía la hiperlipidemia, y el acido nicotínico está aprobado para ser usado en pacientes con hiperlipidemia y enfermedad renal crónica5,11, no se solicitó el consentimiento informado de los pacientes para la administración del ácido nicotínico, del cual se quería observar si presentaba un efecto beneficioso reductor de fosfatos.
Para obtener el KT/V de la urea se utilizaron las recomendaciones sugeridas en el UPTODATE 14.1 (KT/V calculator), teniendo en cuenta todas las variables allí anotadas.
El programa estadístico utilizado fue EpiInfo versión 6.04d desarrollado por la organización mundial de la salud (OMS), las variables cuantitativas se analizaron por medio de promedios y desviación estándar, utilizando la prueba de t de Student; las variables cualitativas por medio de proporciones y la prueba de Chi-cuadrado.
RESULTADOS
Nueve pacientes fueron incluidos en este estudio observacional, edad promedio: 48,2 años, 6 mujeres, 3 varones; causa de la enfermedad renal crónica: 2 Nefropatías hipertensivas, 3 Nefropatías diabéticas, 2 Nefropatías lúpicas, 1 riñón de mieloma y 1 etiología desconocida; tiempo promedio en diálisis: 34,7 meses, 3 pacientes en hemodiálisis y 6 en diálisis peritoneal. Todos los pacientes recibieron a los 3 meses la dosis de 1.000 miligramos y continuaron con ella durante todo el periodo de observación, lográndose adherencia al medicamento del 100%.
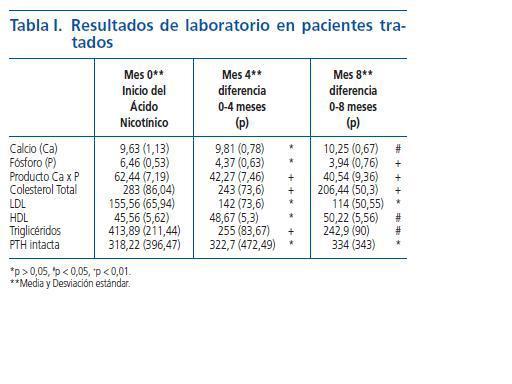
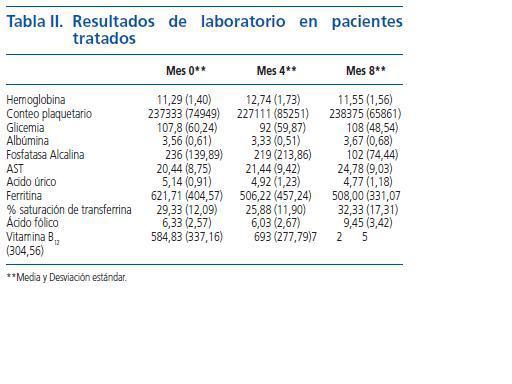
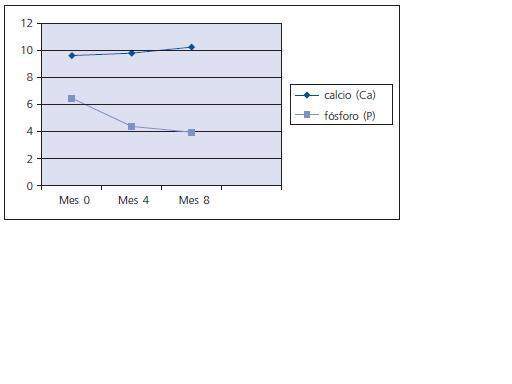
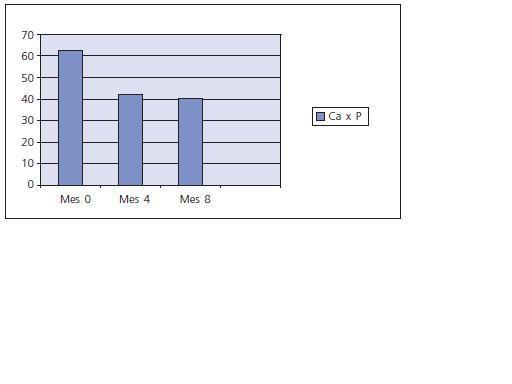
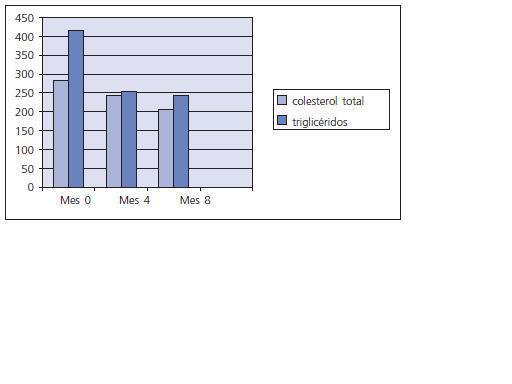
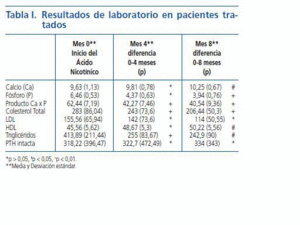
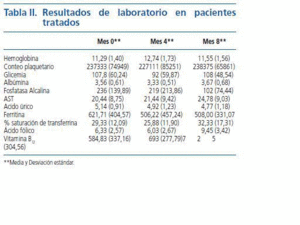
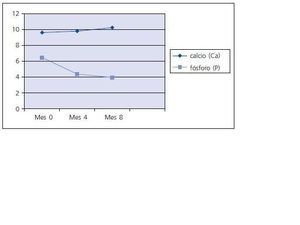
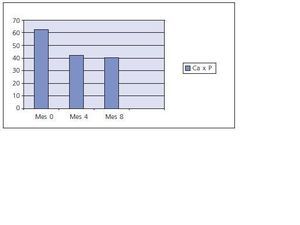
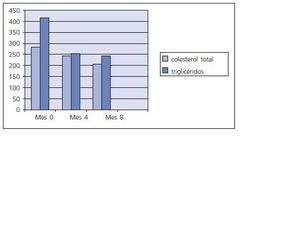
Entre los paraclínicos evaluados se encontraron significativas modificaciones, siendo las más importantes: el Calcio (Ca) sérico se elevó progresivamente, y al mes 8 pasó de un valor inicial de 9,63 +/- 1,13 a 10,25 +/- 0,67 (p < 0,05); el Fósforo (P) se redujo alcanzando su disminución un valor significativo a los 8 meses : inicial 6,46 +/- 0,53, 4 meses 4,37 +/- 0,63 (p > 0,05) y 8 meses 3,94 +/- 0,76 (p < 0,01); el producto Ca x P obtuvo reducciones importantes tanto a los 4 como a los 8 meses; la reducción en el Colesterol total y los Triglicéridos fue significativa en todos los periodos, no siendo así para la LDL, aunque la HDL se elevó a valores significativos a los 8 meses; la PTH intacta no tuvo cambios importantes (ver tabla I y figs. 1, 2 y 3). No se presentaron modificaciones importantes en los valores de Hemoglobina, glóbulos blancos, conteo plaquetario, pruebas de función hepática (AST, ALT, Bilirrubinas total y directa), pruebas de coagulación (TTP y TP), ácido úrico, glicemia, albúmina, creatinina, Bun, % saturación transferrina, ferritina, ácido fólico y vitamina B12 (ver tabla II). El KT/V promedio fue de 1,98 y ningún paciente presentó los conocidos efectos secundarios generados por este medicamento: prurito, enrojecimiento facial, diarrea o crisis gotosas.
DISCUSIÓN
Los pacientes con ERC tienen entre 10 a 100 veces más probabilidades de sufrir un evento cardiovascular que la población general6. Los niveles altos de fósforo séricos han demostrado que se asocian con mayor mortalidad de todas las causas, mortalidad cardiovascular, calcificaciones vasculares y valvulares12-15; de tal manera que se estima que por cada 1 mg/dl de elevación del fósforo sérico en pacientes con ERC se incrementa el riesgo de padecer infarto de miocardio en un 35%16. Es claro por lo tanto que tratar de reducir los niveles de fósforo sérico a los valores recomendados por las guías DOQI (menores de 5,5 en estadio 5 de ERC) es un objetivo que se debe buscar por parte de todos los nefrólogos17, objetivo del cual en reciente evidencia se muestra que estamos muy lejos, puesto que solo el 44% de los pacientes en hemodiálisis tienen una concentración de fósforo dentro del rango normal15.
Tanto la dieta baja en fosfatos, como la hemodiálisis convencional por 4 horas se han demostrado incapaces de lograr las metas sugeridas18, de ahí que sea necesaria la utilización de quelantes de fosfato vía oral, los cuales permiten la eliminación por tubo digestivo de este mineral.
El hidróxido de aluminio y las sales de calcio se utilizaron por décadas como medicamentos quelantes, pero sus marcados efectos colaterales han llevado a restringir su uso a un grupo especial de pacientes4. El carbonato de Lantano es un elemento raro de la tierra con buena capacidad quelante, pero a la fecha hay preocupación respecto a su perfil de seguridad por la gran acumulación hepática que presenta19, quedando como medicamento quelante de primera elección hasta la fecha el Sevelamer, un polímero sintético intercambiador iónico20, cuya eficacia ha sido demostrado en gran cantidad de trabajos21,22. Desafortunadamente su alto costo y el gran número de tabletas que debe de consumir diariamente el paciente para lograr controlar sus niveles de fósforo sérico, lo hacen de difícil prescripción en nuestro medio.
La capacidad del ácido nicotínico, su metabolito activo la nicotinamida y su prodroga el Niceritrol de reducir el fósforo sérico en pacientes con ERC ha sido demostrado desde hace varios años23,24, recientemente se ha comparado la eficacia de la nicotinamida con el sevelamer25 y el ácido nicotínico a bajas dosis con Carbonato de Lantano26, lográndose una eficacia terapéutica muy similar por ambos productos, con la ventaja de requerir una a dos dosis al día y ser muy costo efectivo27. A diferencia de lo que ocurre con el ácido nicotínico, el cual es comercializado en nuestro país en presentaciones de liberación prolongada en concentraciones de 500, 750 y 1.000 miligramos, la nicotinamida es un preparado magistral, y aunque tiene un buen efecto reductor de fosfatos tiene el inconveniente de generar marcados efectos secundarios28, como se observó en el trabajo realizado por Galeano C y cols., en el cual 1 g diario de nicotinamida logro una significativa reducción del fósforo sérico, pero a expensas de la aparición de muchos efectos secundarios28.
El efecto hipofosforémico del ácido nicotínico fue descubierto accidentalmente por Shimoda y cols., cuando observo que la administración de Niceritrol a pacientes en hemodiálisis con hipocolesterolemia de HDL reducía significativamente los valores de fósforo sérico24. Ello los llevó a realizar un estudio doble ciego en el cual confirmaron tal efecto a diferencia del placebo29, y posteriormente demostraron en animales de experimentación que el efecto era generado por aumento en las pérdidas de fosfato fecales y no en las urinarias30. Su mecanismo básico de acción radica en inhibir la actividad o expresión de la proteína cotransportadora de sodio-fosfato (NaPi-2b) en el intestino delgado7,31, cuya actividad es regulada por los niveles de fósforo séricos y por la Vitamina D activa [1,25 OH (2) vitamina D (3)]32-34. El acido nicotínico es una vitamina del complejo B, la cual se convierte en el organismo en los dinucleótidos adenosina nicotinamida (NAD) y fosfato adenosina nicotinamida (NADP), ellos son coenzimas de muchas reacciones de oxidación-reducción, observándose que luego de la administración de nicotinamida las concentraciones corticales renales de NAD se aumentan significativamente, por lo cual inhiben la captación de fosfato por las vesículas del borde en cepillo de las células del tubulo proximal en ratas, inclusive en condiciones de dieta baja en fosfatos, mecanismo de reabsorción mediado por la proteína NaPi-2a35,36. Es posible que estas altas concentraciones se generen también en las células de la mucosa del intestino delgado y allí ejerzan un efecto similar sobre la proteína NaPi-2b inhibiendo su función31, promoviendo el aumento en las pérdidas fecales de fosfatos. En nuestro trabajo observamos que el acido nicotínico genero una reducción significativa de los niveles de fósforo sérico a los 8 meses, pero no a los 4, ello indica que muy probablemente la dosis necesaria a tomar por los pacientes para lograrse el efecto deseado sea de 1.000 miligramos, puesto que en ese momento el 100% de los pacientes ya la recibían.
Además del efecto hipofosforémico del ácido nicotínico, su acción hipolipemiante es muy notoria. Ello es el resultado de su capacidad de reducir la síntesis hepática de VLDL, triglicéridos, y aumentar la síntesis de HDL, también puede reducir los niveles de LDL en un 10-15% y de colesterol total37-40. Su efecto además se genera por estímulo del receptor GRP109A sobre los adipósitos, en los cuales ejerce un efecto inhibidor de la lipasa hormono-sensible41. Las cifras de colesterol total y LDL se redujeron en el presente trabajo, pero ello puede ser consecuencia de la asociación del ácido nicotínico con el hipolipemiante que previamente recibían los pacientes, y no un efecto aislado del medicamento.
Los niveles de PTH intacta no se modificaron significativamente y no tenemos una explicación clara del porque, aunque es factible que la ausencia de variaciones en los niveles de PTH podrían sugerir que el ácido nicotínico interferiría con la función del cotransportador Na-Pi en la membrana de las células paratiroideas, bloqueando su acción y evitando que las modificaciones del fósforo extracelular afecten la producción y secreción de la paratohormona42. Se requiere de un periodo de seguimiento mayor y de un número de pacientes más grande para realmente obtener datos con mayor significancia estadística, aunque es conveniente resaltar que el control del fósforo y del calcio parecen más importante en primer término que el propio control de la PTH, pues la relación entre la mortalidad y fósforo o calcio parece ser más consistente (o menos compleja) que la asociada a PTH20. La reducción en los niveles de Fosfatasa alcalina en nuestro estudio de un valor inicial promedio de 236 a 219 a los 4 meses y 102 a los 8 meses, sugiere que el ácido nicotínico al lograr modificar los valores de fósforo sérico altera el proceso de remodelación ósea.
Entre los efectos secundarios atribuibles a dosis altas de ácido nicotínico utilizadas en pacientes en diálisis se encuentran descritos: diarrea43, gota, cefalea, rubor facial, prurito, trombocitopenia23,44, hiperglicemia, elevación de las enzimas hepáticas e hiperuricemia, aunque en recientes publicaciones de trabajos realizados con el uso de preparados de liberación prolongada la aparición de efectos colaterales ha sido idéntica a la del placebo45,46. Ninguno de los efectos secundarios clínicos y de laboratorio se presentó en nuestros pacientes, ello fue muy probablemente el resultado de las bajas dosis utilizadas (máximo 1 g), y de la administración rutinaria de ácido acetilsalicílico (100 mgs 1 hora antes) el cual bloquea el efecto liberador de prostaglandinas (PGD2 y PGE2) inducido por el ácido nicotínico a través de su receptor GPR109A principalmente en las células inmunes de la piel41.
En conclusión en este trabajo que es el primero a más largo plazo (8 meses) hasta ahora publicado, en el cual se utilizo el acido nicotínico de liberación prolongada, se muestra su efectividad terapéutica para mejorar el perfil lipídico y corregir la hiperfosfatemia refractaria, demostrando que este medicamento es seguro, de bajo costo y fácil de administrar una vez al día, lo cual aumenta notoriamente la adherencia del paciente, siendo a la fecha el ideal a formular cuando se presenta la combinación de factores hiperlipidemia e hiperfosforemia refractarias al tratamiento clásico en pacientes con ERC.
Tabla 1.
Tabla 2.
Figura 1.
Figura 2.
Figura 3.