El hiperparatiroidismo secundario (HPTS) es una complicación habitual en pacientes con enfermedad renal crónica que se caracteriza por unos niveles elevados de hormona paratiroidea (PTH) y una serie de anomalías en el metabolismo mineral-óseo. En pacientes con HPTS, el tratamiento con paricalcitol, un activador selectivo de los receptores de la vitamina D, ha demostrado reducir los niveles de PTH con mínimas variaciones del calcio y del fósforo séricos. El efecto clásico de paricalcitol es el de mediador en la homeostasis mineral y ósea. Sin embargo, estudios recientes han indicado que los beneficios del tratamiento con paricalcitol van más allá de la reducción de PTH, por ejemplo, ocasionando efectos positivos en la enfermedad cardiovascular y en la supervivencia. El objetivo del presente trabajo es revisar los estudios más significativos sobre los llamados efectos pleiotrópicos del tratamiento con paricalcitol en pacientes con ERC.
Secondary hyperparathyroidism (SHPT) is a common complication in patients with chronic kidney disease (CKD) that is characterised by elevated parathyroid hormone (PTH) levels and a series of bone-mineral metabolism anomalies. In patients with SHPT, treatment with paricalcitol, a selective vitamin D receptor activator, has been shown to reduce PTH levels with minimal serum calcium and phosphorus variations. The classic effect of paricalcitol is that of a mediator in mineral and bone homeostasis. However, recent studies have suggested that the benefits of treatment with paricalcitol go beyond PTH reduction and, for instance, it has a positive effect on cardiovascular disease and survival. The objective of this study is to review the most significant studies on the so-called pleiotropic effects of paricalcitol treatment in patients with CKD.
El papel fisiológico clásico del sistema hormonal de la vitamina D es el de mediador fundamental en la homeostasis mineral y ósea. La 1α,25-dihidroxivitamina D3 se une con alta afinidad a los receptores de la vitamina D (RVD) y regula los niveles de calcio (Ca) y fósforo (P) séricos, aumentando su absorción en el intestino, la reabsorción de calcio en los túbulos renales y la supresión de la secreción de la hormona paratiroidea (PTH), que es a su vez un regulador clave del metabolismo mineral1. El descenso de los niveles de 1α,25-dihidroxivitamina D3 es atribuido al aumento de la producción de FGF23 inducido por la acumulación de fosfatos que, aún sin incrementar el P sérico, estimula la producción de FGF23. Por consiguiente, el déficit de vitamina D desempeña un papel central en el desarrollo del hiperparatiroidismo secundario (HPTS), una complicación frecuente y precoz en los pacientes con enfermedad renal crónica (ERC)2-4 que progresa a medida que se va reduciendo el filtrado glomerular4. El HPTS se caracteriza por el aumento de los niveles de PTH y la presencia de anormalidades minerales y óseas1,2. El HPTS y las alteraciones del metabolismo mineral producen fundamentalmente consecuencias clínicas a 2 niveles: en el sistema músculo-esquelético y en el sistema cardiovascular. Las consecuencias en el sistema músculo-esquelético son debidas al aumento del remodelado óseo, cuya lesión habitual es la osteítis fibrosa. Las consecuencias en el sistema vascular se asocian al riesgo aumentado de calcificación vascular2.
El tratamiento usual del HPTS conlleva la restricción de fósforo en la dieta y la administración de fármacos como los captores de fósforo, activadores de los RVD (selectivos y no selectivos) y/o calcimiméticos como cinacalcet2,3.
El primer activador de los RVD (ARDV) en comercializarse fue el calcitriol2. Se trata de un fármaco destacado en el tratamiento del HPTS en pacientes con ERC. Sin embargo, esta molécula induce frecuentemente hipercalcemia, hiperfosfatemia y formación de cálculos renales y la probabilidad de calcificación debido a sus potentes efectos sobre la absorción intestinal de Ca y P4.
En 1998 se aprobó paricalcitol para el tratamiento del HPTS5. Este análogo de la vitamina D de tercera generación surgió ante la necesidad de tratamientos capaces de inhibir las concentraciones de PTH elevadas en pacientes con HPTS, con un efecto mínimo sobre las concentraciones séricas de Ca, P y del producto calcio-fósforo (Ca×P) y, sin toxicidad renal4. Recientemente, el paricalcitol ha sido reclasificado por la Organización Mundial de la Salud como H05BX (fármacos antiparatiroideos) en lugar de A11CC (vitamina D y análogos).
El efecto beneficioso de paricalcitol en la reducción de los niveles de PTH en pacientes con ERC está ampliamente establecido4. Su eficacia terapéutica se debe a la selectividad tisular de su mecanismo de acción4. Paricalcitol se considera un activador de los RVD selectivo. El término selectivo hace referencia a la unión diferencial del ligando al RVD. La síntesis de activadores selectivos de vitamina D (AsRVD) como el paricalcitol y maxacalcitol aparece como consecuencia de la necesidad clínica de ampliar la ventana terapéutica de las formas clásicas de la vitamina D e intentar disminuir el riesgo de hipercalcemia e hiperfosfatemia asociado al uso de los derivados no selectivos calcitriol o alfacalcidol. Los AsRVD permiten inhibir la síntesis y secreción de la PTH de un modo más eficiente y con un menor impacto sobre la absorción intestinal del calcio y fósforo6. La selectividad de paricalcitol se explica a nivel bioquímico por el extremo C-terminal del receptor de la vitamina D, que es la región que se une específicamente al ligando6.
Aunque las actuales guías de práctica clínica para la ERC limitan el uso de los ARVD al tratamiento del HPTS7, se han identificado RVD en más de 30 tejidos humanos diferentes (tabla 1)8. Esto sugiere las diferentes acciones que puede tener la vitamina D además de las relacionadas con la homeostasis mineral y ósea, dando lugar a los denominados efectos no clásicos de la vitamina D8,9, entre los que destacan su efecto como inmunomodulador antiinflamatorio, sobre el remodelado cardiomiocitario9, su efecto sobre la protección renal y el menor efecto sobre la progresión de la calcificación vascular, especialmente en algunos derivados.
Distribución tisular de los receptores de la vitamina D
| Sistema | Tejido |
|---|---|
| Endocrino | Paratiroides, células pancreáticas B, células tiroideas C |
| Cardiovascular | Células del músculo liso arteriales, miocitos cardiacos |
| Músculo-esquelético | Osteoblastos, condrocitos, músculo estriado |
| Gastrointestinal | Esófago, estómago, intestino |
| Hepático | Células del parénquima hepático |
| Renal | Túbulos, aparato yuxtaglomerular (renina), podocitos |
| Reproductivo | Testículos, ovarios, útero |
| Inmunitario | Células T, células B, médula ósea, timo |
| Respiratorio | Células alveolares del pulmón |
| Epidermis | Queratinocitos, folículos pilosos |
| Sistema nervioso central | Neuronas |
La amplia difusión de los RVD en los tejidos humanos permite unos efectos potenciales en la mejoría de la estructura y la función cardiovascular, reduciendo el riesgo de enfermedad y mortalidad cardiovascular, sobre todo en los pacientes con ERC6.
Paricalcitol y supervivencia en pacientes hemodializadosEl HPTS afecta al menos a la mitad de los pacientes con enfermedad renal terminal en diálisis10 y está asociado a distintas enfermedades y comorbilidades, tales como aumento del riesgo de fracturas, complicaciones vasculares e infecciones, entre otras. Muchas de estas comorbilidades pueden ser causa de hospitalizaciones. Dobrez et al. observaron que los pacientes tratados con paricalcitol presentaron un menor riesgo de ingresos hospitalarios por cualquier causa (–14%; p<0,0001), menos ingresos hospitalarios por año (–0,642; p<0,001) y menos días de permanencia en el hospital (–6,84; p<0,001) frente a los tratados con calcitriol10.
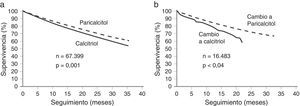
Además, varios estudios epidemiológicos han puesto de manifiesto el importante efecto sistémico de la activación del RVD en la supervivencia de los pacientes con HPTS en hemodiálisis5,11. Los resultados del primer estudio demostraron que el tratamiento con paricalcitol redujo la tasa de mortalidad en un 16% vs. el ARVD calcitriol (IC del 95%)5. En este estudio de cohortes históricas, la diferencia en la supervivencia fue significativa a los 12 meses de tratamiento y aumentó con el tiempo (p<0,001) (fig. 1a)5. Del número total de pacientes incluidos en el estudio, hubo un subgrupo que cambió del tratamiento con calcitriol al tratamiento con paricalcitol. Este subgrupo de pacientes tuvo una mejor tasa de supervivencia a los 2 años que el subgrupo de pacientes que cambió del tratamiento con paricalcitol al tratamiento con calcitriol (73% vs. 64%, p=0,04) (fig. 1 b)5. La ventaja en la supervivencia de los pacientes tratados con paricalcitol frente a los tratados con calcitriol parece ser independiente de los niveles basales de calcio, fósforo y PTH5.
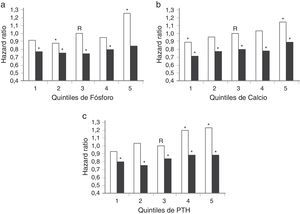
En un segundo estudio retrospectivo, los pacientes que recibieron vitamina D IV (calcitriol o paricalcitol) mostraron una tasa de supervivencia un 20% superior a la de aquellos pacientes que no recibieron vitamina D (HR: 0,80; IC del 95%)11. La supervivencia a 2 años fue del 75,6% en el grupo de pacientes que recibieron vitamina D frente al 58,7% en el grupo de pacientes que no recibieron tratamiento con vitamina D (p<0,001)11. La ventaja en la supervivencia de los pacientes tratados con vitamina D IV frente a los no tratados con vitamina D parece ser también independiente de los niveles basales de calcio, fósforo y PTH (fig. 2)11.
Hazard ratios de muerte de acuerdo con los quintiles de P (a), C (b) y PTH (c). Las barras oscuras representan el efecto de recibir vitamina D inyectable y las barras claras representan el efecto de no recibir vitamina D inyectable.
R: categoría de referencia.
* p<0,05.
Adaptado de Teng et al.11, 2005.
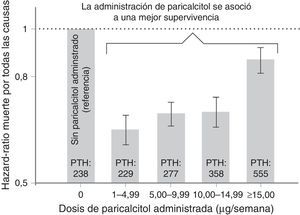
Otro estudio publicado por Kalantar-Zadeh et al. también asoció el tratamiento con paricalcitol con la mejora de la supervivencia en una cohorte de pacientes en hemodiálisis crónica12. Los autores observaron que el tratamiento con paricalcitol a cualquier dosis se relacionó con una mejora de la supervivencia en comparación con aquellos pacientes que no fueron tratados con este activador del receptor de la vitamina D12,13. Posteriormente, Lee et al. recogieron los resultados del estudio de Kalantar-Zadeh et al. y demostraron también que la administración de cualquier dosis de paricalcitol se asocia a una mejora en la supervivencia en subgrupos de pacientes en hemodiálisis de mantenimiento (fig. 3)13.
Relación entre la dosis de paricalcitol y el riesgo de mortalidad.
Adaptado de Lee et al.13, 2007.
Protección vascular: paricalcitol en la calcificación vascular, la aterosclerosis y la estructura, y función cardiaca.
Los pacientes con ERC en estadio 5 en diálisis experimentan una alta tasa de mortalidad debida a complicaciones cardiovasculares14-17. Numerosos estudios indican que el déficit de vitamina D y de la activación de su receptor se asocia a calcificación y disfunción vascular, así como a mortalidad cardiovascular en la población general y en pacientes con ERC1. La calcificación del tejido vascular es frecuente en los pacientes con ERC14,16 y tiene consecuencias hemodinámicas, como la pérdida de elasticidad arterial, aumento de la velocidad de la onda de pulso, desarrollo de hipertrofia ventricular izquierda, disminución de la perfusión de la arteria coronaria, isquemia miocárdica y fallo cardiaco17. Esta calcificación ocurre a 2 niveles distintos en el vaso. Por un lado, tiene lugar en la capa íntima, asociándose a aterosclerosis y. por otro lado, en la capa media, donde se asocia a arteriosclerosis debida a factores como la edad, la diabetes y la etapa terminal del fallo renal14,17.
Los mecanismos precisos responsables del desarrollo y la progresión de la calcificación vascular en pacientes con ERC no se conocen completamente16. Durante muchos años se ha propuesto que la calcificación vascular era el resultado de un proceso pasivo, resultado de unos niveles elevados de fósforo y del producto Ca×P17. Sin embargo, estudios recientes ponen de manifiesto la relación entre la calcificación vascular y la osteogénesis17, indicando que la calcificación vascular es un proceso activamente regulado17,18.
El calcitriol y otros análogos de la vitamina D se utilizan para el tratamiento del HPTS, pero existe controversia en torno al hecho de si estos activadores de los RVD aceleran directamente el proceso de calcificación vascular17. Por ejemplo, estudios in vitro e in vivo han demostrado que calcitriol induce calcificación vascular a altas dosis. Sin embargo, otros ARVD, como paricalcitol, son menos hipercalcemiantes, menos hiperfosforemiantes y menos propensos a inducir calcificación vascular16.
Los ARVD pueden tener efectos diferenciales en la calcificación vascular, y estos efectos son independientes del producto Ca×P14,16, de los niveles séricos de Ca y P14 y de la PTH16. A diferencia de paricalcitol, el calcitriol15,16 y el doxercalciferol14,16 parecen aumentar el contenido de calcio aórtico en ensayos con ratas urémicas nefrectomizadas. Más importante aún, el calcitriol y el doxercalciferol parecen aumentar la expresión de Cbfa-1 (RunX-2), factor de transcripción que pone en marcha los mecanismos activos de calcificación vascular16.
Por otro lado, es conocido que las células vasculares del músculo liso (CVML) poseen RVD y la enzima 25-hidroxivitamina D3-1α-hidroxilasa, indicando que la vitamina D y sus análogos desempeñan un papel importante en la funcionalidad y fisiología de este tipo celular17. En un estudio de Cardús et al., altas dosis de calcitriol, pero no de paricalcitol, aumentaron la calcificación en las CVML de ratas nefrectomizadas18. Este mismo estudio mostró que el tratamiento con dosis hipercalcemiantes de calcitriol aumentó la presión del pulso (diferencia entre la presión arterial sistólica y la presión arterial diastólica), probablemente debido a la extensa calcificación observada en las arterias. En cambio, en las ratas tratadas con paricalcitol no se observó aumento de la calcificación aórtica ni de la presión del pulso18.
Noonan et al., al cuantificar las consecuencias funcionales de la calcificación vascular, observaron que paricalcitol no tuvo efectos en la velocidad de onda de pulso, mientras que dosis más altas de doxercalciferol aumentaron la velocidad de onda de pulso en ratas nefrectomizadas a las 6 semanas del estudio14.
Por otro lado, aunque la activación de los RVD puede mitigar la calcificación vascular en la uremia inducida, datos recientes apoyan el papel de la activación de los RVD en la prevención o en el enlentecimiento de la aterosclerosis8. Los ARVD han mostrado un efecto beneficioso sobre la trombosis, la inflamación y la vasodilatación, factores de riesgo asociados a la función endotelial y al proceso aterosclerótico19. Según un estudio realizado en cultivos primarios de células humanas del músculo liso de la aorta, los RVD pueden desempeñar un papel en la aterosclerosis mediante la regulación del inhibidor del activador del plasminógeno-1, la trombospondina 1 y la trombomodulina. Así, los RVD podrían contribuir al beneficio terapéutico que presentan los análogos de la vitamina D al reducir el riesgo de morbimortalidad en pacientes con ERC en estadio 520.
Otro estudio posterior evaluó el efecto protector de paricalcitol, de un inhibidor de la enzima conversora de angiotensina (IECA) (enalapril) o de la combinación en el daño oxidativo en aortas de ratones ateroscleróticos21. En este estudio, paricalcitol o enalapril, o la combinación de ambos, previnieron la formación de placa aterosclerótica en ratones deficientes de ApoE21y mostraron un efecto protector frente al estrés oxidativo cardiaco en la uremia22. Esta protección frente a la inflamación y al daño oxidativo de la aterosclerosis fue mayor con la terapia combinada (enalapril + paricalcitol) que con la monoterapia21. En los resultados del estudio también se observó que tanto paricalcitol como enalapril en monoterapia, así como la combinación de ambos, redujeron la concentración de la enzima malondialdehído aórtica (MDA) y aumentaron los niveles de la enzima glutatión peroxidasa (GSH)21. Tanto la reducción de los niveles de MDA como el aumento de los niveles de GSH son indicativos del efecto protector de paricalcitol, enalapril o la combinación de ambos en este modelo de ratones ateroscleróticos21. Asimismo, paricalcitol también parece mejorar la función endotelial de ratas urémicas de manera dependiente de la dosis e independientemente de los niveles de PTH o de la presión arterial19.
Por otro lado, se piensa que paricalcitol se asocia a una menor morbilidad cardiovascular, posiblemente por la modificación de la estructura y la función cardiaca23,24. El estudio PRIMO trató de determinar los efectos de paricalcitol en la masa ventricular izquierda durante un periodo de 48 semanas en pacientes con ERC e hipertrofia ventricular izquierda23,24. Durante el periodo de estudio, paricalcitol no redujo la masa ventricular izquierda ni mejoró ciertas medidas Doppler de la función diastólica, pero pareció estar asociado a un menor número de hospitalizaciones por causas cardiovasculares23. En un análisis post hoc del ensayo PRIMO, hubo una reducción significativa del índice de volumen del ventrículo izquierdo en el grupo de pacientes tratados con paricalcitol comparado con los del grupo placebo (p=0,002)24.
Protección renal: reducción de la proteinuria y fibrosis renalVarios estudios han puesto de manifiesto el papel renoprotector de los análogos de la vitamina D en modelos animales experimentales con enfermedades glomerulares25.
La nefropatía diabética, caracterizada por lesiones glomerulares, infiltración inflamatoria, atrofia tubular y fibrosis intersticial26, es una de las enfermedades renales más complejas y se asocia muy comúnmente a complicaciones cardiovasculares. La lesión o fibrosis túbulo-intersticial en la ERC conduce a la etapa terminal de la insuficiencia renal27. En el modelo de ratón con nefropatía obstructiva intersticial por ligadura ureteral unilateral27, el paricalcitol redujo la inflamación intersticial y la producción y el acúmulo de componentes de la matriz intersticial (colágeno y fibronectina). En este modelo, el paricalcitol también inhibió la transición de células epiteliales a mesenquimales, proceso que es en parte responsable de la fibrosis renal27. Además, el paricalcitol restableció la cantidad de RVD en la nefropatía obstructiva27. Paricalcitol también bloqueó, in vitro e in vivo, la expresión del gen Snail, un factor de transcripción que desempeña un papel crucial en el inicio de la transición de células epiteliales a mesenquimales. Estos resultados indican que el efecto beneficioso de paricalcitol está asociado a su capacidad para preservar el fenotipo del epitelio tubular mediante la supresión de la transición27. Igualmente, el paricalcitol tiene un efecto beneficioso inhibiendo la inflamación renal gracias al secuestro de la señalización de los factores de transcripción nuclear, como el factor nuclear kappa B (NF-KB)26.
La proteinuria/albuminuria es un importante marcador de enfermedad renal y cardiovascular28,29 asociada a la progresión de la ERC1. El aumento de las proteínas urinarias refleja un mayor grado de enfermedad glomerular o disfunción tubular renal subyacente1, y desempeña un papel directo en la progresión de la enfermedad renal y cardiovascular1,28,29.
El sistema renina-angiotensina-aldosterona (SRAA) se ha identificado como un mediador importante en el daño renal progresivo en la nefropatía diabética. Los fármacos que afectan al SRAA, como los IECA y los antagonistas de los receptores de angiotensina (ARA-II), pueden retrasar la mortalidad y morbilidad cardiovascular y renal30. Sin embargo, la proteinuria residual puede ser alta en pacientes que reciban estos tratamientos1. Por este motivo surge la necesidad de estrategias terapéuticas diferentes para reducir este riesgo residual1. Estudios recientes han puesto de manifiesto que la activación selectiva del RVD podría ser interesante en la reducción de la proteinuria en pacientes con ERC29.
En uno de los análisis post hoc de un ensayo aleatorizado que evaluaba la eficacia de paricalcitol por vía oral en la reducción de la PTH en pacientes con ERC3,4, se observó una reducción de la proteinuria en más del 50% de los pacientes tratados con paricalcitol, independientemente del tratamiento concomitante con inhibidores del SRAA (p=0,004)28. En otro estudio aleatorizado, doble-ciego, el paricalcitol redujo significativamente la excreción proteica medida por la relación proteína-creatinina urinaria a nivel basal y al final del estudio en 2 grupos de pacientes, uno tratado con paricalcitol y otro con placebo29. En un estudio de corta duración, 24 pacientes fueron aleatoriamente asignados para recibir placebo, 1 o 2μg de paricalcitol. Tras la evaluación, se observó una reducción de la proteinuria que fue independiente de los cambios hemodinámicos o de la reducción de los niveles de PTH31.
Por otro lado, el estudio VITAL mostró que el tratamiento de 24 semanas con 2μg de paricalcitol redujo la albuminuria residual en pacientes con diabetes mellitus tipo 2 y nefropatía que estaban siendo tratados con dosis estables de IECA o ARA-II30. El cambio de la relación albúmina-creatinina urinaria (UACR) desde el nivel basal hasta el final del tratamiento fue mayor en los grupos de pacientes tratados con paricalcitol (1 o 2μg) frente a los del grupo placebo (p=0,071). En la figura 4 se observa cómo la variación de la UACR parecía tener una relación dosis-respuesta con el uso de paricalcitol, indicando que el paricalcitol podría ser un tratamiento adyuvante importante en la reducción de la albuminuria residual30.
Cambio en la relación albúmina-creatinina urinaria desde el nivel basal hasta el final del tratamiento (A) y durante el tratamiento y la retirada (B).
Adaptado de de Zeeuw et al.28, 2010.
En un metaanálisis de 9 estudios (n=832) publicado recientemente por Cheng et al., se confirma el efecto beneficioso de paricalcitol en la reducción de la proteinuria (p<0,001) sin aumento del riesgo de efectos adversos32.
Paricalcitol como agente inmunomodulador y antiinflamatorioVarios estudios epidemiológicos han relacionado el déficit de vitamina D con una mayor susceptibilidad a enfermedades mediadas por el sistema inmunitario, incluyendo infecciones crónicas y enfermedades autoinmunes33. Los procesos inflamatorios sistémicos son comunes en pacientes con ERC y constituyen un factor de mal pronóstico1. También se conoce que las células inmunitarias expresan enzimas activadoras de la vitamina D, permitiendo la conversión local de la vitamina D inactiva a su forma activa, 1,25(OH)(2)D(3)33. Estos datos indican que la vitamina D desempeña un papel en el mantenimiento de la homeostasis inmunitaria33. En este contexto, diversos estudios han evaluado el efecto inmunomodulador de paricalcitol y otros ARVD25,30,33.
Paricalcitol y calcitriol han demostrado reducir la diferenciación de las células dendríticas inmaduras desde los monocitos, así como su capacidad para ser activadas25. La prevención de la maduración de las células dendríticas puede desempeñar un papel importante en la prevención de enfermedades autoinmunes, incluyendo la aterosclerosis25. La acción inmunomoduladora de la vitamina D también ocurre a través de la regulación de la actividad de diversos tipos de células inmunitarias como los macrófagos, las células dendríticas y las células T33,34, y de la regulación de la expresión de las citocinas proinflamatorias RANTES y TNF-α34.
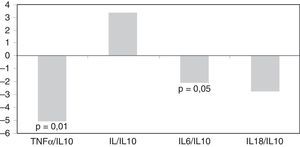
Tan et al. observaron también el efecto beneficioso de paricalcitol en la inhibición de la inflamación renal, gracias al secuestro de la señalización del NF-KB34. Otro estudio doble-ciego, aleatorizado y a corto plazo mostró en pacientes con ERC una reducción significativa de un marcador inflamatorio como la proteína C reactiva (PCR), determinada por el método ultrasensible31. Asimismo, el paricalcitol se asoció a una modulación de la inflamación en pacientes en hemodiálisis mediante la reducción de biomarcadores inflamatorios como la PCR y el TNF-α, así como por la mejora de las relaciones IL-6/IL-10 y TNF-α/IL-1035. Estos efectos antiinflamatorios del paricalcitol fueron independientes de las concentraciones de PTHi (fig. 5)35.
En otro estudio publicado recientemente por Sánchez-Niño et al. también se observó el efecto antiinflamatorio tanto de paricalcitol como de calcitriol en un modelo experimental de ratas con diabetes inducida por estreptozotocina. Calcitriol y paricalcitol redujeron la expresión de los mediadores antiinflamatorios fibronectina y renina en podocitos cultivados. Estos ARVD disminuyeron la inflamación glomerular incluso a dosis subantiproteinúricas36.
Importancia de paricalcitol en el paciente trasplantadoEl trasplante renal normofuncionante corrige los desequilibrios endocrinos y metabólicos secundarios al deterioro de función renal37,38. Sin embargo, después del trasplante renal, en un porcentaje nada despreciable de pacientes se observa persistencia en el tiempo de PTH elevada que, si bien en el paciente con normofunción del injerto suele regresar lentamente, en el paciente con leve o moderado deterioro de función renal puede persistir indefinidamente. La persistencia del HPT es un factor de riesgo de pérdida de masa ósea e incremento del riesgo de fracturas. El descenso en la densidad mineral ósea también se ha asociado a un mayor riesgo de aterosclerosis39. Así pues, el mejor control de la PTH podría mejorar ambos aspectos.
Por otro lado, diversos estudios han mostrado que un año después del trasplante, la proteinuria está presente hasta en el 45% de los pacientes aunque en 2 tercios de ellos es inferior a 500mg/día40,41. La proteinuria es uno de los factores que condicionan, de manera relevante, la reducción de la supervivencia del injerto renal42.
Puesto que hay cierto grado de similitud entre la nefropatía crónica del injerto y la enfermedad renal crónica, se podría asumir «a priori» que los abordajes terapéuticos antiproteinúricos podrían ser beneficiosos en pacientes trasplantados renales43,44. Como se ha visto a lo largo de esta revisión, en pacientes con ERC el paricalcitol ha mostrado ser capaz de reducir la proteinuria tanto en pacientes con HPTS como con PTH normal.
Sin embargo, la experiencia con paricalcitol en pacientes con trasplante renal es muy limitada, aunque en los pocos estudios publicados el paricalcitol parece haber sido efectivo para mejorar el control de la PTH y de la proteinuria en este grupo de pacientes.
En un estudio retrospectivo que incluía a 58 pacientes trasplantados renales con hiperparatiroidismo secundario, el tratamiento con paricalcitol redujo significativamente los niveles séricos de PTHi y la proteinuria (35% de disminución en relación a los niveles basales). La función renal permaneció estable durante el tratamiento con paricalcitol, con una diferencia significativa con respecto a la disminución observada en los 2 años previos al tratamiento45. En otro estudio prospectivo en una población de 46 pacientes trasplantados que evaluaba el peptidoma urinario, el tratamiento con 1μg/día de paricalcitol durante 3 meses redujo eficazmente los niveles de PTH y modificó de manera notable el perfil de péptidos urinarios37. Otro estudio, publicado solo en forma de abstract, que compara el empleo de diferentes análogos de vitamina D en pacientes con trasplante renal, el tratamiento con paricalcitol se asoció a una mayor reducción de la proteinuria46.
La toxicidad por anticalcineurínicos es una de las causas más importantes de nefropatía crónica del injerto renal. Se ha visto, a nivel experimental, que el paricalcitol atenúa la nefropatía inducida por ciclosporina suprimiendo la inflamación y las fibrosis intersticiales, así como la apoptosis de células tubulares epiteliales47. Este podría ser, por tanto, un efecto beneficioso adicional del paricalcitol en los trasplantados renales en tratamiento con anticalcineurínicos.
ConclusionesParicalcitol, un ARVD de tercera generación, proporciona un control eficaz del HPTS con mínimos efectos de hipercalcemia y de hiperfosfatemia4. Su eficacia terapéutica se debe a la selectividad tisular de su mecanismo de acción, ya que no regula al alza el receptor de vitamina D intestinal y es menos activo que calcitriol a nivel óseo4.
Estudios recientes han indicado que los beneficios de paricalcitol van más allá de la reducción de PTH y el control de la homeostasis mineral y ósea. La presente revisión pone de manifiesto que los efectos pleiotrópicos de paricalcitol sobre la estructura y la función cardiovascular, la proteinuria y la función inmunitaria, entre otros1,8,9, podrían explicar el aumento de la tasa de supervivencia observada en pacientes con ERC tratados con paricalcitol5.
Aunque se necesita una mayor experiencia, la administración de paricalcitol en el paciente con trasplante renal parece una opción segura y prometedora tanto para mejorar el control de valores elevados de PTH, como para mejorar la proteinuria.
Conflicto de interesesLos autores declaran los siguientes conflictos de interés potenciales:
El Dr. Jordi Bover ha dado conferencias esponsorizadas por Abbott (Abbvie), Amgen, Genzyme y Shire. También ha participado en comités asesores nacionales e internacionales de Abbott (Abbvie), Amgen y Genzyme.
El Dr. Alberto Martínez ha recibido ayudas a la investigación y ha dado conferencias esponsorizadas por Abbott (Abbvie), Amgen, Boëhringer-Ingelheim, Esteve, Janssen-Cilag, Novartis, Roche y Shire. También ha participado en “advisory boards” (comité asesor) de Abbott (Abbvie), Amgen, Esteve, Roche y Shire.
El Dr. Egido ha desempeñado labores de asesor científico, ha recibido financiación a la investigación y ha dado conferencias esponsorizadas por Abbott (Abbvie).
La Dra. Elvira Fernandez-Giraldez ha recibido financiación a la investigación y ha dado conferencias esponsorizadas por Abbott (Abbvie).
El Dr. Carlos Solozabal ha dado conferencias esponsorizadas por Abbott (Abbvie).