La glomerulonefritis membranoproliferativa por inmunocomplejos (GNMP-IC) idiopática es un diagnóstico de exclusión una vez descartados los procesos etiológicos más frecuentes asociados a este patrón de daño glomerular (infecciosos, enfermedades autoinmunes, gammapatías entre los más frecuentes).
La GNMP-IC idiopática podría compartir con la glomerulopatía C3 la activación de la vía alternativa del complemento mostrando en muchos casos un descenso de los valores del C3 en suero.
No existe en el momento actual un tratamiento específico para esta glomerulonefritis, aunque se han utilizado diversos fármacos inmunosupresores (prednisona, micofenolato, ciclofosfamida, rituximab) dependiendo la severidad del caso.
Presentamos un caso clínico con diagnóstico de GNMP-IC idiopática que se presenta como síndrome nefrítico-nefrótico de curso agresivo con deterioro rápidamente progresivo de la función renal sin respuesta al tratamiento convencional con necesidad de hemodiálisis, que logra remisión completa tras iniciar tratamiento con iptacopán, un inhibidor oral del factor B de la vía alternativa del complemento y mostramos la evolución tras 12 meses de tratamiento.
Membranoproliferative glomerulonephritis due to immune complexes (MPGN-IC) idiopathic is a diagnosis of exclusion, made after ruling out the most common etiological processes associated with this pattern of glomerular injury (infectious, autoimmune diseases, gammopathies, among others). Idiopathic MPGN-IC shares with C3 glomerulopathy the activation of the alternative complement pathway, often evidenced by decreased serum C3 levels.
Currently, there is no specific treatment for this type of glomerulonephritis; however, various immunosuppressive agents (such as prednisone, mycophenolate, cyclophosphamide, rituximab) have been used depending on the severity of the case.
We present a clinical case diagnosed with idiopathic MPGN-IC presenting as an aggressive nephritic-nephrotic syndrome with rapidly progressive renal deterioration unresponsive to conventional therapy, requiring hemodialysis. Complete remission was achieved after initiating treatment with iptacopan, an oral inhibitor of factor B of the alternative complement pathway, and we demonstrate the patient's evolution over 12 months of treatment.
La glomerulonefritis membranoproliferativa por inmunocomplejos (GNMP-IC) idiopática es un diagnóstico de exclusión una vez obtenido el diagnóstico histológico compatible y descartados otros como pueden ser cuadros infecciosos, enfermedades autoinmunes o gammapatías entre los procesos etiológicos más frecuentes asociados a este patrón de daño glomerular1–5.
Distintos estudios apuntan que la GNMP-IC idiopática parece compartir con la glomerulopatía C3 la activación de la vía alternativa del complemento mostrando en muchos casos un descenso de los valores del C3 en suero2,3. El tratamiento de esta entidad, dependiendo de la gravedad del cuadro clínico, incluye tratamiento de soporte con antiproteinuricos como inhibidos del sistema renina-angiotensina, antialdosterónicos o ISGLT2, asociando corticoides, micofenolato mofetil (MMF) e incluso ciclofosfamida o rituximab en casos más graves. Pero no existe en el momento actual un tratamiento específico para esta glomerulonefritis1,6–8.
Presentamos un caso clínico con diagnóstico de GNMP-IC idiopática de curso agresivo sin respuesta al tratamiento convencional que logra remisión completa tras iniciar tratamiento con iptacopán, un inhibidor oral del factor B de la vía alternativa del complemento que inhibe específicamente la actividad enzimática de la convertasa C39 y mostramos la evolución tras 12 meses de tratamiento.
Caso clínicoMujer de 52 años con antecedentes personales de obesidad con índice de masa corporal (IMC) de 30 kg/m2 e implantación de balón gástrico en 2022 y pérdida de 30kg de peso (IMC de 24,9 kg/m2) con retirada del mismo un mes antes del ingreso. Síndrome facetario lumbar con necesidad de infiltración periarticular a nivel lumbar bilateral en abril de 2023. Fumadora activa. Sin alergias conocidas ni realiza ningún tratamiento farmacológico.
La paciente acude al servicio de urgencias en Julio de 2023 por cuadro de edematización progresiva de tres semanas de evolución sin otra clínica acompañante. Niega episodios infecciosos previos, toma de antiinflamatorios no esteroideos (AINE) u otros fármacos en las semanas previas.
A la exploración física la paciente presenta tensión arterial 151/89mmHg, frecuencia cardiaca normal, afebril, auscultación cardiopulmonar normal y edemas en extremidades inferiores con fóvea hasta rodillas.
En un primer control analítico realizado en urgencias destaca: hemograma y coagulación normales, bioquímica sanguínea con creatinina (Cr): 1,03mg/dL, proteínas totales 5g/dL y albúmina 2,9g/dL. El sedimento urinario con hematíes: 64,24/μL, leucocitos: 55,4/μL y un ratio proteínas/Cr en orina (uPCR): 4.113mg/g.
Ingresamos a la paciente con el diagnóstico de síndrome nefrítico-nefrótico para estudio etiológico y tratamiento deplectivo, instaurando inicialmente tratamiento diurético intravenoso e inhibidor de la enzima convertidora de angiotensina (IECA) con buena respuesta inicial. Durante el ingreso hospitalario se realizan distintas pruebas complementarias destacando: - complemento C3: 51,8mg/dL (80-190), C4: 22,3mg/dL (15-55), IgG: 351mg/dL (552-1.631), IgA: 108mg/dL (70-400) e IgM: 44mg/dL (33-293), colesterol 255mg/dL.
Autoinmunidad (anticuerpos antinucleares [ANA], anticuerpos antiantígeno nuclear extraible [ENAs], anticuerpos anticitoplasma de neutrófilos [ANCAs], antiPLA2R, antiMBG, antipéptido citrulinado, factor reumatoide) y marcadores tumorales (alfafetoproteína, antígeno carcinoembrionario [CEA], antígeno tumoral [CA] 125, CA 19.9) negativos. Proteinograma normal. Proteínas totales 4,2g/dL. Albúmina 2,8g/dL. Sedimento de orina: 64 hematíes/μL, 55 leucocitos/μL. Orina 24h: diuresis 3.800mL. Proteinuria 4,8g/24h, albuminuria 3,3g/24h. Serología: virus de la hepatitis B (VHB), virus de la hepatitis C (VHC), virus de la inmunodeficiencia humana (VIH) e interferón gamma (IGRA) negativos. Ecografía de abdomen normal.
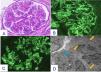
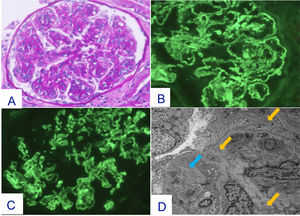
Se practica biopsia renal y dada la evolución inicial favorable de la paciente, se procede al alta a la espera de los resultados de la biopsia, que posteriormente establece el diagnóstico de GNMP-IC una vez realizados estudios de microscopia óptica (MO), inmunofluorescencia (IF) y microscopia electrónica (ME) (fig. 1).
Cambios histopatológicos en la primera biopsia renal (Julio-2023).
Glomérulo en el que se advierte un patrón de lesión membranoproliferativo con desdoblamientos de la MBG. Tinción de PAS x20 (A). En el estudio mediante IF directa se advierten depósitos difusos y globales cápilo-mesangiales para IgG (+++) (B) y para C3 (+++) (C), además de depósitos de cadena kappa (+++), cadena lambda (+), C1q (++), IgM (+), C4 (+) y C4d (+++). El estudio mediante ME revela la presencia de depósitos amorfos electrondensos en área mesangial y en MBG (flechas amarillas). Imágenes de desdoblamiento de la MBG (flecha azul) (D).
En dicho estudio, la muestra incluida en parafina para MO contiene 29 glomérulos, de los cuales uno se encuentra esclerosado. Todos ellos, muestran expansión mesangial, de la celularidad y de la sustancia mesangial, así como hipercelularidad endocapilar, engrosamiento y desdoblamientos de la membrana basal glomerular (MBG), dando lugar a una acentuación del patrón lobular. En el intersticio se advierte escaso infiltrado inflamatorio de predominio mononuclear. Fibrosis leve y atrofia tubular leve. Las estructuras vasculares muestran hiperplasia miointimal focal y leve. Con la tinción para CD61 no se han demostrado fenómenos trombóticos. La tinción para amiloide A ha resultado negativa.
El material seleccionado para IF contiene 10 glomérulos, ninguno esclerosado. Se observa depósito difuso y global glomerular granular periférico en la MBG y en área mesangial para IgG (+++), C3 (++/+++), cadena kappa (+++), cadena lambda (+), C1q (++), IgM (+), C4 (+). C4d (+++) glomerular difuso y global capilar y mesangial. No se observan depósitos en región tubulointersticial ni paredes vasculares. IgA ocasionales trazas glomerulares.
En el estudio de ME se observan depósitos amorfos electrondensos localizados en la MBG, sobre todo en región subendotelial e intramembranosos, con engrosamientos e imágenes de desdoblamiento de la MBG, así como incremento de la celularidad endocapilar. En podocitos se advierte fusión de pedicelos. También se advierten depósitos en área mesangial. No se advierten depósitos con las características de la enfermedad por depósitos densos ni tampoco se han identificado depósitos organizados en forma de fibrillas.
Ante este diagnóstico se amplía el estudio para despistaje de glomerulonefritis secundaria con solicitud de crioglobulinas, cadenas ligeras libres, inmunofijación y proteinuria de Bence-Jones, PET-TAC, ecocardiografía y estudio del complemento (Anexo A), resultando todo normal o negativo por lo que se considera una GNMP-IC idiopática.
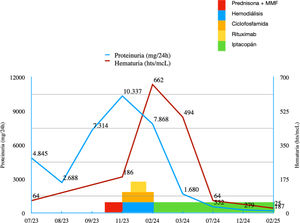
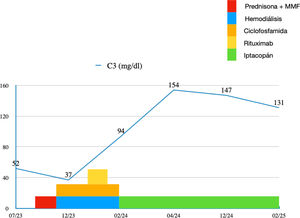
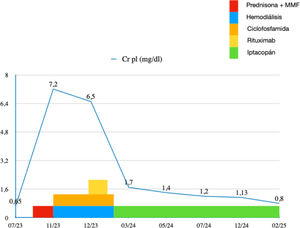
La evolución posterior de la paciente es desfavorable con ascenso de proteinuria a 7,2g/24h (fig. 2) con sedimento urinario muy activo y consumo persistente de C3 (fig. 3) por lo que iniciamos tratamiento con prednisona a 1mg/kg de peso y MMF 2g diarios, a pesar de lo cual, tras un mes de tratamiento continua evolución desfavorable con deterioro de la función renal rápidamente progresivo con Cr 5,9mg/dL por lo que ingresa de nuevo para tratamiento intravenoso (fig. 4).
Se administran 3 bolos de 1g de metilprednisolona y 6 bolos de ciclofosfamida a 12,5mg/kg de peso sin respuesta por lo que se añade tratamiento con rituximab 0,5g semanal durante cuatro semanas.
La evolución de la paciente continua desfavorable a pesar del tratamiento recibido quedando en anuria y precisando terapia renal sustitutiva (TRS) mediante hemodiálisis que inicia en Noviembre de 2023.
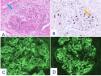
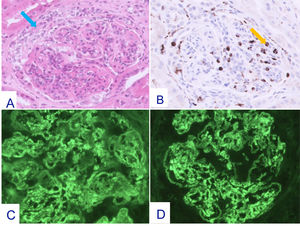
Se practica una segunda biopsia renal durante dicho tratamiento, en diciembre de 2023, que confirma la GNMP-IC pero ahora se evidencia proliferación extracapilar en ocho de los 20 glomérulos que contiene la muestra (ninguno esclerosado), de las cuales seis son semilunas epiteliales y dos mixtas, con fibrosis intersticial y atrofia tubular leves (fig. 5).
Cambios histopatológicos en la segunda biopsia renal (Dic-2023).
Glomérulo en el que se advierte incremento de la celularidad mesangial e hipercelularidad endocapilar junto a proliferación extracapilar en forma de semiluna epitelial (flecha azul) Hematoxilina-eosina x 20 (A). La tinción para CD68 pone de manifiesto incremento de células monocitarias en el interior de capilares glomerulares (flecha amarilla) Inmunoperoxidasa x 20 (B). En el estudio mediante IF directa se advierten depósitos difusos y globales cápilo-mesangiales para IgG (+++) (C) y para C3 (+++) (D).
Dada la severidad del caso y la refractariedad al tratamiento solicitamos iptacopán a través del programa de usos compasivos de Novartis. La paciente firmó el consentimiento informado para autorizar su uso y fue vacunada contra gérmenes encapsulados previo al inicio del tratamiento, de acuerdo con las recomendaciones de la ficha técnica del producto.
La paciente inicia en febrero de 2024 tratamiento con iptacopán 200mg cada 12h por vía oral comprobando normalización del complemento a las 72h (fig. 2), recuperación progresiva de la diuresis y del filtrado glomerular, lo que permite a la paciente suspender la diálisis, y descenso progresivo de la proteinuria y la microhematuria (figs. 3 y 4).
Actualmente la paciente se encuentra en tratamiento con prednisona 2,5mg (en pauta de descenso) e iptacopán, además del tratamiento de soporte. Tras 12 meses de tratamiento con el antiFactor B, la paciente presenta Cr pl de 0,8mg/dL (TFGe 75mL/min/1,73 m), proteinuria de 0,2g/24h y ausencia de microhematuria en el sedimento (figs. 2-4).
Destacar que no ha presentado ningún evento infeccioso de gravedad, salvo una infección urinaria aislada que respondió adecuadamente a tratamiento antibiótico oral sin necesidad de interrumpir el tratamiento, ni ningún efecto secundario asociado a iptacopán.
DiscusiónLa GNMP-IC puede ocurrir en el contexto de enfermedades autoinmunes (nefritis lúpica, artritis reumatoide, síndrome de Sjögren, crioglobulinemia, enfermedad mixta del tejido conectivo), infecciones virales crónicas, infecciones bacterianas, anemia de células falciformes y gammapatías monoclonales1-5. En estos casos, el tratamiento de la condición subyacente (inmunosupresión para enfermedades autoinmunes, antivirales y antibióticos para infecciones virales y bacterianas) a menudo también mejora la lesión y disfunción renal1–5.
Cuando no se objetiva ninguna de estas patologías como factor causal se considera idiopática como es el caso de la paciente que aquí presentamos. La GC3 parece compartir con la GNMP-IC idiopática la activación de la vía alternativa del complemento, pero hasta ahora no existe un tratamiento etiológico específico para estos casos1,2.
El beneficio de la inmunosupresión en la GNMP-IC es incierto. Se han intentado tratamientos con corticosteroides orales e intravenosos, inhibidores de la calcineurina, ciclofosfamida, MMF y rituximab, pero los resultados obtenidos son escasos y controvertidos6–8. Mientras que en algunos estudios un tratamiento prolongado con prednisona oral en niños con GNMP-IC idiopática mostró cierto beneficio en ralentizar la progresión de la enfermedad10, no hay evidencia de que los esteroides sean efectivos en adultos2,11.
Dos estudios retrospectivos recientes, uno multicéntrico11 y otro en una cohorte de un solo centro pediátrico6, que incluyeron pacientes con GC3 y GNMP-IC idiopática, no encontraron una asociación entre el tratamiento inmunosupresor (corticoides y MMF) y la mejora en los resultados de la enfermedad renal o en la histología.
El rituximab ha demostrado ser efectivo en pacientes con formas secundarias y depósitos inmunes monoclonales. Este tratamiento también se intentó en algunos pacientes con GC3 primaria o GNMP-IC pero los resultados publicados son esencialmente negativos7. En nuestra paciente dada la agresividad y la rápida evolución se ensayaron distintos tratamientos (esteroides, MMF, ciclofosfamida y rituximab) sin éxito.
Actualmente diversas moléculas que inhiben el complemento a distintos niveles (factor B, factor D, C3, C5, C5r) se encuentran bien en desarrollo o aprobadas.
Iptacopán es una pequeña molécula administrada por vía oral que se une al factor B y Bb, no previene la formación de la convertasa C3, pero inhibe específicamente la actividad enzimática de la convertasa C3, bloqueando la escisión de C3 y la activación del bucle de amplificación, sin afectar las vías clásicas/lectinas9.
En un estudio fase 2 abierto (NCT03832114), el tratamiento durante 12 semanas con iptacopán se asoció con una reducción significativa (45%) en la proteinuria en pacientes con GC3 en el riñón nativo (cohorte A), y con una reducción significativa de los depósitos de C3 en los injertos renales de pacientes con GC3 recurrente postrasplante (cohorte B). El tratamiento fue bien tolerado sin eventos adversos severos12.
Los resultados preliminares a los 12 meses de 26 pacientes que participaron en el estudio de extensión a largo plazo (NCT03955445) mostraron que el 53% de los pacientes de la cohorte A cumplió con el objetivo compuesto de TFGe estable/mejorado, una reducción del ≥ 50% desde el inicio en la relación proteína/creatinina en orina (uPCR) y un aumento del ≥ 50% en el C3 sérico. En los pacientes de la cohorte B, la TFGe se mantuvo estable y los niveles de C3 aumentaron en un 96%13. Recientemente se han publicado los resultados preliminares a 33 meses de tratamiento con resultados favorables en cuanto a reducción de proteinuria (41%) y evolución de la función renal14.
Un estudio multicéntrico, doble ciego y controlado con placebo en fase 3 (APPEAR-C3G, NCT04817618) está en curso en pacientes adolescentes y adultos, de 12 a 60 años con GC3, aleatorizados a recibir iptacopán o placebo durante seis meses, seguido de un tratamiento abierto con iptacopán durante seis meses. El objetivo principal es evaluar la eficacia de iptacopán en comparación con el placebo en la reducción de la proteinuria. Los objetivos secundarios incluirán el objetivo renal compuesto, puntaje total de actividad histológica y fatiga15. De este estudio se han presentado recientemente resultados a 12 meses que muestran en el brazo de iptacopán una reducción sostenida de la proteinuria a los 12 meses (-37%), una TFGe estable y sostenida durante 12 meses (+0,84mL/min/1,73 m2) y con un perfil de seguridad favorable16.
Un ensayo fase 3 APPARENT (NCT05755386) en adultos y adolescentes con GNMP-IC idiopática se encuentra en fase de inclusión de pacientes17.
Por otro lado, existen otras moléculas que inhiben el complemento a otros niveles y que también se muestran prometedoras en este tipo de patología como es el caso del pegcetacoplán (PEG), un inhibidor de C3/C3b.
VALIANT (NCT05067127) es un ensayo doble ciego, controlado con placebo, que investiga la eficacia y seguridad de PEG en adolescentes y adultos con GC3 en riñón nativo o recurrente en riñón trasplantado y en GNMP-IC18. Se aleatorizaron 124 pacientes: 63 en el grupo de PEG (infusión subcutánea dos veces por semana) y 61 en el de placebo, observando una reducción del 68,3% en la uPCR en el grupo PEG frente a placebo en la semana 26 (p <0,0001). Los resultados fueron consistentes en todos los subgrupos analizados (tipo de enfermedad, edad y estado de trasplante). Además se observó una marcada reducción del depósito de C3 en el tejido renal y una estabilización clínicamente significativa del eGFR en comparación con placebo. La frecuencia y gravedad de los eventos adversos relacionados con el tratamiento fueron similares entre los grupos18.
En nuestra paciente, iptacopán normalizó los niveles de C3 en plasma a las 72h y se mostró eficaz en la mejoría del filtrado glomerular (posibilitando abandonar la TRS) hasta su normalización, así como en la remisión de la proteinuria, siendo bien tolerado sin presentar efectos adversos destacables.
En este punto de la evolución, dado que no existe evidencia sobre la duración óptima del tratamiento, nos planteamos proponer a la paciente una nueva biopsia y si muestra ausencia de actividad suspender con control estrecho y monitorizando los niveles de C3 como marcador en este caso.
ConclusiónIptacopán fue eficaz en GNMP-IC idiopática grave refractaria al tratamiento estándar.
El estudio de la vía alternativa del complemento incluyó la determinación de anticuerpos antifactor H, C3 nephritic factor y estudio genético del complemento mediante exoma completo, centrándonos en los genes relacionados con defectos en las vías del complemento: C1QA, C1QB, C1QC, C1R, C1S, C4A+C4B, C2, C3, C5, C6, C7, C8A, C8B, C8G, C9, CD46, CD55, CD59, CFB, CFD, CFH, CFHR1, CFHR2, CFHR3, CFHR4, CFHR5, CFI, CFP, FCN3, MASP2, SERPING1, THBD.
Los autores declaran que no han recibido financiación para la realización de este artículo.
Los autores declaran no tener ningún conflicto de intereses.