El acceso vascular (AV) es una condición sine qua non para que los pacientes con enfermedad renal crónica (ERC) sean tratados mediante hemodiálisis (HD) y es el factor más importante que determina el éxito o fracaso de los programas de HD crónica1. De los 3 tipos de AV utilizados en la actualidad, es decir, fístula arteriovenosa interna (FAVI), injerto habitualmente sintético de PTFE y catéter central, existe un amplio consenso en que la FAVI es el AV de elección2-4. Las Guías SEN del AV, actualmente en fase de revisión por el grupo de trabajo de AV, consideran como indicadores de calidad un porcentaje ≥ 80 % de enfermos incidentes con AV permanente (FAVI o injerto) y de pacientes prevalentes con FAVI así como un porcentaje < 10% de enfermos prevalentes con catéter tunelizado (CT)2.
El trabajo que se presenta en este número de NEFROLOGIA ha sido elaborado por el Grupo de Estudio del AV de la Sociedad Madrileña de Nefrología (SOMANE) y cuenta con el apoyo de la Consejería de Sanidad de la Comunidad Autónoma de Madrid (CAM)5. Se trata de un estudio retrospectivo y multicéntrico referido a 2.332 pacientes de 35 centros y efectuado mediante una encuesta distribuida a las Unidades de HD de la CAM. El objetivo del mismo es analizar los diferentes modelos de gestión del AV para hemodiálisis en la CAM y su repercusión sobre diversos indicadores de calidad del AV5.
En este estudio de la CAM, se clasificaron a los centros en tres niveles de valoración (bueno, suficiente e insuficiente) a partir de una puntuación obtenida a partir de las siguientes 3 variables5: 1) Organización nefrológica: consulta de ERC avanzada (ERCA) estructurada, protocolo multidisciplinar completo y base de datos con obtención rutinaria de indicadores de calidad. 2) Nivel de satisfacción alcanzado con el Servicio quirúrgico de referencia 3) Nivel de satisfacción alcanzado con el Servicio radiológico de referencia. En relación a los centros valorados como “insuficientes”, los centros valorados como “buenos” presentaron una menor utilización de catéteres, menor tasa de trombosis y mayor prevalencia de tratamiento sobre el AV tanto electivo por disfunción como de rescate por trombosis5.
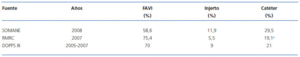
La situación actual del AV para HD existente en la CAM y que se presenta en este número de NEFROLOGIA no es óptima5. En este estudio, el 45 % de los enfermos iniciaron HD mediante catéter el año 2008 y, de un año para otro (del 31-12-2007 al 31-12-2008), se objetivó en el paciente prevalente un incremento del porcentaje de catéteres desde el 24,7 % hasta el 29,5 % y una reducción del porcentaje de FAVI desde el 62,3% hasta el 58,6 %5. Desafortunadamente, resultados similares se han evidenciado en otras Comunidades autónomas de España. Según datos procedentes del Registre de malalts renals de Catalunya (RMRC)6, que es uno de los Registros de enfermos renales de mayor prestigio de Europa, entre los años 2002 y 2005 el porcentaje de enfermos que iniciaron HD en Catalunya mediante FAVI siempre ha sido inferior al 50 % (oscilando entre 44 y 48%) y se evidenció un incremento del CT a expensas del no tunelizado6. El porcentaje de FAVI en los pacientes prevalentes en Catalunya ha ido disminuyendo progresivamente a lo largo de los años desde el 86 % (31-12-1997) hasta el 75,4 % (31-12-2007) de forma inversamente proporcional al incremento paulatino de los CT6. Los resultados del estudio multicéntrico impulsado por el grupo de trabajo sobre calidad en Nefrología de la SEN referidos al AV incidente y prevalente de 2.516 enfermos de 28 Unidades de HD de España durante el año 2007 demostró que ningún centro cumplía el objetivo de tener > 80 % de pacientes con un AV maduro al inicio de la HD7. La tabla 1 refleja la distribución del AV prevalente en la CAM, Catalunya y en el global de España según DOPPS III (2005-2007)4-6.
En relación a la FAVI, la presencia de un catéter venoso para HD se ha asociado a numerosas complicaciones que se traducen en una elevada morbimortalidad4,6,8-10. A partir de datos obtenidos por el RMRC y por el estudio CHOICE (Choices for Healthy Outcomes In Caring for ESRD) se ha demostrado que iniciar programa de HD a través de un catéter central supone, en relación a iniciar HD mediante FAVI, un incremento del riesgo de mortalidad debidamente ajustado por las diversas variables consideradas del 30 y el 50%, respectivamente6,11. Se podría argumentar que este riesgo incrementado de mortalidad asociado al catéter no depende del catéter en sí mismo sino a que los enfermos portadores del mismo presentan un status cardiovascular precario, en relación a su avanzada edad y mayor comorbilidad, que por un lado imposibilita la construcción de la FAVI y por otro lado condiciona su mayor mortalidad. Sin embargo, Allon y cols demostraron que, una vez debidamente ajustadas las diversas variables consideradas, el riesgo de mortalidad disminuía o aumentaba en los pacientes al cambiar catéter por AV permanente y viceversa, respectivamente12.
Por tanto, dadas sus potenciales complicaciones, es una obligación ética restringir al máximo la tasa de catéteres existente8. En la misma línea que otros autores, creemos que la causa del exceso de catéteres es multifactorial, es decir, existen varios factores concurrentes que son responsables de esta situación y, consecuentemente, es preciso actuar simultáneamente a varios niveles para intentar mejorarla13,14. Se han descrito los siguientes factores, de menor o mayor peso específico, asociados con el incremento de los catéteres tanto en el enfermo incidente como prevalente en HD (tabla 2):
Algunos autores han justificado el exceso de catéteres existente a que el paciente contemporáneo con ERC es “clínicamente distinto” al de hace 10-20 años debido a su mayor edad y mayor prevalencia de diabetes mellitus y comorbilidades cardiovasculares4,11,14,15. Se ha argumentado que la peor situación clínica del enfermo actual afecto de ERC podría condicionar un árbol vascular desfavorable que dificultaría la construcción y/o maduración de un AV permanente normofuncionante14,15. En este sentido, de los 616 pacientes incidentes incluidos en el estudio CHOICE (66,6 % con catéter, sólo 13,8 % con FAVI), los enfermos que iniciaron HD mediante catéter presentaron un score más severo de comorbilidad en relación a los que iniciaron HD mediante FAVI11. Según datos obtenidos en las 3 fases del estudio DOPPS, la probabilidad de que el paciente prevalente se dialice mediante FAVI es menor en presencia de sexo femenino, edad avanzada, obesidad, diabetes mellitus, arteriopatia periférica y celulitis recidivante4.
Si la mayor prevalencia de diabetes mellitus y comorbilidades cardiovasculares tuviera un impacto decisivo en el exceso de catéteres existente, sería lógico suponer que los enfermos no diabéticos y sin comorbilidades cardiovasculares presentarían una tasa muy baja de catéteres. Sin embargo, datos procedentes de Catalunya durante el periodo 2000-2007 han demostrado que, ante el mejor de los escenarios posible, es decir, ante la evolución normal de la enfermedad renal, un seguimiento nefrológico superior a 2 años y la ausencia de diabetes mellitus y comorbilidades cardiovasculares, el porcentaje de FAVI y de catéter central en el paciente incidente de Catalunya fue de 66,9 % y 31,4 %, respectivamente6. En este sentido, en un programa de construcción de FAVI efectuado sobre 121 enfermos prevalentes dializados mediante CT, Asif y cols., evidenciaron que el 95 % de los pacientes con CT y evaluados mediante un mapa vascular (exploración física y flebografía) presentaban una venas adecuadas para la construcción de una FAVI16. Por tanto, parecen existir otras causas, además del “factor paciente”, responsables de la tasa actual de catéteres.
2. El factor centro.
Al igual que en la CAM5, en el resto de España también existen diferencias notorias al comparar distintas Unidades de HD en relación a la distribución del tipo de AV tanto en el enfermo incidente como prevalente en HD6,7. Por ejemplo, según los datos presentados en el Quinto Congreso de la Vascular Access Society del año 2007, el 94 % de los pacientes prevalentes se dializaban mediante FAVI en una Unidad de HD Murcia17. En el año 2007, iniciaron HD mediante catéter en Catalunya entre el 20 y el 100 % de los enfermos según la Unidad de HD considerada6.
Como se sugiere desde la CAM5, pueden existir varias causas que actúen simultáneamente en un mismo centro que condicionen el exceso de catéteres existente y, a la vez, estas causas pueden ser distintas entre las diferentes Unidades de HD consideradas. Aunque en algunos estudios se destaca a la cirugía del AV para explicar las desigualdades existentes entre las Unidades de HD18,19, existen otros elementos relevantes asociados al “factor centro” como por ejemplo la inexistencia de una consulta de ERCA o bien la ausencia de un programa de monitorización del AV. De cualquier forma, no es aceptable desde ningún punto de vista que pacientes incidentes de la misma edad y comorbilidad ya tengan de entrada un riesgo de mortalidad distinto en relación al “factor centro” según inicien HD mediante FAVI o catéter central8.
3. La cirugía del acceso vascular.
En el estudio de la CAM5, la organización nefrológica se consideró buena o suficiente en la mayoría de los centros (80 %, 28/35). La satisfacción de los nefrólogos ante el soporte prestado o recibido por radiología vascular fue buena o suficiente en el 74 % (26/35) de los centros. En cambio, más de la mitad de los centros de la CAM (57 %, 20/35) consideraron insuficiente el soporte prestado o recibido por los servicios quirúrgicos.
La figura del cirujano, habitualmente cirujano vascular, es clave para cambiar la dinámica existente de exceso de catéteres13,19. Es muy importante que el cirujano vascular esté integrado en un equipo multidisciplinar. Su actividad es fundamental para la obtención de un AV permanente funcionante y tiene que estar involucrado, conjuntamente con el radiólogo vascular, tanto en la intervención electiva sobre la estenosis significativa del AV como en el rescate urgente del AV post-trombosis.
En el análisis de regresión multivariado efectuado en el estudio de Prischi y cols., referido a 108 enfermos dializados mediante FAVI radiocefálica, el único parámetro de relevancia pronostica sobre la permeabilidad de la FAVI fue el cirujano20. Según Basile y Lomonte, el cirujano es el principal factor que determinante en la maduración de la FAVI21. En el estudio de Feldman y cols., optimizando la técnica quirúrgica es posible aumentar la probabilidad de maduración exitosa de la FAVI desde el 55,5 al 84 % CAM15. Según Allon y Robbin, uno de los factores necesarios para obtener una FAVI madura y de supervivencia prolongada es restringir los procedimientos quirúrgicos sobre el AV a cirujanos con interés y experiencia demostrables22. En opinión de Linda Francisco, el cirujano vascular debe cumplir los siguientes 3 requisitos CAM23:
4. La consulta de enfermedad renal crónica avanzada (ERCA).
En la CAM5, un porcentaje importante de centros (45,7 %, 16/35) no disponía de una consulta de ERCA estructurada. Esta consulta es muy importante tanto para indicar precozmente la construcción de la FAVI como para su seguimiento periódico durante la fase de maduración10,24. En una serie nacional, el 73 % de los enfermos valorados previamente en la consulta de ERCA iniciaron HD mediante FAVI9.
Cuanto menores son las visitas nefrológicas en la consulta de ERCA, menor es la probabilidad de iniciar HD mediante un AV permanente. En el estudio de Stehman-Breen y cols., los pacientes con sólo 1 visita al nefrólogo presentaron una probabilidad 79 % inferior de iniciar HD mediante un AV permanente que los enfermos visitados más de 5 veces24.
5. El mapa vascular.
Para reducir la tasa de catéteres, es fundamental disponer de un mapa vascular, tanto arterial como venoso, de todos los pacientes afectos de ERC en la consulta de ERCA25,26. Además de la exploración física, la evaluación vascular mediante ecografía Doppler debería efectuarse en la mayoría de enfermos27.
El mapa vascular es imprescindible para efectuar la conversión de CT a FAVI en el paciente prevalente16,28. En la ya mencionada serie de Asif y cols, de los 86 enfermos dializados mediante CT y sometidos a evaluación vascular mediante exploración física y flebografia, se consiguió una FAVI normofuncionante en el 77 % de los casos16.
6. La remisión tardía del paciente a la consulta de ERCA.
La dedicación del nefrólogo al paciente con ERCA depende de la remisión precoz o tardía del mismo a la consulta. Existe una relación inversa entre el tiempo de seguimiento del enfermo afecto de ERC por el nefrólogo y la probabilidad de iniciar programa de HD mediante catéter4,6,11. Según datos de DOPPS, el porcentaje de pacientes que inician HD mediante catéter central en España es muy distinto según la primera visita al nefrólogo se produjera en un intervalo de tiempo igual o superior a 4 meses (25,6 %) o bien inferior a 1 mes (81 %)4. Según datos del RMRC, el porcentaje de enfermos que inició HD mediante catéter durante el intervalo 1997-2007 en Catalunya fue progresivamente superior según el tiempo de seguimiento nefrológico fuera mayor de 2 años, entre 1-2 años y menor de 1 año6.
7. El equipo multidisciplinar
Uno de los factores principales para reducir la tasa de catéteres y aumentar la de FAVI tanto en el paciente incidente como prevalente es la creación de un equipo multidisciplinar para el manejo del AV10,17,22,27. En este equipo tienen que estar representados todos los profesionales responsables del AV del enfermo, es decir, nefrólogos, cirujanos vasculares, radiólogos vasculares y enfermeras de HD17,22. Habitualmente, este equipo está coordinado por un nefrólogo o una enfermera de HD27. Las funciones más importantes del equipo multidisciplinar son las siguientes:
- Establecer protocolos de actuación consensuados.
- Gestionar la lista de espera para la intervención sobre el AV.
- Decidir el tipo, localización y timing de construcción del AV permanente según el resultado del mapa vascular.
- Seguimiento del AV permanente en la consulta de ERCA desde su construcción hasta el inicio de su punción (antes de iniciar programa de HD) y en la sala de HD (paciente prevalente).
- Asegurar el diagnóstico precoz de los casos de estenosis significativa del AV permanente mediante la evaluación de los resultados de los métodos de screening aplicados en la consulta de ERCA (antes de iniciar programa de HD) y en la sala de HD (enfermo prevalente).
- Garantizar el tratamiento electivo de la estenosis significativa del AV permanente mediante radiología y/o cirugía vascular antes de su trombosis.
- Asegurar un tratamiento de rescate urgente mediante radiología y/o cirugía vascular de los casos de trombosis del AV sin necesidad de la implantación de un catéter central.
- Actualización de la base de datos en relación al AV de cada paciente.
- Evaluación periódica de los objetivos propuestos
En la CAM, menos de la mitad de los centros (48,6 %, 17/35) presentaban protocolos de actuación consensuados entre los Servicios de Nefrología, Cirugía y Radiología vascular5. En España, algunos equipos multidisciplinares estructurados están ya operativos desde hace 10 años, como en el Hospital Fundación Alcorcón (Madrid), el Hospital Reina Sofía (Murcia) o el Hospital de Terrassa (Barcelona). En el Hospital Clínico de Barcelona se ha creado la Unidad Funcional del Acceso Vascular, de composición multidisciplinar, con el objetivo de mejorar la situación del AV tanto del propio Hospital como de otros centros de Catalunya.
Se ha demostrado el efecto favorable de implantar estrategias de priorización en la gestión de la lista de espera para la intervención sobre el AV27,29. Según datos de DOPPS, existe una relación inversamente proporcional entre la probabilidad de iniciar HD mediante un AV permanente y el tiempo transcurrido: entre la remisión del paciente y la evaluación por el cirujano, y también entre la evaluación por el cirujano y la construcción del AV3. Como resultado de la gestión del AV mediante 5 criterios de priorización en el equipo multidisciplinar existente en el Hospital Parc Taulí de Sabadell, el 80 % de los enfermos iniciaron HD mediante FAVI29.
8. La prevención de la causas no anatómicas de trombosis.
En alrededor del 15-20 % de los casos, la trombosis del AV permanente del paciente prevalente en HD se debe a causas no anatómicas, es decir, no provocadas por la progresión de una estenosis significativa del AV. Las causas no anatómicas más frecuentemente involucradas son la hipotensión arterial, deshidratación extracelular, insuficiencia cardiaca, compresión extrínseca del AV, infección local, alteraciones de la coagulación sanguínea y poliglobulia en algunos enfermos dializados mediante injertos sintéticos de PTFE bajo tratamiento mediante agentes estimulantes de la eritropoyesis2,3. El nefrólogo debe actuar sobre estas causas para evitar la trombosis del AV y la eventual implantación de un catéter central.
9. Los programas de monitorización del AV.
Todos los Servicios de Nefrología de España deberían desarrollar programas de seguimiento del AV permanente tanto durante la fase de maduración en la consulta de ERCA como durante el programa de HD crónica2,3. El objetivo de estos programas es el diagnóstico precoz de la estenosis significativa del AV y efectuar su reparación electiva antes de su trombosis. Estos programas se basan en la aplicación de diversos métodos de screening para la detectar la estenosis del AV y en su intervención preventiva mediante mediante técnicas de radiología y/o cirugía vascular2,3.
Debe efectuarse un seguimiento del AV en la consulta de ERCA para diagnosticar precozmente la falta de maduración del AV permanente en relación a la presencia de estenosis. Habitualmente, los métodos de monitorización aplicados son la exploración física y la ecografía Doppler 26,30. La intervención electiva de estos casos de falta de maduración puede evitar el inicio del programa de HD mediante un catéter central31.
La causa más frecuente de trombosis del AV (80-85 % de los casos) en el paciente prevalente es la estenosis significativa del AV, es decir, la reducción igual ó superior al 50% del calibre vascular. Los programas de monitorización del AV deben permitir el diagnóstico de la estenosis subclínica mediante la aplicación de diversos métodos de screening y su corrección electiva mediante técnicas de radiología y/o cirugía vascular32. Sin establecer un programa estructurado de seguimiento del AV en las Unidades de HD, no es posible ni reducir la tasa de trombosis ni el porcentaje de catéteres en el enfermo prevalente.
Los métodos de monitorización del AV se pueden clasificar como de primera y segunda generación (tabla 3)33. En la CAM, se utilizaron preferentemente los métodos de monitorización de primera generación como técnicas de screening para diagnosticar la disfunción del AV5. El método de seguimiento de mayor difusión fue la disminución del flujo sanguíneo de la bomba QB del monitor de HD (95,7 %, 30/35). Únicamente se utilizó la determinación del flujo sanguíneo del AV (QA) como método de segunda generación en un tercio de los centros (11/35), a pesar de que es el método de elección para el seguimiento del AV permanente2,3. Ningún centro utilizó la ecografía Doppler para monitorizar el AV. El tratamiento preventivo o electivo de la disfunción del AV no se contempla en varios centros de la CAM5.
Para evitar la trombosis del AV y reducir así la tasa de catéteres es prioritario introducir a los métodos de segunda generación en las Unidades de HD. Los métodos de screening para la determinación indirecta del QA del AV son técnicas dilucionales que se han convertido en las de elección para la monitorización del AV2,3,34,35. En presencia de una estenosis significativa y a diferencia de los métodos de primera generación, el QA disminuye siempre independientemente del tipo de AV (FAVI o injerto de PTFE), localización y topografía de la estenosis (arteria nutricia, anastomosis, vena arterializada, vena central)3,33,36,37. Por otra parte, hay que aprovechar al máximo las prestaciones de la ecografía Doppler y el ecógrafo portátil tiene que entrar de una vez por todas en la sala de HD38.
Según los datos de la CAM5, se objetivó una correlación negativa entre la tasa de tratamiento preventivo por disfunción y la tasa de trombosis del AV. La aplicación de programas de seguimiento del AV ha conseguido como mínimo una reducción del 40 % de la tasa de trombosis del AV1. En un estudio prospectivo de casos y controles efectuado en Mollet del Vallès (Barcelona), se evidenció una menor tasa de trombosis en los AV monitorizados mediante determinaciones de QA utilizando el método Delta-H34.
En la CAM, la causa más prevalente de efecutar HD a través de un catéter central en el momento de la encuesta fue el agotamiento del capital vascular sin posibilidad de cirugía para realizar FAVI o injerto de PTFE (44 % de los pacientes)5. Según datos de DOPPS, la probabilidad de que el enfermo prevalente se dialice mediante catéter es directamente proporcional al número de AV permanentes previos4. Es probable que si se hubiera desarrollado un programa de seguimiento integral del AV se hubieran podido evitar la mayoría de casos trombosis y estos enfermos se dializarían en la actualidad mediante FAVI o injerto de PTFE.
10. El rescate de los AV trombosados.
Es muy importante el rescate mediante técnicas de radiología y/o cirugía vascular del AV trombosado diagnosticado en la consulta de ERCA para evitar que el paciente inicie HD mediante catéter central31.
La trombosis del AV permanente en el enfermo prevalente no debería ser sinónimo de implantación de un catéter central. En estos casos, debe intentarse siempre el rescate del AV trombosado mediante técnicas de radiología y/o cirugía vascular de forma urgente para evitar la implantación de un catéter central y conseguir que el paciente efectúe la siguiente sesión de HD mediante el AV repermeabilizado39.
11. La educación del enfermo renal
Como en otros estudios16,28, la negativa del enfermo a cambiar de AV fue una de las causas (4%) de la persistencia del catéter central en el paciente prevalente en la CAM5. El nefrólogo debe identificar el motivo por el cual el enfermo prefiere el catéter central y, a través de diversas estrategias, tiene la obligación moral de intentar persuadir al paciente prevalente para cambiarlo por un AV permanente8. La educación del enfermo renal fue una de las piedras angulares utilizadas en el programa implantado por Asif y cols para convertir CT por AV permanente en el paciente prevalente16.
12. El reciclaje de los profesionales a cargo del enfermo renal.
Algunos programas de mejora del AV para cambiar la distribución de FAVI y CT, se basan en promover el reciclaje de los profesionales a cargo del enfermo renal40. En este sentido, uno de los objetivos del actual grupo de AV de la SEN, que se ha reorganizado en un formato multidisciplinar, es impulsar Cursos y Jornadas sobre el AV en toda España así como Simposios monográficos del AV en cada Congreso Nacional de la SEN.
El estudio realizado por los nefrólogos de Madrid es único en su género en España ya que nos proporciona un dibujo preciso de la situación actual del AV en una Comunidad Autónoma5. Ahora ya se conocen las principales deficiencias de la CAM y se han identificado 3 puntos clave para mejorar el AV. A partir de los resultados obtenidos en este estudio, se ha puesto en marcha un plan de mejora tutelado por la Consejería de Sanidad de Madrid y auspiciado por SOMANE, con la colaboración de ALCER-Madrid. Si la administración y los especialistas involucrados en el manejo del AV ponen toda la carne en el asador, se puede revertir la situación actual y mejorar los resultados actuales.
Conceptos clave para mejorar la situación actual del AV en España:
Tabla 1. Distribución del AV prevalente en la CAM según la SOMANE, en Catalunya según el RMRC y en el global de España según DOPPS III. Datos obtenidos de las referencias 4, 5 y 6
Tabla 2. Factores asociados con la actual tasa de FAVI y de catéteres tanto en el paciente incidente como prevalente en HD
Tabla 3. Clasificación de los métodos de monitorización del AV. Adaptado de referencia 33