La eritropoietina es una hormona glicoproteica esencial para la progenie eritrocitica como factor de crecimiento y de viabilidad.La senalizacion bioquimica de la EPO implica un proceso de fosforilacion de la tirosina en el receptor homodimerico de la EPO,con una subsecuente activacion intracellular de proteinas kinasas, y factores de transcripcion.El tratamiento con las agentes estimulantes de la eritropoietina(ASE) se consideraba efectivo y falto de efectos deleterious mejorando asi el manejo de las anemias asociadas al enfermedad renal cronica,permitiendo la disminucion del requerimiento de transfusiones sanguineas.Sin embargo, recientes estudios aleatorizados han mostrado un incremento de la mortalidad, lo que ha hecho que se replantee su uso.Esta revision quiere mostrar lo que se sabe acerca de la fisiologia de este factor plasmatico,que representa mas que un factor de produccion de eritrocitos., y de su efecto pleitropico con su uso clinico en la incidencia de maliginidades,trombosis,hypertension y retinopatia diabetica
The glycoprotein hormone erythropoietin is an essential viability and growth factor for the erythrocytic progenitors. EPO signalling involves tyrosine phosphorylation of the homodimeric EPO receptor and subsequent activation on intracellular proteins, kinases and transcription factors. Treatment with erythropoietic stimulating agents (ESA) or ecombinant human EPO (rHuEPO) is efficient and safe in improving the management of the anaemia associated with chronic kidney disease, and allowing avoidance of transfusions with blood products. However, the unanticipated increase in mortality found in recent randomized studies is prompting a reassessment of this view. The present review will show what is known about the physiology of this plasma factor that, it is now clear, is more than just an erythrocyte production factor, and its pleitropic effects influencing the incidence of malignancy, thrombosis, hypertension and retinopathy.
Introduccion
La eritropoietina fue por primera vez aislada por Carnot y Defladre en experimentos realizados en 1905 y 19061. No fue hasta el 1948 en que se utilizo por primera vez el termino “eritropoiesis” para describir la presencia de “ factores plasmaticos”, no identificados hasta entonces, que se generaban en condiciones de anoxia para estimular la produccion de eritropoietina2. Durante los siguients 40 anos la EPO(eritropoietina) fue definitivamente aislada y purificada3 permitiendo el desarrollo de tests con sensibilidad suficiente para entender su fisiologia4. La clonacion de la eritropoietina humana(rHuEPO) no solo permitio su utilizacion con exito para el tratamiento de las anemias por enfermedad renal cronica(ERC) sino que se convirtio en la mejor herramienta para mejorar nuestro entendimiento de esta glicoproteina5. Antes de disponer de la EPO humana recombinante hace 15 anos,el 25% de los pacientes renales en terapias renales sustitutivas necesitaban tranfusiones de productos derivados de la sangre.El tratamiento con la EPO recombinante ha permitido una mejora de la calidad de vida de pacientes con anemia,y el farmaco es uno de los productos de mayor venta en el mundo.Mientras que la EPO y la darbopoietina alfa(modificada para tener una vida media mas prolongada)estimulan la produccion eritrocitica satisfactoriamente, en la mayoria de los casos, se ha notado una creciente preocupacion por su uso.Preocupacion que emergio despues de la publicacion de dos estudios aleatorizados realizados en pacientes de ERC de estadios 3 y 4 6,7. Estudios que mostraron falta de beneficio y complicaciones significativas cuando la EPO humana recombinante se utilizo para alcanzar una hemoglobina diana de 13-15 g/dl comparado con los pacientes que alcanzaron una hemoglobina diana entre 10.5-11.0 g/dl.Las advertencias publicadas por la FDA sugieren que hay muchas preguntas sin respuesta acerca del uso terapeutico de la EPO8. Para poder entender el uso de la EPO como tratamiento para las anemias mirando mas alla de hemoglobinas diana,seria conveniente entender la fisiologia de esta y de su receptor(EPOR) y como intervienen como factores de crecimiento y citokinas.Esta vision podria ayudar a los clinicos a entender de el porque de la asociacion de las hemoglobinas normales diana y los resultados adversos asociados a ellas..Esta revision intentara mostrar la asociacion de la fisiologia de la EPO con su aparente potencial oncogenico,tendencia a desarrollar trombosis,incidencia de hipertension y mecanismos y efectos pleitropicos relacionados con la retinopatia diabetica.Siempre teniendo en cuenta que la condiciones de algunos pacientes,concretamente los oncologicos,son diferentes y no siempre extrapolables a los pacientes renales,sobre todo en lo que acontece a los dosis y a los periodos de administracion de las EPO’S.
Estructura y fisiologia de la eritropoietina humana
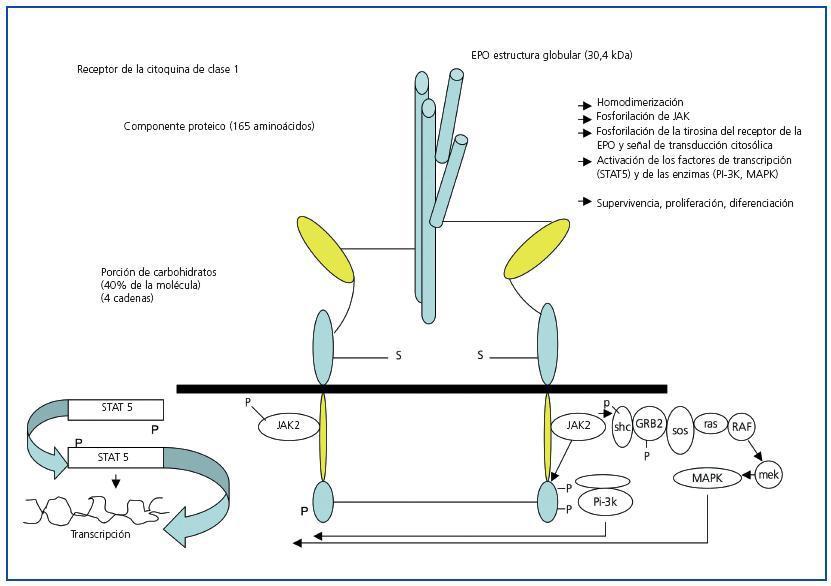
La EPO es una citokina de caracter pleitropico y proangiogenico y que ademas ejerce efectos protectores en diversos organos de origen no hematopoietico.Es tambien una hormona de caracter glicoproteico que actua como regulador primario de la eritropoiesis.Como se ha mencionado anteriormente,es un miembro de la familia de las citokinas de clase I que conforman una estructura de character globular y compacto de cuatro cadenas de helices alfa9. La masa molecular es de 30.4 kilodaltons10 el nucleo peptidico es de 165 aminoacidos y se basta para ejercer de receptor de enlace y de estimulacion de la eritropoiesis in vitro”,la porcion de carbohidrato(40% de la molecula total)es necesaria para la estabilidad de la hormona en vivo11. La EPO se produce en los hepatocitos en el periodo fetal,.Despues del nacimiento la EPO circulante se origina en las celulas peritubulares corticales de character fibroblastico12. El estimulo principal para la produccion de la EPO es la hipoxia tisular.La EPO esta presente en el suero de pacientes con ERC pero sus niveles no se correlacionan bien con los niveles de hemoglobina serica, en cambio ,en los pacientes con una funcion renal preservada,muestran niveles de EPO que aumentan de un modo exponencial al decremento de la concentracion de hemoglobina serica.Los valores pueden incrementar hasta 10,000 U/l comparado con valores normales de 15U/l13. La EPO como otras glicoproteinas plasmaticas circula como isoformas que difieren en la glicosilacion,masa molecular,actividad biologica,e imunoreactividad.Hay variaciones diurnas en la concentracion de la EPO circulante con incrementos de los valores nocturnos sobre los diurnos de hasta un 40%14.Un factor transcripcional llamado factor inductor de la hipoxia(HIF) regula los niveles de la EPO a traves de sensores de oxigeno.La EPO se regula por la distribucion de oxigeno mas que por los niveles de hemoglobina y es el oxigeno serico el parametro esencial(pero de dificil medicion o determinacion) en el manejo de las anemias lo que hace que sea inadecuada la seleccion de las hemoglobinas diana como parametro terapeutico .Todavia esta por dilucidar el mecanismo de degradacion de la EPO circulante.Hay evidencia de eliminacion de la EPO en la circulacion mediante endocitosis por eritrocitos y otras celulas que poseen receptores de la EPO15. Del mismo modo, se han desarrollado nuevas formulaciones de EPO humana recombinante.como CERA(receptor de continua activacion para la eritropoiesis),que contiene metoxipolietilenoglicol para prevenir la internalizacion del farmaco y asi prolongar su vida media biologica.
La EPO se une a dos receptors identicos(EPOR) que existen como homodimeros16. Dos moleculas janus kinasas 2(JAK2)tirosina kinasa,que estan en contacto con la region citoplasmatica del receptor de la EPO,se activan17 causando la canalizacion de diversas senales de transduccion.El efecto de la EPO se detiene mediante la accion de(HCP)la fosfatasa hematopoietica celular que cataliza a JAK218 Tabla 1.Originalmente los investigadores mantuvieron la nocion de que la EPO tenia su accion exclusivamente en el sistema hematopoyetico.Estudios recientes han demostrado que es una hormona de caracteristicas pleitropicas.Los primeros experimentos que demostraron una accion de la EPO fuera del sistema hematopoietico los realizo Anagnostou et al. quien demostro un efecto de la EPO de caracter mitogenico y quimiotactico en las celulas endoteliales , ,asi como la presencia de lugares de enlace o receptors(EPOR)19. Del mismo modo, se ha descrito un efecto anti-apoptotico con caracteristicas de proteccion tisular en tejidos neuronales20. Estas observaciones se han confirmado en otros tejidos organicos por investigadores ,que han propuesto que este efecto protector,se realiza no mediante la interaccion del clasico homodimero del EporR mediante el que la EPO estimula la eritropoiesis, sino mediante un heteroreceptor compuesto por un EpoR que interactua con un no-EPO receptor produciendo un proceso de dimerizacion o trimerizacion21. Se ha aislado RNA mensajero correspondiente a receptores de la EPO, en el endotelio,epicardio,pericardio,mesangio,celulas epiteliales,islotes pancreaticos,placenta, y y ciertas areas definidas del cerebro.Basados en estos hallazgos se ha propuesto que la EPO tiene funciones angiogenicas y neurotropicas22. Sin embargo,todavia esta por aclarar de una manera diafana el papel fisiologico del combinado EPO/receptor EPO en tejidos no eritrociticos.
Malignidad y anemia en el tratamiento con la EPO humana recombinate(EPO)
La anemia es un factor de caracter pronostico independiente en la supervivencia de pacientes con cancer23. El estudio europeo da la anemia en el cancer ,mostro que el 72% de los pacientes con procesos oncologicos de caracter hematologico y que el 66% de los pacientes con tumors solidos presentaban cuadros anemicos,aunque la prevalencia varia con respecto al tipo de proceso tumoral.La patofisiologia es multifactorial.Hay evidencia de que la anemia provoca una falta de respuesta terapeutica a la radioterapia,quimioterapia e incluso a la cirugia24. Diversos estudios clinicos han sugerido una mejora de la supervivencia en pacientes cancerosos que recibieron EPO humana recombinante a causa de su anemia.Por el contrario,
Otros estudios mencionan efectos adversos del uso de la EPO humana recombinante en canceres diversos.Un analisis de seguridad realizado en un estudio aleatorizado del uso de la EPO alfa ,en pacientes con cancer de pulmon de celulas grandes,resulto en la teminacion del estudio25. El analisis sugirio una supervivencia menor en los pacientes tratados con EPO humana recombinante.Han habido resultados similares en estudios de cancer de cabeza y cuello asi como de mama26,27. Data de supervivencia previa, ha demostrado un incremento de fallecimientos prematuros de los pacientes con procesos cancerosos,sugiriendo que la EPO humana recombinante,al ser utilizada en las dosis prescritas,provoca un aumento del crecimiento tumoral.Por otro lado, algunos han especulado que la EPO humana recombinante,mediante el aumento de la hemoglobina serica,disminuye los factores de crecimiento tumoral mediante la reduccion de HIF,(factor inducible por hypoxia,proteina compuesta por dos subnidades a y b que se unen y tranforman en HIF-1 en situaciones de bajo oxigeno tisular,regulando la expresion de hasta doce genes que actuan en el transporte de oxigeno,aumento de la capilarizacion,metabolismo anaerobico,y proliferacion celular), descrito por Semenza y Wang en 1992 a traves de un aumento en el transporte de oxigeno28 Es interesante subrayar que antes de la introduccion de la EPO humana recombinate, la incidencia de cancer , en los pacientes de terapia renal sustitutiva ,era menor de la esperada29. Un analisis de 28,049 pacientes con ERC en terapias renales sustitutivas durante la era anterior al uso de la EPO humana recombinante revelo una ratio de incidencia estandar de 0.9.Un analisis posterior realizado por USRDS(sistema renal de datos de E.E.U.U.)hasta el 1994, mostro un ratio de incidencia estandar de un 1.2 con el mayor incremento en los pacientes menores de 35 anos30.Un entendimiento mejor acerca de esta incidencia puede provenir de un conocimiento de la estructura quimica del receptor de la EPO humana recombinante.La EPO tiene una receptor N terminal extracelular asociado con la capacidad de union de la EPO mientras que el receptor C terminal intracellular esta asociado a senales de transduccion.La EP0 se une a dos receptores identicos que existen en forma de homodimeros como se ha mencionado anteriormente.La activacion del receptor de la EPO ocurre a traves de la fosforilacion de la tirosina de un complejo de proteinas entre las que se incluye el mismo receptor,fosforilacion que se realize mediante la interaccion de la enzima tirosina kinasa.La reaccion quimica mencionada origina una respuesta cellular de character pleitropico31.La actividad de la enzima tirosina kinasa es importante en los receptors del factor de crecimiento a si como de los oncogenes, y debido a su habilidad como potencial estimulador mitogenico,se ha dilucidado que estas moleculales tienen un potencial oncogenico latente32. Diversos investigadores han documentado la presencia y expression de receptores de la EPO en numerosas lineas celulares de caracter tumoral(celulas de canceres hepaticos entre otros).Celulas de canceres de prostate y rinon expresan tambien receptores de la EPO,y la EPO parece servir de factor de crecimiento de estas celulas33. Las celulas de cancer de ovario ,expuestas a la EPO humana recombinante,demuestran un aumento de la transduccion de la senal de la EPO y de resistencia a la quimioterapia mediante una reduccion de las proteinas Bcl-2 y Bcl10 relacionadas con la apoptosis celular34.
La EPO humana recombinante puede influenciar el crecimiento tumoral de otras maneras.Epo puede promover la angiogenesis tumoral mediante su accion en la proliferacion de celulas endoteliales.La presencia de receptors de la EPO, a nivel tisular ,en el carcinoma indiferenciado de pulmon de celulas grandes, puede reducir la supervivencia del paciente ,sugiriendo un papel potencial de caracter paracrino de la EPO endogena en la agresividad del crecimiento tumoral35. Otra posible conexion entre la EPO y el cancer es la de las enfermedades quisticas renales.Los pacientes con la enfermedad de Von Hyppel-Lindau(VHL),tienen una alta incidencia de tumores renales, y los rinones de estos pacientes muestran una morfologia similar a la poliquistosis renal y ademas niveles elevados de hemoglobina y EPO sericas36. La evidencia demostrada al respecto por diversos estudios ,en los que se utilizo la EPO en pacientes cancerosos,es preocupante y debido a esos estudios mencionados anteriormente y a datos extraidos de otros estudios clinicos, la ODAC(FDA’S Oncology Drug Advisory Committee) reunida en dos ocasiones (mayo del 2004 y del 2007)emitio avisos en el uso de agentes estimulantes de la eritropoietina en los pacientes con procesos tumorales.Si asumimos que las dosis terapeuticas de EPO y darbopoietina,( y la de otros agentes en desarrollo),pueden estimular el crecimiento de ciertos procesos tumorales,de que modo se pueden sintetizar nuevas moleculas de EPO que realizen su accion hematopoietica sin presentar estos efectos deletereos en los tejidos tumorales?.Se podrian utilizar los heteroreceptores que actuan como complejos funcionales del receptor de la EPO en celulas tumorales y asi la estructura dominio de la EPO que se une a otros receptores seria diferente de los otros dos receptores dominios. De ese modo se podria disenar una molecula de EPO de caracter ‘mutante”37
Trombosis con los agentes estimulantes de la eritropoietina(ASE)
En la era previa al uso de la eritropoietina humana recombinante era rara la incidencia de la trombosis venosa profunda y embolismo pulmonar.38,39. Los nefrologos se percataron de aumentos alarmantes en la frequencia de eventos de caracter trombotico40. Otras datos mostraron un riesgo elevado de embolismo pulmonary en poblaciones de pacientes en terapia renal sustitutiva,con un ratio de incidencia ajustada por edad de 2.11,despues de excluir pacientes en dialysis con factores de riesgo a esos eventos41. Recientes estudios de caracter retrospectivo mostraron que el uso de la eritropoietina humana recombinante resulto en un mayor numero de eventos de caracter trombotico(hazard ratio 1.4,95% CI 1.06-1.96)en pacientes criticos y de cancer de mama42. Sabemos que la eritropoietina humana recombinante aumenta la agregabilidad plaquetaria43 y que ademas disminuye los niveles de proteinas C y S.Esta agregabilidad se puede revertir con el uso de aspirina.Sin embargo las trombosis de accesos vasculare de hemodialisis no se previenen con esta y esta claro que los mecanismos fisiopatologicos de estas trombosis son complejos.La viscosidad sanguinea aumenta directamente con los niveles de hemoglobina y se penso que este aumento estaba relacionado con el incremento de la incidencia de trombosis en los casos de policitemia.Con la correction de la anemia mediante el uso de la eritropoietina humana recombinante,uno esperaria un incremento de los casos de trombosis de accesos vasculares,sin embargo,los casos de trombosis de estos accesos parecen no tener relacion con los niveles de hemoglobina44. Se debe mas a un proceso de hiperplasia de la intima del vaso sanguineo originada por una proliferacion de las celulas del tejido muscular liso,el cual no responde a la accion de la aspirina pero que se estabiliza con el uso de los agentes inhibidores de la enzima covertidora de la angiotensina45. Recientemente se ha demostrado que el angiotensinogeno II estimula un factor de crecimiento similar a la insulina a traves de la induccion de receptores de tirosina kinasa en el tejido muscular liso de caracter vascular lo que provoca un aumento de la hyperplasia vascular en la intima46. Parece entonces que tanto la EPO,como el angiotensinogeno II,son factores de crecimiento similar a otras citokinas que activan los receptors de tirosina kinasa y que no son tan inususales la presencia de efectos nocivos como la hipertension y la enfermedad vascular en ambos.Desde el punto de vista clinico una posible explicacion de la incidencia de trombosis en esta poblacion seria la trombocitosis debida a la presencia de deficiencia de hierro por el uso de ASE47. En un estudio de pacientes cancerosos en quimioterapia que recibian ASE el tratamiento con hierro endovenoso redujo el aumento de plaquetas por encima de las 350.000.De hecho los pacientes que presentaban conteos plaquetarios por encima de los 350.000 estaban asociados a una incidencia mas alta de eventos tromboembolicos.El uso de hierro endovenoso redujo el riesgo de eventos tromboembolicos en un 40%48. Un punto de reflexion acerca de esta hipotesis referente al posible efecto protector de hierro endovenoso,es el que en ciertos estudios publicados, que hacian referencia a la poblacion en hemodialisis con problemas cardiovasculares,el uso del hierro no tenia caracter protector e incluso demostro generar efectos deletereos49, aunque estos resultados se deben ver con cierto escepticismo,ya que los datos del tratamiento no se completaron hasta despues de la finalizacion del mismo.Sin embargo mas estudios van ha ser necesarios en futuro para confirmar estos hechos.
La hipertension como efecto secundario de la eritropoietina o de sus agentes estimulantes (ASE)
Datos iniciales recogidos en la literatura, en los que se demostraba la eficacia de la EPO recombinante,constataron como efecto secundario mas frecuente la hypertension arterial50. Resultados que no sorprenden sobre todo por que la hypertension puede presentarse asociada a entidades como la policitemia51. No obstante no esta demostrado con veracidad absoluta la relacion entre hipertension y aumento del hematocrito52. La administracion de EPO recombinante aumenta la resistencia vascular periferica y disminuye el gasto cardiaco,todo esto debido a un aumento de endotelinas,angiotensina,inoperancia de la relajacion del entotelio vascular,alteracion de los niveles del calico en le tejido muscular liso del endotelio vascular y de la liberacion de serotonina por las plaquetas.Es sabido que el tratamiento con los agentes estimulantes de la eritropoietina(ASE) causan un empeoramiento de la presion arterial en un 30% de los pacientes53. En un meta-analisis reciente realizado en una revision de la literatura basada en la normalizacion de la hemoglobina,se mostraba un aumento consistente de la presion arterial en las hemoglobinas diana de valores altos en comparacion con los de valores bajos54. En el estudio CREATE6, el grupo de pacientes con hemoglobina diana normalizada,presentaban una presion sistolica arterial por encima de los 160 mmHg en un 50%.Un a posible explicacion a los valores tan altos de presion arterial en estos estudios sea la falta de control adecuado de la hipertension en estos pacientes,lo que hace que no representen feacientemente esta relacion entre hipertension y el uso de ASE.Hampl y sus colegas en alemania55 utilizaron un regimen intesivo de terapia antihipertensiva con dosis maximas de bloqueadores beta,de los receptores de la angiotensina e IECA’S logrando mediciones de presion arterial normalizadas antes del inicio de las sesiones de terapia renal sustitutiva,lo que difiere de los estudios aleatorizados de los ASE recientes y de las practicas habituales de las unidades de hemodialisis.De hecho en los resultados de este grupo de investigadores,se mostro que la normalizacion de los niveles de la hemoglobina serica se acompanaba de no solo una falta de incremento de presion arterial,sino de un descenso en los valores de la misma.No obstante,el uso de estos regimenes antihipertensivos en nuestra poblacion provoca una incidencia importante de hipotension durante la dialisis.A nivel de investigacion basica como el efecto antihipertensivo de la EPO puede ser independiente del hematocrito,seria posible retener el efecto eritropoietico eliminando el hipertensivo.Hay sitios especificos en la molecula de la EPO que determinan ese efecto hipertensivo y eso a permitido la creacion de modelos geneticos animales que eliminan ese efecto preservando la accion hematopoietica56
Retinopatia diabetica y los ASE
La eritropietina(EPO) es un factor de crecimiento como otras citokinas que activan los receptores de las tirosina kinasas.Se ha establecido una relacion directa entre incidencia de la retinopatia proliferativa ,en pacientes en terapia renal sustitutiva, y el uso de la eritropoietina recombinante57. Parece ser que la eritropietina es en si misma un factor de crecimiento angiogenico58, y los niveles de EPO en el humor vitreo y acuoso predicen la retinopatia y el edema de macula con mayor precision que los factores de crecimiento endoteliales.En un reciente estudio, donde se utilizo un modelo animal de retinopatia, el uso de la EPO protegia de la apoptosis neuronal inducida por hypoxia tisular y al mismo tiempo con el tiempo aumentaba la neovascularizacion59. Por lo tanto las diferentes etapas de la nephropatia diabetica pueden determinar que la EPO muestre efectos beneficiosos o deletereos60.
Conclusion
Esta claro que la glicoproteina originalmente aislada como una hormona por sus efectos en la hematopoiesis es en realidad una citokina con caracteristicas de factor de crecimiento que ha evolucionado hasta adquirir diferentes propiedades celulares independientes de la eritropoiesis.Estos efectos de caracter no hematopoieticos pueden ser de caracter deletero.Sin embargo es necesario un mejor entendimiento de la fisiologia de esta molecula y de sus receptors lo que conllevaria a crear una molecula nueva que minimizaria estos efectos.Conocimiento que sera esencial para los clinicos de ahora y del futuro.Es cierto como se ha mencionado anteriormente, que con los estudios aleatorizados realizados con la EPO es necesaria la creacion de una hipotesis que permita el uso de los ASE minimizando efectos secundarios.Puede que mediante una terapia antihipertensiva intensiva,un tratamiento agresivo con hierro endovenoso,optimizacion de la utilizacion de oxigeno mediante la correccion de la acidosis metabolica y el suplemento con substancias relacionadas con el metabolismo energetico como la l-carnitina, vitaminas B6 y B12 y el acido folico ademas de evitar dosis elevadas de ASE ,se puedan evitar los efectos deleteros relacionados con la hypertension y la trombosis y disminuir la tendecia de aumento de el riego de mortalidad que los estudios CREATE,CHOIR y NHCT(Normal Hematocrit Cardiac Trial) entre otros, han mostrado.
Figura 1.