La encefalopatía por contraste es una complicación neurológica relacionada con el contraste utilizado en procedimientos endovasculares o tomografía computarizada (TC). Los principales factores de riesgo son la hipertensión arterial, la diabetes mellitus, la enfermedad renal crónica (ERC), contrastes hiperosmolares, cantidad de contraste infundida y su infusión directa en el territorio cerebral posterior, o patologías que cursen con daño de barrera hematoencefálica. La sintomatología es inespecífica y puede presentarse como alteración del nivel de conciencia, focalidad neurológica o crisis comiciales. El diagnóstico es de exclusión tras haber descartado los accidentes cerebrovasculares (ACV) isquémicos o hemorrágicos; el TC o la resonancia magnética (RM) son de utilidad para su diferenciación. Generalmente aparece poco tiempo tras la exposición y la sintomatología dura 48-72 h con recuperación completa, aunque se han descrito casos con persistencia de los síntomas o mayor duración. El tratamiento es la monitorización con medidas de soporte y la terapia de sustitución renal con hemodiálisis (HD) en aquellos pacientes en programa crónico. Es importante que el nefrólogo conozca esta entidad, dada la susceptibilidad del paciente en HD, así como su potencial papel terapéutico en estos pacientes.
Contrast-induced encephalopathy is a neurological complication related to contrast used in endovascular procedures or computed tomography (CT). The main risk factors are arterial hypertension, diabetes mellitus, chronic kidney disease (CKD), hyperosmolar contrasts, the amount of infused contrast and its direct infusion in the posterior cerebral territory, or pathologies with blood–brain barrier damage. Symptomatology is non-specific and may present as altered level of consciousness, neurological focality or seizures. Diagnosis is done by exclusion after ischemic or hemorrhagic stroke has been ruled out; CT or MRI are useful for differentiation. Generally, it appears shortly after exposure and the symptoms lasts 48–72 h with complete recovery, although cases with persistence of symptoms or longer duration have been described. Treatment consists of monitoring, supportive measures and renal replacement therapy (RRT) with hemodialysis (HD) in patients in chronic RRT program. It is important for the nephrologist to be aware of this entity given the susceptibility of the patient on HD as well as its potential therapeutic role in these patients.
La encefalopatía inducida por contraste (EIC), también llamada neurotoxicidad inducida por contraste, es una patología del sistema nervioso central (SNC) secundaria a la toxicidad resultante de la exposición de contrastes radiológicos en pacientes sometidos a procedimientos diagnósticos o terapéuticos basados en su utilización (por ejemplo, angiografía cerebral, tomografía computarizada [TC], cateterismo cardiaco).
La enfermedad renal crónica en estadios avanzados (ERCA), grados 4-5 según la clasificación Kidney Disease Improving Global Outcomes (KDIGO)1, con filtrado glomerular estimado (FGe) inferior a 30 mL/min, supone un factor de riesgo para la toxicidad relacionada de estos agentes, como la nefropatía por contraste, debido a su menor aclaramiento renal2. Se han reportado casos de EIC en terapia renal sustitutiva en hemodiálisis2,3 (HD), así como en pacientes con ERC sin especificar el FGe correspondiente4.
Los primeros trabajos que tratan sobre esta neurotoxicidad datan de la década de los 60 en pacientes sometidos a angiografías cerebrales5, en los que debido a su presentación clínica se bautizó como «ceguera cerebral transitoria» (CCT). Posteriormente fue descrita por especialistas alejados de la neurología, pero con uso común del contraste radiológico, concretamente, tras cateterismo cardiacos4 o TC6.
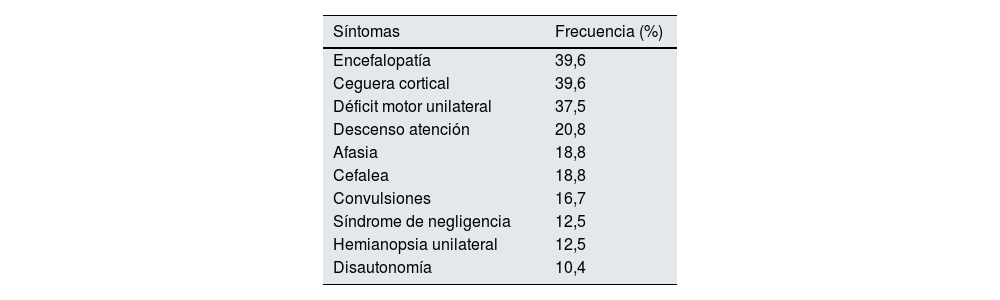
La presentación clínica es variada, desde alteración del nivel de conciencia hasta focalidad neurológica o crisis comiciales (tabla 1). Su inicio es precoz (minutos-horas) tras la exposición al medio de contraste y se resuelven en 48-72 h generalmente. Debido a la mayor permeabilidad natural de la barrera hematoencefálica (BHE) en el córtex posterior7, la sintomatología visual es la más reportada en la literatura. Algunos autores postulan una distinta presentación clínica en pacientes con ERCA8, pero no existen estudios comparativos que muestren tal diferencia.
Manifestaciones clínicas de encefalopatía inducida por contraste. Adaptado de Viganò et al.11
| Síntomas | Frecuencia (%) |
|---|---|
| Encefalopatía | 39,6 |
| Ceguera cortical | 39,6 |
| Déficit motor unilateral | 37,5 |
| Descenso atención | 20,8 |
| Afasia | 18,8 |
| Cefalea | 18,8 |
| Convulsiones | 16,7 |
| Síndrome de negligencia | 12,5 |
| Hemianopsia unilateral | 12,5 |
| Disautonomía | 10,4 |
Su incidencia es desconocida con exactitud, dada la infrecuente presentación. Un trabajo clásico de los años 70 estima una incidencia de 3,6% de todas las angiografías cerebrales9, aunque una revisión más reciente elaborada por el grupo de Li et al. que compara los casos con EIC respecto todos los pacientes sometidos a una angiografía cerebral en un periodo de 10 años en cinco centros distintos de China estima una incidencia de 0,3-1%10. Se ha descrito tras procedimientos angiográficos de distintos territorios vasculares (troncos supraaórticos espinal, torácico, coronario y abdominal), siendo los procedimientos cerebrales aquellos de mayor riesgo11.
Fisiopatología y factores de riesgoLa hipótesis más aceptada es la toxicidad directa sobre las neuronas tras una alteración de la BHE. Los mecanismos exactos son desconocidos, pero se postula que la hiperosmolaridad de estos agentes produce vasodilatación, contracción del endotelio cerebrovascular y apertura de las uniones celulares del endotelio, tal y como Rapoport expuso en sus experimentos utilizando soluciones hiperosmolares con manitol infundidas en el territorio carotídeo de ratones12; facilitando el efecto tóxico directo del contraste sobre las neuronas que, junto con ambiente hiperosmolar, conlleva un edema del tejido cerebral. Actualmente la mayoría de contrastes utilizados son de naturaleza hipoosmolar (iopamidol o iohexol, entre otros) o isoosmolar (iodixanol principalmente), con una supuesta ventaja teórica respecto los hiperosmolares, a pesar de que los denominados «hipoosmolares» presentan una osmolalidad superior a la sanguínea; sin embargo, no existen estudios comparativos entre los hiperosmolares y el resto que reflejen una incidencia menor de estos últimos, ni entre los hipoosmolares y los isoosmolares. En el caso de los contrastes hipoosmolares, la diferencia entre osmolalidades resultante afectaría a la BHE y en el caso de los isoosmolares, al no existir esta diferencia de osmolalidad, se presupone mayor toxicidad en los casos que presenten BHE dañadas por la presencia de otros factores de riesgo, junto con un posible efecto tóxico directo sobre el endotelio.
Respecto a los factores de riesgo relacionados con esta entidad, se ha descrito la insuficiencia renal por su teórico menor aclaramiento renal de los agentes utilizados. En este sentido, un trabajo realizado por el grupo australiano de Spina et al.4 revisa todos los casos de EIC tras cateterismo cardiaco hasta 2017, encontrando que la ERC se halla en 15% (8/52), por detrás de la hipertensión arterial (HTA) con 57,7% (30/52) y la diabetes mellitus con 25% (13/52). Otro trabajo realizado por el grupo japonés de Matsubara et al., en el que revisan todos los casos de EIC tras embolización de aneurismas intracraneales en su centro durante un periodo de 10 años, encuentran una incidencia de 38% (3/8) en pacientes en HD, postulando el riesgo añadido a la mayor exposición por la ausencia de eliminación renal3. La principal limitación fue que los pacientes con ERC que no realizaban HD de forma crónica fueron excluidos debido a la no realización del procedimiento por el riesgo de empeoramiento de la función renal. Por último, el trabajo de Chu et al.13 sí encuentra resultados estadísticamente significativos respecto el papel de la ERC como factor de riesgo de esta patología, con una diferencia de FGe de hasta 20 mL/min entre ambos grupos, al analizar la incidencia de EIC en pacientes con ictus isquémicos agudos a los que se realizaron trombectomía endovascular durante cinco años en dos centros terciarios de Taiwán; sin embargo, no categorizan la ERC para ver si estadios avanzados suponen mayor riesgo ni establecen un valor umbral.
En cuanto otros factores de riesgo, el trabajo de Li et al.10 no encuentra resultados estadísticamente significativos respecto la HTA o la DM al analizar los factores de riesgo de EIC en pacientes sometidos a una angiografía cerebral. Los mismos autores asumen la posible relevancia de la HTA crónica debido a su papel como disruptor de la BHE, demostrada en otras patologías como el síndrome de encefalopatía posterior reversible (PRES), afectando a las arteriolas cerebrales y promoviendo la isquemia y el edema vasogénico14. En su trabajo, Li et al. encuentran una prevalencia de 55,6% en el grupo de EIC, a diferencia de 36,8% del grupo control, a pesar de la no significación estadística. Respecto a la DM, aunque sin significancia estadística, encuentran una prevalencia de 11,1% en comparación a 6,8% del grupo control, apoyando la teoría de una mayor susceptibilidad a la isquemia y a edema cerebral secundario a episodios de hipoglucemia recurrente, debido al aumento de electrolitos intracelulares durante estos episodios, tal y como sucede en la cetoacidosis diabética15. En este sentido, un trabajo americano de 1978 que utilizó la tomografía por emisión de positrones con 18F-fluorodesoxiglucosa demostró que el córtex posterior presenta tasas de metabolismo mayores que otras áreas cerebrales16, argumento que explicaría la mayor susceptibilidad de esta área del SNC al compromiso del aporte de glucosa estímulos nocivos.
Debemos resaltar dos limitaciones del trabajo de Li et al.; primero, solo 18 pacientes (0,35%) presentaron EIC, y no se incluyeron los pacientes que debutaron con encefalopatía sin ceguera; y segundo, los pacientes con insuficiencia renal fueron excluidos y no se analizó su papel como factor de riesgo. Los únicos factores estadísticamente significativos que encontraron fueron la dosis de contraste administrada y su administración directa en la circulación posterior cerebral.
Otros factores relacionados con el paciente descritos son las enfermedades autoinmunes por el posible vasoespasmo y edema vasogénico sobre el territorio cerebral, aumentando la susceptibilidad a la neurotoxicidad por contraste10, aunque no existen estudios específicos en ese sentido. La EIC parece ser una reacción idiosincrática, por lo que la exposición repetida no supone un factor de riesgo para desarrollar EIC, debido a exposiciones previas o posteriores asintomáticas al episodio en pacientes con EIC17.
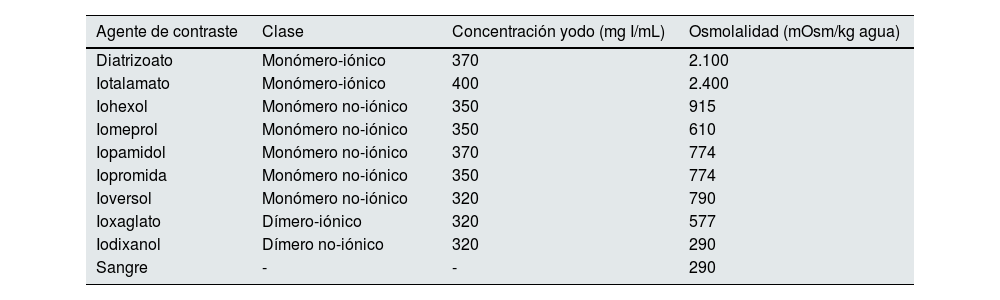
En cuanto a factores relacionados con la técnica o el contraste utilizado, solo Li et al.10 hallan un resultado significativo acerca de la infusión directa sobre el territorio posterior en comparación con la circulación cerebral anterior, aunque ya previamente existía la creencia del riesgo aumentado por la mayor permeabilidad de la BHE en dicho territorio. Respecto al contraste, este grupo encuentra una asociación con mayores dosis, pero no existen trabajos que recomienden una cantidad máxima, aunque proponen una dosis no superior de 200 cc o 300 cc si su administración es sistémica18, recalcando que la infusión intracraneal debe acompañarse de menores dosis19, aunque se han reportado casos de EIC con hasta 25 cc infundidos en territorio carotídeo20. Por último, los contrastes radiológicos se clasifican según su composición iónica y osmolalidad. No hay estudios que comparen la incidencia de EIC entre contrastes iónicos y los no-iónicos (más hipoosmolares, tabla 2). Teóricamente, los contrastes hipoosmolares y no-iónicos suponen menor riesgo de desarrollar EIC, pero la mayoría de los casos descritos corresponden con este tipo de agentes, al ser los más utilizados en estas intervenciones20.
Características de algunos agentes de contraste. Comparación de osmolalidad respecto la sanguínea. Adaptado de Spina et al.4
| Agente de contraste | Clase | Concentración yodo (mg I/mL) | Osmolalidad (mOsm/kg agua) |
|---|---|---|---|
| Diatrizoato | Monómero-iónico | 370 | 2.100 |
| Iotalamato | Monómero-iónico | 400 | 2.400 |
| Iohexol | Monómero no-iónico | 350 | 915 |
| Iomeprol | Monómero no-iónico | 350 | 610 |
| Iopamidol | Monómero no-iónico | 370 | 774 |
| Iopromida | Monómero no-iónico | 350 | 774 |
| Ioversol | Monómero no-iónico | 320 | 790 |
| Ioxaglato | Dímero-iónico | 320 | 577 |
| Iodixanol | Dímero no-iónico | 320 | 290 |
| Sangre | - | - | 290 |
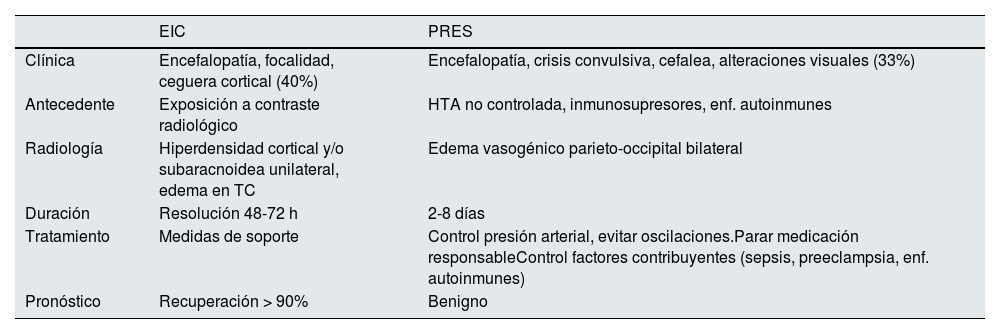
El diagnóstico de la EIC se realiza por exclusión de las patologías más prevalentes y de mayor peligro, principalmente los ACV isquémicos o hemorrágicos. Otra etiología que descartar es el PRES, el cual comparte bases fisiopatológicas y su diferenciación resulta compleja (tabla 3). Otras etiologías a descartar son las infecciones, vasculitis o trombosis venosa21.
Diferencias entre encefalopatía inducida por contraste (EIC) y síndrome de encefalopatía posterior reversible (PRES)
| EIC | PRES | |
|---|---|---|
| Clínica | Encefalopatía, focalidad, ceguera cortical (40%) | Encefalopatía, crisis convulsiva, cefalea, alteraciones visuales (33%) |
| Antecedente | Exposición a contraste radiológico | HTA no controlada, inmunosupresores, enf. autoinmunes |
| Radiología | Hiperdensidad cortical y/o subaracnoidea unilateral, edema en TC | Edema vasogénico parieto-occipital bilateral |
| Duración | Resolución 48-72 h | 2-8 días |
| Tratamiento | Medidas de soporte | Control presión arterial, evitar oscilaciones.Parar medicación responsableControl factores contribuyentes (sepsis, preeclampsia, enf. autoinmunes) |
| Pronóstico | Recuperación > 90% | Benigno |
Enf.: enfermedad; HTA: hipertensión arterial; TC: tomografía computarizada.
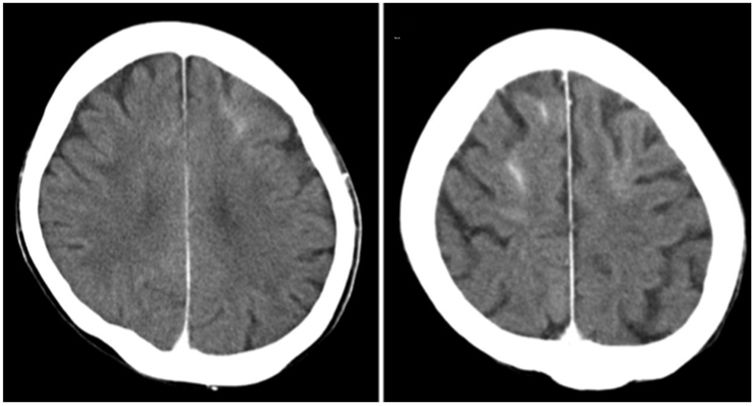
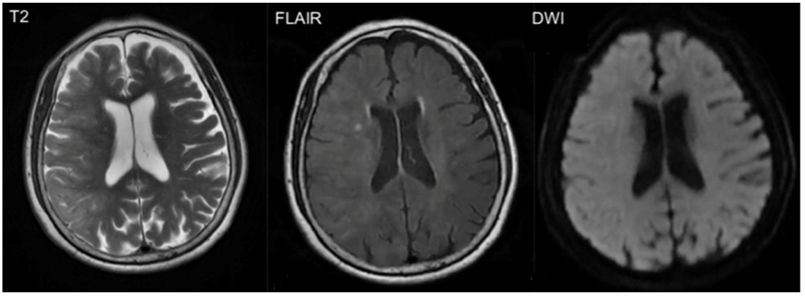
La primera prueba aconsejada, tras una exploración neurológica detallada, generalmente es el TC cerebral sin contraste, en el cual se puede observar edema cerebral y realce cortical de las áreas afectas o del espacio subaracnoideo22, aunque también puede haber ausencia de signos radiológicos20. Especialmente el TC dual energy permite diferenciar si las hiperdensidades observadas corresponden a contraste o hemorragia12. Los casos reportados de pacientes en HD no presentan signos radiológicos distintos (fig. 1). Otra prueba útil es la RM por su capacidad de evidenciar lesiones isquémicas, principalmente con la secuencia DWI mediante la restricción en la difusión producida por la isquemia; la secuencia FLAIR identifica las áreas edematizadas22 (fig. 2). Otro examen que ayuda a la diferenciación, especialmente respecto la hemorragia subaracnoidea, es el análisis del líquido cefalorraquídeo (LCR), donde la ausencia de xantocromía o hematíes iría en contra de esta, así como una concentración de contraste superior a la sanguínea iría de la mano de la extravasación del mismo4.
Tomografía computarizada (TC) cerebral sin contraste de mujer de 63 en hemodiálisis sometida a tercera embolización endovascular de aneurisma de la arteria comunicante anterior íntegro con hemiparesia izquierda posprocedimiento (sometida a dos intervenciones previas sin incidencias en el pasado). TC muestra hiperdensidad cortical en el surco de ambos lóbulos frontales. Matsubara et al.3 Con permiso de los autores.
Resonancia magnética (RM) de mujer de 84 años con hemiplejía izquierda y desviación derecha de la mirada con pérdida de conciencia tras cateterismo cardiaco. RM a las dos horas del procedimiento muestra borramiento de surcos a nivel parieto-occipital derecho respecto a contralateral con hiperintensidad córtico-subcortical a ese nivel en T2 y FLAIR, sugestivo de edema cerebral y ausencia de lesiones isquémicas en DWI. Meng-Ru et al.19 Con permiso de los autores.
No existen criterios diagnósticos unificados de la EIC. Solo el grupo taiwanés de Chu et al.13 estableció unos criterios diagnósticos en las primeras 24 h del cuadro clínico en pacientes con clínica neurológica previa (sometidos a trombectomía endovascular tras ictus isquémico agudo), combinando datos clínicos (aumento de cuatro o más puntos en la National Institutes of Health Stroke Scale [NIHSS], empeoramiento de la escala de Glasgow en dos o más puntos, o mejoría retardada tras la trombectomía no explicada por el área isquémica original, ictus recurrente o transformación hemorrágica) y radiológicos (cambios edematosos más allá del área isquémica junto con realce por contraste); no obstante, estos criterios no han sido validados en ninguna cohorte externa. Tampoco hay datos que sugieran criterios diagnósticos diferentes en pacientes con ERCA.
Quizás la patología más difícil de discernir sea el PRES, cuya base consiste en un edema vasogénico cerebral secundario a una alteración de la BHE en el contexto de HTA pronunciada o fluctuaciones importantes de la presión arterial, enfermedades autoinmunes, inmunosupresión o enfermedad renal. Los síntomas neurológicos son inespecíficos y pueden solaparse con la EIC, aunque las mayores series recogen que la encefalopatía, las convulsiones y la cefalea son los más prevalentes, a diferencia de la EIC (tabla 3). A nivel radiológico, clásicamente se evidencia edema en los lóbulos parieto-occipitales de ambos hemisferios, pero no es infrecuente la afectación de otras áreas como el lóbulo frontal o temporal; la sustancia blanca subcortical también se ve afectada por el edema que generalmente es asimétrico, pero casi siempre bilateral23. Así, la principal ayuda para el diagnóstico diferencial será el antecedente relevante del uso de contraste yodado y la presencia de hiperdensidades en el TC a favor de la EIC.
Tratamiento y prevenciónNo existen ensayos clínicos que comparen distintas estrategias terapéuticas para la EIC, solo datos observacionales y experiencias clínicas en las que el rango terapéutico va desde la mera observación con soporte vital hasta la terapia renal sustitutiva (TRS) de urgencia.
En la revisión sistemática realizada por Quintas-Neves et al.24 en pacientes con EIC tras angiografías del SNC con pruebas de imagen realizadas posteriormente, encuentran que el tratamiento más utilizado añadido al de soporte es la corticoterapia (50%), tal vez por su efecto beneficioso sobre el edema cerebral indicado en otras patologías, para disminuir la presión intracraneal; otros tratamientos son la fluidoterapia intensa (37,5%), manitol (18,8%), antiepilépticos (10,4%), utilizados solo en aquellos casos con crisis convulsivas, y calcioantagonistas (10,4%). Sin embargo, no hallan ninguna diferencia respecto a la recuperación clínica, concluyendo que no existen recomendaciones más allá de la monitorización y el tratamiento de soporte.
En otra revisión sistemática sobre EIC tras cateterismo cardiaco4 recogen únicamente dos casos clínicos de pacientes con ERC en HD (2/52) desde 1970 hasta 2017, en los que precisamente fueron los únicos que recibieron TRS en forma de HD como soporte con mejoría clínica posterior. También se han descrito casos en angiografía cerebral de pacientes en HD que se someten a una sesión de urgencia tras la presentación clínica con buena evolución25. Asimismo, Matsubara et al.3 describieron tres casos de EIC en pacientes en terapia crónica de HD que presentaron EIC tras embolización de aneurismas cerebrales, a los que se realizó una sesión de HD al día siguiente con mejoría clínica. Por lo tanto, la evidencia hasta el momento reserva el uso de TRS en forma de HD a aquellos pacientes que se encuentren de forma crónica en la misma, no existiendo datos que apoyen la indicación para pacientes con función renal preservada o con ERCA.
Respecto a las estrategias preventivas no hay trabajos que las evalúen directamente. Únicamente se han extraído conclusiones secundarias de aquellos que se proponen averiguar los factores de riesgo para la EIC, siendo la minimización de dosis de contraste el único consejo actualmente en vigor10, así como la clásica recomendación de una correcta hidratación para evitar otras toxicidades relacionadas.
PronósticoLa evolución de esta patología es habitualmente buena con recuperación neurológica completa entre 24-72 h10, pero se han descrito casos con una duración de hasta 10 días con posterior recuperación4. De los EIC tras cateterismo cardiaco registrados, se recuperó 96% (50/52) y dos pacientes no recuperaron completamente el cuadro; mientras que en los casos descritos tras angiografías del SNC24 esta recuperación fue de 89,6% (43/48), cuatro con mejoría parcial y un paciente fallecido. Los pacientes en HD presentaron todos recuperación completa tras la sesión pertinente de TRS3. No hay datos que sugieran un peor pronóstico o una evolución más tórpida de los pacientes con ERCA.
Por último, se han descrito casos en el pasado de EIC fatal demostrada por autopsia tras aortografía (3/8) o angiografía cardiaca (5/8), y en todos se utilizaron contrastes hiperosmolares, los cuales ya no se utilizan en la actualidad. Solo encontramos un caso de EIC fatal secundario a angiografía carotídea con iopamidol (baja osmolalidad), con descenso del nivel de conciencia 14 h tras la intervención y signos clínicos compatibles con herniación cerebral con mala evolución posterior26. Debemos recalcar que es el único caso descrito de una patología infrecuente con más de 90% de recuperación íntegra.
FinanciaciónLos autores declaran la ausencia de financiación para esta investigación.
Conflicto de interesesLos autores declaran ausencia de conflicto de interés para esta investigación.