Las alteraciones en el sentido del olfato (disosmia, anosmia, hiposmia) son frecuentes en los pacientes con enfermedad renal crónica; sin embargo, hasta el momento actual las causas, consecuencias y tratamiento de estas alteraciones han sido poco abordadas. Los pacientes con enfermedad renal crónica sin tratamiento de diálisis muestran disminución en la percepción olfativa y existe controversia sobre si estas alteraciones se corrigen con la diálisis. El grado de percepción olfativa es similar cuando se compara la población en diálisis peritoneal y en hemodiálisis. El trasplante renal corrige estos déficits olfativos. Una de las probables consecuencias de esta afección es el impacto en el estado nutricional del paciente.
Alterations in the sense of smell (dysosmia, anosmia, hyposmia) are frequently experienced by patients with chronic kidney disease. However, currently, the aetiology and consequences are poorly understood, with no effective treatments available to address such impairment. In general, the capacity of olfactory perception is affected in patients with chronic kidney disease (even in those who have not undergone dialysis therapy), and whether these alterations improve after dialysis is disputed. Patients in peritoneal dialysis and haemodialysis have the same olfactory perception defects. Kidney transplantation improves olfactory perception, and one important consequence of such impairment is the potential impact on the patient's nutritional status.
Las alteraciones en el sentido del olfato como es la disminución de la sensibilidad y la percepción a los olores (disosmia, anosmia, hiposmia) son frecuentes en la población y por lo general son poco reconocidas. La prevalencia de estas alteraciones se incrementa de manera importante en adultos mayores a partir de los 70 años. En Estados Unidos y de acuerdo con la encuesta National Health and Nutrition Examination Survey (NHANES III), la prevalencia de disosmia en la población general es del 12,4%, mientras que el 3% presenta anosmia. Sin embargo, a partir de los 80 años, el 39% presenta algún grado de disfunción olfativa1.
Además de la edad, la percepción del olor se ve afectada por diversas enfermedades (diabetes, enfermedades neurodegenerativas, enfermedades de las vías respiratorias, cáncer, etc.), traumatismos, ingesta de medicamentos, exposición a herbicidas, solventes y radiación, y el estado nutricional de las personas2.
El objetivo de la presente revisión es analizar la prevalencia, fisiopatología y tratamiento de los trastornos olfativos en pacientes con enfermedad renal crónica (ERC). Existen actualmente pocos estudios que permitan entender la etiología y fisiopatología de las alteraciones olfativas en este grupo de pacientes, por lo que hasta el momento no hay tratamientos adecuados para la atención de este problema.
Percepción olfativaLa cavidad nasal está revestida con receptores somatosensoriales (dolor, calor, presión) de los nervios trigémino, glosofaríngeo y vago; sin embargo, las señales quimiosensoriales están mediadas únicamente por el nervio olfatorio.
Las moléculas de olor que se encuentran en el aire entran a la nariz por las fosas nasales donde se disuelven en las secreciones de la mucosa que recubren la cavidad nasal. Posteriormente estas moléculas se unen a los receptores de las neuronas sensoriales olfatorias. El número de moléculas de olor en el medio ambiente es mayor que el número de receptores que tenemos en la nariz. En el ser humano, el 3% de todos los genes codifican para receptores olfatorios, existiendo aproximadamente 450 tipos de receptores olfatorios. Por ello, una molécula puede estimular una combinación de receptores y así crear una representación única en el cerebro. El cerebro registra cada una de estas representaciones como un olor particular.
El procesamiento primario de señales olfativas se produce en el bulbo olfatorio. Los axones no mielinizados de las neuronas sensoriales olfatorias ascienden a través de las perforaciones de la placa cribiforme del hueso etmoides para originar la sinapsis en el bulbo olfatorio. Son alrededor de 10 millones de neuronas las que procesan los olores en el bulbo olfatorio3. Después de pasar por el bulbo olfatorio, la información olfativa se transmite a centros cerebrales superiores dentro de la corteza olfatoria primaria (incluido el núcleo olfatorio anterior, el tubérculo olfatorio, la corteza piriforme y la corteza periamigdaloide) y del sistema límbico (hipotálamo, hipocampo, amígdala), lo que permite procesar múltiples señales para formar una percepción olfativa4,5.
Valoración de la función olfatoriaLa mayoría de las pruebas para valorar la función olfatoria se basan en la identificación y discriminación de una variedad de olores. En general el estudio de la capacidad olfativa se lleva a cabo mediante la realización de 3 pruebas: a) valoración del umbral del olor, en la cual se determina la concentración mínima necesaria para que un olor sea percibido por una persona; b) discriminación olfativa, en la que se evalúa la capacidad de una persona para diferenciar un olor de otro diferente, y c) identificación del olor, en donde se determina si la persona puede reconocer un olor.
La evaluación de la capacidad olfativa es compleja ya que la simple identificación de olores requiere en gran medida de algunas habilidades verbales del sujeto. Además, las pruebas de identificación de olores tienen una fuerte connotación cultural ya que no todos los olores son recocidos de la misma forma entre las personas (connotación cultural de los olores)6,7.
Olfato en la enfermedad renal crónicaEl sentido del olfato es de suma importancia para la comunicación, para establecer relaciones entre individuos, para detectar y apreciar los alimentos, para la detección oportuna de sustancias tóxicas, etc. La percepción del olor disminuye con la edad y es afectado por medicamentos, desnutrición y enfermedades como la diabetes mellitus. Los estudios realizados en pacientes con ERC han demostrado que en esta población los trastornos del sistema olfativo son frecuentes (tabla 1).
Resumen de los estudios de función olfatoria en pacientes con enfermedad renal crónica
| Autor | Sujetos (n) | DM2 (%) | Umbral | Discriminación | Identificación | Anosmia(%) |
|---|---|---|---|---|---|---|
| Schiffman et al.10 | 27(HD=11, C=16) | ND | Disminución en pacientes en HD | ND | ||
| Vreman et al.8 | 81(HD=26, ERC=7, C=48) | ND | No significativamente elevado en pacientes con ERC | ND | ||
| Griep et al.9 | 101(HD=38, DP=16, TR=28, ERC=19) | ND | Déficit en pacientes con ERC, HD y DPMejoría en pacientes con TR | ND | ||
| Frasnelli et al.11 | 79(HD=49, ERC=15, C=15) | ND | Sin cambios en relación con población control | Disminución | Déficit en pacientes con ERC y HD | 4,7 |
| Raff et al.12 | 49(HD=31, C=18) | 48 | Sujetos control mejor que HD | ND | ||
| Landis et al.13 | 52(HD=20, DP=8, C=24) | ND | Déficit en pacientes con HD y DPa | Pacientes en DP mejor score que HD | ND | |
| Koseoglu et al.14 | 107(ERC=30, HD=38, DP=15, C=24) | 0 | DP mejor que HD mejor que ERC | Déficit en pacientes con ERC, HD y DP | Pacientes en DP mejor score que HD. Ambos grupos mejor que ERC | 8,4 |
| Nigwekar et al.15 | 161(ERC=36, HD=94, DP=6, C=25) | 50 | Déficit en pacientes con HD y DPNormal en ERC | Disminución en ERC y enfermedad renal terminal | 10 |
C: control sano; DP: diálisis peritoneal; ERC: enfermedad renal crónica; HD: hemodiálisis; TR: trasplante renal.
Vreman et al.8 en uno de los primeros estudios realizados para valorar el sentido del olfato en población con ERC (hemodiálisis [HD]), encontraron que la percepción olfativa se encontraba disminuida (aunque no significativamente) en los pacientes masculinos; pero este déficit no se relacionó con la concentración de cinc en sangre y cabello (tabla 2).
Resumen de las variables que pueden afectar la función olfatoria en pacientes con enfermedad renal crónica
| TFG | Clara asociación entre disminución de la TFG y mayores déficits olfatorios |
| Kt/V | Aparentemente sin asociación con alteraciones olfatorias |
| Urea | Estudios contradictorios:Griep et al.10: asociación entre niveles de urea y déficits olfatorios pero otros estudios no han corroborado esta asociación13 |
| Desnutrición | Déficits olfatorios asociados con marcadores de desnutrición (p. ej. SGA, TCP) |
| PCR | Hallazgos contradictorios:Raff et al.12 asociación entre niveles de PCR y déficits olfatoriosKoseoglu et al.14 no relación |
| Toxinas urémicas | Déficits olfatorios no asociados con toxinas urémicas (P-cresol, etc.)12 |
| Tratamiento | Estudios contradictorios si la diálisis mejora los déficits olfatorios; en algunas pruebas olfatorias, los pacientes en DP tienen menor déficit olfatorio que pacientes en HDLandis et al.13: Identificación y umbral al ácido acético mejoran posthemodiálisisGriep et al.:10 No mejoría con el tratamiento (isoamil acetato [plátano/pera]) |
DP: diálisis peritoneal; HD: hemodiálisis; PCR: proteína C reactiva; SGA: valoración global subjetiva; TCP: tasa de catabolismo proteico; TFG: tasa de filtrado glomerular.
Griep et al.9 estudiaron a 101 pacientes con ERC (38 en HD, 16 con diálisis peritoneal [DP], 28 con trasplante renal y 19 sin diálisis con tasa de filtrado glomerular≤30ml/min), y encontraron que el umbral olfativo fue menor en pacientes con DP, HD y ERC con tasa de filtrado glomerular≤30ml/min. Los resultados de las pruebas olfativas en los sujetos trasplantados fueron similares al grupo control y no hubo diferencia entre los sujetos en HD vs. DP; en pacientes en HD la percepción olfativa no tuvo cambios entre la evaluación pre- y posdiálisis. Los niveles séricos de urea y fósforo estuvieron inversamente relacionados con la capacidad olfativa de los sujetos, lo cual indica que el sistema olfativo pudiera ser afectado por la elevada concentración de estos elementos. Sin embargo, el hecho de que solamente mejore la percepción olfativa por el trasplante y no por la diálisis indica una regulación compleja de esta función.
Frasnelli et al.11 encontraron déficit olfativo en el 56% de 49 pacientes con ERC en HD. En relación con las pruebas de olfatometría realizadas, el 11% de los pacientes tuvieron un incremento en el umbral olfativo, el 38% reducción de la discriminación de los olores y el 48% déficits en la identificación del olor.
Raff et al.12 estudiaron la relación entre las alteraciones en las pruebas olfativas, los parámetros clínicos de desnutrición y niveles de toxinas urémicas como la monometilamina, etilamina, indoxil sulfato, y P-cresol sulfato en 31 pacientes con ERC en HD. El estudio demostró la asociación entre la disfunción olfativa, mayores niveles de la proteína C reactiva y la desnutrición de los pacientes. No se encontró correlación entre el grado de disfunción olfativa y los niveles séricos de albúmina, colesterol y toxinas urémicas. Los resultados de este estudio muestran la contribución del proceso de desnutrición e inflamación en las alteraciones en la función olfativa en pacientes con ERC.
Landis et al.13 realizaron pruebas olfativas antes y después de cada sesión de HD con el objetivo de observar si este procedimiento modificaba la función olfativa, y mostraron que la capacidad olfativa evaluada por las pruebas de función olfativa mejoraron después de recibir la sesión. Además, el estudio reportó mayor deterioro en la función olfativa en pacientes en HD que en pacientes en DP.
Por otro lado, Koseoglu et al.14 en pacientes no-diabéticos en diferentes estadios de la ERC (ERC sin diálisis, HD y DP) reportaron mayor deterioro de la función olfatoria en pacientes en DP.
Nigwekar et al.15 demostraron un mayor déficit olfativo en las pruebas de identificación y discriminación, con umbral olfativo normal en pacientes con ERC comparados con el grupo control. En este estudio también se demostró la correlación entre el déficit olfativo y el estado nutricional de los pacientes.
Hasta el momento es difícil concluir si el déficit olfatorio presenta un deterioro progresivo de acuerdo con la progresión del daño renal, tampoco hay evidencia concluyente de la modalidad de diálisis más efectiva para mejorar el déficit en la función olfativa. Por otro lado, los diferentes estudios muestran evidencia de la relación entre el estado nutricional y la función olfativa en pacientes con ERC.
La desnutrición se encuentra asociada con la disminución en niveles séricos de vitaminas (p. ej. vitamina B12) y oligoelementos que también afectan la función olfativa de los pacientes, asimismo, esta disminución en la capacidad olfativa predispone a menor ingesta de alimentos y mayor desnutrición13,15.
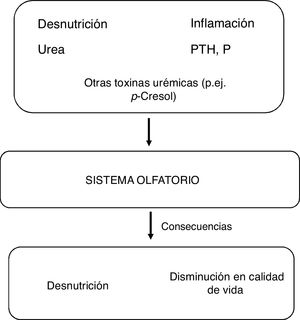
FisiopatologíaLos estudios dirigidos a conocer los mecanismos de daño en el sistema olfativo en ERC son escasos, y es posible que el deterioro olfativo se relacione con daño neuronal asociado con el fallo renal (fig. 1). Alteraciones en la función olfativa representan un biomarcador no invasivo de disfunción neurológica ya que las toxinas urémicas pueden dañar la integridad del epitelio olfatorio, del bulbo olfatorio y áreas centrales de procesamiento central del olfato. Además de la acumulación de toxinas urémicas, otros factores causales de daño neuronal son el estrés oxidativo, la neuroinflamación y alteraciones en la barrera hematoencefálica.
Otro factor capaz de afectar la función olfativa en el paciente son los cambios y disminución del flujo sanguíneo cerebral en pacientes con ERC, los cuales están bien descritos, y se caracterizan por presentar engrosamiento de la capa íntima arteriolar, disfunción endotelial, calcificación vascular y disfunción en la autorregulación de los vasos sanguíneos16.
TratamientoEscoger la diálisis adecuada y mejorar la depuración de las toxinas urémicas son parte del tratamiento para mejorar los síntomas asociados a la neuropatía urémica; sin embargo, los reportes respecto a la mejoría del sistema olfativo con el tratamiento de diálisis son controversiales ya que no todos los estudios han demostrado mejoría posdiálisis12. También, se desconoce si la modalidad de diálisis (HD, DP) influye de manera positiva en la función olfativa de los pacientes10,13.
Por otro lado, hay estudios que han demostrado que los pacientes con trasplante renal recuperan la función olfativa en un grado similar al de los grupos control; esto se debe a la alta plasticidad y capacidad de recuperación de la mucosa y neuronas olfatorias10. Uno de los tratamientos experimentales que se han propuesto para mejorar la función de la mucosa olfatoria es la teofilina. La teofilina es un activador de la fosfodiesterasa que incrementa el nivel intracelular del AMPc e induce activación de transportadores de membrana en conjunto con activación de la V-ATPase. Un pequeño estudio realizado en 7 pacientes con ERC en HD y déficit olfativo demostró la utilidad de la teofilina intranasal en corregir las alteraciones del tracto respiratorio en el 70% de ellos15.
Función de los receptores olfatorios y riñón (el olor del riñón)Los receptores olfatorios son receptores acoplados a proteínas G, se encuentran localizados en los cilios de las neuronas sensoriales y exhiben gran sensibilidad para los diversos odorantes volátiles. Debido a que el epitelio renal está en contacto continuo con una diversidad de sustancias químicas, el riñón es un órgano ideal para tomar ventaja de las funciones sensoriales de estos receptores. Se ha demostrado la presencia de receptores olfatorios en el riñón entre otros órganos extraolfatorios, pero se desconoce la localización en la nefrona de la gran mayoría de estos receptores17. Asimismo, la mayoría de los receptores olfatorios son considerados como receptores «huérfanos» («orphan receptors»)) ya que hasta el momento se desconoce su ligando18.
Recientemente, estudios realizados por Pluznick et al.19 han demostrado que estos receptores pueden tener una función importante en la secreción de renina, regulación de la filtración glomerular y procesos de reabsorción tubular. El receptor Olfr78 se localiza en la arteriola glomerular aferente; este receptor es activado por ácidos grasos de cadena corta como el acetato y el propionato, y es probable que regule la presión arterial mediada por renina ya que ratones Olfr78 -/- tienen concentraciones bajas de renina y presión arterial normal. Los ácidos grasos de cadena corta son sintetizados por la microbiota intestinal, y análisis funcionales han demostrado que la disminución de bacterias productoras de ácidos grasos de cadena corta, con disminución en los niveles de acetato, se han asociado al desarrollo de hipertensión arterial, de tal forma que esta clase de receptores podrían estar relacionados con los cambios de presión arterial mediados por la microbiota intestinal20. Los agonistas relacionados estructuralmente OR51E1 y OR11H7 activan a la adenil-ciclasa e incrementan el flujo intracelular de calcio en la mácula densa. La adenil-ciclasa 3 [AC3] es una isoforma de la adenil-ciclasa indispensable en las vías de señalización olfativas ya que ratones AC3 null -/- carecen de capacidad olfativa. Es interesante la colocalización en riñón de la AC3 con receptores-asociados a proteínas G en la mácula densa y túbulo distal. Los ratones AC3 null -/- no presentan cambios en su presión arterial, pero sí disminución en la concentración plasmática de renina21.
Otros receptores olfatorios como el Olfr1393 han demostrado desempeñar un papel importante en la regulación de la excreción urinaria de glucosa, ya que regula la expresión del SGLT 1 en túbulo proximal. El ratón Olfr1393 null -/- tiene disminución en la expresión tubular del SGLT-2, esto genera glucosuria euglucémica22, y en estos ratones con diabetes se ha demostrado disminución de la progresión de daño renal23.
ConclusiónLos déficits olfativos son frecuentes en la población con ERC, pero muchos aspectos de su fisiopatología se desconocen. Se conoce ampliamente el papel de la percepción olfativa en la ingesta, por lo que un deterioro de esta función podría promover una mala nutrición del paciente. Hasta la fecha, no existe un tratamiento establecido para mejorar la función olfativa en pacientes con ERC pero el trasplante renal revierte estos déficits. Receptores olfatorios se encuentran localizados también en el riñón y tienen funciones relacionadas con el control de la presión arterial y excreción de glucosa.
- •
Las alteraciones en la función olfativa de los pacientes con ERC en prediálisis, DP y HD son frecuentes, aunque poco reconocidas.
- •
Las pruebas más frecuentes realizadas para valorar función olfativa son: umbral, discriminación e identificación del olor.
- •
Una de las consecuencias más importantes de los déficits olfativos es su asociación con el estado nutricional de los pacientes.
- •
El efecto de la HD en el olfato es contradictorio, ya que no todos los estudios han demostrado corrección del déficit con el tratamiento.
- •
El trasplante renal corrige la disosmia.
- •
Los receptores olfatorios localizador en el riñón tienen funciones relacionadas con el control de la presión arterial y excreción de glucosa.
Los autores declaran no tener conflicto de intereses.
Los autores agradecen la revisión del manuscrito por parte de la M.Sc. Olga Cuenca.