Definido como la sensación desagradable que provoca el deseo de rascarse, el prurito es el síntoma cutáneo más frecuente asociado a la uremia, pudiendo aparecer en casi la mitad de los pacientes con enfermedad renal crónica (ERC) avanzada. Más allá de su repercusión directa sobre la calidad de vida, el prurito asociado a la ERC (Pa-ERC) es un predictor independiente de mortalidad que además ejerce un efecto sinérgico con otros síntomas también relacionados con la calidad de vida, como la depresión y el insomnio. Aunque se han propuesto diferentes mecanismos para explicar su origen, la etiopatogenia del Pa-ERC sigue sin conocerse por completo. Dado que se han identificado nuevas dianas terapéuticas y recientemente varios ensayos clínicos han mostrado resultados prometedores, nuestra comprensión actual de las interrelaciones se ha ampliado significativamente, considerando multifactoriales los mecanismos fisiopatológicos subyacentes al Pa-ERC. En la presente revisión se discuten los potenciales factores desencadenantes de prurito en el paciente con ERC, incluyendo las hipótesis sobre la xerosis cutánea, el acúmulo de toxinas urémicas, la desregulación del sistema inmune y la inflamación sistémica, la neuropatía urémica y los desequilibrios en el sistema opioide endógeno, así como otras causas no urémicas de prurito, con el objetivo de orientar al clínico para realizar un adecuado abordaje etiopatogénico del Pa-ERC en su día a día.
Defined as the unpleasant sensation that causes the desire to scratch, pruritus is the most common skin symptom associated with uremia and appears in almost half of patients with advanced chronic kidney disease (CKD). Beyond its direct impact on quality of life, CKD-associated pruritus (CKD-aP) is an independent predictor of mortality that also has a synergistic effect with other quality of life-related symptoms, such as insomnia, depression, and anxiety. Although different mechanisms have been proposed to explain the origin of Pa-ERC, its etiopathogenesis is still not fully understood. Since new therapeutic targets have been identified and several clinical trials have recently shown promising results, our current understanding of the interrelationships has expanded significantly and the pathophysiological mechanisms underlying CKD-aP are now considered to be multifactorial. The potential triggers of pruritus in patients with CKD are discussed in this review, including hypotheses about skin xerosis, accumulation of uremic toxins, dysregulation of the immune system and systemic inflammation, uremic neuropathy, and imbalances in the endogenous opioid system. Other non-uremic causes of pruritus are also discussed, with the aim of guiding the physicians to apply an adequate etiopathogenic approach to CKD-aP in their day-to-day clinical practice.
El prurito se define como la desagradable sensación de picazón en la piel, bien sea en un área concreta, bien generalizada a todo el cuerpo, que provoca ganas de rascarse1,2. El prurito urémico es el síntoma cutáneo más común en pacientes con enfermedad renal crónica (ERC), sobre todo en estadios avanzados de la enfermedad, y aunque se le conoce así, como prurito urémico, el hecho de que no se conozca una relación directa causa-efecto con la uremia (ya que no se suele dar en pacientes que presentan episodios de fracaso renal agudo) hace más preciso referirse a él como prurito asociado a la ERC (Pa-ERC), término que cada vez se utiliza con más frecuencia al hablar de esta dolencia3.
La presentación clínica del Pa-ERC es variable, afectando generalmente a zonas grandes de la piel de manera discontinua y simétrica, siendo más sintomático por la noche4. La cara, el pecho y las extremidades son las áreas más comúnmente reportadas, aunque puede llegar a ser generalizado hasta en el 25-50% de los pacientes que lo padecen5. A diferencia de las causas dermatológicas del prurito crónico, el Pa-ERC no cursa con alteraciones cutáneas primarias, aunque puede coexistir con xerosis hasta en el 50-80% de los pacientes y con el tiempo se pueden producir alteraciones cutáneas secundarias como excoriaciones o prurigo nodularis a consecuencia del rascado crónico6,7. En los pacientes en hemodiálisis (HD), hasta el 25% refieren un aumento de intensidad del prurito durante la sesión de diálisis o inmediatamente después de ella8,9. Otros factores desencadenantes descritos, además de la sesión de HD, son el frío, el calor, ducharse, realizar actividades físicas o situaciones de estrés. Desafortunadamente, la mayoría de los pacientes con Pa-ERC lo padecen durante meses o incluso años9,10.
Prevalencia y consecuencias clínicasEl Pa-ERC es un síntoma muy frecuente cuya prevalencia aumenta conforme avanza el estadio de función renal. En los estadios prediálisis se ha observado hasta un 24% de prevalencia11, aumentando hasta un 40-55% en los pacientes en diálisis12,13. Su impacto negativo sobre la calidad de vida es muy importante, y se le relaciona con la aparición de alteraciones del sueño, ansiedad, depresión y problemas para mantener la actividad física y laboral habituales14–18, así como con un aumento de la mortalidad de los pacientes que lo presentan19,20. A pesar de su trascendencia clínica, el Pa-ERC es una afección infradiagnosticada y con un abordaje terapéutico poco estandarizado y muchas veces subóptimo. En un análisis del DOPPS se evidenció que hasta el 69% de los médicos no investigaban activamente la posibilidad de que sus pacientes tuvieran prurito, mientras que casi el 20% de los pacientes que lo padecían no lo comentaban con su equipo médico12. Más recientemente, un estudio realizado a través de la página web de la Sociedad Española de Nefrología ha permitido validar estos resultados21. Tras analizar la percepción y práctica habitual de 135 nefrólogos españoles encuestados de manera anónima, se confirma como el Pa-ERC sigue siendo en nuestro medio un trastorno infradiagnosticado, no codificado y con un alto grado de desconocimiento acerca de su prevalencia, fisiopatología y abordaje terapéutico21.
Esta aparente falta de interés en el diagnóstico y el manejo del Pa-ERC puede explicarse al menos en parte por el desconocimiento de los mecanismos exactos subyacentes al Pa-ERC por parte del clínico, lo que limita su capacidad de realizar un abordaje etiopatogénico para identificar y tratar a muchos de los pacientes afectados por el prurito12. Sin embargo, aunque las relaciones moleculares precisas en la fisiopatología del prurito urémico siguen sin estar claras, gracias a los resultados prometedores de los últimos ensayos clínicos y la identificación de nuevas dianas terapéuticas, nuestra comprensión actual de la etiopatogenia del Pa-ERC se ha ampliado significativamente22. Aunque en una reciente revisión general sobre el Pa-ERC se mencionan brevemente los potenciales mecanismos fisiopatológicos de esta dolencia23, creemos necesaria una revisión en profundidad de dichos mecanismos. Este artículo pretende resumir el conocimiento actual sobre la fisiopatología del prurito en el paciente con ERC, con el objetivo de orientar al clínico para realizar un adecuado abordaje etiopatogénico del Pa-ERC en su día a día.
Recomponiendo las piezas del puzleLa fisiopatología del Pa-ERC es compleja y sigue sin estar del todo aclarada1,2,10,24. En ausencia de modelos experimentales convincentes para estudiar el prurito, nuestra comprensión de su etiopatogenia deriva de múltiples fuentes heterogéneas, en ocasiones contradictorias5. Dichas fuentes incluyen asociaciones epidemiológicas (y no necesariamente causales) entre el Pa-ERC y otras manifestaciones de la ERC, como el hiperparatiroidismo secundario o el acúmulo de toxinas urémicas; estudios que comparan el medio inmunoquímico de la piel en pacientes con ERC con y sin Pa-ERC; y las inferencias sobre los mecanismos subyacentes a la aparición del prurito obtenidas ex juvantibus a partir de la respuesta a la acción farmacológica de tratamientos efectivos del Pa-ERC5,22.
Las asociaciones clásicas de nuevo a examenHistóricamente, diversas alteraciones bioquímicas del metabolismo óseo-mineral se han correlacionado con la presencia de prurito en los pacientes con ERC. En un primer análisis del estudio DOPPS, Pisoni et al. observaron asociaciones significativas entre hiperfosfatemia superior a 5,5mg/dL, o un producto calcio×fósforo aumentado, con la presencia de prurito moderado o grave15. Estos hallazgos, estrictamente observacionales, han motivado que tradicionalmente una gran mayoría de los nefrólogos hayan considerado la restricción del fósforo en la dieta o el tratamiento quelante como el primer escalón terapéutico en el tratamiento del Pa-ERC12. Del mismo modo, muchos nefrólogos intensificarían el tratamiento con calcimiméticos y vitamina D para reducir los niveles de hormona paratiroidea en pacientes con prurito intenso, atendiendo a estudios antiguos y no controlados en los que se describió una mejoría del síntoma tras una paratiroidectomía25,26. Sin embargo, estudios posteriores han revelado que las asociaciones entre la intensidad del prurito y los niveles elevados de fósforo20,27,28, hormona paratiroidea12,28,29 y calcio30 son inconsistentes, no existiendo ningún estudio de intervención que evidencie que un mejor control bioquímico de las alteraciones del metabolismo óseo-mineral mejora el Pa-ERC. Además de su escasa utilidad para mejorar el prurito, la restricción de fósforo en la dieta en pacientes con prurito podría conducir a un mayor de riesgo de desnutrición y a culpabilizar innecesariamente a los pacientes por la aparición de sus propios síntomas12.
Una diálisis adecuada (estimada mediante Kt/V) es otro de los factores relacionados históricamente con la presencia de Pa-ERC12. En un estudio de 1995, aumentar el Kt/V de 1,05 a 1,24 se asoció a una mejoría del prurito31. Sin embargo, esta asociación no se ha confirmado en estudios más recientes, donde la dosis de diálisis administrada es habitualmente muy superior, con Kt/V medios de 1,512,15,27.
Finalmente, la histamina se ha considerado durante mucho tiempo el principal mediador químico del prurito, independientemente de la causa, y la mayoría de los nefrólogos de todos los países han venido utilizando antihistamínicos como tratamiento farmacológico de primera línea, pese a que dicho tratamiento no está respaldado por la evidencia12. De hecho, como describiremos posteriormente, la sensación de prurito se transmite a través de fibras nerviosas tanto histaminérgicas como no histaminérgicas32,33. Esto explica por qué el uso de antihistamínicos no permite controlar eficazmente el Pa-ERC10,34,35, no estando su uso exento de efectos secundarios relevantes como el mareo y la somnolencia12. En una reciente revisión de la Cochrane, el uso de antihistamínicos tuvo efectos inciertos en el control del prurito urémico, con un calidad de la evidencia baja a moderada. Dicha revisión destacó además como la mayoría de los ensayos clínicos realizados con otras moléculas habían incluido pacientes con ausencia de respuesta a antihistamínicos, lo que ilustra la limitación de estos fármacos para el control del Pa-ERC36.
Todos estos datos indican que todavía tenemos un gran margen de mejora a la hora de procurar el bienestar de los pacientes con ERC a través de un mayor conocimiento sobre la fisiopatología del prurito y un mayor uso de tratamientos efectivos. Poner al día nuestra comprensión actual de la patogenia del Pa-ERC puede servir al clínico en su objetivo último de ayudar a los pacientes con ERC a mejorar su calidad de vida a través de un mayor control de sus síntomas37.
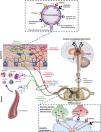
Hacia el conocimiento del origen y la transmisión del pruritoLa figura 1 muestra una descripción general de las conexiones y vías de señalización generalmente involucradas en la fisiopatología del Pa-ERC5,22,38,39. Este se origina en la piel por activación de receptores específicos (pruritoceptores) mediante diversas sustancias que incluyen prostaglandinas, histamina, citocinas, neuropéptidos (como la sustancia P), proteasas y toxinas urémicas (como la β2-microglobulina)40–42. Dichas sustancias, denominadas pruritógenos, son liberadas por queratinocitos, linfocitos, mastocitos, neuronas u otras células presentes en la epidermis y la dermis41,42. Al igual que sucede a nivel central (ver más adelante), los estudios actuales demuestran que los receptores opioides (RO) periféricos también desempeñan un papel fundamental en la modulación del prurito43. Mientras que el RO-μ ejerce un papel inductor, el estímulo del RO-κ inhibiría la producción del Pa-ERC, tal y como ha demostrado el tratamiento con difelikefalin, un agonista selectivo de dicho receptor periférico44. La actividad de los pruritógenos puede verse modulada por el medio urémico5. Así, por ejemplo, en los pacientes con Pa-ERC hay un aumento de las citocinas inflamatorias y pruritógenas producidas por los linfocitos Th1, como el interferón-γ, la interleucina (IL)-6 y el factor de necrosis tumoral-α45,46, y por los linfocitos Th2, como la IL-3147. Del mismo modo, en la piel de dichos pacientes hay un aumento en la cantidad de mastocitos48, de células dérmicas productoras de proteasas (por ejemplo, triptasa)49 y de β2-microglobulina50, que han demostrado tener actividad pruritógena per se40. Más recientemente, en pacientes con Pa-ERC se ha observado una disminución significativa en la expresión del receptor opioide κ en la piel en comparación con la piel de aquellos con ERC sin prurito51.
Conexiones y vías de señalización involucradas en la fisiopatología del prurito asociado a la enfermedad renal crónica.
GRP: péptido liberador de gastrina; H: histamina; ILs: interleucinas; NK1: neurocinina-1; NMDA: N-metil-D-aspartato; NPs: neuropéptidos; NPPB: polipéptido natriurético B; O: opiode; PGs: prostaglandinas; PRs: proteasas; R: receptor.
Adaptada de Makar et al.5, Verduzco y Shirazian24, Ikoma et al.38 y Yosipovitch y Bernhard39.
Los pruritógenos activan neuronas sensitivas primarias, que pueden ser dependientes o independientes de histamina38, lo que explicaría la limitada respuesta a los antihistamínicos que se observa en los pacientes con Pa-ERC. Ambas vías del prurito, mediadas por histamina y no histamina, se superponen con las del dolor1,52, estando, por tanto, estrechamente relacionadas la transmisión del prurito y la del dolor53. El prurito (y el dolor) se transmite a través de fibras amielínicas (tipo C), que se consideran polimodales porque pueden reaccionar a diversos estímulos de naturaleza térmica, mecánica o química (como la hipoxia, la hipoosmolaridad o el acúmulo de sustancias), tanto a nivel local (piel) como a nivel sistémico54. Las neuronas sensitivas primarias son capaces de transmitir la sensación de prurito mediante la sinapsis con neuronas sensitivas secundarias en los ganglios dorsales mediante neurotransmisores específicos del prurito. Por ejemplo, el glutamato, liberado por las neuronas presinápticas, ejerce su función pruritogénica a través de los receptores N-metil-D-aspartato. Dicha liberación de glutamato puede ser bloqueada por la disminución del flujo de entrada de Ca+2 inducida por gabapentina o pregabalina, lo que lleva a una menor activación de receptores N-metil-D-aspartato y, por tanto, a una menor sensación de prurito55. Otros neurotransmisores, como la sustancia P y el péptido liberador de gastrina, son liberados por las neuronas presinápticas y transmiten la sensación de prurito a través de los receptores NK1R y BB2, respectivamente38. Más recientemente, el polipéptido natriurético B, también conocido como péptido natriurético cerebral, ha sido implicado como uno de los principales neurotransmisores entre las fibras nerviosas sensibles al picor y las neuronas posteriores en la médula espinal a través de la vía dependiente del péptido liberador de gastrina56,57, estando sus niveles en sangre correlacionados con el grado de Pa-ERC en pacientes en HD58. Al igual que a nivel periférico, los receptores opioides en la médula espinal juegan también un papel fundamental en el control del prurito. La administración de morfina induce prurito mediante su unión al RO-μ, mientras que el prurito se puede reducir tanto con antagonistas del RO-μ como la naloxona y la naltrexona59 como con agonistas centrales del RO-κ como la nalfurafina60, sin modificar los efectos antinociceptivos de la morfina38.
Factores involucrados en el prurito asociado a ERCLa comprensión del modelo previamente simplificado de la fisiopatología se ha vuelto mucho más complejo, considerando multifactoriales los mecanismos etiopatogénicos subyacentes al prurito (fig. 2)1,12,53. Dichos mecanismos incluyen factores dermatológicos como la xerosis o la disfunción de la barrera cutánea; factores sistémicos como la disfunción del sistema inmune y el estado proinflamatorio inherente a la ERC; factores neurológicos, incluyendo la neuropatía urémica y la desregulación del sistema opioide endógeno, con sobreexpresión de los receptores opioides μ y regulación a la baja de los receptores κ; la acumulación de toxinas y otras sustancias metabólicas; y factores asociados al tipo de terapia renal sustitutiva que promueven o exacerban la aparición del prurito1,2,10,53,61,62. Aunque el tratamiento del Pa-ERC escapa a los objetivos de esta revisión, en la tabla 1 se describen las principales intervenciones utilizadas en el manejo del Pa-ERC junto con su mecanismo de acción, a fin de ayudar al nefrólogo a vincular los elementos fisiopatológicos del prurito con su manejo clínico5,36,44,50,63–81.
Intervenciones y mecanismo de acción de las principales terapias utilizadas en el manejo del Pa-ERC
| Intervención/fármaco | Mecanismo de acción conocido o supuesto | Ensayos clínicos más relevantes |
|---|---|---|
| Alteraciones neuropáticas | ||
| Gabapentinoides (gabapentina y pregabalina) | Derivado del neurotransmisor GABA, el mecanismo de acción no está claro. A pesar de su nombre, no actúa sobre los receptores GABA, sino que probablemente inhiben la subunidad α2δ de los canales de calcio en el asta posterior, disminuyendo la entrada de Ca+2 y la liberación de glutamato en la neurona presináptica5,50 | En un metaanálisis que incluyó 297 pacientes de 5 ECA, gabapentina y pregabalina redujeron significativamente el Pa-ERC (4,95cm de reducción en la escala EVA; IC 95%: 5,46 a 4,44) frente a placebo (evidencia de certeza alta)36 |
| Agonistas de los RO-κ (nalfurofina, difelikefalin) | El estímulo de los receptores opioides κ inhibe la vía neural del prurito tanto a nivel periférico (difelikefalin) como central (nalfurofina). A nivel periférico, los receptores se sitúan en la superficie de los mastocitos cutáneos y los queratinocitos. A nivel central, se sitúan en el asta posterior de la médula. La eficacia de los agonistas de los RO-κ periféricos indica que el principal mecanismo de acción sobre el Pa-ERC es periférico63 | En un metaanálisis que incluyó 661 pacientes de 6 ECA (4 con nalfurofina y 2 con difelikefalin), los agonistas RO-κ redujeron significativamente el Pa-ERC (1,05cm de reducción en la escala EVA; IC 95%: 0,71 a 1,4) frente a placebo (evidencia de certeza alta)36. En 2 ECA publicados posteriormente y que incluyeron 174 y 378 pacientes en HD, respectivamente, difelikefalin, en comparación con placebo, redujo significativamente la intensidad del prurito y mejoró la calidad de vida relacionada con el Pa-ERC44,64 |
| Capsaicina tópica | Actúa sobre los canales TRPV1 en las neuronas sensoriales periféricas, deplecionando y previniendo la acumulación de la sustancia P5 | En un metaanálisis que incluyó 2 ECA con 116 pacientes, la aplicación 4 veces al día de capsaicina tópica frente a crema (placebo) redujo los síntomas del prurito urémico (DME −0,84; IC 95%: −1,22 a −0,45; evidencia de certeza moderada)36 |
| Alteraciones dermatológicas | ||
| Emolientes | Restauran la permeabilidad de la barrera cutánea5 | Un ECA intraindividual (comparación pierna izquierda frente a derecha) que incluyó 100 pacientes con xerosis urémica de moderada a grave, la aplicación 2 veces al día durante una semana de una emulsión que contenía glicerol 15% y parafina 10% en una pierna en comparación con la emulsión sola en la otra pierna, seguida de un uso abierto del producto de prueba en todas las áreas xeróticas, mostró que el uso de emulsión que contenía glicerol y parafina fue muy eficaz en el Pa-ERC (mejoría en el 75% de los pacientes) y la calidad de vida al final del estudio65 |
| Desregulación del sistema inmune | ||
| Cúrcuma | La cúrcuma, comúnmente utilizada como especia, es un polvo de los rizomas de Curcuma longa L. que se utiliza en la medicina asiática para el tratamiento de la inflamación y las heridas de la piel. La curcumina (diferuloilmetano), el componente más activo y no tóxico de la cúrcuma, es un polifenol con actividad antiinflamatoria66 | Un ECA de 100 pacientes en HD mostró como la administración de 500mg de cúrcuma (22,1mg de curcumina) cada 8h frente a placebo disminuyó la intensidad del Pa-ERC y los niveles de PCRUS67 |
| Ácidos grasos poliinsaturados (aceite de onagra) | Formado principalmente por ácido linoleico que posee ácidos grasos Ω-6, los cuales reducen la producción de ácido araquidónico y, por tanto, la síntesis de citocinas proinflamatorias como el leucotrieno B4 y la prostaglandina E25 | Un pequeño ECA con 16 pacientes en HD mostró como el aceite de onagra rico en ácidos grasos poliinsaturados mejoró los síntomas generales de la piel, incluido el prurito, significativamente en comparación con los que recibieron ácido linolénico solo68 |
| Cromoglicato sódico | El cromoglicato sódico es un fármaco que bloquea la desgranulación de los mastocitos en respuesta a los antígenos, lo que provoca una disminución de la liberación de histamina, leucotrienos y otros productos inflamatorios de los mastocitos69 | Un ECA de 62 pacientes en HD mostró como la administración de 135mg de cromoglicato sódico oral cada 8h frente a placebo disminuyó la intensidad del Pa-ERC70 |
| Sulfato de Zn | El déficit de Zn favorece la desgranulación excesiva de mastocito, mientras que su suplementación previene la desgranulación y la liberación de histamina71 | En un metaanálisis que incluyó 76 pacientes de 2 ECA, la suplementación con 220-400mg al día de sulfato de Zn redujo significativamente el Pa-ERC (1,77cm de reducción en la escala EVA; IC 95%: 0,66 a 1,77) frente a placebo (evidencia de certeza moderada)36 |
| Montelukast | Los antagonistas de los leucotrienos evitan el papel de los leucotrienos en el mantenimiento de la respuesta inflamatoria después de la desgranulación | En un metaanálisis que incluyó 2 ECA con 87 pacientes, la administración de montelukast frente a placebo redujo los síntomas del Pa-ERC (DME −1,40; IC 95%: −1,87 a −0,92; evidencia de certeza moderada)36 |
| Fototerapia UVB | Apoptosis de los mastocitos cutáneos y de los queratinocitos. Disminuye la expresión de linfocitos Th172 | En un metaanálisis que incluyó 4 ECA con 86 pacientes, la fototerapia UVB redujo los síntomas del Pa-ERC (DME −2,49; IC 95%: −4,62 a −0,36; evidencia de certeza baja)36 |
| Acúmulo de toxinas y otras sustancias | ||
| Hemodiálisis de alto flujo | Mejora la depuración de toxinas urémicas73 | En un metaanálisis que incluyó 3 ECA con 202 pacientes en HD, la HD de alto flujo redujo significativamente el Pa-ERC (2,60cm de reducción en la escala EVA; IC 95%: 1,97 a 3,22) frente a la HD de bajo flujo (evidencia de certeza baja)36 |
| Hemodiafiltración en línea | Mejora la depuración de toxinas urémicas y el estado inflamatorio74–76 | En un ECA con 51 pacientes en HD con Pa-ERC, el uso de HD de alto flujo y de hemodiafiltración en línea se asoció a un descenso significativo del Pa-ERC77 |
| Hemodiálisis adsortiva | Disminuye los niveles de toxinas ligadas a proteínas y de citocinas proinflamatorias como la IL-6, difícilmente depurable por otras técnicas de diálisis78,79 | Un ECA de 90 pacientes en HD mostró como el uso de HD con una resina en hemoperfusión redujo significativamente el Pa-ERC (2,37cm de reducción en la escala EVA; IC 95%: 1,97 a 3,22) frente a la HD estándar80. En un pequeño ensayo cruzado con 19 pacientes en HD con prurito grave, la utilización de una membrana adsortiva de pometilmetacrilato se asoció a un descenso significativo del Pa-ERC81 |
DME: diferencia de medias estandarizada; ECA: ensayo clínico aleatorizado; EVA: escala visual analógica; GABA: ácido gamma-aminobutírico; HD: hemodiálisis; IL: interleucina; Pa-ERC: prurito asociado a la enfermedad renal crónica; PCRUS: proteína C reactiva ultrasensible; RO: receptor opioide; TNF-α: factor de necrosis tumoral alfa; TRPV1: receptor de potencial transitorio vanilloide 1; UVB: ultravioleta B.
La piel seca o xerosis, caracterizada por una superficie cutánea áspera, agrietada y escamosa, está estrechamente asociada con la sensación de prurito crónico, siendo una manifestación cutánea habitual en pacientes con ERC, alcanzando una prevalencia de hasta el 85% de los pacientes en HD82–84. Numerosos factores pueden contribuir a la aparición de xerosis en esta población, incluyendo la atrofia de las glándulas secretoras, el engrosamiento de la zona basal, la alteración de la composición lipídica del estrato córneo y la disminución en el grado de humedad en la epidermis, haciéndola más sensible a factores dañinos externos83–85. Los motivos por los que se produce esta deshidratación de la epidermis en pacientes con ERC aún no han sido suficientemente aclarados, habiéndose planteado el desplazamiento de los líquidos osmóticos a través de las membranas celulares, así como las ganancias y pérdidas de agua en relación con las sesiones de diálisis y, más recientemente, la presencia de microangiopatía de los vasos dérmicos, como los principales factores22,84–86. Dicha microangiopatía, presente desde estadios prediálisis de ERC, se produce por el efecto directo de las alteraciones endocrinas, metabólicas e inmunológicas asociadas al medio urémico87,88, generando disfunción endotelial a nivel de los vasos distales a las arteriolas más pequeñas, lo que resulta en una hipoperfusión con hipoxia tisular a nivel cutáneo89, entre otros tejidos86,87,90. La mejoría de la microangiopatía que se observa tras el trasplante refuerza el papel etiopatogénico de la uremia en dicho trastorno89. Adicionalmente, el rascado continuo de los pacientes con prurito puede dar como resultado un mayor daño e inflamación de la piel que promueve y cronifica el Pa-ERC, estableciendo un círculo vicioso entre prurito y rascado, produciendo lesiones cutáneas secundarias6,7,61.
Todos estos hallazgos evidencian que la sequedad de la piel puede agravar el Pa-ERC, como en muchas otras condiciones pruriginosas91, siendo razonable recomendar el uso de emolientes en pacientes con Pa-ERC, ya que medidas tan simples como la hidratación de la piel pueden mejorar al menos parcialmente dicho síntoma5,92. Sin embargo, el hecho de que los pacientes con Pa-ERC y piel seca mejoren al hidratar la piel (tabla 1)65, pero que muchos pacientes con xerosis marcada no necesariamente sufran de prurito93, orienta a que la piel seca sea probablemente un factor potenciador de la sensación de prurito más que un factor etiológico per se84,94.
La inflamación picaLa microinflamación tanto a nivel cutáneo como sistémico ha sido propuesta en los últimos años como uno de los principales factores responsables del Pa-ERC5,10,22,24. A nivel local, las proteasas, como la tripsina, la triptasa, las catepsinas y las calicreínas, también funcionan como pruritogénos en situaciones de inflamación cutánea41,42. A nivel sistémico, diversos estudios observacionales han demostrado como los pacientes en diálisis con prurito presentan una proporción significativamente mayor de diversos marcadores de inflamación, incluyendo células Th1, niveles de proteína C reactiva, IL-6 e IL-2, en comparación con los pacientes sin prurito45,95. Otros marcadores inflamatorios como la leucocitosis, la elevación de ferritina o el descenso de albúmina se han asociado también a la aparición de prurito6,96.
La interacción entre el sistema nervioso y el sistema inmunológico se produce a través de pequeñas moléculas y citocinas que son liberadas por las células inflamatorias y activan los pruritoceptores en las neuronas sensoriales, mientras que estas liberan neuropéptidos como la sustancia P y el péptido regulador del gen de la calcitonina, que activan las células inmunitarias y no neuronales1. De todos estos mediadores, la histamina es una de las sustancias históricamente mejor estudiadas, estando implicada en la maduración, la activación y la quimiotaxis de las células inmunitarias como los monocitos, las células T, los macrófagos y otras células inmunitarias97. Sin embargo, el papel de la histamina en el Pa-ERC, al igual que en otras formas de prurito más allá de la urticaria y las reacciones alérgicas, se considera muy limitado24. Pese a que la respuesta alérgica también puede estar desregulada en los pacientes con ERC, en los que se han descrito niveles elevados de histamina y mastocitos, los cambios cutáneos clásicos específicos de la histamina, como los habones, están ausentes en los pacientes con Pa-ERC10, en los que además la mayoría de los ensayos clínicos diseñados para disminuir la liberación de histamina han obtenido resultados negativos. Aunque se sabe que la serotonina es un activador de los receptores neuronales de la vía espinotalámica y ha sido propuesta como otro de los mediadores responsables del prurito24, el uso de antagonistas de los receptores de la serotonina como ondansetrón no ha demostrado ser eficaz en el control del Pa-ERC36,98.
Junto con la histamina y la serotonina, en los últimos años se han descrito una serie de citocinas clave involucradas en el prurito (y el dolor), siendo IL-2, IL-4, IL-13 e IL-31 las más conocidas22. Consistente con esta hipótesis, la administración intradérmica de IL-2 produce sensación de prurito99, mientras que anticuerpos que bloquean la IL-31 o su receptor, como el nemolizumab, han demostrado disminuir la sensación de prurito100,101. Aunque recientemente ha sido descrita una cascada metabólica conocida como prurito inducido por señalización de IL-6/pBRK/p-ERK, por la cual la IL-6 (y el calcio) desencadenan la sensación de prurito, otros mecanismos moleculares que relacionen la regulación de estado inflamatorio con la presencia de prurito siguen siendo poco conocidos102. El hecho de que el prurito de los pacientes con ERC mejore al aplicar terapias inmunomoduladoras como la fototerapia con rayos ultravioleta B36,103,104 o al utilizar técnicas de diálisis con capacidad de reducir el estado inflamatorio (tabla 1)74–81 apoya sin duda la hipótesis inmunológica en la etiopatogenia del Pa-ERC. Además, cada vez hay más evidencia de que la inflamación también está involucrada en la modulación del sistema opioide y, por lo tanto, potencialmente también en la aparición del prurito (ver más adelante)24.
La desregulación del sistema opioide endógeno y otros cambios neuropáticosLos RO, distribuidos en el sistema nervioso central y periférico, así como en otras células como queratinocitos, melanocitos y células inmunitarias, parecen tener un importante papel modulador del prurito1,105, incluyendo el Pa-ERC1,10,22,24,43. Datos recientes evidencian que la desregulación del sistema opioide endógeno puede participar en la aparición y transmisión del Pa-ERC, bien sea por la sobreestimulación de los RO-μ, el antagonismo de los RO-κ periféricos o un desequilibrio entre la estimulación y la inhibición de los RO μ y κ, respectivamente106,107. Esta hipótesis se basa en la observación de que los opioides que se utilizan para el dolor, como la morfina (agonistas del RO-μ), pueden, sin embargo, desencadenar prurito, mientras que los antagonistas del RO-μ como la naloxona59, así como los agonistas del RO-κ tanto a nivel central (por ejemplo, nalfurorina) como periférico (por ejemplo difelikefalin), pueden disminuirlo (tabla 1)36,43,44,60. Adicionalmente, se ha demostrado en pacientes con Pa-ERC una asociación entre la actividad de los RO-κ y la intensidad del prurito51.
Más allá de su dependencia directa con el prurito y el dolor, cada vez tenemos más pruebas de la interacción entre el sistema opioide endógeno y la inflamación, lo que resalta la compleja interrelación que existe entre queratinocitos, células inmunitarias y fibras nerviosas en la etiopatogenia del Pa-ERC10,24. El descubrimiento de que el estado inflamatorio modifica la expresión de los RO periféricos y el hecho de que los opioides tienen mayor efecto analgésico en el tejido inflamado llevó al descubrimiento de péptidos opioides en linfocitos, polimorfonucleares y monocitos/macrófagos108–111. La activación de los RO-κ en las células inmunitarias, incluidos los monocitos y los linfocitos T, disminuye la liberación de sustancias químicas proinflamatorias, como las prostaglandinas, que a su vez también pueden ser pruritogénicas112,113. Curiosamente, la IL-6 y el factor de necrosis tumoral-α producen analgesia mediada por opioides en el tejido inflamado114, mientras que esas mismas citocinas y otras como IL-1α o IL-1β inducen hiperalgesia en tejido no inflamado115. Existen además variantes genéticas de los RO que podrían explicar las diferencias que observamos en nuestros pacientes en su susceptibilidad al prurito o en las respuestas a los tratamientos del mismo116.
Además de la desregulación del sistema opioide, otros mecanismos de neuropatía central y periférica asociadas a la ERC podrían contribuir a la aparición del Pa-ERC62. En este sentido, en pacientes en diálisis se ha descrito una respuesta central alterada al estímulo del prurito117, así como una asociación entre la intensidad del Pa-ERC y el grado de neuropatía somática en forma de parestesias118. La evidencia de que tratamientos para la neuropatía urémica como la capsaicina tópica o la administración de gabapentinoides orales también pueden aliviar el prurito (tabla 1)36 demuestran como las alteraciones neuropáticas son, al menos parcialmente, responsables de la aparición del Pa-ERC.
El acúmulo de toxinas y otras sustanciasEl acúmulo de sustancias urémicas y otras sustancias secundario al descenso en el filtrado glomerular de los pacientes con ERC se ha postulado como uno de los mecanismos implicados en la aparición del Pa-ERC. Entre estas sustancias históricamente se han incluido la hormona paratiroidea, el calcio, el fósforo y el aluminio. En los pacientes con hiperparatiroidismo secundario se ha observado una mayor prevalencia de Pa-ERC, si bien no todos los pacientes con hiperparatiroidismo secundario tienen prurito y, en aquellos que sí lo tienen, no siempre el tratamiento del hiperparatiroidismo se asocia a un mejor control del prurito119. En los pacientes con Pa-ERC existe un aumento de los iones de calcio libres extracelulares en la capa basal de la epidermis comparado con los pacientes con ERC sin prurito120, mientras que la hiperfosfatemia puede favorecer la formación y depósito de sales de fosfato cálcico en la piel y otros tejidos, pudiendo activar las fibras nerviosas locales y favorecer la aparición de prurito10,121. En un estudio reciente se objetivó que los pacientes con niveles más elevados de aluminio en sangre presentaban una mayor prevalencia de prurito122, resaltando la importancia de determinar periódicamente y mantener en rango los niveles de aluminio en los pacientes en HD123. Respecto a otras sustancias que se han relacionado con la aparición del Pa-ERC, en un estudio reciente que valoró el perfil metabólico de los paciente en HD con prurito mediante cromatografía líquida y espectometría de masas, se han planteado hasta 9 biomarcadores que podrían estar relacionados con esta afección, incluyendo toxinas ligadas a proteínas, fosfolípidos y esteroides: LysoPE (20:3(5Z,8Z,11Z)/0:0), glucurónido de p-cresol, LysoPC(20:2(11Z,14Z)), hipotaurina, ácido 4-aminohipúrico, LysoPC(16:0), ácido fenil acético, ácido quinurénico y androstenediona124. Estos metabolitos aparecen aumentados en mayor grado en aquellos pacientes con Pa-ERC grave, de manera que aquellos tratamientos o técnicas de diálisis dirigidos a disminuir sus niveles en sangre podrán mejorar la clínica relacionada con el prurito urémico (tabla 1)36,74–81. La descripción de estos metabolitos, su estudio y el conocimiento de sus características nos pueden ayudar a entender por qué unas técnicas de depuración pueden ser más eficaces que otras en el tratamiento de esta dolencia (ver más adelante)125.
El tipo de diálisis importaActualmente, ninguno de los tratamientos dialíticos de los que se dispone han demostrado ser eficaces totalmente para revertir el Pa-ERC. Entre las opciones de diálisis, aunque clásicamente se creía que la peritoneal era más eficaz (por la mayor eliminación de moléculas de mediano peso molecular en aquellos pacientes que mantienen la función renal residual)126, otros trabajos más recientes encuentran justo lo contrario127. En un reciente metaanálisis de 42 estudios transversales, la prevalencia de Pa-ERC según la técnica fue similar entre paciente en HD y diálisis peritoneal (55 vs. 56%)13. Por tanto, no hay un claro consenso sobre cuál de las opciones de diálisis (HD o diálisis peritoneal) es mejor para evitar la aparición de prurito. Así, a la hora de elegir la mejor opción para un paciente con Pa-ERC, cualquiera de las 2 técnicas parece presentar similar perfil terapéutico. Se sabe que la dosis de diálisis, estimada mediante Kt/V, tiene una relación inversa con la intensidad del prurito, siendo, por tanto, imprescindible optimizar la prescripción de la diálisis en esta población31. Se han publicado trabajos en los que la adecuación de la dosis y de la técnica prescrita pueden mejorar, al menos parcialmente, la clínica del Pa-ERC128,129. Lo que sí es evidente es que recibir un trasplante renal que restaure la función renal en el paciente con ERC mejora significativamente la sintomatología, lo que sin duda apoya la hipótesis del acúmulo de toxinas en la fisiopatología del Pa-ERC130.
Dentro de las técnicas de HD, considerando que las toxinas unidas a proteínas y las de peso molecular medio pueden jugar un papel en la fisiopatología del Pa-ERC125, aquellas que ayuden a eliminar estas toxinas urémicas, como son las técnicas que combinan el transporte difusivo con el transporte convectivo o adsortivo, pueden mejorar la clínica relacionada con el Pa-ERC, incluyendo la HD de alto flujo36, la hemodiafiltración en línea77 o técnicas de HD adsortiva (tabla 1)80,81, Dentro de este último grupo, la hemoperfusión con resinas neutras80, el uso de membranas adsortivas de polimetilmetacrilato81,131,132 y la hemodiafiltración con regeneración de ultrafiltrado (HFR-Supra)133 han mostrado resultados prometedores a la hora de aliviar el Pa-ERC, atribuyendo su efecto antipruriginoso a una mayor depuración de toxinas ligadas a proteínas y de citocinas proinflamatorias como la IL-6, difícilmente depurable por otras técnicas de diálisis78,79,134. Siguiendo este mecanismo de depuración aplicado al control de Pa-ERC, debemos comentar otras 2 opciones terapéuticas de las que se tienen muy pocos resultados, como son el uso de carbón activado por vía oral, cuya baja selectividad a la hora de adsorber sustancias ha impedido la generalización de su uso135, y la HD expandida, que parece mejorar la depuración de moléculas de mediano peso molecular incluso en pacientes en los que por problemas de flujo del acceso vascular no es ventajoso prescribir técnicas convectivas, y que podría ser una buena opción para mejorar la sintomatología de los pacientes, aunque aún no tenemos trabajos que demuestren su eficacia en el control del Pa-ERC más allá de casos clínicos aislados136,137. El tipo de acceso vascular para HD también podría tener un papel en la aparición del Pa-ERC, siendo menos frecuente en los pacientes con fístula arteriovenosa que en aquellos con catéter. Posibles mecanismos implicados podrían ser una mejor depuración de toxinas y un menor estado inflamatorio asociados al uso de fístula respecto al catéter138.
Causas de prurito no asociadas a ERCLa presentación del prurito en pacientes con ERC puede ser muy variada, y puede resultar difícil hacer el diagnóstico diferencial con otras causas de prurito. Siempre se debe plantear la posibilidad de que el prurito que aparece en pacientes con ERC no sea por su dolencia renal, y se deben descartar otras causas de prurito7,9. Debemos considerar que el prurito del paciente no es de origen urémico cuando es refractario a un ensayo de tratamiento razonable, cuando los síntomas son asimétricos y se acompañan de lesiones ampollosas o ulcerosas, o cuando aparecen junto con otros síntomas clínicos compatibles con otras enfermedades sistémicas. En ocasiones el prurito se relaciona con el inicio de la administración de un nuevo fármaco, o incluso con medicamentos que el paciente lleva tiempo recibiendo4. Las causas de prurito no relacionadas con la uremia que debemos descartar en los pacientes con prurito se recogen en la tabla 2.
Causas de prurito no urémico
| Enfermedades dermatológicas | Enfermedades sistémicas |
|---|---|
| Hipersensibilidad a fármacos y otras alergias | Hipercalcemia |
| Dermatitis de contacto | Colestasis |
| Cirrosis biliar primaria | |
| Psoriasis | Hepatitis vírica |
| Penfigoide bulloso | Enfermedades hematológicas tumorales |
| Linfoma de Hodgkin | |
| Dermatofitosis | Linfoma cutáneo de células T |
| Tiña cruris | Policitemia vera |
| Tiña pedis | |
| Tiña corporis | Virus de la inmunodeficiencia humana |
| Otras infecciones no micóticas | |
| Sarna | |
| Ácaros | |
| Piojos |
Aunque el prurito es el síntoma cutáneo más común en nuestros pacientes con ERC, no hemos sabido darle un tratamiento adecuado, debido, entre otras causas, al desconocimiento de su fisiopatología, lo que ha limitado en gran medida el uso de tratamientos efectivos. La etiopatogenia del Pa-ERC es compleja y sigue sin estar del todo aclarada, aunque recientemente se han descrito mecanismos potencialmente implicados en su aparición y transmisión, incluyendo: 1) las alteraciones en la estructura y función de la piel presentes en la ERC; 2) la alteración en la respuesta inmune y el estado inflamatorio crónico asociado a la uremia; 3) la desregulación del sistema opioide endógeno y la neuropatía urémica, y 4) el acúmulo de toxinas urémicas en la piel y el tejido celular subcutáneo. Una comprensión más profunda de la fisiopatología del Pa-ERC sin duda nos ayudará a superar el reto que supone su tratamiento, proporcionándonos una base valiosa para el desarrollo futuro de tratamientos para esta afección, lo que finalmente redundará en una mejor calidad de vida de las personas con ERC.
Conflicto de interesesESA: honorarios por consultoría de Vifor Pharma.
GA: honorarios por consultoría de Vifor Pharma.
JMB: honorarios por conferencias de Fresenius, Baxter y Vifor Pharma; honorarios por consultorías de Vifor Pharma.
MP: honorarios por conferencias de Fresenius, Baxter, Astellas y AstraZeneca; honorarios por consultorías de Vifor Pharma y Baxter.
NA: honorarios por conferencias de Vifor Pharma, Baxter, Amgen, AstraZeneca y Rovi; honorarios por consultorías de AstraZeneca y Novo Nordisk.
PM: honorarios por conferencias de Abbott, Amgen, Fresenius-Kabi, Nutricia, Palex, Sanofi y Vifor Pharma; honorarios por consultorías de Fresenius-Kabi, Palex y Vifor Pharma, así como becas de viaje de Amgen y Fresenius Medical Care.
RSV: honorarios por conferencias de Amgen, Fresenius-Kabi, AstraZeneca y Baxter; honorarios por consultorías de Baxter y Vifor Pharma.
VES: honorarios por consultorías de Amgen, Novo Nordisk y Vifor Pharma, así como becas de viaje de Amgen y Baxter.
El resto de los autores confirman no tener ningún conflicto de intereses.
Los autores quieren dar las gracias a Roser Peiró, PhD, por sus estimulantes comentarios y sugerencias durante toda la redacción del manuscrito; y a Marta Maojo, por su ayuda en la redacción del abstract.
Agradecemos también a Servier Medical Art (https://smart.servier.com/) la distribución libre de imágenes médicas, utilizadas en parte para la realización de las figuras del trabajo.