INTRODUCCIÓN
El trasplante renal (TR) constituye una alternativa terapéutica bien establecida en pacientes con enfermedad renal crónica, tanto si se encuentran sometidos a técnicas de reemplazo renal como si permanecen en situación de prediálisis, al haber demostrado su beneficio en términos de supervivencia y calidad de vida1,2. La supervivencia del injerto censurada por muerte ha experimentado un avance notable en las últimas décadas, fruto de la introducción de regímenes de inmunosupresión más potentes que han permitido reducir la incidencia del rechazo agudo a cifras inferiores al 12%3-5. No obstante, los pacientes sometidos a TR siguen sufriendo un exceso de morbimortalidad respecto a la población general derivado de los efectos deletéreos a medio y largo plazo del tratamiento inmunosupresor, que conducen a un mayor riesgo de infecciones, eventos cardiovasculares y neoplasia de novo5,6. En concreto, las complicaciones infecciosas suponen una de las principales causas de muerte con injerto funcionante, solo por detrás de la mortalidad de origen cardiovascular6.
La implementación en la práctica clínica de estrategias de monitorización inmunológica durante el período de seguimiento postrasplante podría resultar en la minimización de estos eventos adversos al permitir el ajuste individualizado del tratamiento con arreglo al estado global de inmunosupresión de cada paciente, como recientemente ha demostrado un ensayo clínico basado en la determinación de los niveles intracelulares de trifosfato de adenosina (ATP por sus siglas en inglés, adenosine triphosphate) en los linfocitos T CD4+ mediante un test comercial7. La estrategia ideal de monitorización inmunológica debería estar fundamentada en biomarcadores sensibles y específicos, que fueran capaces de compendiar la naturaleza multidimensional de la respuesta inmune tanto innata como adaptativa, cuya determinación fuera sencilla y reproducible desde un punto de vista técnico, y que pudieran ser puestos en conocimiento del clínico en un corto período de tiempo a fin de permitir la toma de decisiones terapéuticas8. Hasta la fecha, la única estrategia con un grado significativo de implantación en la práctica asistencial se limita a la monitorización de los niveles plasmáticos de fármacos inmunosupresores, principalmente anticalcineurínicos e inhibidores de la diana de la rapamicina en mamíferos (m-TOR por sus siglas en inglés, mammalian target of rapamycin). Por desgracia, este abordaje unidimensional, de carácter exclusivamente farmacocinético, dista de cumplir estos requisitos9,10.
La presente revisión se centrará en una serie de estrategias de monitorización inmunológica que comparten su naturaleza no patógeno específica (resumidas en la tabla 1). Es decir, estos biomarcadores proporcionan una evaluación de la respuesta inmune que, ya sea funcional o exclusivamente cuantitativa, no está circunscrita a un determinado microorganismo, toda vez que no se basan en un estímulo antigénico concreto8. Deben ser diferenciados, por tanto, de los abordajes que tienen por objeto evaluar la magnitud y la funcionalidad de la respuesta celular adaptativa específica frente a ciertos virus, y cuyo esfuerzo se ha centrado fundamentalmente hasta el momento en el citomegalovirus (CMV). Estas técnicas, basadas en la medición de citoquinas de tipo Th1 como el interferón gamma en linfocitos previamente estimulados con péptidos virales, lisados virales o células dendríticas infectadas con virus vivos, han experimentado un notable desarrollo en los últimos años y quedarán fuera de nuestro objetivo, por lo que se remite al lector interesado a revisiones recientes al respecto11,12.
NIVELES SÉRICOS DE INMUNOGLOBULINAS
La inmunidad humoral desempeña un papel crucial en la respuesta protectora tanto innata como adaptativa frente a los microorganismos causantes de infección. Interviene, entre otras funciones, en la opsonización y fagocitosis de bacterias encapsuladas (como Streptococcus pneumoniae o Neisseria meningitidis), en la activación del complemento o en la citotoxicidad celular dependiente de anti-cuerpos (tabla 2)13. En el paciente portador de TR concurren una serie de factores que actúan de forma deletérea sobre este brazo efector de la inmunidad, entre los que destacan el síndrome de malnutrición, inflamación y aterosclerosis en el periodo de diálisis pretrasplante y el propio tratamiento inmunosupresor14. En ese sentido, algunos autores han sugerido una asociación entre el uso del micofenolato de mofetilo y la disminución de los niveles séricos de inmunoglobulina G (IgG), que podría estar media-da por el efecto directo de este fármaco sobre la funcionalidad de los linfocitos B15-17. También se ha observado que la administración de anticalcineurínicos o de bolos de esteroides como terapia del rechazo agudo contribuye indirectamente a la alteración de la inmunidad humoral a través de un mecanismo inhibitorio sobre los linfocitos T CD4 Th2 y sus citoquinas (necesarios para la activación y expansión de los linfocitos B)14,18. Por todo ello, la hipogammaglobulinemia (HGG) es más frecuente en los receptores de TR que en sujetos sanos o en pacientes con enfermedad renal crónica no trasplantados. Esta complicación aparece habitualmente de novo tras el trasplante. En nuestra experiencia, la prevalencia de la HGG a expensas de IgG (definida por niveles séricos de IgG < 700 mg/ dl) se incrementó desde el 6,6% en situación basal hasta el 52% en el primer mes postrasplante, para mantenerse en el 31,4% al sexto mes19. En un metaanálisis realizado a partir de 579 receptores de TR incluidos en seis estudios, la prevalencia de la HGG IgG a lo largo del primer año postrasplante fue del 40%. Es destacable que el descenso de la concentración de la IgG fuera clasificada como grave (< 400 mg/dl) hasta en el 8% de los casos20.
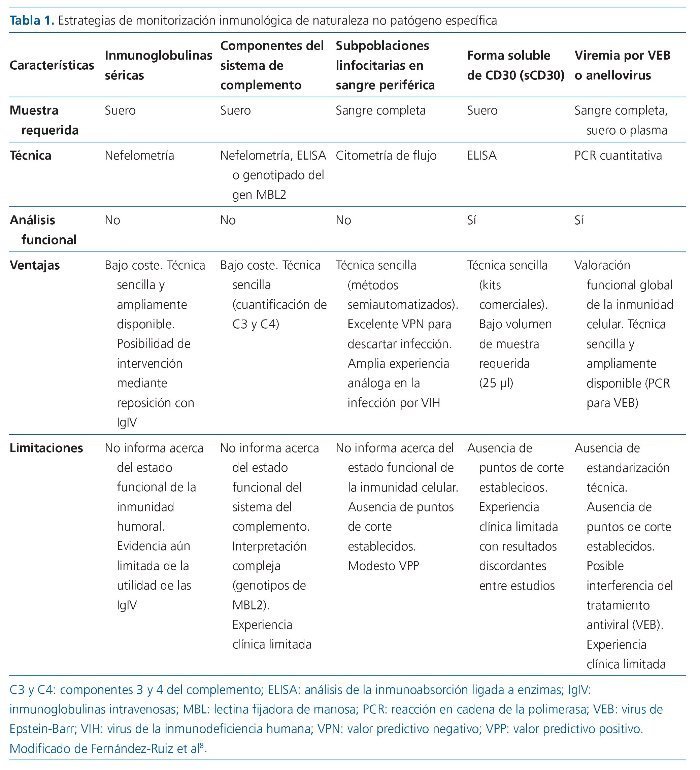
Desde el ya clásico trabajo de Wieneke et al, publicado hace más de 30 años, son múltiples los estudios que han analizado el impacto del desarrollo de la HGG de novo sobre la incidencia de complicaciones infecciosas en distintos tipos de trasplante de órgano sólido (TOS)17,19,21-26. En vista del papel de la inmunidad humoral en la respuesta frente a bacterias encapsuladas, no es sorprendente que la asociación patogénica más ampliamente documentada sea la que vincula HGG e infección bacteriana27. Por ejemplo, nuestro grupo demostró que los receptores de TR con HGG de cualquier clase (IgG, IgA o IgM) en el primer mes postrasplante presentan una mayor incidencia de infección de etiología bacteriana a lo largo de los meses siguientes (hazard ratio [HR]: 1,81) tras ajustar en un modelo multivariante por potenciales confusores (edad del paciente o desarrollo previo de rechazo, entre otros)19. De hecho, observamos una suerte de «gradiente de riesgo» según el cual la incidencia de infección bacteriana global, de bacteriemia y de pielonefritis aguda se incrementaba de forma progresiva conforme disminuían los niveles de la IgG (figura 1). Hasta la mitad de los receptores que presentaron niveles séricos de IgG por debajo de 500 mg/dl en el primer mes habían sufrido algún tipo de infección bacteriana al finalizar el sexto mes postrasplante. También hemos demostrado recientemente que la presencia de la HGG IgG predice el desarrollo de diarrea por Clostridium difficile tras el TR28, en la línea de trabajos previos en receptores de trasplante cardíaco29,30.
Figura 1. Incidencia acumulada en el sexto mes postrasplante de infección bacteriana global, bacteriemia y pielonefritis aguda en una cohorte de 304 receptores de trasplante renal en función de los niveles séricos de inmunoglobulina G (IgG) determinados en el primer mes. Modificado de Fernández-Ruiz et al19.
El impacto de las alteraciones adquiridas de la inmunidad humoral en receptores de TR y de otros tipos de TOS no se limita a la infección bacteriana. En el citado metaanálisis de Florescu et al, los pacientes con HGG IgG grave presentaron un riesgo incrementado de infección por CMV (odds ratio [OR]: 2,40), aspergilosis invasora (OR: 8,19) y otras infecciones fúngicas (OR: 3,69)20. Sin duda, resulta más cuestionable establecer un nexo etiopatogénico directo entre los niveles de la IgG y la susceptibilidad a virus herpes y hongos filamentosos, toda vez que la inmunidad humoral juega un papel secundario en la respuesta frente a estos microorganismos en comparación con la inmunidad celular31,32. No debe excluirse, por lo tanto, que la presencia de la HGG no actúe más bien como un marcador de riesgo capaz de identificar a pacientes más frágiles, con mayor carga de comorbilidad y peor estado nutricional33.
La monitorización postrasplante de los niveles séricos de inmunoglobulinas presenta varias ventajas: amplia disponibilidad, sencillez técnica (la determinación suele realizarse mediante nefelometría), bajo coste y existencia de puntos de corte validados en la literatura14. Otro de los principales atractivos de esta estrategia radica en la posibilidad de intervención a través de la administración de preparados de inmunoglobulinas inespecíficas por vía intravenosa (IgIV). De este modo, y si se asume que la HGG juega un papel patogénico en el desarrollo de la infección postrasplante, su reversión permitiría disminuir la incidencia de esta complicación sin necesidad de modificar el tratamiento inmunosupresor y, por tanto, sin comprometer la supervivencia del injerto14. La administración periódica de IgIV y de preparados similares por vía subcutánea constituye un abordaje profiláctico de contrastada utilidad en la inmunodeficiencia variable común y otras inmunodeficiencias primarias por déficit de anticuerpos34. Por desgracia, la experiencia acumulada hasta el momento en el campo del TOS es limitada y de baja calidad metodológica, y ofrece resultados discordantes. Carbone et al comunicaron su experiencia con un grupo de 55 receptores de trasplante cardíaco con HGG IgG (< 600 mg/dl) y al menos un episodio previo de infección, que fueron sometidos a una estrategia de reposición con IgIV (dosis de 300-400 mg/kg repetidas de forma mensual hasta alcanzar niveles de IgG superiores a 750 mg/dl). Los autores observaron un descenso en la incidencia de infecciones graves una vez que se inició el tratamiento, así como la normalización de ciertos parámetros funcionales de inmunidad humoral (títulos de anticuerpos antitoxoide tetánico y frente al antígeno de superficie del virus de la hepatitis B [anti-HBsAg]), en ausencia de efectos adversos reseñables35. Recientemente han publicado una experiencia favorable con el uso de preparados por vía subcutánea36. Claustre et al obtuvieron resultados comparables en receptores de trasplante pulmonar, si bien el carácter retrospectivo y no aleatorizado limita la validez de su estudio37. Por el contrario, un ensayo clínico de diseño cruzado también realizado en receptores de trasplante pulmonar con HGG IgG (< 500 mg/dl), que fueron aleatorizados a recibir IgIV o placebo a lo largo de dos periodos consecutivos de 12 semanas, no fue capaz de detectar diferencias en la incidencia de infección bacteria-na (aun cuando los niveles de IgG aumentaron de forma significativa durante la fase de administración de las IgIV). Hay que señalar, no obstante, que solo fueron incluidos 11 pacientes en este ensayo38. Florescu et al tampoco pudieron demostrar que la administración periódica de IgIV tuviera un efecto aparente sobre la mortalidad o la supervivencia del injerto en un estudio retrospectivo basado en una cohorte reducida y heterogénea integrada por receptores de diversos tipos de TOS39. Según nuestro conocimiento, no se ha publicado hasta ahora ningún estudio de esta naturaleza enfocado específicamente a receptores de TR. A esta limitada evidencia disponible hay que añadir que la reposición periódica con IgIV constituye una terapia de coste elevado y no exenta de riesgos (fenómenos tromboembólicos arteriales y venosos, reacciones transfusionales o hemólisis)40,41.
NIVELES SÉRICOS DE COMPONENTES DEL SISTEMA DEL COMPLEMENTO
El sistema del complemento actúa como un instrumento efector de la respuesta inmune tanto innata como adaptativa en tareas que incluyen la opsonización de bacterias encapsuladas (mediada fundamentalmente por los componentes C3b y C4b), la puesta en marcha de reacciones anafilactoides (componentes C3a y C5a), el aclaramiento de inmunocomplejos circulantes o la inducción de lisis celular por parte del complejo de ataque a la membrana (componentes C5b a C9)42. Sus tres vías de activación reconocen diversas señales, bien sean mediadas por anticuerpos (porción Fc de IgM e IgG) o independientes de estos (secuencias poliméricas de la superficie de los microorganismos), y confluyen sobre C3, cuya activación resulta en la constitución de la convertasa de C5 (C4b-C2aC3b en las vías clásica y asociada a lectinas y [C3b]2Bb en la vía alternativa). La convertasa de C5, a su vez, pone en marcha el complejo de ataque a la membrana sobre la célula diana43.
La monitorización del sistema del complemento se ha realizado clásicamente mediante parámetros funcionales que cuantifican su capacidad hemolítica (CH50 para la vía clásica y AP50 para la alternativa)44. La relativa complejidad técnica de este abordaje, no obstante, limita su aplicabilidad en la práctica habitual. La determinación mediante nefelometría o análisis de inmunoabsorción ligada a enzimas (ELISA por sus siglas en inglés, enzyme linked immunosorbent assay) de los niveles séricos de algunos de sus componentes, como el C3, el C4 o la lectina fijadora de manosa (MBL por sus siglas en inglés, mannose-binding lectin), supone una alternativa más accesible45. Otra aproximación consiste en el análisis de los determinantes genéticos que modulan la concentración sérica de la MBL. Ha sido caracterizada una serie de polimorfismos de nucléotido único (SNP por sus siglas en inglés, single nucleotide polymorphisms) en el exón 1 y en la región promotora del gen MBL2, localizado en el cromosoma 10 y que codifica dicho componente de la vía de las lectinas46. Los alelos variantes de estos SNP originan defectos en la expresión del gen y en la polimerización de la proteína que son en gran parte responsables de la amplia variabilidad interpersonal observada en la concentración sérica de la MBL. Así, se estima que hasta la tercera parte de la población mundial presenta niveles deficientes de MBL, con notables diferencias étnicas en su distribución47.
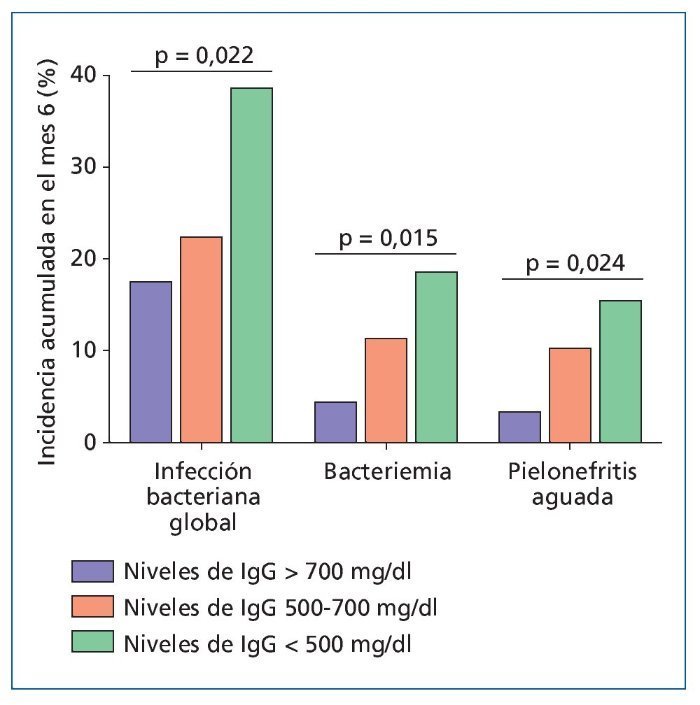
La utilidad de la monitorización de ciertos componentes del sistema del complemento a la hora de individualizar el riesgo de infección tras el TR ha sido evaluada en varios estudios. Nuestro grupo determinó las concentraciones de C3 y C4 en situación basal (pretrasplante) y en los meses primero y sexto postrasplante en una cohorte de 270 pacientes48. Como era previsible a la luz de la posición clave que ocupa C3 en la cascada del complemento, este biomarcador se reveló más útil que C4. En concreto, la hipocomplementemia C3 (HCC3) en el primer mes (definida por niveles séricos de C3 < 84 mg/dl) estuvo presente en el 20% de los receptores y fue identificada como un factor de riesgo independiente para el desarrollo de infección global (HR: 1,91) y bacteriana (HR: 2,13) durante el período intermedio (meses 1 a 6 postrasplante) (figura 2). La HCC3 en el sexto mes también se asoció con el desarrollo de infección bacteriana tardía (HR: 3,34). Es destacable que la mortalidad de cualquier causa también estuvo incrementada de forma significativa entre los pacientes que presentaron HCC3 en el primer mes48. Otros autores han comunicado asociaciones similares entre las concentraciones séricas de C3 y la incidencia de infección en receptores de trasplante cardíaco49 y hepático50.
Figura 2. Incidencia acumulada en el sexto mes postrasplante de diversos tipos de infección en 270 receptores de TR con y sin hipocomplementemia C3 (definida por niveles séricos < 84 mg/dl) en el primer mes. Modificado de Fernández-Ruiz et al48. CMV: citomegalovirus. *p < 0,05; **p < 0,01.
La inmunidad innata y la adaptativa ejercen funciones parcialmente complementarias. Se ha sugerido que la inmunosupresión que acompaña al TOS, al actuar de forma preferente sobre la respuesta adaptativa, permite poner de manifiesto deficiencias constitutivas en el sistema del complemento que carecen de impacto clínico aparente en el huésped inmunocompetente51. Esta hipótesis cobra especial relevancia al considerar el efecto de los niveles de la MBL y de sus determinantes genéticos sobre la susceptibilidad a la infección postrasplante. Por ejemplo, Manuel et al publicaron un caso muy ilustrativo de bacteriemia por meningococo (una bacteria encapsulada) en un receptor de TR con valores normales de C3, C4 y CH50, pero con niveles indetectables de MBL52. Broeders et al observaron un mayor riesgo de sepsis y de infección respiratoria en receptores de TR con niveles disminuidos de MBL24. En un estudio basado en 152 receptores de trasplante reno-pancreático simultáneo, Verschuren et al demostraron que cada incremento de 500 ng/ml en la concentración basal de la MBL se asociaba a un descenso en el riesgo posterior de infección del tracto urinario (OR: 0,83) y de sepsis de origen urológico (OR: 0,68)53. Todos estos hallazgos son congruentes con la mayor incidencia de shock séptico y otras infecciones que ha sido demostrada en receptores de injertos hepáticos procedentes de donantes portadores del alelo variante (O) en el exón 1 del gen MBL2 en comparación con los que reciben órganos de sujetos con el alelo salvaje (hay que señalar que la MBL se sintetiza mayoritariamente en el hígado, por lo que el genotipo del donante es el principal factor que determina sus niveles séricos tras el trasplante hepático)54,55.
El papel de la MBL como molécula de reconocimiento de patrones (PRM por sus siglas en inglés, pattern recognition molecule) explica igualmente su participación en la inmunidad antiviral. Se ha observado una mayor incidencia de infección asintomática y de enfermedad por CMV tras la interrupción de la profilaxis con valganciclovir en receptores de TR de alto riesgo (donante seropositivo/receptor seronegativo) con los niveles de la MBL disminuidos (< 500 ng/ml) en la determinación basal56. En el contexto del trasplante hepático57 y pulmonar58 se han comunicado resultados similares. Por el contrario, el estudio de Segedal et al no pudo concluir que los niveles basales de la MBL modificaran el riesgo de infección o de enfermedad por CMV en receptores de TR, si bien los autores describieron una asociación entre esta complicación y la concentración de la proteína 2 de serina-lectina fijadora de manosa (MASP-2 por sus siglas en inglés, mannose-binding lectin-associated serine protease 2), una proteasa involucrada en la vía de activación asociada a las lectinas59. No se ha observado, sin embargo, que la incidencia de nefropatía por poliomavirus BK esté incrementada en receptores deficientes en MBL60.
CUANTIFICACIÓN DE LAS SUBPOBLACIONES LINFOCITARIAS EN LA SANGRE PERIFÉRICA
El empleo del recuento en la sangre periférica de determinadas subpoblaciones linfocitarias como marcador subrogado del grado de inmunosupresión postrasplante y, por tanto, del riesgo de infección, supone una extrapolación plausible al contexto del TR de la experiencia adquirida en otros tipos de huéspedes inmunodeprimidos8. Por ejemplo, el recuento de linfocitos T CD4+ se usa desde hace décadas para estratificar el riesgo de infección oportunista en pacientes infectados por el virus de la inmunodeficiencia humana (VIH) y para establecer la indicación de profilaxis61. Se ha propuesto un abordaje similar para la linfocitopenia T CD4+ idiopática62. Por otra parte, el uso de agentes depletores linfocitarios es frecuente en receptores de TR, ya sea como tratamiento de inducción o tras el desarrollo de un rechazo celular. Tanto los anticuerpos monoclonales anti-CD3 (muromonab-CD3 [OKT-3]) y anti-CD25 (alemtuzumab) como los policlonales (globulina antitimocítica de conejo o de caballo) ejercen un profundo impacto sobre el recuento linfocitario en sangre periférica que puede extenderse hasta más allá del primer año tras su administración63,64. El incremento del riesgo de infección postrasplante vinculado a estas terapias está bien contrastado65,66 y justifica las actuales recomendaciones de estrategias específicas de prevención frente a la infección por CMV67,68. De forma análoga y siguiendo la pauta establecida en los pacientes con VIH, las guías de práctica clínica de la National Comprehensive Cancer Network (NCCN) contemplan la monitorización de los linfocitos T CD4+ con el fin de individualizar la duración de la profilaxis frente a Pneumocystis jirovecii en pacientes oncohematológicos previamente tratados con alemtuzumab o análogos de las purinas69.
Sobre la base de estas evidencias preliminares, son varios los estudios que han demostrado que los receptores de TR con recuentos disminuidos de linfocitos T CD4+ afrontan una mayor incidencia de infecciones por patógenos oportunistas (predominantemente intracelulares), con especial relevancia en el caso de P. jirovecii70-72. En un estudio reciente, el número de linfocitos T CD4+ fue significativamente menor en pacientes con neumonía por P. jirovecii respecto al grupo control, integrado por receptores de TR que también habían sido sometidos a un lavado broncoalveolar, pero en los que no se identificó este microorganismo (242 frente a 412 células/mm3). En el análisis multivariante, la presencia de linfocitopenia absoluta (< 750 células/mm3) a lo largo de los 50 días previos al diagnóstico actuó como un factor de riesgo independiente para el desarrollo de esta complicación73. Algunos autores han sugerido que la administración generalizada de profilaxis con trimetoprim-sulfametoxazol durante los primeros meses tras el TR está retrasando el período de riesgo clásicamente asumido para la infección por P. jirovecii, con un aumento progresivo de casos de aparición muy tardía (a partir del primer año postrasplante)73-75. De este modo, la monitorización selectiva del recuento de linfocitos T CD4+ tras determinados eventos que obliguen a incrementar el tratamiento inmunosupresor (el diagnóstico de un rechazo agudo, por ejemplo) permitiría identificar a aquellos pacientes que podrían beneficiarse de la prolongación o reintroducción de la profilaxis frente a Pneumocystis, en una estrategia de evaluación individual del riesgo de infección.
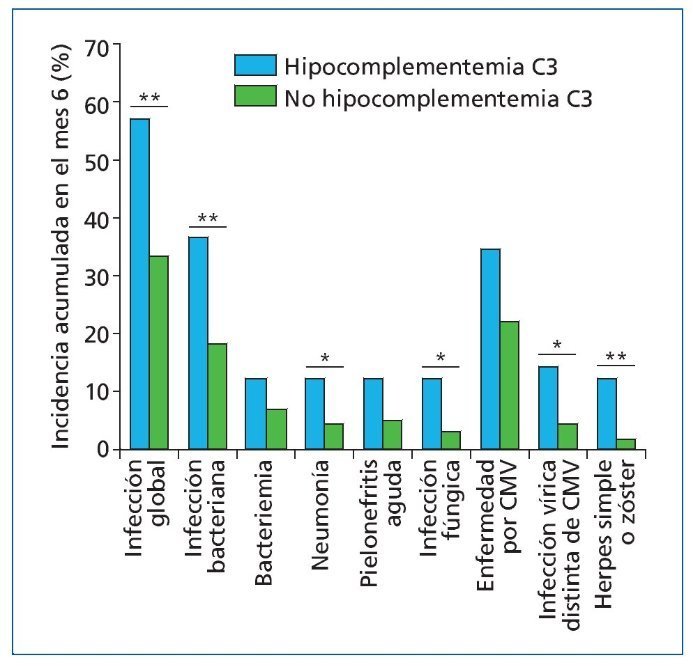
En el escenario específico del receptor de TR con infección por el VIH, Carter et al observaron que la presencia de un recuento de linfocitos T CD4+ < 200 células/mm3 a lo largo del seguimiento se asoció al desarrollo de infección grave (y no solo oportunista), si bien el tamaño muestral analizado era pequeño (n = 20). Como cabía esperar, los pacientes sometidos a inducción con globulina antitimocítica mantuvieron recuentos linfocitarios más bajos que los que recibieron anticuerpos monoclonales anti-CD2576. En una cohorte de 42 receptores de TR, en su mayor parte tratados con basiliximab, Calarota et al comprobaron que el recuento de linfocitos T CD8+ durante los 8 primeros meses postrasplante fue consistentemente menor entre los pacientes que presentaron alguna infección oportunista77. Nuestro grupo también ha explorado esta estrategia de monitorización inmunológica en 304 receptores de TR en los que llevamos a cabo la determinación de linfocitos totales y de diversas subpoblaciones linfocitarias (linfocitos T CD4+ y CD8+, linfocitos B y células natural killer [NK]) en varios puntos (situación basal y meses primero y sexto)78. Como primer hallazgo, comprobamos que la cinética de cada una de estas subpoblaciones difería marcadamente según el tipo de terapia de inducción administrada. Así, el recuento de linfocitos T CD4+ presentó un acusado nadir al primer mes en los pacientes tratados con globulina antitimocítica policlonal, mientras que aumentaba ligeramente respecto al basal entre los que no recibieron inducción o esta consistió en basiliximab. La cinética de los linfocitos T CD8+ fue similar, aunque con diferencias menos evidentes (figura 3). Por este motivo, analizamos de forma separada en cada uno de estos dos grupos el papel predictivo de las subpoblaciones linfocitarias mediante curvas características de operación del receptor (ROC por sus siglas en inglés, receiver operating characteristic). Entre los pacientes que recibieron globulina antitimocítica, la presencia de linfocitopenia T CD4+ (definida por un recuento < 50 células/mm3) en el primer mes se asoció al desarrollo de infección oportunista y, particularmente, de enfermedad por CMV durante el período posterior (meses 1 a 6). En el grupo sin inducción o tratado con basiliximab, fueron los linfocitos T CD8+ los que exhibieron mejor capacidad predictiva, de forma que la presencia de linfocitopenia a expensas de esta subpoblación (recuento < 100 células/mm3) incrementó de forma significativa el riesgo de infección oportunista global (HR: 3,55) y de enfermedad por CMV (HR: 4,19). Cabe destacar que ambos puntos de corte presentaron excelentes valores predictivos negativos (superiores al 83%) para el posterior desarrollo de infección, lo cual permitiría individualizar un subgrupo de receptores de muy bajo riesgo en los cuales sería factible discontinuar las profilaxis habituales78. Recientemente hemos comunicado una asociación similar entre el recuento de células NK y el riesgo de infección fúngica invasora tras el TOS79. Por último, la validez de la monitorización de ciertas subpoblaciones en la sangre periférica (linfocitos T CD4+ y CD8+) como aproximación al estado neto de inmunosupresión también se ha visto corroborada en una serie de estudios centrados en el desarrollo de la neoplasia de novo postrasplante80-83.
Figura 3. Cinética postrasplante de diversas subpoblaciones linfocitarias en sangre periférica en función del tipo de tratamiento de inducción administrado: A) linfocitos T CD4+. B) linfocitos T CD8+. Modificado de Fernández-Ruiz et al78. *p < 0,05; **p < 0,01.
CONCENTRACIÓN DE LA FORMA SOLUBLE DE LA CD30
La CD30 es una glucoproteína transmembrana perteneciente a la superfamilia del receptor del factor de necrosis tumoral y del factor de crecimiento neural84. Clásicamente empleada como marcador de la célula de Reed-Sternberg en el linfoma de Hodgkin85, se ha comprobado que la CD30 también se expresa en linfocitos T y B normales, células NK y células dendríticas86. Si bien su misión aún no ha sido dilucidada por completo, se cree que participa en la regulación del balance Th1/Th2 de la respuesta celular y en la generación de linfocitos T de memoria87. Se ha comprobado que la coestimulación con células que expresan la CD30 induce a los linfocitos T a polarizarse en sentido Th2 y a sintetizar el correspondiente repertorio de citoquinas (como la interleucina 4 [IL-4] o la IL-13)88,89. Además de la forma de superficie celular (de 120 kDa), existe una forma soluble de 85 kDa (sCD30) generada tras la separación enzimática de su porción extracelular por parte de la metaloproteasa enzima de conversión del factor de necrosis tumoral alfa (TACE por sus siglas en inglés, tumor necrosis factor-alpha converting enzyme)90 y que es liberada al plasma durante el proceso de activación de los linfocitos T91.
La monitorización de la sCD30 ha recibido una creciente atención en los últimos años como estrategia de monitorización inmunológica en el TR86,92. Varios estudios han mostrado que los niveles basales de la sCD30 se relacionan de forma inversa con la supervivencia del injerto, a expensas fundamentalmente de una mayor incidencia de rechazo entre los receptores con concentraciones séricas más elevadas92-96. Süsal et al comunicaron que este efecto deletéreo sobre el pronóstico del injerto es sinérgico al ejercido por la sensibilización pretrasplante (panel reactive antibody [PRA] > 5%) o el número de incompatibilidades de los antígenos leucocitarios humanos (HLA por sus siglas en inglés, human leukocyte antigen) entre donante y receptor97. Estos hallazgos han llevado a sugerir que los niveles elevados de la sCD30, en su condición de marcador de activación de la subpoblación linfocitaria Th2, son un mejor predictor del riesgo de rechazo humoral que del riesgo de rechazo celular86,98.
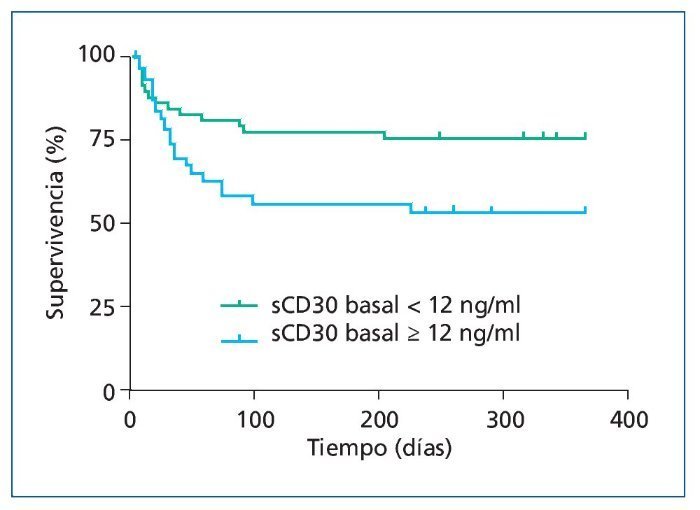
La utilidad de la sCD30 como biomarcador del riesgo de infección postrasplante ha sido explorada en un número reducido de trabajos que por desgracia han proporcionado resultados discordantes. Un estudio realizado entre receptores de TR demostró que los pacientes que sufrieron algún episodio de neumonía postrasplante partían de niveles basales de sCD30 significativamente menores respecto a los que permanecieron libres de esta complicación (123 frente a 151 UI/ml)99. Nikaein et al también observaron que las concentraciones pretrasplante reducidas (< 90 UI/ml) de sCD30 se asociaban a un mayor riesgo de infección tras el trasplante cardíaco100. Sin embargo, estos mismos autores comunicaron la asociación inversa (niveles basales más elevados de sCD30 en pacientes con infección posterior) en el contexto del TR101. En un intento de aportar luz en esta discordancia, analizamos mediante un kit comercial de ELISA la concentración de sCD30 tanto en situación basal como en varios puntos postrasplante en 101 receptores de TR. En nuestra experiencia, los niveles basales de este biomarcador fueron significativamente mayores en pacientes con infección bacteriana (pero no en infección global o por CMV) a lo largo de los primeros 12 meses postrasplante. La supervivencia libre de infección bacteriana fue significativamente menor entre los receptores con niveles basales de sCD30 ≥ 12 ng/ml (figura 4), asociación que se mantuvo después de ajustar por otras variables en un modelo multi-variante (HR: 4,1). Como explicación proponemos que el nivel de la sCD30 actúa fundamentalmente como un marcador de actividad de los linfocitos Th2, los cuales ofrecen una respuesta protectora frente a patógenos bacterianos menos eficaz que los linfocitos con diferenciación Th1 o Th17. En la misma línea, se ha demostrado que los pacientes sometidos a diálisis crónica con concentraciones elevadas de la sCD30 presentan mayor riesgo de infección o de neoplasia86.
Figura 4. Supervivencia libre de infección bacteriana a lo largo del primer año postrasplante en una cohorte de 101 receptores de trasplante renal según los niveles séricos de la forma soluble de la CD30 (sCD30) en situación basal. Fernández-Ruiz et al (datos no publicados).
P para la diferencia entre ambos grupos [test de rangos logarítmicos] = 0,012.
VIREMIA POR VIRUS DE EPSTEIN-BARR Y ANELLOVIRUS
La última estrategia revisada se basa en la determinación periódica, mediante técnicas moleculares (reacción en cadena de la polimerasa [PCR por sus siglas en inglés, polymerase chain reaction]), de la carga viral en sangre completa o en muestras acelulares (plasma o suero) de determinados virus que desarrollan una infección latente en el hospedador y cuyo control replicativo depende fundamentalmente de la inmunidad celular adaptativa. La reactivación de estos virus latentes (presentes en la mayor parte de la población adulta), aunque asintomática, vendría a constituir un parámetro subrogado del grado de funcionalidad de la respuesta inmune. De confirmarse esta hipótesis podríamos disponer de biomarcadores muy sensibles que actuarían como una suerte de «sumatorio funcional» de la carga global de inmunosupresión. Son fundamentalmente dos los agentes explorados hasta ahora con esta finalidad: el virus de Epstein-Barr (VEB) y los anello-virus.
El VEB es un virus herpes gamma que presenta la capacidad, gracias a un amplio repertorio de mecanismos de evasión inmune, de establecer una infección latente en el compartimento de linfocitos B que dura toda la vida del huésped102. Dado que su control depende de la inmunidad celular adaptativa, se ha comprobado que la reactivación del VEB es un fenómeno frecuente en receptores de TOS103-105. Si bien este fenómeno replicativo es subclínico en la mayor parte de las ocasiones, puede llegar a producir daño orgánico directo o contribuir indirectamente a la patogénesis del síndrome linfoproliferativo postrasplante106. Varios grupos, incluyendo el nuestro, han trabajado con la viremia del VEB como marcador de competencia funcional de la respuesta inmune celular en receptores de trasplante cardíaco, pulmonar y renal107-109. Por ejemplo, hemos observado que la demostración mediante la PCR cuantitativa en sangre completa de viremia persistente (más de 30 días) o elevada (más de 1.500 copias/ml) a lo largo de los 6 primeros meses postrasplante se asocia al desarrollo de complicaciones tardías por exceso de inmunosupresión, como infección oportunista o neoplasia de novo108.
Los anellovirus son virus de pequeño tamaño carentes de envoltura, dotados de un genoma circular de ADN de cadena simple e integrados en la familia Anelloviridae. En 1997 fue identificado el primer anellovirus, denominado «torque teno virus (TTV)»110, seguido 3 años después del torque teno minivirus (TTMV)111. Los anellovirus exhiben una gran diversidad genética, por lo que la taxonomía de esta familia se ha ido ampliando hasta quedar definida en torno a nueve géneros y decenas de especies diferentes112. La primoinfección tiene lugar en edades tempranas a través de diversas vías (perinatal, respiratoria o fecal-oral), tras lo que establecen una infección latente, fundamentalmente en células mononucleares de sangre periférica113. De este modo, la prevalencia de infección por TTV y TTMV en población general adulta supera el 90% y su replicación transitoria a bajo nivel es frecuente entre sujetos inmunocompetentes114. Hasta el momento, no ha sido demostrado ningún efecto patogénico directamente atribuible en el ser humano (son virus huérfanos). No obstante, varios estudios han demostrado que la reactivación de la infección latente es más frecuente en pacientes con enfermedades crónicas debilitantes o cáncer en comparación con sujetos sanos115,116. Este hallazgo podría ser explicado por el papel fundamental que la inmunidad mediada por células desempeña en el control de la replicación viral. Por ejemplo, existe una correlación inversa entre la carga viral de TTV y el recuento de linfocitos T CD4+ en pacientes con infección por el VIH117. Por otra parte, se ha demostrado que los pacientes en hemodiálisis crónica presentan con más frecuencia viremias elevadas (> 5 x 103 copias/ ml) de TTV respecto a los controles sanos118. Basándose en esta evidencia, algunos autores han tratado de evaluar la potencial utilidad que la monitorización de la viremia por anellovirus (fundamentalmente por TTV) podría tener como aproximación a la carga global de inmunosupresión en diversos tipos de receptores de TOS, incluyendo el renal119, el hepático120,121 y el pulmonar122. Si bien adolecen de tamaños muestrales reducidos, escasa frecuencia de monitorización o ausencia de correlato con eventos clínicos bien definidos, estos estudios preliminares representan una «prueba de concepto» prometedora.
CONCLUSIONES Y PERSPECTIVAS FUTURAS
Como se ha tratado de exponer en esta revisión, la aplicación de estrategias de monitorización inmunológica basadas en biomarcadores no patógeno específicos en receptores de TR ofrece la posibilidad de individualizar el riesgo de complicación infecciosa postrasplante y de optimizar así los resultados a largo plazo de este procedimiento. Si bien se han realizado prometedores avances en este sentido a lo largo de los últimos años, la experiencia clínica basada en estudios de intervención es hasta el momento muy limitada. Los mecanismos moleculares y celulares implicados en la respuesta inmune frente a la infección son complejos y con frecuencia redundantes. Por ello, el diseño de cualquier estrategia de monitorización debe ponderar la sensibilidad y especificidad del parámetro empleado, por un lado, y su sencillez técnica y aplicabilidad por otro. La elaboración de un score multidimensional que incorpore varios de estos biomarcadores y que permita asignar un riesgo concreto de infección a cada receptor de TR podría facilitar de forma notable el proceso de decisión clínica.
Financiación
Algunos de los resultados presentados en esta revisión han sido obtenidos en estudios financiados por el Instituto de Salud Carlos III, Ministerio de Economía y Competitividad (Fondo de Investigaciones Sanitarias [FIS] 11/01538 y Proyecto Integrado de Excelencia [PIE] 13/00045), y por la Fundación Mutua Madrileña de Investigación Médica (FMM 2010/0015). Mario Fernández Ruiz disfruta de un contrato de investigación clínica Juan Rodés (JR 14/00036) del Instituto de Salud Carlos III, Ministerio de Economía y Competitividad.
Conflicto de intereses
Los autores declaran que no tienen conflictos de intereses potenciales relacionados con los contenidos de este artículo.
Correspondencia:
Mario Fernández Ruiz
Unidad de Enfermedades Infecciosas. Hospital Universitario 12 de Octubre, Madrid.
mario_fdezruiz@yahoo.es