El diagnóstico actual del rechazo agudo es tardío (cuando ha dado lugar a disfunción renal) o invasivo (biopsia renal que confirma la sospecha clínica o biopsias de protocolo que diagnostican el rechazo agudo subclínico). Sería deseable disponer de biomarcadores que permitieran la monitorización y diagnóstico precoz no invasivo del rechazo agudo. Estos biomarcadores podrían representar la respuesta inmune frente al injerto o la inflamación renal que caracteriza histológicamente al rechazo. Estudios recientes han evaluado la cuantificación en orina de mRNA que codifica proteínas implicadas en el rechazo renal o quimioquinas inducidas por interferón como biomarcadores no invasivos de rechazo agudo. La evaluación de mRNA urinario es cara, compleja y la muestra es evaluable en una proporción insuficiente de casos para uso rutinario. Sin embargo, la determinación en orina de quimioquinas activadoras de CXCR3, como CXCL9 y CXCL10, es prometedora para el diagnóstico temprano del rechazo agudo humoral, celular o mixto. Los niveles urinarios de CXCL9 y CXCL10 aumentan en orina antes de que se diagnostique el rechazo con la metodología actual y pueden mejorar el diagnóstico del rechazo humoral en conjunción con la determinación de anticuerpos donante-específicos. Sin embargo, los niveles urinarios aumentan en otras formas de inflamación renal, incluida la infección, y los estudios disponibles hasta ahora son observacionales. Antes de la incorporación a la práctica clínica rutinaria, sería necesario realizar ensayos clínicos en los que se usaran los niveles de quimioquinas urinarias para tomar decisiones diagnósticas o terapéuticas y se evaluara el impacto pronóstico.
Current diagnosis of acute rejection is established late (after the development of renal dysfunction) or is invasive (through renal biopsy confirming clinical suspicion or protocol biopsies that diagnose acute subclinical rejection). There is a need for biomarkers that would allow monitoring and early non-invasive diagnosis of acute renal rejection. Such biomarkers could reflect the immune response to the kidney graft or the renal inflammation that histologically characterizes rejection. Recent studies have assessed urinary quantification of mRNA codifying the proteins involved in rejection or interferon-induced chemokines as non-invasive bio-markers of acute rejection. Urinary mRNA assessment is expensive and complex and the number of patients whose sample can be assessed is too small for its routine use. However, urinary determination of CXCR3-activating chemokines, such as CXCL9 and CXCL10, is promising for the early diagnosis of acute cellular, humoral or mixed cellular and humoral rejection. Urinary CXCL9 and CXCL10 levels are increased in urine before diagnosis of rejection with current methods and can improve the diagnosis of humoral rejection when used in conjunction with donor-specific antibodies. However, urinary levels are increased in other forms of renal inflammation, including infection, and the available studies to date are observational. Before the inclusion of these biomarkers in routine clinical practice, clinical trials are needed that use urinary chemokine levels for clinical or therapeutic decision-making and that evaluate their prognostic impact.
INTRODUCCIÓN
El trasplante es la terapia renal sustitutiva que ofrece mayor supervivencia y mejor calidad de vida en pacientes con enfermedad renal crónica avanzada1. Los avances en inmunosupresión y monitorización han mejorado la morbilidad a medio y largo plazo. No obstante, durante el primer año postrasplante, entre el 9 y el 14% de los receptores sufren un rechazo agudo2, que puede tener, a largo plazo, un impacto negativo sobre la supervivencia del injerto y conducir a una disfunción crónica del mismo3. El rechazo agudo es el mayor predictor de disfunción crónica del injerto. Es esencial para el manejo del trasplantado renal evitar o retrasar la progresión hacia disfunción crónica del injerto mediante el diagnóstico precoz de rechazos agudos. Los marcadores validados disponibles actualmente para monitorizar el rechazo, como el incremento de la creatinina o el aumento de la proteinuria, son tardíos e inespecíficos. Por tanto, el patrón oro actual para el diagnóstico del rechazo del injerto es la biopsia renal4. Este es, sin embargo, un método invasivo, costoso y con posibilidad de complicaciones (hematuria, anuria, hematoma perirrenal, hemorragia y shock, fístula arteriovenosa e incluso pérdida del injerto). Además, la interpretación de la biopsia es subjetiva y dependiente del observador.
El rechazo agudo se clasifica, según criterios analíticos, en clásico, si se acompaña de un incremento de la creatinina, y subclínico, si la creatinina no cambia. El rechazo agudo subclínico se diagnostica mediante biopsias de protocolo, realizadas en fechas prefijadas, y no sobre la base de hallazgos clínicos o analíticos. Ambas formas de rechazo pueden ser, según criterios histológicos, humorales o celulares5. La gravedad del rechazo se define según la intensidad de la glomerulitis, la endotelitis/arteritis y la inflamación tubulointersticial en la clasificación de Banff5. Observamos que estos términos hacen referencia a la inflamación de diferentes nichos renales, por lo que se puede hipotetizar que el uso de métodos no invasivos para monitorizar el grado de inflamación renal podría ser útil para detectar el rechazo.
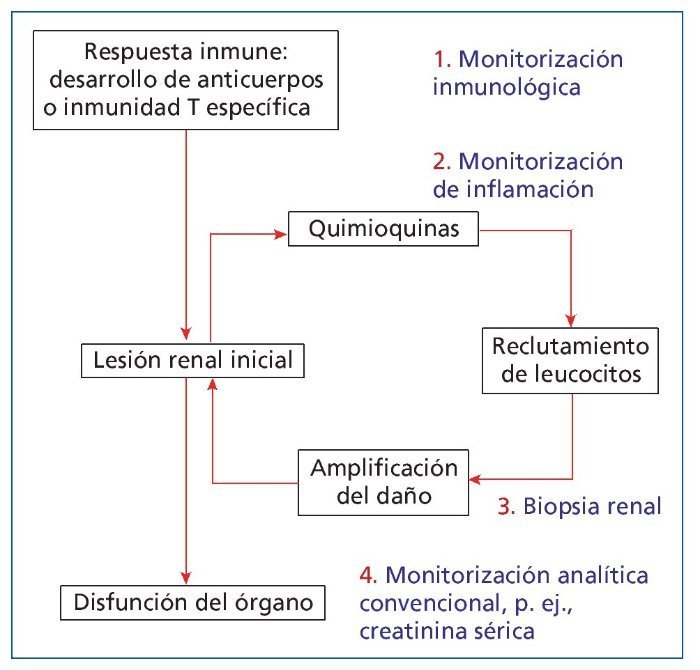
Con estas premisas, es necesario desarrollar pruebas diagnósticas incruentas y biomarcadores con alta sensibilidad y especificidad que se modifiquen de forma precoz ante el inicio del rechazo, que sean capaces de evaluar el riesgo inmunológico y de orientar la toma de decisiones, y que disminuyan la necesidad de realizar biopsias renales4,6. En este artículo, revisaremos el estado actual de los biomarcadores de inflamación para predecir y diagnosticar el riesgo inmunológico del injerto o guiar las decisiones terapéuticas tras el trasplante renal, y su posible aplicación a la práctica clínica diaria (figura 1).
Figura 1. Situación de los marcadores de inflamación renal dentro de la secuencia de acontecimientos que lleva al diagnóstico del rechazo agudo. Los números hacen referencia a la secuencia temporal de acontecimientos y, por lo tanto, a la precocidad teórica con la que la determinación de parámetros representativos de ese fenómeno puede permitir el diagnóstico de rechazo.
INFLAMACIÓN DEL INJERTO RENAL
De entre los diversos componentes de la respuesta inflamatoria, las quimioquinas son moléculas particularmente atractivas cuando se quiere evaluar la inflamación de forma precoz o el grado de actividad de la respuesta inflamatoria. En efecto, las quimioquinas son citoquinas quimiotácticas secretadas por las células parenquimatosas y del sistema inmune, en respuesta al estrés celular o a los amplificadores de la inflamación. Así pues, pueden ser la primera evidencia de que una célula renal está expuesta a un estrés y preceden a la infiltración masiva de leucocitos en respuesta a las propias quimioquinas, al daño tisular consecuencia de esta infiltración y a la disfunción del órgano como consecuencia de la lesión tisular. Asimismo, el cese de la respuesta inflamatoria implica que se dejan de producir quimioquinas y, por lo tanto, de atraer nuevos leucocitos al foco infamatorio.
Los interferones están implicados en el rechazo, por lo que se ha prestado especial atención a las quimioquinas producidas por células renales en respuesta a interferones y que, además, atraen linfocitos T, células clave del rechazo. Sin embargo, las quimioquinas son promiscuas desde todos los puntos de vista: numerosos tipos celulares diferentes pueden secretar múltiples quimioquinas, cada una de ellas en respuesta a múltiples estímulos posibles, y, a su vez, las quimioquinas pueden con frecuencia activar varios receptores, que comparten con otras quimioquinas, y así atraer diversos tipos celulares7. De hecho, diversas moléculas proinflamatorias, además de los interferones, estimulan la producción de quimioquinas por las células renales, incluyendo citoquinas de la superfamilia del factor de necrosis tumoral (TNF, por sus siglas en inglés, tumour necrosis factor) y productos bacterianos, así como nefrotóxicos7-10. Por lo tanto, a priori, se esperaría que el hallazgo de niveles elevados de quimioquinas fuera inespecífico desde el punto de vista de la etiología (infecciosa o inflamación estéril) y que la magnitud del cambio estuviera más relacionada con la intensidad de la inflamación que con la etiología. Así, por ejemplo, hace más de 20 años ya se observó que tóxicos podocitarios que causan proteinuria elevaban la producción renal de la proteína inducible por interferón gamma 10 (IP-10, por sus siglas en inglés, interferon gamma-inducible protein 10) en ratas y que el TNF era un potente inductor de la producción de IP-10 por parte de las células renales11. Las quimioquinas atraen leucocitos durante la respuesta inmune y la inflamación12 mediante la activación de receptores transmembrana específicos acoplados a proteínas G13.
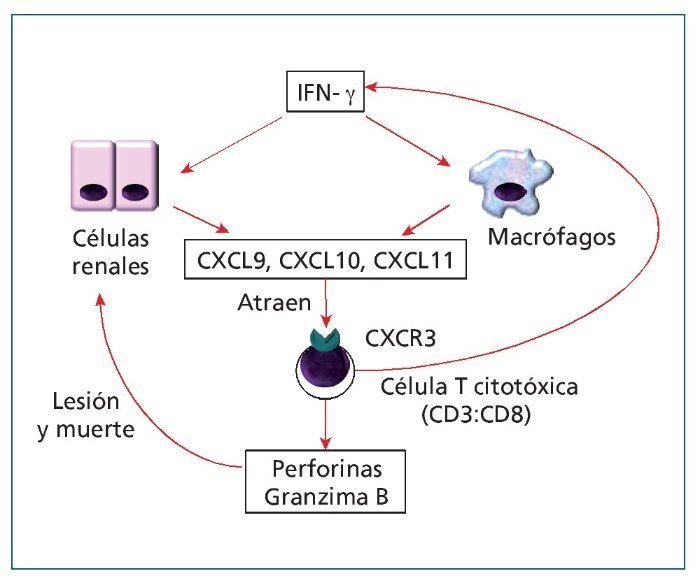
El CXCR3 es un receptor de quimioquinas expresado en los linfocitos T y B, y en las células natural killer (NK) que es activado por las quimioquinas CXCL11, CXCL10 y CXCL9, que atraen principalmente a linfocitos T activados, que tienen una alta expresión del CXCR314-16 (figura 2). Dos de las quimioquinas que activan el receptor CXCR3 (CXCL9 y CXCL10) se han relacionado con el desarrollo del rechazo agudo17,18. Sin embargo, tenemos que destacar que los estudios que han relacionado estas quimioquinas con el rechazo estaban diseñados sobre la base de hipótesis prestablecidas. Si bien esta es una forma ortodoxa de hacer ciencia, existe la posibilidad de que, debido al conocimiento limitado de la biología humana, no se hayan estudiado moléculas que podrían dar información más sensible y específica. Este tipo de aproximación, no sesgada, es característica de las aproximaciones ómicas, como la transcriptómica o la proteómica19-22.
Figura 2. Situación de los principales marcadores de inflamación renal mencionados dentro de la ruta inmunológica del rechazo agudo.
La inflamación del injerto renal puede tener diversas etiologías, además del rechazo, incluyendo la isquemia de reperfusión, la recidiva de la enfermedad de base, las infecciones bacterianas o virales, o los nefrotóxicos. En el injerto renal de donante cadáver, la inflamación precede a la implantación del órgano, como se ha podido demostrar en estudios transcriptómicos, como los recogidos en la base de datos Nephromine (www.nephromine.org). Se piensa que estos cambios son consecuencia de la muerte cerebral. Así, por ejemplo, en comparación con los riñones de donantes vivos o de pacientes con síndrome nefrótico de cambios mínimos, en el riñón de donante cadáver está aumentada la expresión génica de las quimioquinas CXCL9 y CXCL10, de la interleucina 18 (IL-18), de la quimiocina CCL2, de la quinasa apical de la vía no canónica del factor de transcripción proinflamatorio nuclear kappa B (NF-kB por sus siglas en inglés, nuclear factor kappa B), MAP3K14 y del receptor de la citoquina TWEAK (por sus siglas en inglés, TNF-like weak induced of apoptosis) de la superfamilia del TNF, TNFRSF12A. Sin embargo, está disminuida la expresión de KL, el gen que codifica el factor antienvejecimiento de origen renal Klotho. Estos resultados son interesantes porque ponen en contexto aquellos obtenidos en el trasplante renal humano que discutiremos a continuación: no solo el interferón, sino también citoquinas como el TWEAK, aumentan la expresión de quimioquinas en células tubulares y disminuyen la expresión de Klotho, que, a su vez, también tiene propiedades antinflamatorias y antifibróticas23-27.
ÁCIDO RIBONUCLEICO MENSAJERO URINARIO
El ácido ribonucleico mensajero (mRNA por sus siglas en inglés, messenger ribonucleic acid) en orina de pacientes trasplantados renales podría resultar informativo como biomarcador de rechazo agudo. Ya en el año 2001 se estudiaron 151 muestras de orina de 85 receptores de trasplante renal y se desarrollaron y describieron técnicas de cuantificación de mRNA de proteínas citotóxicas en las células urinarias, abriendo así una larga y compleja línea de investigación científica en ese ámbito28. De los 85 pacientes evaluados en este estudio, 38 fueron sometidos a biopsia renal, de los que se obtuvieron 44 muestras. Los niveles altos de mRNA de perforina y granzima B (proteínas de linfocitos T citotóxicos) y de CD3 (marcador de linfocitos T) en las células urinarias se asociaron al desarrollo de rechazo agudo de trasplante.
En 2013, se publicó el mayor estudio de mRNA urinario y rechazo de trasplante renal, que expuso tanto la promesa como las debilidades de esta aproximación. En 4.300 muestras de orina de 485 receptores de trasplante renal recogidas desde el tercer día de la intervención hasta los 12 meses posteriores (días postrasplante 3, 7, 15 y 30; y meses 2, 3, 4, 5, 6, 9, y 12; y en el momento de la biopsia y 2 semanas después) se evaluaron los niveles de mRNA de ocho marcadores asociados previamente al rechazo y se observó que tres estaban claramente relacionados con el rechazo agudo29. Los tipos de mRNA identificados fueron 18S ribosomal (rRNA), y el mRNA de CXCL10 y de CD3e, estos últimos normalizados por 18S mRNA. Los autores integraron los tres biomarcadores en un solo parámetro, una huella molecular estimada mediante una fórmula matemática (−6,1487 + 0,8534 log10[CD3ε/18S] + 0,6376 log10[IP-10/18S] + 1,6464 log10[18S]), que permitió establecer un valor de corte de –1,213. Este parámetro no aumentó con infecciones del tracto urinario, con bacteriemia ni con infecciones por citomegalovirus (CMV), pero sí se asoció con infección por virus BK (p = 0,03). Los autores concluyen que la determinación urinaria de estos tipos de mRNA podría tener valor diagnóstico y pronóstico del rechazo agudo celular sin biopsia renal, una vez descartada la infección por BK mediante métodos no invasivos. El estudio tenía ciertas limitaciones, como la imposibilidad de recoger todas las muestras de orina previas a las biopsias y, en algunos casos, el hecho de no cumplir los controles de calidad exigidos. Los pacientes seleccionados presentaron un bajo porcentaje de rechazo mediado por anticuerpos, por lo que no se puede validar para diagnóstico de rechazo humoral. Una desventaja de esta metodología es que solo el 83% de las muestras son válidas. En este sentido, las técnicas analíticas implicadas son caras y complejas, y aplicarlas para no disponer de un resultado válido en uno de cada seis pacientes es a priori cuestionable. Finalmente, el área bajo la curva (AUC por sus siglas en inglés, area under the curve) para el diagnóstico de rechazo se redujo desde 0,85 (intervalo de confianza [IC] del 95%, 0,78-0,91) en el estudio inicial a 0,74 (IC del 95%, 0,61-0,86) en la fase de validación externa, con un límite del intervalo de confianza muy cercano a 0,50.
QUIMIOQUINAS URINARIAS
Hay varios trabajos publicados que abordan la utilidad de la determinación de las quimioquinas urinarias, fundamentalmente la CXCL9 y la CXCL10, para el diagnóstico del rechazo agudo4,6. Comentaremos aquí los más destacados e ilustrativos del valor de estas quimioquinas.
Un estudio observacional, prospectivo y multicéntrico, con 280 receptores de injerto renal, estudió seis tipos de mRNA (CCR1, CXCR3, granzima B, IL-8, CXCL9 y CXCL10) y dos quimioquinas (la CXCL9 y la CXCL10) en orina. Los niveles de la CXCL9 o la CXCL10 urinarias fueron más altos en el rechazo agudo que en pacientes sin rechazo (otros diagnósticos), pero los niveles de la CXCL10 urinaria no diferenciaron el rechazo de infección19. La CXCL9 urinaria permitió diagnosticar el rechazo agudo con un área bajo la curva de 0,86, un valor predictivo positivo de 68% y un valor predictivo negativo de 92%, con lo que se podrían, idealmente, evitar biopsias renales en pacientes con sospecha clínica de rechazo y niveles bajos de la CXCL917 urinaria. La combinación de la proteína CXCL9 y el mRNA CXCL9 aportó resultados marginalmente mejores, con valor predictivo positivo de 71% y valor predictivo negativo de 92%, lo que no parece justificar la determinación añadida del mRNA17. Los niveles urinarios de la CXCL9 aumentaron un mes antes de la realización de una biopsia renal por sospecha clínica de rechazo agudo con diagnóstico de rechazo agudo. En este sentido, la CXCL9 en orina podría predecir el rechazo agudo y contribuir a realizar una biopsia renal antes, lo que facilitaría el tratamiento precoz del rechazo. Además, la monitorización de los niveles de la CXCL9 urinaria podría ayudar a la identificación de una adecuada resolución del rechazo agudo, si se tiene en cuenta que los niveles de dicho biomarcador disminuyeron tras 30 días de tratamiento con éxito del rechazo. Es más, existió una relación entre los niveles urinarios de la CXCL9 y los datos de inflamación del injerto (categorías i [inflamación intersticial] y t [tubulitis] de Banff) en biopsias de protocolo a los 6 meses. Finalmente, la medición de los niveles de la CXCL9 urinaria al sexto mes postrasplante renal permitiría estratificar los receptores en bajo y alto riesgo de rechazo renal, ya que existió una relación entre la CXCL9 urinaria elevada en el sexto mes y la aparición de rechazo clínico entre el sexto y el 24 mes postrasplante renal (odds ratio, 4,7; sensibilidad, 83%; especificidad, 84% [p = 0,005]). El AUC fue de 0,88; el valor predictivo negativo, de 99%, y el valor predictivo positivo, de 15%, lo que permitiría identificar receptores con bajo riesgo de rechazo. En este sentido, los niveles indetectables de la CXCL9 en orina predijeron una función estable del injerto a largo plazo con valor predictivo negativo para deterioro de la función renal por encima del 99%, independientemente de diversas características clínicas del paciente. En resumen, en este estudio, la CXCL9 urinaria global fue el parámetro con mejor comportamiento pronóstico y diagnóstico de rechazo agudo.
En otra cohorte de 244 receptores de trasplante renal muy sensibilizados (27% con anticuerpos antidonante) en los que se practicaron 281 biopsias renales, se observó una asociación significativa entre los niveles urinarios de la CXCL9 y de la CXCL10, sin normalizar o normalizados por la creatinina urinaria (CXCL9/CrU y CXCL10/ CrU), y la inflamación renal categorizada por la clasificación de Banff, tanto tubulointersticial (categorías i y t), como microvascular (categorías g [glomerulitis] y ptc [capilaritis peritubular])18. Sin embargo, no se evidenció relación de estas quimioquinas con los criterios de rechazo crónico de la clasificación de Banff18. Los niveles urinarios de la CXCL10 y del cociente CXCL10/CrU fueron más altos en el rechazo agudo y el cociente CXCL10/ CrU diagnosticó el rechazo agudo celular (AUC, 0,80; IC, 95%; 0,68 a 0,92), humoral (AUC, 0,76; IC, 95%; 0,69 a 0,82) y mixto (AUC, 0,82; IC, 95%; 0,74 a 0,90). El cociente CXCL10/CrU permitió estimar el riesgo de pérdida del injerto después de un rechazo humoral agudo. Además, la combinación del cociente CXCL10/CrU con los anticuerpos donante específicos inmunodominantes permitió mejorar el AUC para el diagnóstico de rechazo agudo humoral (sube de 0,75; IC, 95%; 0,68-0,82 hasta 0,83; IC, 95%; 0,77-0,89). La CXCL9 y el cociente CXCL9/CrU, sin embargo, se incrementaron de forma significativa en los rechazos mixtos y los rechazos celulares puros, pero no en los rechazos humorales puros. Las curvas características de operación del receptor (ROC por sus siglas en inglés, receiver operatingcharacteristic) mostraron superioridad de la CXCL9 y del cociente CXCL9/CrU (AUC, 0,86; IC, 95%; 0,74-0,98 y 0,90; IC, 95%; 0,84-0,97) respectivamente respecto a la CXCL10 y al cociente CXCL10/CrU en la predicción del rechazo agudo celular. En general, los valores predictivos positivos de la determinación de quimioquinas urinarias fueron menores (12 a 59%) que los valores predictivos negativos (84 a > 99% para el diagnóstico de rechazo agudo o sus modalidades). En resumen, el cociente CXCL10/Cr urinario tuvo el mejor comportamiento global en este estudio respecto a su asociación con el grado histológico de inflamación tubulointersticial y microvascular en el trasplante renal y la discriminación del rechazo, y su combinación con los niveles séricos de anticuerpos donante específicos mejoró el diagnóstico no invasivo del rechazo agudo humoral, aunque el cociente CXCL9/CrU tuvo mejor comportamiento para el diagnóstico del rechazo celular.
CONCLUSIONES
En resumen, diversas publicaciones han expuesto que la determinación en orina mediante un análisis de inmunoabsorción ligada a enzimas (ELISA por sus siglas en inglés, enzyme linked immunosorbent assay) técnicamente simple de quimioquinas activadoras del CXCR3 (la CXCL9 y la CXCL10) permite detectar inflamación renal diagnóstica de rechazo agudo incluso cuando esta es subclínica, ya que aumentan hasta un mes antes de un episodio diagnosticado por biopsia de rechazo agudo, disminuyen en respuesta al tratamiento antirrrechazo y pueden llegar a predecir la disfunción posterior del injerto. Sin embargo, pueden aumentar en otras condiciones asociadas a inflamación renal, como infección viral o bacteriana, y no existen puntos de corte bien definidos ni ensayos validados para su uso clínico. La otra aproximación, la determinación de niveles urinarios del mRNA, resulta más compleja, no ofrece ventajas frente a la determinación de quimioquinas y presenta una tasa inaceptable de estudios no válidos para la práctica de la medicina en el siglo XXI. En general, los estudios disponibles sobre el potencial biomarcador de la determinación urinaria de las quimioquinas o del mRNA de moléculas inflamatorias son observacionales. Por lo tanto, no han podido demostrar la utilidad clínica de estas determinaciones. Para ello se necesitarían ensayos clínicos en los que se evaluara si los resultados del estudio de las quimioquinas urinarias permiten tomar decisiones clínicas (por ejemplo, biopsiar o no biopsiar, modificar el tratamiento o no modificarlo) que mejoren el pronóstico de los pacientes. Por otra parte, la forma de seleccionar los marcadores que se han estudiado hasta ahora (derivada de hipótesis) no garantiza que estos sean los mejores biomarcadores posibles. Sería necesario realizar estudios no sesgados de tipo ómico para identificar posibles biomarcadores urinarios de inflamación que en estos momentos no se puedan proponer basándose en hipótesis debido al conocimiento insuficiente de la biología humana30 . Finalmente, es muy posible que en el trasplante renal, al igual que ocurre en otros campos de la medicina e incluso de la nefrología, el uso simultáneo de varios biomarcadores (un panel de biomarcadores) proporcione información más sensible y específica que el estudio de un solo biomarcador19-22.
En conclusión, los biomarcadores urinarios de inflamación no están listos para su uso clínico en 2016.
Agradecimientos
Fondo de Investigación en Salud (FIS), PI13/00047, Instituto de Salud Carlos III-Redes Temáticas de Investigación Cooperativa en Salud (RETICS)- Red de Investigación Renal (REDinREN) RD12/0021-Fondo Europeo de Desarrollo Regional (FEDER), Sociedad Española de Nefrología, Sociedad Española de Trasplante, Fundación Renal Íñigo Álvarez de Toledo (FRIAT), Comunidad de Madrid/ CIFRA S2010/BMD-2378. FIS a BFF (Joan Rodés), Programa Intensificación Actividad Investigadora a AO.
Conflicto de intereses
Los autores declaran que no tienen conflictos de intereses potenciales relacionados con los contenidos de este artículo.
Correspondencia:
Alberto Ortiz
Dialysis Unit. Fundación Jiménez Díaz, Madrid.
aortiz@fjd.es