Los pacientes con enfermedad renal crónica (ERC) tiene alto riesgo de morbimortalidad cardiovascular. Las alteraciones estructurales cardiacas subclínicas tienen valor pronóstico en estos pacientes. El objetivo fue estudiar la calcificación valvular, su evolución y relación con diferentes factores de riesgo.
Material y métodosSe seleccionó aleatoriamente parte de la muestra del estudio NEFRONA analizando la calcificación valvular aórtica y mitral en ecocardiogramas de la visita basal y a los 24 meses.
ResultadosSe estudiaron 397 pacientes con filtrado glomerular estimado (FGE) basal de 33ml/min/1.73m2 con disminución significativa hasta 30.9ml/min/1.73 m2 Se produjo aumento del área de placa carotidea y femoral, así como aumento de los pacientes con calcificación valvular a los 24 meses. Se observó asociación positiva de la calcificación mitral a 24 meses con la edad, el índice tobillo brazo (ITB) y el producto calcio fósforo (CaxP) basal, sin asociación con el FGE. La calcificación aórtica a los 24 meses presentó asociación positiva con el área total de placa carotidea, el fósforo y la edad basal, sin relación con el FGE.
ConclusionesSe objetivó en pacientes con ERC, sin enfermedad cardiovascular conocida progresión de la calcificación valvular a dos años independientemente del FGE. Presentaron mayor calcificación valvular mitral aquellos de mayor edad, mayor ITB y producto CaxP. Presentaron mayor calcificación valvular aórtica aquellos de mayor edad, mayores niveles de fósforo y mayor área total de placa carotidea. La identificación de estos pacientes con mayor riesgo, podría ayudar a evitar eventos cardiovasculares futuros intensificando el seguimiento.
Patients with chronic kidney disease (CKD) are at high risk of cardiovascular morbidity and mortality. Subclinical cardiac structural alterations have prognostic value in these patients. The aim was to analyse the prevalence of valvular calcification, the evolution and the relationship with different risk factors.
Material and methodsPart of the sample of the NEFRONA study was randomly selected. Aortic and mitral valve calcification were analysed in echocardiograms performed at the baseline visit and at 24 months.
ResultsWe included 397 patients, the estimated basal glomerular filtrate (eGFR) was 33ml/min with significant decrease to 30.9ml/min. There was an increase in the area of carotid and femoral plaque, as well as an increase in patients with aortic and mitral calcification at 24 months. A positive association of mitral calcification at 24 months with age, ankle-brachial index (ABI) and calcium-phosphorus product (CaxP) at baseline visit was observed, without association with eGFR. Aortic calcification at 24 months was positively associated with age, phosphorous and total carotid plaque area at baseline, with no relationship to eGFR.
ConclusionsA significant prevalence of valvular calcification was observed in patients with CKD without known cardiovascular disease.Two-year progression was observed independently of the eGFR. Patients with higher risk of mitral valve calcification were those with older age, higher ABI and CaxP product. Patients with a higher risk of aortic calcification were those with older age, higher phosphorous levels and larger area of carotid plaque. Identifying these higher risk patients would help to avoid future cardiovascular events intensifying follow-ups.
La enfermedad renal crónica (ERC) se ha convertido en uno de los problemas principales de salud pública en las últimas décadas1,2. El análisis de datos a nivel mundial ha revelado que cerca de 500 millones de adultos la padecen1,3. La trascendencia epidemiológica de la ERC se basa en dos aspectos fundamentales. Por un lado, el tratamiento sustitutivo renal en la ERC avanzada que aunque afecta únicamente al 1% de estos pacientes, supone una merma importante en la calidad de vida y es el tratamiento más costoso de las enfermedades crónicas, con un consumo del 5% de los presupuestos sanitarios1. Por otro lado, la ERC ocasiona, desde los estadios iniciales, un aumento muy significativo del riesgo de morbimortalidad cardiovascular y mortalidad total2,4,5.
En el año 2018 se publicó el Análisis del Estudio de Nutrición y Riesgo Cardiovascular en España (ENRICA), estudio epidemiológico nacional, con una muestra de 11.505 sujetos representativos de la población adulta española. Su objetivo era estimar la prevalencia de la ERC y evaluar el impacto de los factores de riesgo cardiovascular (FRCV) sobre la misma. El resultado principal fue la observación de que 1 de cada 7 adultos en España presentó datos de ERC (15% de la población). La ERC se constató más frecuentemente en varones, sujetos de edad avanzada y con enfermedad cardiovascular (ECV) o con FRCV. La observación de una relación continua y creciente entre la prevalencia de ERC y la acumulación de FRCV sugiere que la ERC, a nivel poblacional, puede considerarse una condición cardiovascular6 y denota un notable potencial preventivo en este grupo de pacientes.
La ECV es la primera causa de muerte en pacientes con ERC7 con un incremento del riesgo cardiovascular de hasta 20 veces el de la población general incluso en estadios iniciales8–10. Hasta un 80% de los pacientes con ERC presentan ECV asociada: hipertensión arterial (HTA)(36%), cardiopatía isquémica (22-39%), fibrilación auricular (30%), valvulopatía (24%) e hipertrofia ventricular izquierda (HVI) (50-75% en estadios 3-4 de ERC)11.
Existen diversos modelos capaces de estratificar el riesgo cardiovascular de los pacientes, con la consecuente posibilidad de adecuar su tratamiento y medidas de prevención. Sin embargo, se ha objetivado la existencia de eventos cardiovasculares en grupos de pacientes con riesgo calculado bajo-moderado12, por lo que estos modelos no se ajustan de manera precisa a los pacientes con ERC. Este hallazgo sugiere la existencia de FRCV específicos en este perfil de pacientes a los que se les denomina factores de riesgo no clásicos o emergentes13.
Los factores de riesgo no clásicos o emergentes son muy numerosos: alteraciones del metabolismo óseo-mineral (niveles de fósforo (P), vitamina D, hormona paratiroidea (PTH), el uso de captores de fosfato), biomarcadores lipídicos (Lipoproteína a, Apolipoproteína A1 y B etc), biomarcadores inflamatorios (ProteínaC reactiva (PCR) Interleucinas 1, 6 y 18, Factor de necrosis tumoral α), biomarcadores de hemostasia (D-dímero, fibrinógeno, homocisteína etc), biomarcadores renales (ácido úrino, ferritina, ácido úrico, microalbuminuria, FGF-23) entre otros que han sido objeto de investigación en los últimos años14.
Las alteraciones estructurales cardiacas y vasculares subclínicas, a destacar la HVI, la dilatación de la aurícula izquierda (AI), la ateromatosis carotidea, la enfermedad vascular periférica y la calcificación valvular cardiaca, se detectan de manera frecuente en este perfil de pacientes y tienen valor pronóstico, correlacionándose con alta morbimortalidad cardiovascular15–17. Estas alteraciones se han asociado con numerosos factores de riesgo denominados tradicionales o clásicos como la edad, la HTA, la diabetes mellitus (DM) o la dislipemia (DL), pero también con los factores no tradicionales o emergentes nombrados previamente18. La detección mediante técnicas no invasivas o mínimamente invasivas de las alteraciones estructurales descritas, así como de los factores de riesgo, permitiría la identificación de los pacientes de mayor riesgo cardiovascular, contribuyendo a optimizar la terapéutica y el seguimiento disminuyendo así su morbimortalidad19,20.
La imagen cardiaca cobra mucha importancia en este campo, especialmente la ecocardiografía, dado su bajo coste, su portabilidad y la ausencia de radiación o contraste a diferencia de la tomografía computerizada (TC) o la resonancia magnética (RM) cardiaca. Con el ecocardiograma podemos valorar parámetros con valor pronóstico demostrado, como son la HVI21–23, la dilatación de la AI24 y la presencia de calcificación valvular25–27.
El objetivo principal del presente trabajo es caracterizar en una población con ERC sin ECV conocida la presencia de calcificación valvular y su evolución a 2 años. Otro objetivo es estudiar la influencia sobre la calcificación valvular de factores de riesgo no clásicos e investigar la posible relación con otras manifestaciones de la ECV como son el grosor íntima-media (GIM) carotideo, la presencia de placas de ateroma en carótida y femoral y el índice tobillo-brazo (ITB).
Material y métodosSe trata de un trabajo realizado a partir de la población del estudio NEFRONA 28, observacional, multicéntrico, en pacientes con ERC en estadios 3 a 5D. Fue diseñado para conocer de manera evolutiva (4 años), el desarrollo de la enfermedad ateromatosa y su valor predictivo sobre la morbimortalidad cardiovascular. El protocolo completo del mismo así como los criterios de inclusión y exclusión ya han sido publicados previamente28,29. Desde la finalización del reclutamiento (junio de 2011), los datos han podido ser utilizados por los investigadores que propusiesen un proyecto y que éste fuese aprobado por el Comité Científico.
Se realizó una propuesta de investigación para el estudio de los ecocardiogramas realizados en el protocolo y no analizados hasta la fecha, que fue aceptada en Marzo 2016. Se autorizó así la utilización de la base de datos del estudio tras firmar la carta de compromiso, cediendo posteriormente las variables ecocardiográficas obtenidas. Por lo tanto, en el presente trabajo se valoró de manera retrospectiva junto con los datos epidemiológicos y analíticos, la ateromatosis carotidea y femoral y la presencia de alteraciones estructurales cardiacas en el ecocardiograma en la visita basal y a los 24 meses.
En la propuesta realizada se incluyó el análisis de 400 pacientes (800 ecocardiogramas) con una distribución por estadio de ERC similar a la del estudio inicial: Estadio 2: 0,5% (2,5 pacientes), Estadio 3: 38,4% (192 pacientes), Estadio 4: 25% (125 pacientes), Estadio 5: 8% (40 pacientes) Estadio 5D: 28,1% (140,5 pacientes). El tamaño de la muestra se acordó con los investigadores principales teniendo en cuenta el tiempo de análisis con el objetivo inicial de tener resultados a 2 años. La selección de los pacientes se realizó de forma aleatoria en cada estadio de ERC y fue llevada a cabo por los investigadores principales. Se excluyeron los pacientes cuyos estudios coincidan con los 6 primeros meses de adquisición debido a la curva de aprendizaje de los técnicos, y se incluyeron solamente aquellos pacientes con ecocardiograma de control a los 24 meses. Todos los pacientes firmaron un consentimiento informado y el estudio fue aprobado por el Comité de Ética del Hospital Universitario Arnau de Vilanova (Lleida).
En el análisis de los ecocardiogramas se realizaron las siguientes medidas:
- •
Grado de HVI, cuantificado como milímetros (mm) de septo interventricular (SIV) en plano paraesternal eje largo y si era posible por calidad de imagen, como masa de ventrículo izquierdo (VI) absoluta e indexada por superficie corporal según la fórmula de Mosteller: superficie corporal=√peso corporal (Kg) x talla (cm)/3600). La medida de la masa indexada es la más adecuada y fiable y se tomaría la misma siempre que estuviese disponible. Los puntos de corte para el SIV y la masa de VI se tomaron de las Guías de Cuantificación de Cámaras, así como la fórmula para el cálculo de la masa de VI: Masa de VI=0.8×1.04 × {(SIV+DTDVI+PPd)3-DTDVI3}}+0.6 gr30. SIV=grosor septo interventricular, DTDVI=diámetro telediastólico del ventrículo izquierdo, PPd=grosor de pared posterior de VI en diástole. gr=gramos.
- •
Geometría del VI en función de la dimensión telediastólica (DTDVI), el grosor parietal relativo (GPR) y la masa de VI. El GPR se calcula con la siguiente fórmula: (2 x PPVId/DTDVI. Se clasifican en: patrón normal (masa normal y GPR<0.42), remodelado concéntrico (masa normal y GPR>0.42), hipertrofia excéntrica (masa aumentada y GPR<0.42), hipertrofia concéntrica (masa aumentada y GPR>0.42).
- •
Dimensiones de la AI (diámetro antero-posterior en plano paraesternal eje largo en centímetros (cm) absoluto e indexado por superficie corporal según la fórmula de Mosteller. Medida y puntos de corte de acuerdo con las recomendaciones vigentes30.
- •
La presencia/ausencia de calcificaciones valvulares (Gradación de la calcificación mitral y aórtica en leve/moderada/grave así como su localización en el caso de la calcificación mitral, anillo, velos, subvalvular o todas).
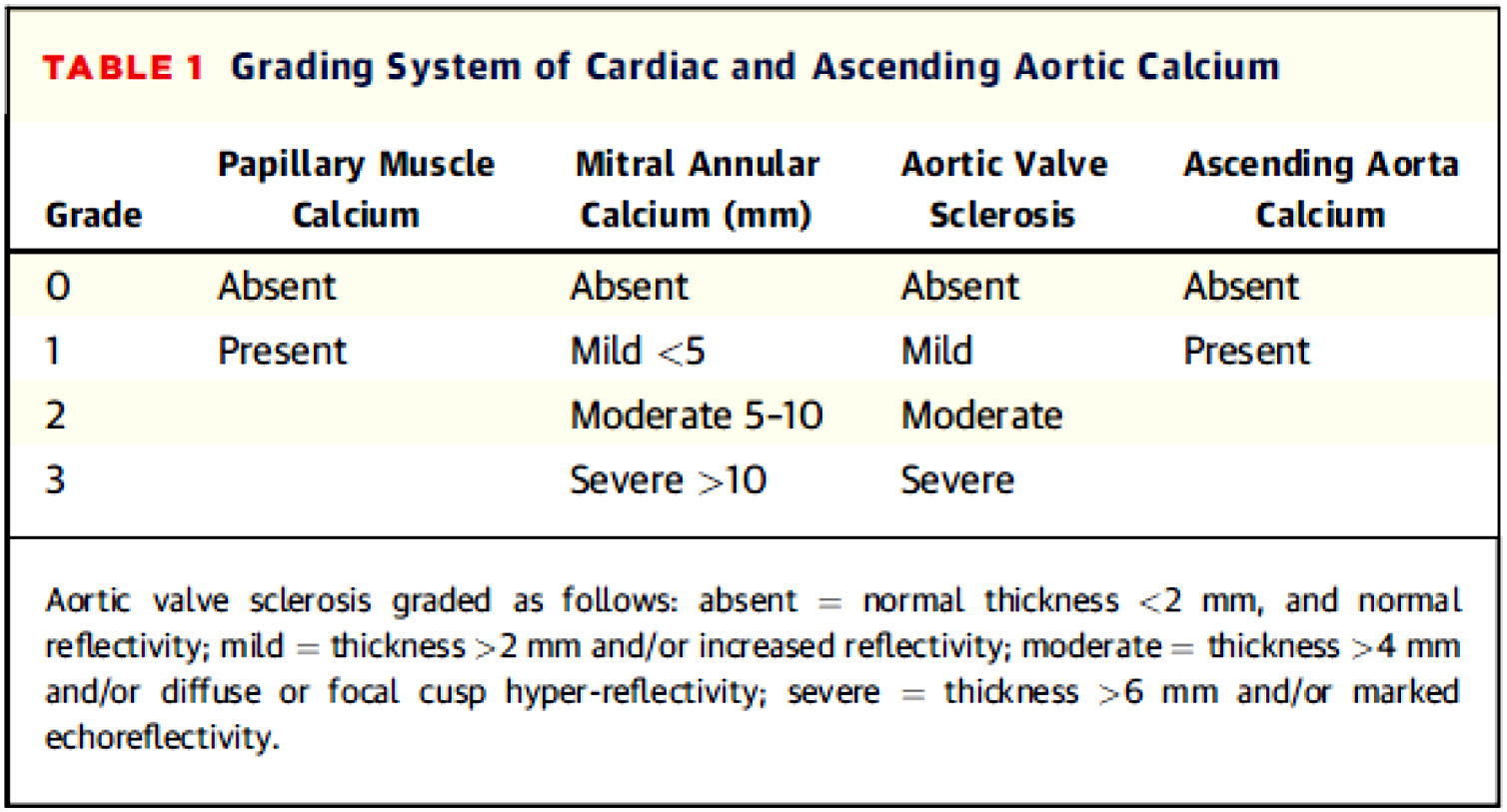
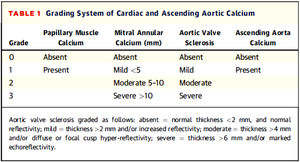
Para la valoración de la calcificación valvular y su gradación, se optó por respetar la clasificación de la calcificación valvular preestablecida en la base de datos del estudio NEFRONA (descrita a continuación) la cual no incluía la descripción de cómo se debía llevar a cabo la gradación de la misma. Dado que no existe un método estandarizado en la literatura, se tuvieron en cuenta publicaciones previas sobre valoración de la calcificación valvular por ecocardiograma, utilizando finalmente la clasificación propuesta por Gaibazzi et al. En el año 2015 propusieron un score (fig. 1) para la valoración del calcio cardiaco y demostraron su asociación independiente con eventos cardiovasculares en pacientes sometidos a ecocardiografía de estrés por indicación clínica31.
Clasificación de la calcificación valvular en el proyecto NEFRONA:
- •
Presencia de calcificación aórtica: si/no.
- •
Gradación de la calcificación aórtica: ligera/moderada/grave.
- •
Presencia de calcificación mitral: si/no
- •
Gradación de la calcificación mitral: ligera/moderada/grave.
- •
Tipo de calcificación mitral: anillo/velo/subvalvular/todas.
Como se muestra en la figura 1, se consideró calcificación mitral leve <5mm, moderada de 5 a 10mm y grave >10mm. Se consideró calcificación aórtica leve como engrosamiento >2mm o aumento de la ecogenicidad, moderada >4mm y grave >6mm.
Para asegurar la reproducibilidad de las medidas se seleccionaron 20 estudios al azar y se repitieron las siguientes medidas: SIV en mm, DTDVI en cm, PPd en mm, y se valoró con sí o no la presencia de calcificación aórtica y mitral. En las variables numéricas se llevó a cabo un análisis mediante un coeficiente de correlación intraclase que resultó ser de 0.85. En las variables categóricas el Índice Kappa que resultó ser de 0.8.
Análisis estadísticoPara el procesamiento y análisis de los datos se contó con la colaboración de la Plataforma de Bioestadística y Epidemiología del Instituto de Investigación Sanitaria del Principado de Asturias (ISPA). Se llevó a cabo el análisis mediante el paquete estadístico R en su versión 3.5.
Las variables cuantitativas con distribución normal se presentan como media (desviación estándar) y el resto como mediana (rango intercuartílico). Las variables discretas se expresan como porcentaje. Las relaciones entre variables discretas se valoraron mediante chi- cuadrado de Mc Nemar. La comparación entre variables continuas entre dos grupos relacionados se llevó a cabo con un análisis con t de Student.
Para el análisis de los factores asociados a la calcificación valvular se emplearon modelos de regresión lineal cuando la variable dependiente era continua y modelos de regresión logística cuando la variable dependiente era binaria. Las covariables con p<0.2 en el análisis univariante se incluyeron en los modelos multivariantes. Se reportan las Odds Ratio (OR) o coeficientes y el riesgo relativo (RR), sus intervalos de confianza (IC) del 95% y los p-valores asociados. Se considera como hallazgo estadísticamente significativo si la p<0.05 con un IC del 95%. El criterio de información de Akaike (AIC) se utilizó para escoger el mejor modelo final.
ResultadosFinalmente se recogieron datos ecocardiográficos de 397 pacientes. Todos ellos fueron extraídos de la base de datos del Estudio NEFRONA con los requisitos comentados previamente respecto a la adquisición de imágenes de ecocardiograma. Se trata de pacientes con una media de edad en la visita basal de 59.1±11.5 años, la mayoría varones (61%) y de raza blanca (97.7%).
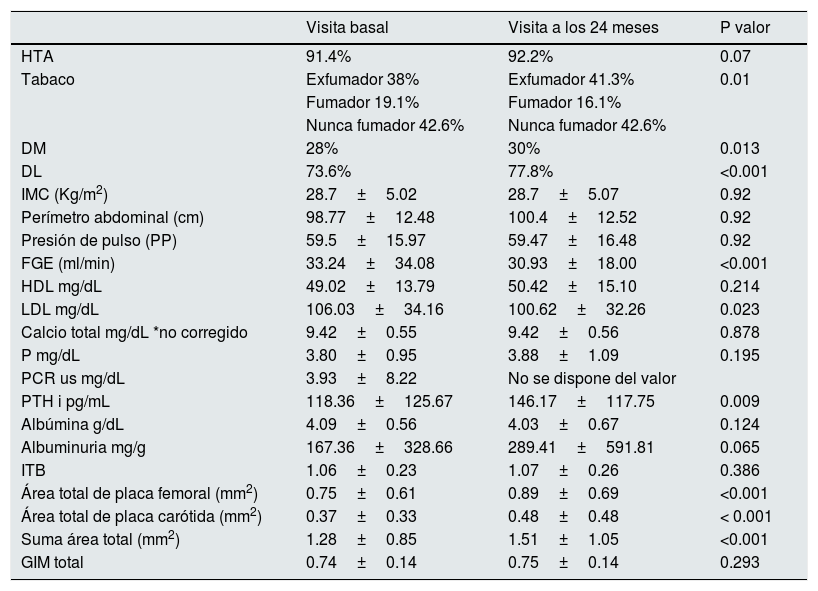
En la tabla 1 se describen las principales características en cuanto a FRCV, variables analíticas y enfermedad vascular en la visita basal y a los 24 meses. Destaca un alto porcentaje de pacientes con HTA al inicio (91.4%) sin aumento significativo en el seguimiento. Más de un cuarto de los pacientes eran diabéticos y casi tres cuartas partes eran dislipémicos al inicio, con aumento de la proporción de ambas condiciones a los 24 meses. El IMC era elevado y compatible con sobrepeso. Los niveles de LDL medio inicialmente fueron de 106mg/dL con un descenso significativo en el seguimiento hasta los 100mg/dL, en paralelo con un aumento de porcentaje de pacientes a tratamiento con estatinas (63% al inicio y 67% a los 24 meses sin alcanzarse la significación, p=0.082). Se obtuvieron unos niveles basales de PTHi de 118pg/mL con un aumento a los 24 meses hasta 146pg/mL, en probable relación con el desarrollo de hiperparatiroidismo secundario al progresar la ERC, con un aumento en los valores de fosfato que no se alcanza la significación estadística, tratándose de una tendencia (p=0.195). En cuanto a la enfermedad vascular cabe resaltar un aumento del área de placa aterosclerótica carotidea y femoral sin apreciarse cambio en el ITB ni en el GIM total.
Características de la población, basales y a los 24 meses
| Visita basal | Visita a los 24 meses | P valor | |
|---|---|---|---|
| HTA | 91.4% | 92.2% | 0.07 |
| Tabaco | Exfumador 38% | Exfumador 41.3% | 0.01 |
| Fumador 19.1% | Fumador 16.1% | ||
| Nunca fumador 42.6% | Nunca fumador 42.6% | ||
| DM | 28% | 30% | 0.013 |
| DL | 73.6% | 77.8% | <0.001 |
| IMC (Kg/m2) | 28.7±5.02 | 28.7±5.07 | 0.92 |
| Perímetro abdominal (cm) | 98.77±12.48 | 100.4±12.52 | 0.92 |
| Presión de pulso (PP) | 59.5±15.97 | 59.47±16.48 | 0.92 |
| FGE (ml/min) | 33.24±34.08 | 30.93±18.00 | <0.001 |
| HDL mg/dL | 49.02±13.79 | 50.42±15.10 | 0.214 |
| LDL mg/dL | 106.03±34.16 | 100.62±32.26 | 0.023 |
| Calcio total mg/dL *no corregido | 9.42±0.55 | 9.42±0.56 | 0.878 |
| P mg/dL | 3.80±0.95 | 3.88±1.09 | 0.195 |
| PCR us mg/dL | 3.93±8.22 | No se dispone del valor | |
| PTH i pg/mL | 118.36±125.67 | 146.17±117.75 | 0.009 |
| Albúmina g/dL | 4.09±0.56 | 4.03±0.67 | 0.124 |
| Albuminuria mg/g | 167.36±328.66 | 289.41±591.81 | 0.065 |
| ITB | 1.06±0.23 | 1.07±0.26 | 0.386 |
| Área total de placa femoral (mm2) | 0.75±0.61 | 0.89±0.69 | <0.001 |
| Área total de placa carótida (mm2) | 0.37±0.33 | 0.48±0.48 | < 0.001 |
| Suma área total (mm2) | 1.28±0.85 | 1.51±1.05 | <0.001 |
| GIM total | 0.74±0.14 | 0.75±0.14 | 0.293 |
Comparación de los FRCV, variables analíticas y enfermedad vascular en la visita basal y a los 24 meses con P valores. IMC=índice de masa corporal. HTA=hipertensión arterial, DM=diabetes mellitus, DL=dislipemia, FGE=filtrado glomerular estimado ITB=índice tobillo-brazo GIM=grosor intima-media
Las causas más frecuentes de nefropatía recogidas en la visita basal fueron la enfermedad vascular (22%), la nefropatía glomerular (15%) y la nefropatía diabética (13.6%), teniendo por lo tanto un gran representación la enfermedad vascular y metabólica. El FGE medio al inicio fue de 33.2ml/min/1.73m2 utilizando la ecuación MDRD-4 (Modification of Diet in Renal Disease-4) con disminución significativa a los 24 meses hasta 30.9ml/min/1.72m2, indicando progresión de la ERC en ese periodo (tabla 1).
Calcificación valvularAl inicio del estudio, un 30% de los pacientes tenían calcificación de la válvula aórtica. A lo largo del periodo de seguimiento, se objetivó un aumento del número de pacientes con calcificación hasta alcanzar el 43.1% (tabla 2), con un incremento en todas las categorías (leve, moderada y grave) (ver tabla 1 en el material suplementario).
Evolución de la calcificación de la válvula aórtica
| Visita basal % | Visita a los 24 meses % | |
|---|---|---|
| Si | 30 (119) | 43.1 (171) |
| No | 63.7 (253) | 49.1 (195) |
| Valores perdidos | 6.3 (25) | 7.8 (31) |
Presencia de calcificación valvular aórtica expresada en porcentaje y en valor absoluto entre paréntesis en la visita basal y a los 24 meses.
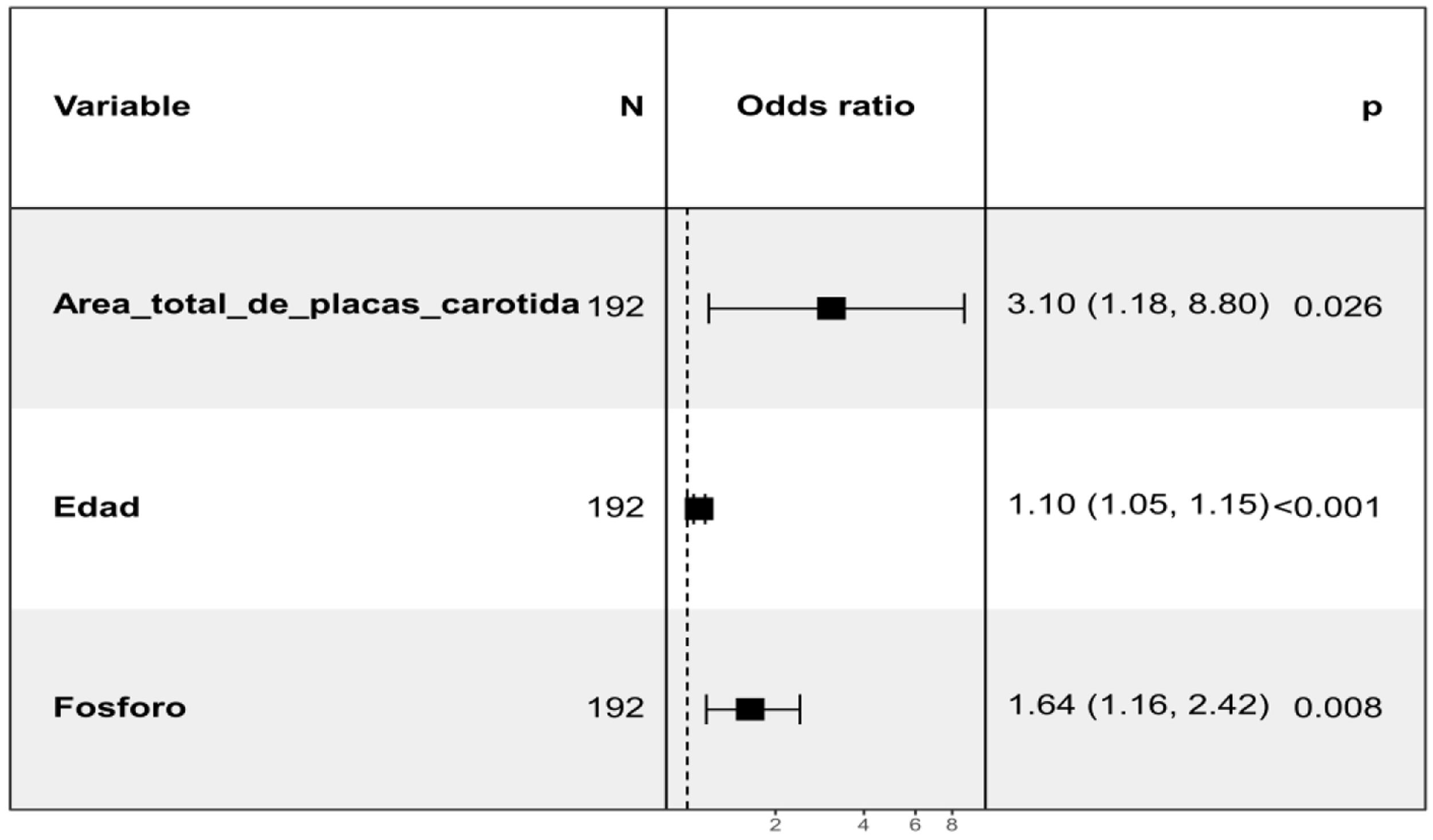
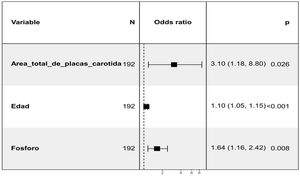
Se valoró la relación de la calcificación valvular aórtica a los 24 meses con los posibles factores o marcadores de riesgo presentes en la visita basal. Para ello, se realizó un análisis inicial no ajustado que mostró asociación positiva con el área total de placa carotidea, el GIM medio total, la edad, la DM, los niveles de P y la presión de pulso (PP). Se tuvo en cuenta el uso de Vitamina D y análogos (calcitriol, paricalcitol, alfacalcidol, colecalciferol, calcifediol) así como el uso de captores de P da base cálcica sin encontrar asociación estadísticamente significativa (tabla 2 en el material suplementario). En relación a los patrones de crecimiento de VI se observó una tendencia que no alcanza la significación hacia una asociación con el remodelado concéntrico de VI (p=0.1) (ver figura 1 del material suplementario). Posteriormente se realizó un análisis multivariante (fig. 2) en el que se mantuvo la relación positiva con el área total de placa carotidea, los niveles de P y la edad en la visita basal. En cuanto al ITB existe una tendencia que no alcanza la significación hacia un mayor ITB en la visita basal en aquellos que presentan calcificación valvular aórtica a los 24 meses.
Respecto a la válvula mitral, el 24.2% de los pacientes tenían calcificación a ese nivel al inicio del estudio, aumentando hasta el 31% a los 24 meses (tabla 3). Se produjo incremento en todas las categorías (anillo, velos, subvalvular) (tablas 3 y 4 del material suplementario).
Evolución de la calcificación de la válvula mitral
| Visita basal % | Visita a los 24 meses % | |
|---|---|---|
| Si | 24.2 (96) | 31 (123) |
| No | 71 (282) | 61.2 (243) |
| Valores perdidos | 4.8 (19) | 7.8 (31) |
Representación en porcentaje y en número absolutos entre paréntesis de la presencia de calcificación valvular mitral en la visita basal y a los 24 meses.
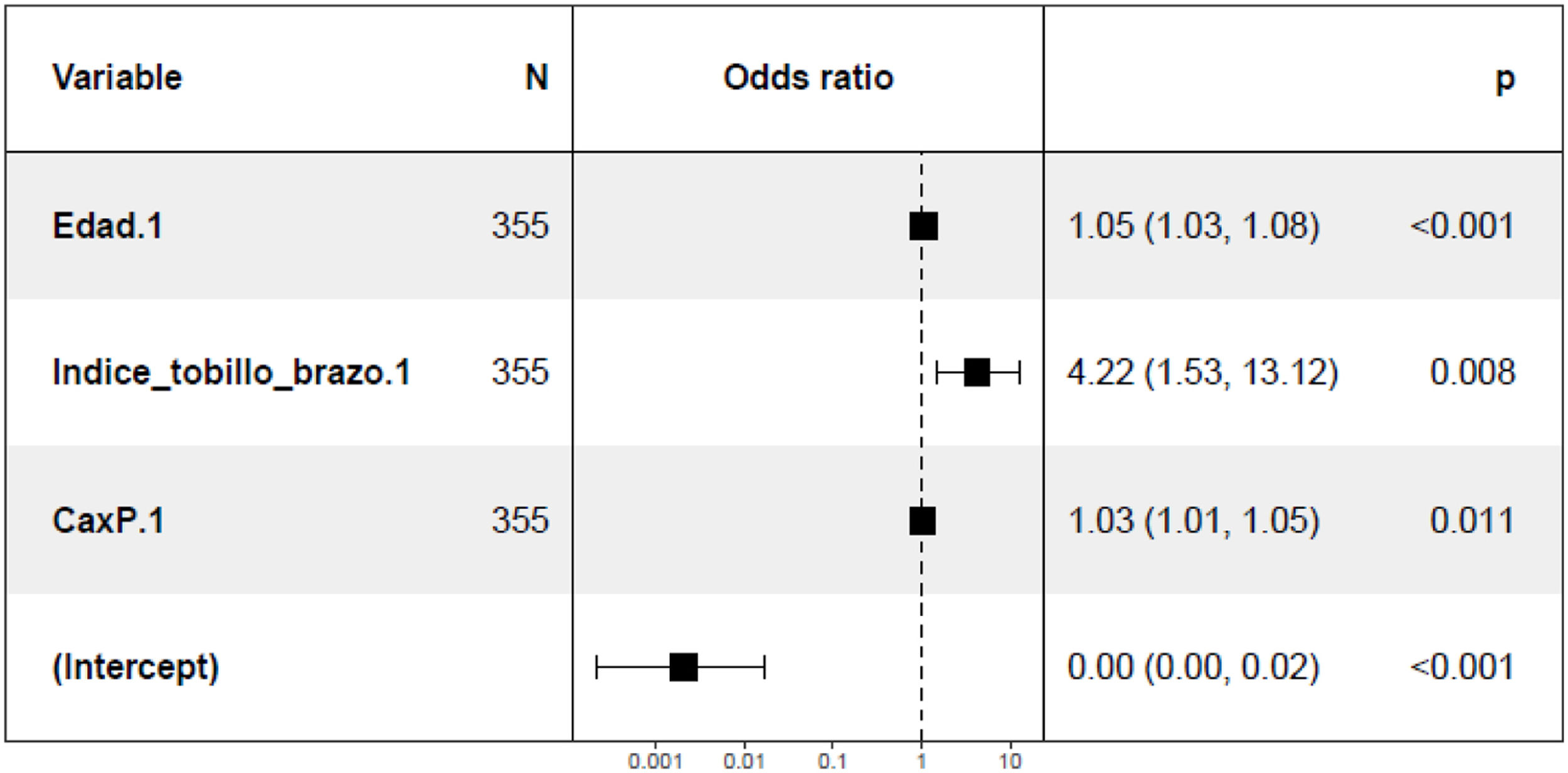
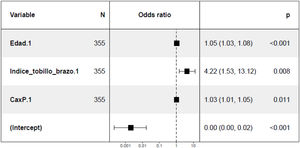
En el estudio de los factores predisponentes a la calcificación mitral a los 24 meses, en el análisis no ajustado se objetivó relación directa con la edad, el ITB, el IMC, el producto Ca x P y la PP en la visita basal (tabla 5 del material suplementario). Se observó también una tendencia hacia una asociación con la presencia de hipertrofia concéntrica de VI en la visita basal (p=0.1) (figura 2 del material suplementario). En el análisis multivariante (fig. 3) se mantiene la asociación positiva con la edad, el ITB y con el producto Ca x P en la visita basal.
DiscusiónEl presente trabajo forma parte del proyecto NEFRONA29 y ha sido realizado con el propósito de aportar a las publicaciones precedentes del estudio, el análisis de la calcificación valvular y su evolución. El hallazgo más relevante de estudio es la constatación de la progresión a los 24 meses de la calcificación valvular, tanto aórtica como mitral, en pacientes sin antecedentes de ECV y la asociación con diferentes perfiles de riesgo.
Cabe destacar que no existen estudios que demuestren a día de hoy que la atenuación de la progresión de la calcificación vascular y/o valvular disminuya la morbimortalidad de los pacientes con ERC. Por otro lado la correlación de la presencia de la misma con eventos CV y hospitalización sí está establecida, demostrando la utilidad de la detección temprana incluso en pacientes en estadios más iniciales de la enfermedad32.
Al analizar los cambios en las imágenes ecocardiográficas a los 24 meses de seguimiento, en nuestro grupo de pacientes, objetivamos aumento de la calcificación aórtica y mitral alcanzando una prevalencia a los 24 meses de 43.1% y 31% respectivamente. Estos hallazgos nos indican una progresión de la calcificación valvular asintomática, dado que se trata de pacientes sin antecedentes de eventos CV, con una prevalencia de más de un tercio de la muestra. En el protocolo del estudio NEFRONA no se incluyó la valoración de la función valvular, pero dada la mayor prevalencia degeneración aórtica y mitral a los 24 meses, podemos asumir una mayor disfunción valvular y por tanto un aumento del riesgo de insuficiencia cardiaca y empeoramiento de su pronóstico vital. Además, este trabajo tiene de novedoso que relaciona, en pacientes sin ECV previa, alteraciones estructurales cardiacas con otras manifestaciones de la enfermedad vascular como la aparición de placas de aterosclerosis en territorio carotideo y femoral y su magnitud (medida como área en mm2), el GIM y el ITB.
Con el objetivo de intentar conocer en nuestros pacientes la probabilidad de desarrollar calcificación valvular, y así realizar una intensificación del seguimiento, se analizó la relación entre calcificación valvular a los 24 meses con variables recogidas en la visita basal que se consideraron potenciales marcadores o factores de riesgo.
En el análisis de la calcificación valvular aórtica se observó que los pacientes con remodelado concéntrico de VI en la visita basal presentan una mayor tendencia (que no alcanza la significación) a presentar calcificación valvular aórtica a los 24 meses respecto al resto de patrones geométricos del VI. Este hallazgo ya fue descrito por Elmariah et al33 en 2012, objetivaron que una vez ajustado por covariables como la hipertensión, factores inflamatorios (PCR de alta sensibilidad, interleucina-6) y la enfermedad vascular subclínica (interpretada como calcificación coronaria) existía asociación entre la calcificación mitral y aórtica y la HVI (sobre todo concéntrica), sin relación con el gradiente obstructivo valvular. Se trataba también de pacientes sin ECV conocida, pero a diferencia de nuestro trabajo no era una cohorte con ERC y las medidas de masa de VI se realizaron mediante RM y la valoración del calcio valvular mediante TC. El uso de estas técnicas supone una mayor exactitud de las medidas, pero también aumento del coste y del tiempo invertido en la realización de las mismas. Los autores discuten que la causa de esta asociación podrían ser parámetros de inflamación no explorados o una HTA realmente no diagnosticada33. A diferencia del estudio mencionado, en nuestro caso observamos una tendencia a una asociación con el patrón de remodelado concéntrico, un paso previo en la alteración de la geometría del VI a la hipertrofia concéntrica, pero que en definitiva nos indica la misma patología de base. El hecho de que no se alcanzase la significación probablemente fuese debido a la limitación del tamaño muestral.
En el análisis multivariante realizado para valorar la relación de la calcificación valvular aórtica a los 24 meses con variables de la visita basal, una vez ajustado por las diferentes covariables observamos asociación positiva con la edad, el área total de placa carotidea y los niveles de P. En cuanto a la edad, se reconoce ampliamente como uno de los principales factores de riesgo de la estenosis aórtica calcificada34,35. En cuanto a la asociación con los niveles de P, está descrita su asociación con la calcificación vascular y la disfunción endotelial36,37 aumentado el riesgo de ateroesclerosis e hipertensión38 pudiendo provocar la rotura de placa aterosclerótica39. En otras publicaciones del estudio NEFRONA se analizó el efecto de los niveles de P sérico en la presencia de ateroesclerosis subclínica mediante la ecografía vascular (carotidea y femoral)40. Respecto a la asociación con el área total de placa carotidea, nos puede indicar mayor relación de la calcificación valvular aórtica con la enfermedad aterosclerótica además de la alteración del metabolismo óseo-mineral. No existen estudios previos específicos que relacionen las placas de aterosclerosis carotideas con la calcificación valvular aórtica en pacientes con ERC, pero sí se han publicado estudios que nos indican cual podría ser el mecanismo fisiopatológico subyacente. Existen datos que sugieren una similitud entre la degeneración valvular aórtica y la aterosclerosis41. Se ha objetivado la presencia de hemorragia en los velos aórticos (de forma similar a la hemorragia intraplaca en el desarrollo de la aterosclerosis) y este hallazgo se ha relacionado con una rápida progresión de la estenosis aórtica. El inicio de la degeneración valvular guarda relación con la disfunción endotelial, la inflamación local y el depósito lipídico mientras que su progresión se asocia con el estrés mecánico, factores genéticos y el proceso de calcinosis. Como describieron Kleinauskienė et al41, el proceso se inicia en la cara vascular de los velos con lesiones focales subendocárdicas, similares a las placas de aterosclerosis. El estrés mecánico activa a las células del intersticio vascular, induciendo proliferación y mineralización activando miofibroblastos y osteoblastos. De la misma manera, el daño endotelial debido al estrés hemodinámico favorece el depósito de LDL y lipoproteína a, partículas con potencial citotóxico e inflamatorio que también favorecen el inicio de la mineralización. De hecho, el tratamiento con estatinas parecía disminuir la progresión de la degeneración valvular aórtica en estudios observacionales pero este beneficio no fue confirmado en estudios randomizados y prospectivos. En el análisis univariante existió una asociación estadísticamente significativa con el producto Ca X P con una p=0.05, que no se mantuvo en el análisis multivariante, pero si se mantuvo la relación con el P. Si el tamaño muestral en nuestro trabajo fuese mayor muy probablemente ambas variables estuviesen incluidas en el modelo final.
Estudios previos como el CRIC18 obtuvieron resultados similares en cuanto a la correlación de la calcificación valvular aórtica (medida por TC) con un menor FGE en pacientes con ERC, observando que esa relación se mantenía independientemente de los FRCV clásicos pero seperdía si se tenían en cuenta los factores de riesgo emergentes (como la PCR y la homocisteína). Por lo tanto estos resultados orientan también hacia la existencia de otros factores responsables
Respecto a la calcificación valvular mitral se observó una tendencia a una mayor presencia de la misma a los 24 meses en aquellos pacientes con HVI concéntrica en la visita basal, como describieron previamente Elmariah et al33. En el análisis de la calcificación mitral a los 24 meses ajustado por las diferentes covariables, se objetiva mayor presencia de calcificación en pacientes de más edad, mayor ITB y mayor producto Ca x P, asumiendo en ellos una mayor disfunción valvular con las consecuencias que esto conlleva sobre la morbilidad cardiovascular. La edad es un factor de riesgo no modificable 42, pero el control del producto Ca x P y la búsqueda activa de aterosclerosis subclínica mediante el uso del ITB nos puede ayudar a predecir que pacientes tendrán una mayor progresión de la calcificación mitral. No existen estudios previos con un diseño específico para mostrar la asociación del ITB con la calcificación valvular, pero sí gran cantidad de referencias en la literatura que relacionan la rigidez arterial en el paciente con ERC con alteraciones del metabolismo del Ca y P y el depósito de minerales en la túnica media arterial (con especial afectación de los miembros inferiores)43, depósito que también se produce a nivel valvular 44. En cuanto al producto Ca x P, se trata de un factor de riesgo ya descrito previamente con efectos sobre la calcificación vascular (debido al de depósito de cristales de hidroxiapatita)45. También se ha constatado en publicaciones previas la asociación del aumento de los niveles circulantes de Ca y P con la calcificación de las células intersticiales de la válvula aórtica45.
Sobre la cohorte del estudio CRIC también fue valorada la calcificación mitral por TC en ERC (no diálisis ni trasplante)46. Se objetivó que la presencia de calcificación del anillo mitral se relacionaba de manera independiente con la edad, la raza caucásica, la disminución del FGE y la hiperfosfatemia. La prevalencia de la calcificación del anillo mitral en esa población era del 19.8% en pacientes caucásicos. En el presente trabajo la prevalencia de calcificación valvular mitral es mayor (24.2% basal y 31% a los 24 meses), probablemente porque se tienen en cuenta también las calcificaciones a nivel de velos y aparato subvalvular y a que se trata de pacientes con una ERC más avanzada (FGE medio en el CRIC de 41ml/min y en nuestro trabajo 30-31ml/min) incluyéndose pacientes en diálisis.
LimitacionesLas principales limitaciones del estudio se relacionan con el tipo de análisis, el tamaño muestral y con la calidad de imagen ecocardiográfica. Se trata de un análisis retrospectivo de la base de datos del estudio, con las limitación inherentes al mismo como el posible sesgo de información. En cuanto al tamaño muestral, fueron estudiados 397 pacientes de los 400 previstos, pero a pesar de ello se han obtenido resultados interpretables y concordantes con la investigación previa.
Para minimizar el problema de la calidad de imagen se excluyeron los pacientes cuyo estudio basal correspondiese a los 6 primeros meses de adquisición de ecocardiogramas debido a la curva de aprendizaje. Pero la calidad de imagen también se ve afectada por la ventana ecocardiográfica del paciente, limitación inherente a cualquier técnica ecográfica. La exclusión de estos pacientes, pudo haber afectado a los resultados finales ya que para el análisis de los modelos multivariantes únicamente se tuvieron en cuenta los casos completos. A pesar de ello se han obtenido modelos concordantes con la investigación previa aportando datos novedosos.
Se debe tener en cuenta que el patrón oro para la valoración de la calcificación es el TC, pero que la valoración por ecocardiograma es recomendada por la ausencia de radiación, la portabilidad y la posibilidad de la valoración de la función valvular.
ConclusionesEn este análisis sobre una muestra de pacientes del proyecto NEFRONA se objetiva en individuos con ERC sin ECV conocida, una prevalencia significativa de calcificación valvular cardiaca subclínica, así como progresión de estas lesiones a los dos años independientemente del FGE. Este hallazgo sugiere la presencia en estos pacientes de factores de riesgo específicos que acompañan al deterioro de la función renal. En nuestra muestra se identifica como pacientes con mayor riesgo de calcificación valvular mitral a 2 años a aquellos de mayor edad, con enfermedad vascular periférica subclínica y con alteraciones del metabolismo óseo-mineral. Los pacientes con mayor riesgo de presentar calcificación valvular aórtica a 2 años también son aquellos de mayor edad, con mayores niveles de P y con mayor área total de placa carotidea, evidenciando una mayor relación con la aterosclerosis. La identificación de estos pacientes de mayor riesgo, podría ayudar a intensificar el tratamiento médico y el seguimiento, para así evitar eventos CV en un futuro.
Conflictos de interesesNinguno.