La fibrosis nefrógena sistémica es una entidad clínica descrita inicialmente como dermopatía esclerodermiforme, en pacientes con insuficiencia renal avanzada, cuya etiopatogenia no está esclarecida. En los últimos años se ha podido comprobar la importancia del gadolinio como agente etiológico, administrado como contraste en las angiorresonancias magnéticas. El depósito de radicales libres de gadolinio sería el causante de desarrollar una fibrosis sistémica. Las guías terapéuticas aconsejan no administrar derivados con gadolinio, especialmente gadodiamida, en pacientes con filtrados glomerulares inferiores a 30 ml/min. No existe tratamiento efectivo para la enfermedad, la cual tiene muy mal pronóstico: la prevención es el arma terapéutica más efectiva por el momento, pues no existen grandes series con un número importante de enfermos tratados. Presentamos un caso con muy mala evolución, el primero descrito en España, con afectación sistémica grave, contrastada en el estudio necrópsico. Recibió repetidas exposiciones a gadolinio, principalmente gadodiamida, factor que influyó probablemente en esa mala evolución. Revisamos los aspectos más actuales de la enfermedad.
Introducción
La fibrosis nefrógena sistémica (FNS) es una nueva enfermedad descrita exclusivamente en pacientes con insuficiencia renal (IR) y expuestos a contraste radiológico con gadolinio. Se le asocia una importante morbi-mortalidad, con evolución dolorosa e incapacitante. Existe una fase aguda tras la exposición al gadolinio, caracterizada por una respuesta inflamatoria que abarca al metabolismo del hierro, y una fase crónica en que predomina la fibrosis sistémica progresiva.
En el año 2000, se describieron los primeros casos de Dermatopatía fibrosante nefrógena (DFN) esclerodermiforme en Estados Unidos1. Posteriormente se han descrito como FNS, sobretodo en Europa y Estados Unidos2,3. Describimos el primer caso conocido en nuestro país.
Caso clínico
Paciente de 63 años de edad con antecedentes personales de: alergia cutánea al bisoprolol, exfumador de dos paquetes/día, enolismo: 150 gr/día, hipertensión arterial de 13 años de evolución, hipercolesterolemia, neoplasia laríngea diagnosticada hacía 12 años, tratada mediante laringectomía, sin radioterapia; bronquitis crónica simple, ulcus duodenal Helicobacter pylori positivo en 1999, año en el cual presentó una hemiparesia derecha por hematoma parenquimatoso cerebral izquierdo. Presentaba arteriosclerosis carotídea bilateral, y ateromatosis aórtica con aneurisma de aorta suprarrenal de 3,8 cm de diámetro. Por el accidente vascular cerebral de 1999 se le detectó IR crónica (C) secundaria a una nefropatía isquémica por estenosis crítica del ostium de la arteria renal dª con riñón derecho atrófico, más ateromatosis de arteria renal izquierda. Entre febrero-1999 y marzo-2000, se le practicaron al paciente 4 angiorresonancias magnéticas (ARNM) con gadolinio (gadodiamida en tres de ellas), dos de troncos supraaórticos (TSA), una aortorrenal, y una aórtica toracoabdominal. Posteriormente se realizó una quinta ARNM por claudicación intermitente e IR progresiva. Presentaba entonces creatininas plasmáticas entre 2,8 y 4 mg/dl y aclaramientos de creatinina inferiores a 30 cc/min.
En febrero-2000 el paciente ingresó por cuadro tóxico y disnea, detectándose un derrame pleural derecho cuyo estudio demostró un exudado linfocitario con ADA negativo, BK, cultivos y citologías negativos. Biopsia pleural: pleuritis fibrinosa con presencia de células gigantes a cuerpo extraño (cristales de colesterol), sin granulomas, con tinciones para micobacterias y amiloide negativas, con ausencia de signos histopatológicos de malignidad. TAC toracoabdominal: mostró el derrame pleural más paquipleuritis, banda periaórtica torácico-abdominal compatible con fibrosis retroperitoneal atípica, y de grasa perirrenal bilateral. Biopsias de grasa subcutánea abdominal y perirrenal negativas para amiloide, compatibles con reacción fibroblástica. Se realizó talcaje pleural y corticoterapia, con cobertura tuberculostática. La analítica sólo mostraba alteración en parámetros inflamatorios de carácter inespecífico, con inmunología normal y/o negativa.
La evolución posterior siguió siendo tórpida, con astenia, anorexia, pérdida de peso, náuseas, inestabilidad cefálica en bipedestación, claudicación intermitente. La última AngioRNM de TSA mostraba una doble estenosis de la carótida interna dª, la mayor del 80%, y del 45% en la izdª. En diciembre-2000 fue intervenido, observando el cirujano vascular un tejido subcutáneo endurecido que afectaba a los vasos, por lo que tomó muestras biópsicas que demostraron un tejido fibroadiposo compatible con una adventicia gruesa, con ocasionales linfocitos; la placa arterial extirpada mostraba ateromatosis, fibrosis, calcificación distrófica focal y trombosis sobreañadida.
En marzo-2001, el paciente inició hemodiálisis periódica por IRC terminal. Posteriormente, ingresó por persistir el cuadro tóxico con kTV > 1, Hb 10,3, aclaramiento de creatinina residual de 5 ml/min. Inmunología, incluidos anticuerpos antifosfolípido, negativa.
Enfermería constata dificultad en las punciones venosas, destacando la presencia de piel endurecida, rugosa. En julio-2001 se trombosa la fístula arteriovenosa (punciones repetidas y dificultosas). Se colocó un catéter tunelizado permanente.
Semanas después, persiste el cuadro tóxico, con náuseas, vómitos ocasionales, diarrea, febrícula, analítica con parámetros inflamatorios elevados, signos progresivos de malnutrición, leucocitosis 24100, trombocitosis 528000. Rx tórax: derrame pleural derecho. Cultivos negativos. Finalmente, el paciente fallece en agosto-2001.
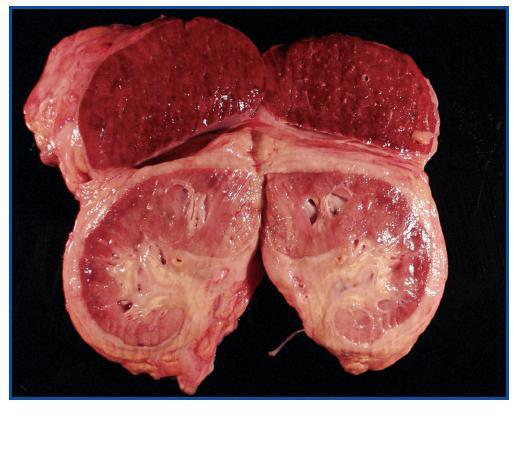
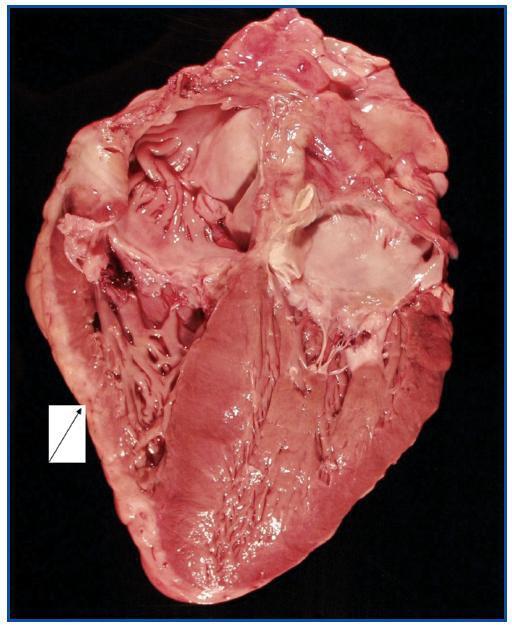
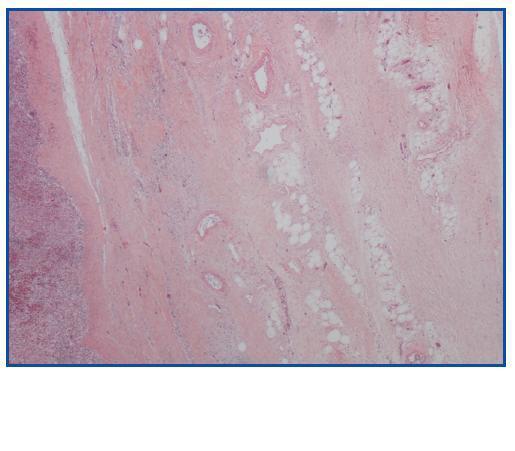
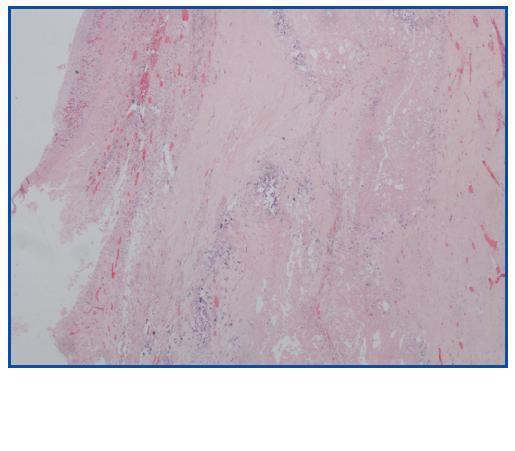
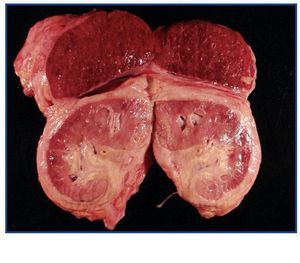
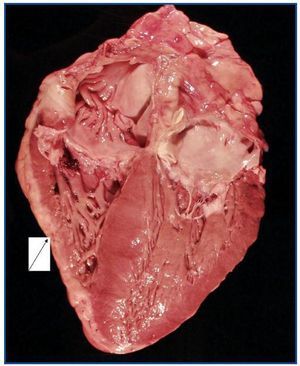
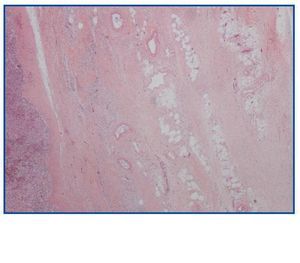
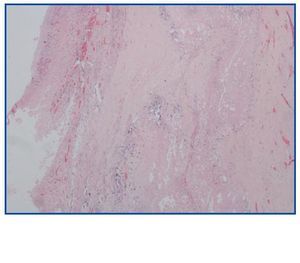
La necropsia demostró un proceso fibrosante sistémico (Figuras 1-4), con afectación de pelvis menor, retroperitoneo, en coraza alrededor de riñones, glándulas suprarrenales y páncreas, abarcando espacio periesplénico y perihepático; y mediastínico, en coraza alrededor de pericardio, arco aórtico y grandes vasos; y paquipleuritis derecha con fibrosis calcificada. Se apreciaron también: pancreatitis crónica fibrosa asociada, atrofia testicular, fenómenos de enfermedad aterombólica, hipertrofia ventricular izdª, y hepatopatía fibrosa crónica, en el contexto de un paciente con arteriosclerosis generalizada severa, con repercusión renal -nefroangiosclerosis bilateral con atrofia renal derecha, encefálica –infarto antiguo quístico izquierdo a nivel de ínsula-, y de colon –colitis isquémica rectosigmoide.
Discusión
El contraste usado más frecuentemente en las ARNM ha sido el gadolinio, compuesto totalmente inocuo en presencia de función renal normal. Sin embargo, desde la óptica nefrológica hay que conocer tres aspectos: el primero y principal es la FNS, descrita inicialmente como DFN4. Segundo, la posibilidad de que el gadolinio a altas dosis pueda producir fracaso renal agudo; y tercero, que la administración de gadolinio se asocia a la posibilidad de presentar alteraciones artefactuales de laboratorio, siendo la pseudohipocalcemia la principal. En base a estos posibles problemas, la indicación nefrológica de administrar gadolinio, especialmente a partir de IR grado III, ha de ser soslayada según la dualidad riesgo-beneficio, que se contemple5.
El gadolinio es un elemento derivado de tierras raras, con propiedades ferromagnéticas. Más de 200 millones de personas han sido expuestas a sus derivados hasta el año 20046. El gadolinio en forma libre e iónica es tóxico, se deposita en tejidos, altera los canales celulares del calcio, la neurotransmisión e interfiere con enzimas celulares7. Por ello se administra en forma de “chelate” (molécula con capacidad absortiva para cationes metálicos). La FDA norteamericana ha validado cinco derivados para la administración en ARNM7. Con el tiempo se ha visto que el aclaramiento renal es muy importante para determinar la farmacocinética de estas moléculas. La IR estadio V determina una eliminación muy mermada de estos derivados, favoreciendo su depósito en tejidos, mientras que en estadios III y IV, el riesgo de toxicidad estaría menos claro. La gadodiamida es el derivado más frecuentemente relacionado con el cuadro clínico2, aunque es probablemente la molécula más ampliamente usada. La exposición a estas sustancias no es el único factor que conduce a la aparición de la FNS. Se necesitan otros cofactores, la IR avanzada sería el más claro. Otros factores barajados han sido la acidosis8, la administración ev de hierro y/o eritropoyetina (EPO), hiperfosfatemia extrema, etc7. En pacientes con IR, el metabolismo del Fe puede jugar un papel esencial en la patogenia de la enfermedad: el tratamiento con dosis elevada de Fe ev, una capacidad reducida de fijación del Fe a transferrina y hemosiderina (malnutrición, proteinuria importante), sepsis, estado inflamatorio crónico, etc, facilitarían la aparición de FNS9.
En el caso de la EPO, parece más plausible que la relación de ésta con la FSN sería una consecuencia y no la causa: los pacientes afectos de FNS presentan un estado inflamatorio importante y por tanto un requerimiento también importante de EPO. No debe ser interpretado como que la mayor dosificación de EPO originaría la FSN10,11.
Schieren G y cols intentan demostrar que la PCR puede ser un buen marcador de la reacción inflamatoria premonitoria de FSN, en caso de elevación de sus niveles tras la administración de gadolinio, ya que algunos derivados gadolínicos aumentan los reactantes de fase aguda en pacientes en hemodiálisis12.
Con todo, la existencia de un estudio piloto donde se detecta gadolinio en 4 de 13 muestras tisulares de 7 pacientes diagnosticados de FNS, puede ser definitivo en la demostración del papel patogénico del gadolinio en esta entidad clínica13.
La FNS descrita inicialmente como una dermopatía fibrosante, cursa con la aparición de máculas y pápulas cutáneas enrojecidas u oscuras en pacientes con insuficiencia renal. La piel adquiere una textura endurecida como de “piel de naranja”; los enfermos pueden manifestar tener dolores y sensación de quemazón, afectándoles todo el organismo excepto la cara. Se ha visto que tras la afectación cutánea, existe afectación de otros órganos como músculos esqueléticos, diafragma, miocardio, pulmón, pleura, pericardio, duramadre, vasos sanguíneos, etc.3,5,9,10,14, tal y como ocurrió en nuestro caso. Algunos autores han descrito un aumento de anticuerpos antifosfolípido en estos pacientes, no confirmado posteriormente3, En nuestro caso fueron positivos en alguna determinación, pero su significado patogénico es dudoso.
Las series descritas siempre son casos observacionales, retrospectivos, por lo que la aseveración inequívoca de la causa (administración de gadolinio) y el efecto (la enfermedad) siempre puede ponerse en duda, como dudas existen en los cofactores necesarios para que aparezca la enfermedad. Hay experiencias que hablan de la presentación de la FSN dependiendo de la dosis administrada y de la repetición en esa administración de gadolinio3,15.
Actualmente, la FSN constituye un reto patogénico y clínico que necesita un enfoque multidisciplinar hasta conseguir su total esclarecimiento16; mientras, los autores están de acuerdo en evitar la administración de gadolinio en pacientes con filtrados glomerulares inferiores a 30 ml/min, especialmente de la gadodiamida16.
La dosis total recibida por nuestro enfermo ha sido de difícil cuantificación, pero evidentemente fue importante. Recibió más de un derivado de gadolinio, en tres ocasiones gadodiamida. Creemos que la exposición (causa) y el efecto (FNS) son claras en nuestro caso, y concuerdan con los requisitos necesarios para aceptar su diagnóstico2,3,5,17,18.
Se ha descrito también que la mayoría de pacientes que fallecen por FSN lo hacen por complicaciones cardiovasculares19, tal y como ocurrió en nuestro paciente. Los enfermos con mayor mortalidad son aquellos que tienen una severa enfermedad previa9, incluso son enfermos con menor afectación cutánea y mayor cardiovascular19. La dosis acumulada de gadodiamida importante, más una dosis elevada de eritropoyetina más un producto calcio-fósforo elevado, sería igual a un mayor riesgo para contraer la FSN, es decir, la existencia de la enfermedad previa severa, constatada por la presencia de un estado inflamatorio activo2,16.
En las autopsias se han encontrado cantidades apreciables de gadolinio, hierro y aluminio en corazón, vasos sanguíneos y piel de estos enfermos19.
Muy recientemente, Agarwal R y cols20, hacen una revisión sistematizada y un meta-análisis de los artículos descritos, y llegan a la conclusión de que hay una evidente conexión entre la administración de contrastes con gadolinio y la aparición de FSN en enfermos con insuficiencia renal avanzada previamente. La relación con la gadodiamida sería la más evidente, pero para estos autores se necesita mayor experiencia para delimitar el peligro de los otros derivados de gadolinio20.
La prevención sería el tratamiento más efectivo contra la enfermedad. La administración de gadolinio en pacientes con insuficiencia renal avanzada ha de ser contemplada según la óptica riesgo-beneficio17. En caso imprescindible podría administrarse, prescribiendo una larga sesión de hemodiálisis inmediatamente después de la exploración radiológica con gadolinio3. La diálisis peritoneal parece ser menos efectiva para la eliminación de los derivados gadolínicos15.
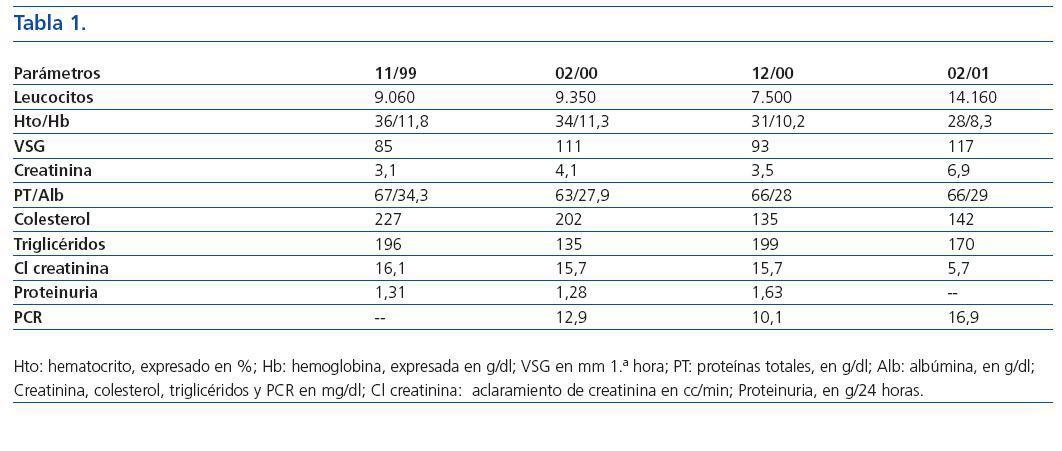
Tabla 1.
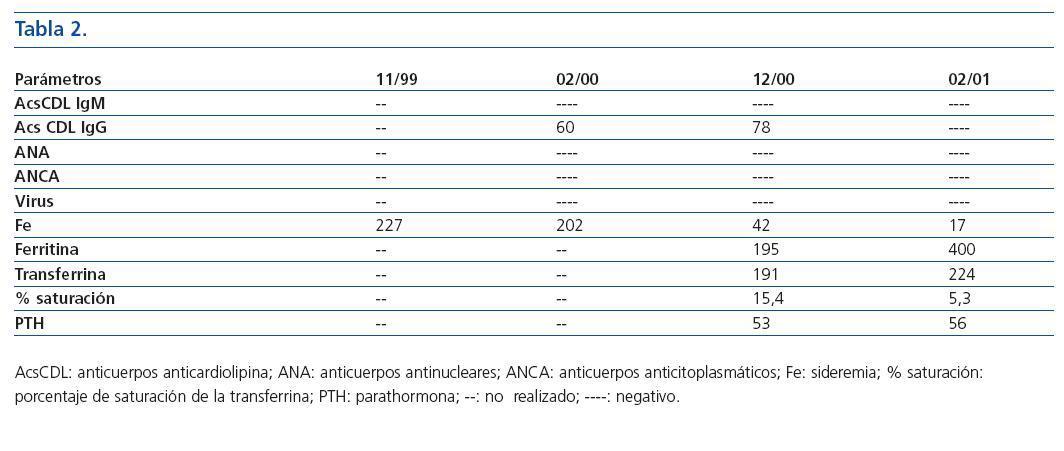
Tabla 2.
Figura 1.
Figura 2.
Figura 3.
Figura 4.