La fotoféresis extracorpórea (FEC) es una modalidad de aféresis que en el ámbito del trasplante de órganos sólidos (TOS) tiene indicación en el tratamiento del rechazo pulmonar, cardiaco o hepático1,2. Su utilidad en el trasplante renal (TxR) sigue siendo contradictoria por los escasos estudios que evalúan la efectividad y la seguridad de esta técnica3–5.
La FEC es una terapia inmunomoduladora que combina la leucoféresis con la fototerapia a través del tratamiento de los leucocitos mediante 8-metoxipsoraleno (8-MOP) y radiación con luz ultravioleta A (UVA)2. Consta de 3 fases6: 1) colección, mediante centrifugación las células mononucleares son separadas del resto de componentes de la sangre; 2) fotoactivación, mediante la adición de 8-MOP y posterior radiación con UVA, y 3) reinfusión del material fotoactivado al paciente.
El mecanismo de acción de la FEC no está completamente comprendido, se especulan distintas vías7,8: 1) tras inducir apoptosis de los linfocitos y ser reinfundidos, son reconocidos por las células dendríticas (CD) cuya interacción inhibe la producción de citoquinas inflamatorias y promueve la de factores antiinflamatorios7; 2) los monocitos activados en el sistema extracorpóreo y reinfundidos se diferencian en CD inmaduras capaces de captar péptidos liberados por el linfocito T aloinmune y desencadenar una respuesta citotóxica clono-específica contra este8, y 3) se induce la diferenciación de células T reguladoras (Treg), con un papel clave en la inmunotolerancia8.
Presentamos el siguiente estudio descriptivo retrospectivo con nuestra experiencia inicial de la FEC en TxR. Se incluyeron todos los pacientes TxR de nuestro centro con diagnóstico histológico de rechazo del injerto que han sido tratados con FEC durante el periodo 2013-2018, con el objetivo de describir las variables demográficas, clínicas y sus desenlaces.
Durante el período de estudio se trataron un total de 8 pacientes cuyas características demográficas y clínicas se recogen en la tabla 1. Desde un punto de vista terapéutico, la indicación de FEC fue la contraindicación al tratamiento convencional (n=4), principalmente por infección concomitante (50%), o la refractariedad (n=4) al tratamiento prescrito en cada caso y que se especifica en la tabla 1. La programación inicial fueron 2 sesiones consecutivas semanales durante 5 semanas, con sesiones adicionales según la evolución al finalizar la primera tanda. Se pudo completar las sesiones programadas en la mayoría de los pacientes (n=5). Los 3 motivos de discontinuación fueron la falta de respuesta al tratamiento, el ingreso hospitalario y la trombosis de la fístula arteriovenosa (FAV).
Características demográficas y clínicas de los pacientes con rechazo del injerto renal tratado con FEC
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
|---|---|---|---|---|---|---|---|---|
| Edad (años) | 61 | 24 | 47 | 49 | 56 | 68 | 45 | 61 |
| Sexo | V | V | M | V | V | V | M | V |
| Enfermedad renal | PQR | GNF | NI | No filiada | No filiada | ND | NI | ND |
| Trasplantes previos | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 |
| Tipo de donación | ME | ME | ME | ME | ME | ME | A | ME |
| Inmunosupresióna | FK | FK | FK | FK | imTOR | FK | FK | FK |
| Tipo de rechazob | RAC IIA | RAC IIA y RCHA | RAC IIIy RCHA | Borderline | RAC IIA y RAH | RAC IIA | RAC IA | RAC IIA |
| Momento del rechazoc | Precoz | Tardío | Tardío | Precoz | Tardío | Precoz | Tardío | Precoz |
| Motivo FEC | Refractario | Refractario | Contraindicación | Refractario | Contraindicación | Contraindicación | Refractario | Contraindicación |
| Tratamiento previo del rechazo | Timo+MP | Timo+MP+RP | — | — | — | — | MP | — |
| Causa de contraindicación | — | — | Comorbilidad | — | Infección | Infección | — | Linfopenia |
| N.° de sesiones | 14 | 19 | 8 | 13 | 13 | 12 | 5 | 5 |
| Completa programación | Sí | Sí | No | Sí | Sí | Sí | No | No |
| Reducción Crs | Sí | No | No | Sí | No | Sí | No | Sí |
| Injerto funcionante | Sí (exitus) | No | Sí (prediálisis) | Sí | Sí | Sí | Sí | Sí |
A: asistolia; Crs: creatinina sérica; FEC: fotoféresis extracorpórea; FK: tacrolimus; GNF: glomerulonefritis; imTOR: inhibidor mTOR; M: mujer; ME: muerte encefálica; MP: metilprednisolona; ND: nefropatía diabética; NI: nefropatía intersticial; PQR: poliquistosis renal; RAC: rechazo agudo celular; RAH: rechazo agudo humoral; RCHA: rechazo crónico humoral activo; RP: recambios plasmáticos; Timo: timoglobulina; V: varón.
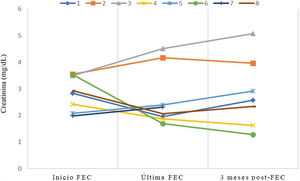
Respecto a los resultados clínicos (tabla 1), la mejoría de la función del injerto en términos de reducción de creatinina al finalizar la terapia (fig. 1) se produjo entre pacientes que presentaban rechazo agudo celular (RAC) precoz (n=4) y se mantuvo a 3 meses de finalizar el tratamiento. El único RAC tardío (>3 meses postrasplante) no pudo completar la programación inicial. Ningún injerto con componente humoral presentó mejoría de la función renal. La pérdida del injerto y reinicio de diálisis se produjo en un paciente con rechazo humoral crónico activo (RHCA). El otro paciente con RHCA se encuentra en situación de prediálisis.
Desde un punto de vista técnico se estudiaron un total de 89 procedimientos, todos realizados con el sistema THERAKOS® CELLEX® Photopheresis System, con la administración de la solución de methoxsalen (UVADEX®) y fotoactivación con luz ultravioleta A. El acceso vascular por sesión fue la FAV (76%) o el catéter vascular central (CVC) (24%), en ningún caso se utilizó acceso periférico. Cada procedimiento duró de media 112,72±13,85min (rango: 86-145). El volumen de tratamiento («buffy coat») fue 189,11±28,67ml por sesión, y el volumen total de fluidos administrados (NaCl y anticoagulación) fue 559,40±41,17ml.
Desde un punto de vista de seguridad, las complicaciones observadas durante las sesiones fueron la fiebre/febrícula (n=2), trombosis de la FAV (n=1), coagulación del sistema extracorpóreo (n=1) y anemización (n=1). Interprocedimiento se produjo un caso de infección urinaria que condicionó ingreso hospitalario y suspensión de la terapia. Un paciente falleció de causa cardiovascular con injerto funcionante 4 años después de la terapia.
Con nuestra experiencia, limitada por el tipo de estudio y la falta de grupo control, extraemos 3 conclusiones iniciales:
- 1.
La utilidad de la FEC parece estar en los casos de rechazo celular, en probable relación con el desencadenamiento de una respuesta inmunomodulador de los linfocitos.
- 2.
No existe una pauta de tratamiento establecida en TxR, aunque en series previas se ha objetivado que con pautas de mayor frecuencia a la mensual se obtienen mejores resultados9.
- 3.
Se puede considerar un tratamiento bien tolerado y seguro. En nuestra experiencia son pocas las complicaciones intrasesión (5 en 89 procedimientos), y según lo descrito en la literatura no hay aumento de la incidencia de infecciones o tumores malignos10.
Finalmente, queremos resaltar 2 hechos particulares de los pacientes TxR. Por un lado, permite que la mayoría tenga como acceso vascular la FAV con menor riesgo de infección con relación a la técnica, a diferencia de otros trasplantados no renal que están obligados al acceso por CVC. Por otro lado, aunque no se ha descrito complicación por sobrecarga de volumen, consideramos que se debe tener especial cuidado con los pacientes que precisan restricción hídrica (infusión de 560ml de media por sesión).
En conclusión, necesitamos más estudios con mayor número de pacientes y grupo control para poder confirmar la efectividad y la seguridad de la FEC en TxR, y poder considerarse una herramienta terapéutica útil como en otros TOS.