El tratamiento del carcinoma renal (CR) ha experimentado una revolución gracias al empleo de fármacos antiproliferativos e inmunomoduladores. Sunitinib (SUN) es un inhibidor de tirosina cinasa (TK) con efecto antiproliferativo y antiangiogénico1. Nivolumab (NIV) es un anticuerpo monoclonal humano, inhibidor check-point, que evita la evasión inmunológica propia del tumor, potenciando la respuesta inmune del paciente2. Ambos fármacos han demostrado aumentar la supervivencia del CR, pero también se han relacionado con toxicidad en distintos órganos. A continuación, describimos un caso de un paciente que presentó daño renal asociado al empleo de SUN y NIV.
Varón de 70 años, con marcapasos por bloqueo AV Mobitz, hipertensión arterial (HTA) y enfermedad renal crónica (creatinina basal 1,4-1,5mg/dl) por pérdida de masa nefronal tras nefrectomía derecha secundaria a CR de células claras (pT3b Nx Mx), en 2014.
Recibió una primera línea con SUN por recidiva de la enfermedad tumoral, que se suspendió tras presentar toxicidad, entre ellas renal, quedando con una creatinina sérica (Crs) entre 1,4-1,8mg/dl. Seis meses después, la enfermedad tumoral progresó, motivando una segunda línea con NIV.
Ocho semanas después de la segunda dosis de NIV, ingresó en Oncología Médica, por presentar deterioro de función renal (Crs de 2,8mg/dl). El sedimento de orina mostró albuminuria (100-200mg/dl), leucocituria y microhematuria. A la exploración física destacaban crepitantes en bases pulmonares y edema hasta el tercio medio de ambos miembros inferiores. Se suspendió NIV e inició tratamiento diurético. A las 48h, la función renal empeoró (Crs de 4,9mg/dl), por lo que se solicitó valoración al servicio de Nefrología.
Tras valoración por el servicio de Nefrología, se completó con una proteinuria de 24h (1,98g/día). Se descartó uropatía obstructiva, así como otras causas sistémicas de fracaso renal agudo (FRA) (serología, autoinmunidad, complemento, inmunoelectroforesis, extensión de sangre periférica, todo negativo). Se decidió realizar una biopsia renal para confirmar un posible FRA asociado al fármaco.
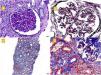
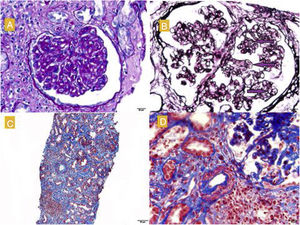
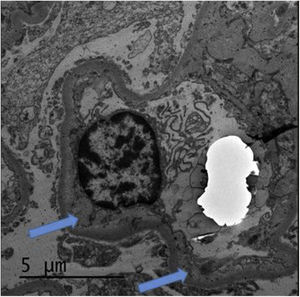
La biopsia renal (fig. 1) confirmó la presencia de un infiltrado linfoplasmocitario a nivel intersticial, sugestivo de nefritis intersticial aguda (NIA) por NIV. Se iniciaron 3 choques de esteroides (250mg el primer día y 125mg el segundo y tercer día), seguidos de oral (0,5mg/kg) en pauta descendente con lo que recuperó su Crs basal y disminuyó la proteinuria (0,8g/día). Recibió profilaxis para Pneumocystis jirovecii con Septrin. Además, en la muestra histológica se objetivó engrosamiento segmentario de paredes capilares con imágenes de doble contorno, compatible con patrón de glomerulonefritis membranoproliferativa, así como hipertrofia podocitaria y daño vascular crónico con disminución de la luz vascular de más del 75%, fibrosis intersticial y atrofia tubular moderadas. La inmunofluorescencia no mostró depósito de inmunoglobulinas o inmunocomplejos, y la microscopia electrónica (fig. 2) confirmó la presencia de ampliación de la lámina rara interna visible en microangiopatía trombótica (MAT), motivo por el cual dichas lesiones se atribuyeron al tratamiento previo con SUN.
A) Glomérulo con refuerzo del dibujo glomerular, proliferación mesangial y engrosamiento de las paredes capilares. PAS, 40×. B) Imágenes de doble contorno (marcadas con flechas). Técnica de plata. C) Fibrosis moderada, atrofia tubular e infiltrados linfoplasmocitarios a nivel intersticial. Masson, 40×. D) Arteriolas con hiperplasia de músculo liso y disminución de la luz. Masson.
Es conocido que la administración de fármacos antiangiogénicos, como SUN, puede producir HTA, proteinuria y MAT1,3. Más aún, recientemente, se han descrito casos de NIA asociados a estos medicamentos4. La muestra histológica mostraba imágenes de doble contorno, hipertrofia podocitaria y disminución de la luz vascular, característico de MAT, y asociado al uso de SUN3.
Por otro lado, el FRA asociado a inhibidores check-point es una realidad también descrita5,6. Normalmente, aparecen a los 3-6 meses de la primera dosis y presentan leucocituria y proteinuria no nefrótica5. El hallazgo histológico característico es la presencia de un infiltrado a nivel intersticial6. Recientemente, Cortazar et al. han descrito una serie de 12 pacientes con nefritis tubulointersticial asociada al empleo de inhibidores check-point6. A diferencia de la NIA inducida por otros fármacos, en la que suele ser un infiltrado formado por eosinófilos, en este caso, el infiltrado lo constituyen principalmente linfocitos. Este hecho puede responder a un mecanismo diferente, derivado de una «reprogramación» del sistema inmune, que produciría una pérdida de tolerancia contra antígenos endógenos a nivel renal, lo que también explicaría el periodo de latencia entre la administración y la aparición del efecto adverso6.
El tratamiento, en ambos casos, es la retirada del fármaco que produce el daño renal. En el caso de la NIA asociada a NIV, el uso de corticoides ha demostrado recuperar la función renal en la mayoría de las situaciones5,6.
Una importante cuestión es si un paciente que ha presentado daño renal asociado a estos fármacos puede volver a recibir dicha medicación. La mayoría de las series recomiendan la suspensión si se alcanza toxicidad grado III-IV, o si requiere hemodiálisis5,6. Se debe realizar un balance entre los beneficios oncológicos de continuar con el tratamiento y el riesgo de recurrencia de la enfermedad renal. Por ello, recomendamos un seguimiento estrecho, monitorizando función renal y presión arterial del paciente para poder actuar con premura, evitando un daño irreversible.