En diciembre de 2019 surgió en Wuhan, China, la COVID-19, causada por el virus SARS-CoV-2 y declarada pandemia global por la Organización Mundial de la Salud en marzo de 2020. Es una infección respiratoria con complicaciones a nivel cardiaco, hematológico, digestivo, neurológico y renal. El fracaso renal agudo (FRA) en pacientes hospitalizados por COVID-19 se presenta en el 0,5-25% y es un factor de mal pronóstico. Los mecanismos de afectación renal no están completamente aclarados. Presentamos la evolución clínica de pacientes ingresados por COVID-19 con FRA que requirieron atención por Nefrología en un hospital terciario de la Comunidad de Madrid, España.
MétodosEste es un estudio observacional prospectivo de todos los casos que ingresaron por COVID-19 entre el 6 de marzo y el 12 de mayo de 2020 y requirieron atención por Nefrología. Se recogieron datos clínicos y analíticos de características basales, y la evolución de la COVID-19 y del FRA.
ResultadosSe analizaron 41 pacientes con una edad media de 66,8 años (DE 2,1), el 90,2% varones, y con enfermedad renal crónica previa en el 36,6%. El 56,1% presentaron neumonía grave o síndrome de distrés respiratorio agudo y el 31,7% requirió ingreso en UCI. El FRA fue de etiología prerrenal en el 61%, necrosis tubular aguda en contexto de sepsis en el 24,4%, glomerular en el 7,3% y por toxicidad tubular en el 7,3%. Se registró proteinuria en el 88,9% y hematuria en el 79,4%. El 48,8% de los pacientes requirió terapia de sustitución renal. La mediana de estancia fue de 12 días (RIC 9-23), y el 22% fallecieron. Los pacientes que desarrollaron FRA durante el ingreso presentaron valores más altos de proteína C reactiva, LDH y dímero-D, una afectación pulmonar más grave, más necesidad de ingreso en UCI, más tratamiento con lopinavir/ritonavir y fármacos biológicos, y mayor necesidad de terapia de sustitución renal.
ConclusionesLa hipovolemia y la deshidratación son una causa frecuente de FRA en pacientes con COVID-19. Aquellos que desarrollan FRA intrahospitalario presentan un perfil de peor pronóstico respiratorio, analítico y renal. Creemos que la monitorización de marcadores renales, así como el manejo individualizado de la volemia, pueden ser determinantes para prevenir el FRA.
In December 2019, a coronavirus 2019 (COVID-19) outbreak, caused by SARS-CoV-2, took place in Wuhan, China, and was declared a global pandemic in March 2020 by the World Health Organization. It is a prominently respiratory infection, with potential cardiological, hematological, gastrointestinal and renal complications. Acute kidney injury (AKI) is found in 0.5-25% of hospitalized COVID-19 patients and constitutes a negative prognostic factor. Renal damage mechanisms are not completely clear. We report the clinical evolution of hospitalized COVID-19 patients who presented with AKI requiring attention from the Nephrology team in a tertiary hospital in Madrid, Spain.
MethodsThis is an observational prospective study including all COVID-19 cases that required hospitalization and Nephrology management from March 6th to May 12th 2020. We collected clinical and analytical data of baseline characteristics, COVID-19 and AKI evolutions.
ResultsWe analyzed 41 patients with a mean age of 66.8 years (SD 2.1), 90.2% males, and with a history of chronic kidney disease in 36.6%. A percentage of 56.1 presented with severe pneumonia or acute respiratory distress syndrome, and 31.7% required intensive care. AKI etiology was prerenal in 61%, acute tubular necrosis in the context of sepsis in 24.4%, glomerular in 7.3% and tubular toxicity in 7.3% of the cases. We reported proteinuria in 88.9% and hematuria in 79.4% of patients. A percentage of 48.8 required renal replacement therapy. Median length of stay was 12 days (IQR 9-23) and 22% of the population died. Patients who developed AKI during hospital stay presented with higher C-reactive protein, LDH and D-dimer values, more severe pulmonary damage, more frequent ICU admission, treatment with lopinavir/ritonavir and biological drugs and renal replacement therapy requirement.
ConclusionsHypovolemia and dehydration are a frequent cause of AKI among COVID-19 patients. Those who develop AKI during hospitalization display worse prognostic factors in terms of pulmonary damage, renal damage, and analytical findings. We believe that monitorization of renal markers, as well as individualized fluid management, can play a key role in AKI prevention.
La COVID-19, enfermedad causada por el coronavirus SARS-CoV-2, surgió en diciembre de 2019 en Wuhan, provincia de Hubei, en China1. Tras una rápida propagación, fue declarada pandemia global por la Organización Mundial de la Salud el 10 de marzo de 2020. Para el 6 de mayo se habían reportado más de 3,5 millones de casos y más de 245.000 muertes en todo el mundo2. La COVID-19 cursa con una afectación eminentemente respiratoria y desencadena un síndrome de distrés respiratorio agudo en sus formas más graves, aunque también se ha descrito afectación a nivel cardiaco, hematológico, digestivo, neurológico y renal3–5.
En la Comunidad de Madrid, entre el 9 de marzo y el 19 de mayo de 2020 se registraron 211.243 casos de sospecha de COVID-19, siendo confirmados 64.410 mediante reverse transcription-polymerase chain reaction (RT-PCR). Se contabilizaron 34.625 hospitalizaciones, 2.413 ingresos en unidades de cuidados intensivos (UCI) y 6.168 muertes6.
Si bien la incidencia de fracaso renal agudo (FRA) en pacientes hospitalizados oscila entre un 0,5 y un 25% en la literatura, siendo incluso mayor en las UCI3–5,7–9, a día de hoy no disponemos de datos fehacientes sobre la incidencia y características reales de la afectación renal asociada a esta pandemia en España. Además, esta afectación en pacientes de COVID-19 no es uniforme según lo comunicado por los hospitales chinos, y puede estar condicionada por la estrategia de detección de casos de cada sistema de salud, la política de ingresos de cada hospital, la definición de daño renal e incluso los factores genéticos y ambientales de las diversas poblaciones afectadas.
De manera más concreta, no existe un consenso en cuanto a la importancia del FRA en pacientes con COVID-19, aunque ya se ha descrito como un factor asociado a mayor mortalidad9,10. La etiología del FRA en pacientes con COVID-19 es también hoy en día objeto de estudio. Se ha descrito afectación directa del SARS-CoV-2 a nivel de células renales8,11, y daño renal secundario a disfunción de otros órganos, a microangiopatía trombótica y a otros factores sistémicos más clásicos, como la hipoperfusión, la sepsis o la rabdomiolisis12,13.
En este trabajo prospectivo presentamos la experiencia de un único servicio de Nefrología en un hospital de tercer nivel en Madrid (España), con cartera de servicios completa y programas de trasplante hematopoyético y de órgano sólido, que atiende a una población de medio millón de personas. En el periodo desde el 26 de febrero hasta el 26 de abril se diagnosticaron 59.129 casos de COVID-19 en la Comunidad de Madrid, de los cuales fallecieron 7.922. En el mismo periodo se registraron 1.603 ingresos por COVID-19 en nuestro hospital, con una mortalidad bruta intrahospitalaria del 12,3%14. Nuestro objetivo es describir las diferentes presentaciones de FRA que requieren intervención del nefrólogo, su evolución clínica y posibles estrategias de detección precoz y nefroprotección.
Material y métodosDiseño del estudio y participantesRealizamos un muestreo sistemático consecutivo de todos los casos de COVID-19 en adultos ingresados en el Hospital Universitario Puerta de Hierro Majadahonda que requirieron atención por el servicio de Nefrología por presentar deterioro de la función renal entre el 6 marzo y el 12 de mayo de 2020. El diagnóstico de COVID-19 se basó en los criterios clínicos y radiológicos establecidos por la Organización Mundial de la Salud y fue confirmado por la detección del SARS-CoV-2 en exudado nasofaríngeo por medio de RT-PCR15. Se obtuvo consentimiento oral de los pacientes para la utilización de tratamientos fuera de indicación en ficha técnica y para el análisis de sus datos, quedando reflejado en la historia clínica electrónica. Este estudio fue aprobado por el Comité de Ética de Investigación del Hospital Universitario Puerta de Hierro Majadahonda (IRB Número 88/20).
Recogida de datos y definicionesIncluimos en el análisis todos los casos con desenlace (exitus o alta) y aquellos que, aun estando ingresados, tenían un seguimiento de al menos 4 semanas. Los datos clínicos y analíticos se recogieron de forma prospectiva desde la historia clínica electrónica del hospital en una base de datos especialmente diseñada. Se incluyen datos demográficos, comorbilidad, aspectos de la COVID-19 y su tratamiento específico (lopinavir/ritonavir, hidroxicloroquina, azitromicina, corticoides, agentes biológicos como interferón, tocilizumab o anakinra), datos analíticos de potencial valor pronóstico16, etiología y evolución del daño renal, duración del ingreso, así como los desenlaces clínicos.
La gravedad de la infección por SARS-CoV-2 fue determinada según la clasificación de la Organización Mundial de la Salud para COVID-19 y la escala CURB-6515,17, considerándose como afectación pulmonar grave los cuadros de neumonía grave y de síndrome de distrés respiratorio agudo. La ventilación mecánica engloba la invasiva y la no invasiva. Los valores normales analíticos fueron los de referencia del laboratorio del hospital. El FRA se clasificó en 3 estadios de acuerdo con las guías KDIGO18, tomando el valor más alto de creatinina sérica registrado durante el ingreso. Se consideró proteinuria a partir de 0,2g/l de proteínas en la tira de orina y hematuria la presencia de al menos 2-5 hematíes/campo en el sedimento. La etiología del FRA fue determinada mediante algoritmos habituales de diagnóstico clínico por especialistas en nefrología. Las técnicas de terapia de sustitución renal (TSR) se categorizaron en hemodiálisis convencional y hemodiafiltración veno-venosa continua. Se etiquetaron como «FRA al ingreso» aquellos FRA diagnosticados en admisión de Urgencias, y «FRA intrahospitalario» aquellos desarrollados durante la estancia hospitalaria.
Análisis estadísticoLas variables continuas se expresaron en medias (desviación estándar) o medianas (rango intercuartílico) y se compararon con el test t de Student o la U de Mann-Whitney. Las variables categóricas se expresaron en porcentajes y se compararon con el test de Chi-cuadrado. El análisis estadístico se realizó con Stata (versión 14.1), aceptando p<0,05 como significación estadística.
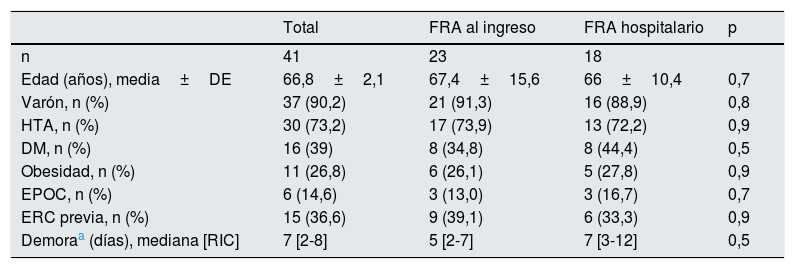
ResultadosCaracterísticas basalesSe incluyeron 41 pacientes, cuyas características basales se recogen en la tabla 1. El 90,2% eran varones y la edad media fue de 66,8 años. El 36,6% presentaban algún grado de enfermedad renal crónica previa o eran trasplantados renales. Se registraron diabetes mellitus, obesidad, hipertensión arterial y EPOC en el 39, 26,8, 73,2 y 14,6% de los casos, respectivamente. El tiempo transcurrido desde el inicio de los síntomas hasta la llegada a Urgencias fue de 7 días de mediana (rango intercuartílico 2-8).
Características basales de los pacientes ingresados por COVID-19
| Total | FRA al ingreso | FRA hospitalario | p | |
|---|---|---|---|---|
| n | 41 | 23 | 18 | |
| Edad (años), media±DE | 66,8±2,1 | 67,4±15,6 | 66±10,4 | 0,7 |
| Varón, n (%) | 37 (90,2) | 21 (91,3) | 16 (88,9) | 0,8 |
| HTA, n (%) | 30 (73,2) | 17 (73,9) | 13 (72,2) | 0,9 |
| DM, n (%) | 16 (39) | 8 (34,8) | 8 (44,4) | 0,5 |
| Obesidad, n (%) | 11 (26,8) | 6 (26,1) | 5 (27,8) | 0,9 |
| EPOC, n (%) | 6 (14,6) | 3 (13,0) | 3 (16,7) | 0,7 |
| ERC previa, n (%) | 15 (36,6) | 9 (39,1) | 6 (33,3) | 0,9 |
| Demoraa (días), mediana [RIC] | 7 [2-8] | 5 [2-7] | 7 [3-12] | 0,5 |
DE: desviación estándar; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FRA: fracaso renal agudo; HTA: hipertensión arterial; RIC: rango intercuartílico.
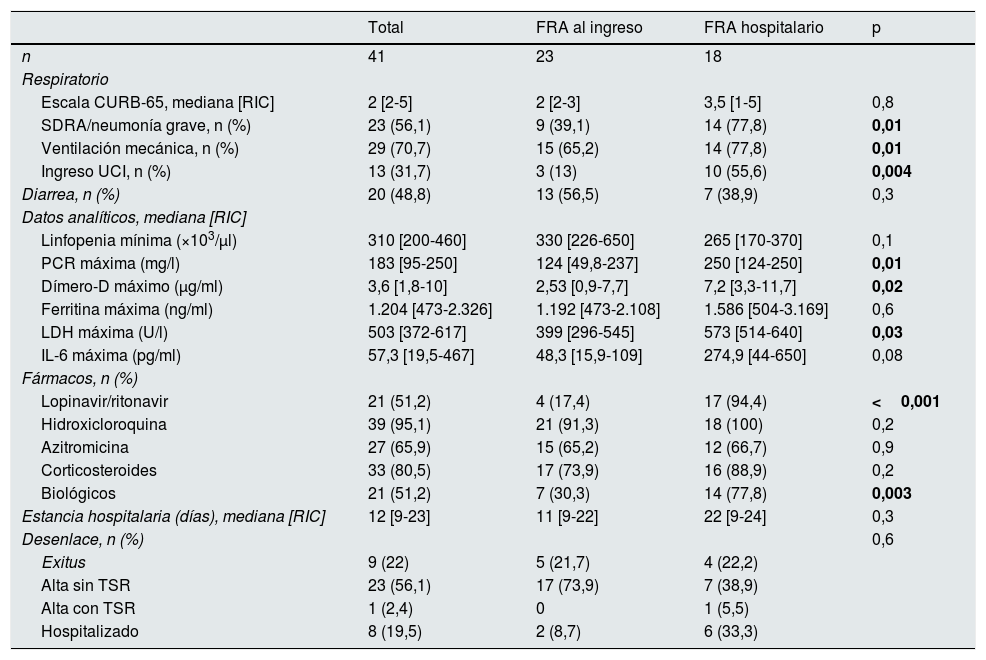
Los datos de la infección por SARS-CoV-2 se recogen en la tabla 2. El 56,1% de las infecciones fueron neumonías graves o síndrome de distrés respiratorio agudo, con una mediana de CURB-65 de 2 (rango intercuartílico 2-5). El 70,7% recibió ventilación mecánica y el 31,7% requirió ingreso en UCI. Se reportó diarrea en el 48,8% de los casos. Los pacientes con FRA intrahospitalario presentaban mayor severidad clínica y mostraban valores de ferritina, proteína C reactiva, IL-6, LDH y dímero-D más elevados que los que ingresaron ya con FRA (tabla 2). Se utilizó lopinavir/ritonavir en el 51,2% de los pacientes, hidroxicloroquina en el 95,1%, azitromicina en el 65,9%, corticoides en el 80,5% y agentes biológicos en el 51,2%.
Evolución clínica de los pacientes ingresados por infección por COVID-19
| Total | FRA al ingreso | FRA hospitalario | p | |
|---|---|---|---|---|
| n | 41 | 23 | 18 | |
| Respiratorio | ||||
| Escala CURB-65, mediana [RIC] | 2 [2-5] | 2 [2-3] | 3,5 [1-5] | 0,8 |
| SDRA/neumonía grave, n (%) | 23 (56,1) | 9 (39,1) | 14 (77,8) | 0,01 |
| Ventilación mecánica, n (%) | 29 (70,7) | 15 (65,2) | 14 (77,8) | 0,01 |
| Ingreso UCI, n (%) | 13 (31,7) | 3 (13) | 10 (55,6) | 0,004 |
| Diarrea, n (%) | 20 (48,8) | 13 (56,5) | 7 (38,9) | 0,3 |
| Datos analíticos, mediana [RIC] | ||||
| Linfopenia mínima (×103/μl) | 310 [200-460] | 330 [226-650] | 265 [170-370] | 0,1 |
| PCR máxima (mg/l) | 183 [95-250] | 124 [49,8-237] | 250 [124-250] | 0,01 |
| Dímero-D máximo (μg/ml) | 3,6 [1,8-10] | 2,53 [0,9-7,7] | 7,2 [3,3-11,7] | 0,02 |
| Ferritina máxima (ng/ml) | 1.204 [473-2.326] | 1.192 [473-2.108] | 1.586 [504-3.169] | 0,6 |
| LDH máxima (U/l) | 503 [372-617] | 399 [296-545] | 573 [514-640] | 0,03 |
| IL-6 máxima (pg/ml) | 57,3 [19,5-467] | 48,3 [15,9-109] | 274,9 [44-650] | 0,08 |
| Fármacos, n (%) | ||||
| Lopinavir/ritonavir | 21 (51,2) | 4 (17,4) | 17 (94,4) | <0,001 |
| Hidroxicloroquina | 39 (95,1) | 21 (91,3) | 18 (100) | 0,2 |
| Azitromicina | 27 (65,9) | 15 (65,2) | 12 (66,7) | 0,9 |
| Corticosteroides | 33 (80,5) | 17 (73,9) | 16 (88,9) | 0,2 |
| Biológicos | 21 (51,2) | 7 (30,3) | 14 (77,8) | 0,003 |
| Estancia hospitalaria (días), mediana [RIC] | 12 [9-23] | 11 [9-22] | 22 [9-24] | 0,3 |
| Desenlace, n (%) | 0,6 | |||
| Exitus | 9 (22) | 5 (21,7) | 4 (22,2) | |
| Alta sin TSR | 23 (56,1) | 17 (73,9) | 7 (38,9) | |
| Alta con TSR | 1 (2,4) | 0 | 1 (5,5) | |
| Hospitalizado | 8 (19,5) | 2 (8,7) | 6 (33,3) |
DE: desviación estándar; FRA: fracaso renal agudo; IL-6: interleucina 6; LDH: lactato deshidrogenasa; PCR: proteína C reactiva; RIC: rango intercuartílico; SDRA: síndrome de distrés respiratorio agudo; TSR: terapia de sustitución renal; UCI: Unidad de Cuidados Intensivos.
En negrita, las diferencias estadísticamente significativas.
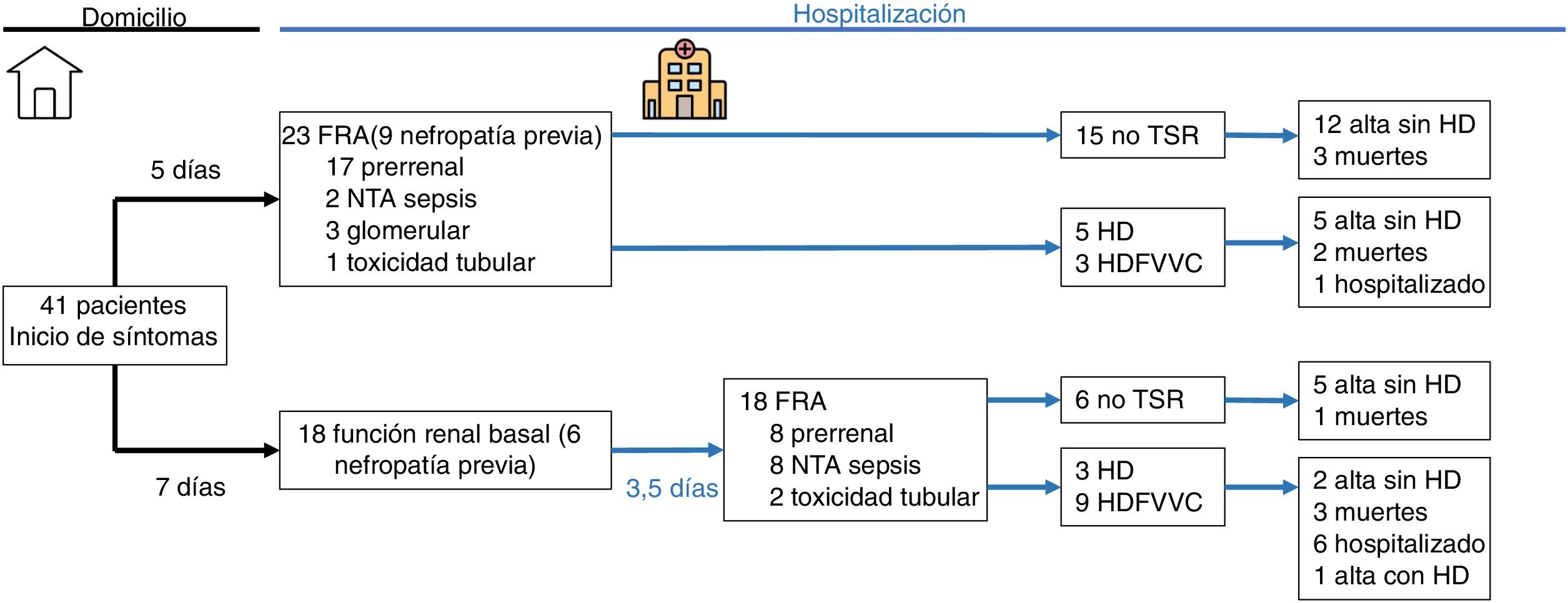
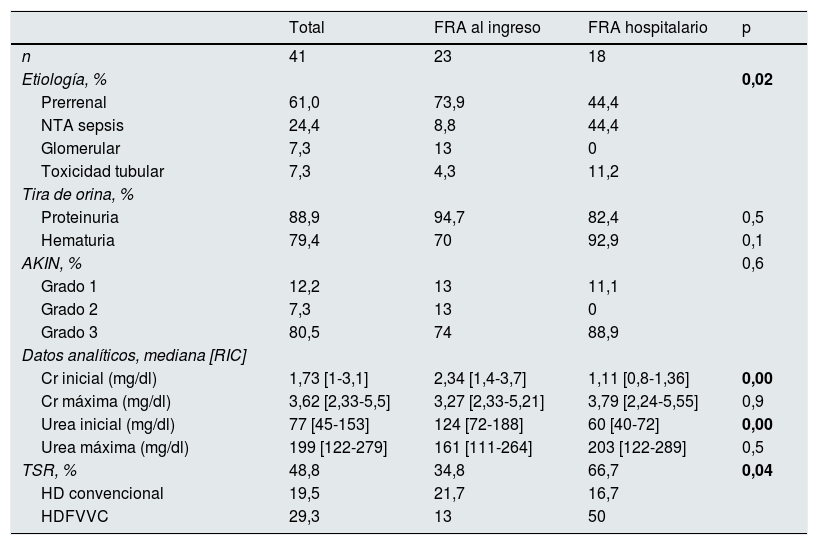
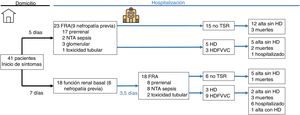
La presentación y la evolución de los FRA quedan recogidas en la tabla 3. El 56,1% de los casos presentaban deterioro agudo de la función renal a su llegada a Urgencias, mientras que el resto desarrollaron FRA durante el ingreso. El 61% de los casos de FRA fueron de causa prerrenal, el 24,4% secundarios a necrosis tubular aguda (NTA) en contexto de sepsis, el 7,3% por toxicidad tubular y el 7,3% de origen glomerular. El 88,9% de los casos presentaron proteinuria>0,2g/l y el 79,4% hematuria en tira de orina. En el 39% de los casos la orina se recogió tras sondaje vesical. Las medias de creatinina y de urea máximas fueron de 4,0 y 205mg/dl, respectivamente. El 12,2% fueron FRA grado 1, el 7,3% grado 2 y el 80,5% grado 3. El 48,8% de los casos requirieron alguna forma de TSR, con una media de 5 sesiones de tratamiento. El 56,1% de los casos se registraron en los primeros 20 días desde el inicio del estudio; en este primer periodo se registraron el 83,3% (15) de los FRA hospitalarios y el 34,8% (8) de los FRA al ingreso.
Características del fracaso renal agudo en los pacientes ingresado por COVID-19
| Total | FRA al ingreso | FRA hospitalario | p | |
|---|---|---|---|---|
| n | 41 | 23 | 18 | |
| Etiología, % | 0,02 | |||
| Prerrenal | 61,0 | 73,9 | 44,4 | |
| NTA sepsis | 24,4 | 8,8 | 44,4 | |
| Glomerular | 7,3 | 13 | 0 | |
| Toxicidad tubular | 7,3 | 4,3 | 11,2 | |
| Tira de orina, % | ||||
| Proteinuria | 88,9 | 94,7 | 82,4 | 0,5 |
| Hematuria | 79,4 | 70 | 92,9 | 0,1 |
| AKIN, % | 0,6 | |||
| Grado 1 | 12,2 | 13 | 11,1 | |
| Grado 2 | 7,3 | 13 | 0 | |
| Grado 3 | 80,5 | 74 | 88,9 | |
| Datos analíticos, mediana [RIC] | ||||
| Cr inicial (mg/dl) | 1,73 [1-3,1] | 2,34 [1,4-3,7] | 1,11 [0,8-1,36] | 0,00 |
| Cr máxima (mg/dl) | 3,62 [2,33-5,5] | 3,27 [2,33-5,21] | 3,79 [2,24-5,55] | 0,9 |
| Urea inicial (mg/dl) | 77 [45-153] | 124 [72-188] | 60 [40-72] | 0,00 |
| Urea máxima (mg/dl) | 199 [122-279] | 161 [111-264] | 203 [122-289] | 0,5 |
| TSR, % | 48,8 | 34,8 | 66,7 | 0,04 |
| HD convencional | 19,5 | 21,7 | 16,7 | |
| HDFVVC | 29,3 | 13 | 50 |
AKIN: Acute Kidney Injury Network; Cr: creatinina; DE: desviación estándar; FRA: fracaso renal agudo; HD: hemodiálisis; HDFVVC: hemodiafiltración veno-venosa continua; NTA: necrosis tubular aguda; RIC: rango intercuartílico; TSR: terapia de sustitución renal.
En negrita, las diferencias estadísticamente significativas.
La comparación de los pacientes con «FRA al ingreso» y «FRA intrahospitalario» se encuentra resumida en las tablas 1-3 y en la figura 1. El grupo de FRA intrahospitalario presentó mayor incidencia de NTA en contexto de sepsis (8,8 vs. 44,4; p=0,008), mayor proteína C reactiva máxima (124 vs. 250; p=0,01), mayor LDH máxima (399 vs. 573; p=0,027), mayor dímero-D (2,53 vs. 7,20; p=0,015), afectación pulmonar más grave (39,1 vs. 77,8; p=0,013), más necesidad de ventilación mecánica (65,2 vs. 77,8; p=0,009), más necesidad de ingreso en UCI (13 vs. 55,6; p=0,004), mayor tratamiento con lopinavir/ritonavir (17,4 vs. 94,4; p=0,000) y con fármacos biológicos (30,3 vs. 77,8; p=0,003), y mayor necesidad de TSR (34,8 vs. 66,7; p=0,043).
Desenlace clínicoLa estancia media fue de 15,8 días, con un tiempo mínimo de seguimiento para aquellos pacientes que seguían ingresados de 4 semanas. Al final del estudio, el 22% de los pacientes habían fallecido, el 56% habían sido dados de alta sin necesidad de TSR, el 2,4% con necesidad de TSR y el 19,5% continuaban ingresados (fig. 1).
DiscusiónEste estudio es el primero que analiza una cohorte española de FRA asociado a COVID-19 seguida por nefrólogos y describe una gran variedad de situaciones de daño renal que van más allá de la mera afectación parenquimatosa directa por el virus SARS-CoV-2. La mayoría de los estudios disponibles provienen de hospitales del área de Wuhan, donde se originó la pandemia8–10, y las referencias más próximas se centran en el manejo del paciente sometido a TSR crónico19.
Los principales trabajos sobre FRA en pacientes con infección por SARS-CoV-2 se centran en la histopatología renal, describiendo el daño como consecuencia del efecto citopático directo del virus o de la tormenta de citocinas secundaria13. Sin embargo, parecen olvidar otros factores fisiopatológicos clásicos del FRA convencional. Nuestro estudio encuentra una alta incidencia de FRA grave de etiología prerrenal, que llega a suponer casi la mitad de los casos y que dobla lo previamente referido por el estudio madrileño GEFRAM en una situación libre de pandemia20. La diarrea es un factor relevante para la deshidratación en estos pacientes, aunque hasta el momento se había considerado un síntoma minoritario en la infección por SARS-CoV-2, presente solo en un 3-10% de los casos3,4,21. Esta frecuencia es 10 veces superior en nuestra serie, aunque no podemos olvidar que se trata de una selección de pacientes por su afectación renal. También resulta llamativo que los pacientes habían tardado una semana en acudir a Urgencias desde que aparecieron los primeros síntomas, similar a lo reportado por Cheng et al.9. Esta situación podría deberse a la combinación de factores como un sistema sanitario saturado, el miedo a acudir a un foco hospitalario y las recomendaciones iniciales de permanecer en el domicilio difundidas por las autoridades sanitarias.
En los momentos iniciales de la pandemia se publicaron documentos de manejo clínico que recomendaban un uso conservador de la fluidoterapia con el objetivo de no producir o agravar la insuficiencia respiratoria con edema pulmonar22,23. Si bien es cierto que la COVID-19 no suele aparecer con un estado de shock que requiera reanimación con volumen24, esta condición se asocia a factores que pueden condicionar hipovolemia, como pérdidas insensibles por la fiebre, pérdidas digestivas e incluso la limitación del acceso libre al agua debido al aislamiento extremo y la falta de acompañantes en la habitación. Resulta llamativo que la incidencia de FRA prerrenal no se distribuya uniformemente durante el periodo de estudio, ya que la mayoría de nuestros casos se registraron en los primeros 20 días del estudio. Ese cambio coincide en el tiempo con la modificación del protocolo hospitalario que inicialmente limitaba el uso de fluidoterapia y promovía el uso generalizado de lopinavir/ritonavir con su consecuente predisposición a la diarrea; de hecho, el 83,3% de los FRA hospitalarios fueron en este primer periodo.
La presentación clínica del FRA fue muy variada, y solo 3 de los casos incluidos (7,3%) fueron asociados a enfermedades glomerulares. Se detectó un caso de nefropatía lúpica no conocida previamente y 2 casos de microangiopatía trombótica, siendo estos últimos cuadros inherentes a la fisiopatología renal descrita por la infección por SARS-CoV-213. Asimismo, tanto la proteinuria como la hematuria se han descrito como factores independientes asociados a mayor mortalidad hospitalaria en estos pacientes9. En nuestro estudio encontramos el doble de frecuencia de proteinuria y hematuria que lo reportado por Li et al. en su serie de 193 casos10, y hasta el triple de lo descrito por Cheng et al. en su serie de 701 casos9, si bien parte de las muestras fueron tomadas tras sondaje vesical.
Hemos observado 2 tipos de pacientes claramente diferenciados: el grupo de FRA al ingreso y el de FRA intrahospitalario. Ambos parten de un perfil demográfico y de comorbilidad similar (tabla 1); sin embargo, el fenotipo de FRA intrahospitalario presenta una proporción significativamente mayor de NTA asociada a sepsis, mientras que el grupo de FRA al ingreso se asocia principalmente a factores prerrenales (tabla 3). En general, el grupo de FRA intrahospitalario concentra a pacientes más graves, con afectación pulmonar más severa, con necesidad de ventilación mecánica e ingreso en UCI y con parámetros analíticos de peor pronóstico (tabla 2)21,25. El FRA fue más grave en este grupo y requirió más tiempo de soporte con TSR.
El FRA se ha definido como factor de peor pronóstico y mayor mortalidad en pacientes ingresados con infección por SARS-CoV-29,10. La mortalidad en este estudio fue del 22%, similar a lo estimado en la población con afectación renal por Cheng et al.9.
Este trabajo es, a nuestro entender, el primero específico sobre desarrollo de FRA en pacientes con infección por SARS-CoV-2 en España y el primero que analiza los diferentes patrones clínicos, destacando la importancia del FRA prerrenal en esta pandemia. No obstante, tiene limitaciones, como el tamaño muestral, una selección negativa de los casos más graves y la falta de biopsia renal.
El escenario de la pandemia COVID está cambiando rápidamente. La incidencia actual se está reduciendo y aliviando la sobrecarga asistencial, hay más disponibilidad de test serológicos y de RT-PCR, y disponemos de más evidencia para ajustar los tratamientos. Esto debería suponer que los pacientes acudan antes a Urgencias y sean tratados desde fases precoces de la enfermedad. Los protocolos han evolucionado y se dirigen a un abordaje global del paciente, que incluye otras complicaciones determinantes en su evolución, como es el FRA. El estudio epidemiológico nacional solo ha identificado un 5% de exposición al virus en población general (11% en Madrid)26. Finalmente, nos enfrentamos a un nuevo perfil de pacientes que ingresan por cualquier motivo y asocian una infección por SARS-CoV-2 detectado por una RT-PCR incidental. La impresión de los expertos es que conviviremos durante meses con los pacientes de COVID-19 y todos los especialistas deben vigilar la afectación renal y proteger al paciente del riesgo de FRA si se pretenden minimizar las consecuencias a largo plazo de esta pandemia.
En conclusión, el FRA se presenta en la COVID-19 con fenotipos variados, entre los que destacan la situación prerrenal y la NTA asociada a sepsis. La monitorización frecuente de marcadores de daño renal, así como el manejo individualizado de la volemia, pueden ser determinantes para prevenir el FRA, especialmente en pacientes con infecciones más graves.
FinanciaciónEstudio cofinanciado por un “Unrestricted Grant” de la FRIAT a través de Fundación Madrileña de Nefrología y el Instituto de Investigación Segovia de Arana-Puerta de Hierro-Majadahonda, Madrid (018/02FRA).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la asistencia técnica de la Dra. Paula López Sánchez, BSc, PhD, en los aspectos metodológicos y de análisis estadístico.