La glomerulonefritis fibrilar (GNF) tiene un mal pronóstico y carece de tratamiento estandarizado.
Materiales y métodosEn este estudio analizamos las características clínicas y patológicas, la evolución y el manejo de 13 pacientes diagnosticados con GNF mediante biopsia renal positiva para DNAJB9 entre 2019 y 2024 en nuestro centro. Se recogieron datos demográficos, comorbilidades, valores de laboratorio, hallazgos histopatológicos y tratamientos. Se definió remisión completa como proteinuria <500mg/g con función renal normal; remisión parcial como reducción >50% de proteinuria a <2.000mg/g con función renal estable; y sin remisión como ausencia de mejora, progresión a enfermedad renal crónica (ERC) estadio 5 o muerte.
ResultadosLa media de edad fue 61,4 años, el 69,2% varones, con una proteinuria mediana de 2.318mg/g (38% en rango nefrótico) y creatinina sérica mediana de 1,64mg/dl. Resultados de biopsia renal: el 29% de los glomérulos estaba esclerosado. El patrón histológico más frecuente fue el membranoproliferativo (61,6%), seguido del mesangial (30,8%) y membranosa (7,7%). La hipoalbuminemia (<3g/dl) se asoció a peor pronóstico (HR: 6,52; p=0,04). La proteinuria >3.500mg/g y la creatinina mostraron tendencias no significativas. El 84,6% recibió inmunosupresión: rituximab (RTX) (61,5%), RTX+micofenolato (7,7%), RTX seguido de ocrelizumab y obinutuzumab (7,7%), y corticoides en monoterapia (7,7%). Se consiguió remisión parcial en el 30,8%, todos tratados con RTX en monoterapia. Un 38,4% progresó a ERC estadio 5 o falleció.
ConclusiónLa GNF mostró mal pronóstico y respuesta parcial a RTX. La GNF con hipoalbuminemia presentó peor pronóstico. Se necesitan estudios prospectivos con mayores cohortes para confirmar estos hallazgos y optimizar su manejo.
Fibrillary glomerulonephritis (FGN) has a poor prognosis and lacks standardized treatment. In this study, we describe clinicopathological characteristics, clinical course, and management of patients with FGN at our center.
Materials and methodsA retrospective cohort study of 13 patients diagnosed with FGN by positive DNAJB9 at kidney biopsy between 2019 and 2024. Demographic data, comorbidities, laboratory values, histopathological findings, and treatments were collected, Complete remission was defined as proteinuria <500mg/g with normal renal function; partial remission as >50% reduction in proteinuria to <2000mg/g with stable renal function; and no remission as absence of improvement, progression to end-stage kidney disease (ESKD), or death.
ResultsThe mean age was 61.4 years, 69,2% male, median proteinuria of 2318mg/g (38% nephrotic range) and serum creatinine 1.64mg/dL, Histopathological findings: 29% global glomerulosclerosis. The most frequent pattern was membranoproliferative (61.6%), followed by mesangial (30.8%) and membranous in 1 patient (7.7%), Hypoalbuminemia (<3g/dL) was associated with worse prognosis (HR 6.52, P=.04); proteinuria >3500mg/g and creatinine showed non-significant trends. Immunosuppression was given in 84.6% of patients: rituximab (RTX) (61.5%), RTX+mycophenolate (7.7%), sequential RTX followed by ocrelizumab and obinutuzumab (7.7%), and corticosteroids alone (7.7%). Partial remission was achieved in 30.8%, all within the exclusive RTX group, A total of 38.4% progressed to ESKD or death.
ConclusionsIn our study, FGN showed poor prognosis and partial response to RTX. FGN with hypoalbuminemia had worse outcomes. Prospective studies and larger cohorts are needed to validate these findings and optimize its management.
La glomerulonefritis fibrilar (GNF) es una enfermedad rara, identificada en el 0,5-1% de las biopsias renales1,2. Se distingue por la presencia de fibrillas no amiloides restringidas al glomérulo, localizadas principalmente en el mesangio y la membrana basal glomerular, las cuales tienen un diámetro típico de 10-30nm y carecen de un centro hueco. En la inmunofluorescencia, se tiñen intensamente para IgG, kappa, lambda y C3, y son habitualmente negativas para rojo Congo1–4.
Se ha asociado a diversas enfermedades autoinmunes, gammapatía monoclonal, neoplasias e infecciones, destacando la hepatitis C. No obstante, en más de la mitad de los casos la causa sigue sin poder identificarse, lo que podría sugerir mecanismos patogénicos aun no comprendidos5,6. Clínicamente, suele manifestarse alrededor de los 60 años de forma inespecífica. Hasta el 70% de los pacientes presentan insuficiencia renal, hematuria y proteinuria, frecuentemente en rango nefrótico. Entre un 15 y un 36% de los casos, la enfermedad puede comenzar como un síndrome nefrótico puro1,2,6,7.
Recientemente se ha demostrado que la proteína DNAJB9, que en condiciones normales se puede encontrar en niveles bajos en células tubulares, podocitos, células mesangiales y endoteliales a nivel renal, se presenta de manera exclusiva en esta enfermedad como depósitos extracelulares. Este hallazgo ha transformado el diagnóstico de la GNF, permitiendo su identificación con una sensibilidad del 98% y una especificidad superior al 99%, eliminando la necesidad de análisis ultraestructurales siendo este último el método clásico para su diagnóstico8–11.
El pronóstico descrito hasta la actualidad es desfavorable, ya que más de la mitad de los pacientes evolucionan a enfermedad renal crónica (ERC) estadio 5 en un plazo de 5 años tras el diagnóstico6. La evidencia sobre un tratamiento óptimo sigue siendo limitada, y el manejo inmunosupresor ha sido variable en diferentes cohortes, incluyendo principalmente esteroides, ciclofosfamida, micofenolato y rituximab (RTX)1,6. Estudios recientes han sugerido que el RTX podría ralentizar la progresión de la enfermedad; sin embargo, la evidencia sobre su eficacia es escasa12,13.
En el estudio actual nos proponemos describir las principales características clínico-patológicas de los pacientes diagnosticados con GNF en nuestro hospital, analizaremos los factores de riesgo asociados a su progresión y exploraremos el impacto del tratamiento en su evolución.
Materiales y métodosRealizamos un estudio de cohorte retrospectivo que incluyó, a 13 pacientes diagnosticados con GNF mediante biopsia renal, confirmada mediante DNAJB9, en nuestro centro entre 2019 y 2024.
Se recogieron los datos demográficos, índice de masa corporal (IMC), comorbilidades asociadas al diagnóstico de GNF, resultados de laboratorio tanto al momento basal como en las visitas de seguimiento, tratamientos utilizados (tanto de soporte como inmunosupresor) y características de la biopsia renal. Dichas variables se obtuvieron de la revisión de las historias clínicas. Como variable clínica basal adicional, se definió la proteinuria en 2 categorías: menor o mayor de 3.500mg/g, debido a su relevancia pronóstica. En cuanto a la biopsia renal, se registró el número de glomérulos por biopsia, el porcentaje de glomérulos esclerosados, el patrón de lesión en la microscopia óptica y la localización de las fibrillas en la microscopía electrónica si estaba disponible. La inflamación y la atrofia tubular se categorizaron en ausente (0%), leve (1-25%), moderada (25-50%) o severa (>50%).
Se recogió información en visitas de seguimiento a los 3, 6 y 12 meses, y posteriormente de forma anual hasta el momento de censura o el fin del periodo de estudio, incluyendo niveles de proteinuria y sus cambios, concentración de albúmina y variaciones en la función renal. Los pacientes se clasificaron en grupos según los tratamientos recibidos (soporte, inmunosupresores o combinación), los cuales se analizaron en función de su desenlace. Como desenlaces del estudio, se establecieron la remisión completa, definida como la reducción de la proteinuria a menos de 500mg/g con función renal normal; la remisión parcial, caracterizada por una reducción de la proteinuria en más del 50% respecto a la basal, con una proteinuria menor de 2.000mg/g y función renal estable (sin incremento mayor al 20% respecto a su valor basal); y la ausencia de remisión, que incluyó a los pacientes que no lograron remisión completa ni parcial, así como aquellos que progresaron a ERC estadio 5 o fallecieron durante el seguimiento.
El análisis estadístico se realizó utilizando Python (versión 3,13). Las variables categóricas se describieron en frecuencias y porcentajes, mientras que las variables continuas se expresaron como media±desviación estándar (SD) o mediana con rango intercuartílico (RIQ), según la distribución evaluada mediante la prueba de normalidad de Shapiro-Wilk, dado el reducido número de pacientes. Los casos con valores perdidos fueron excluidos del análisis correspondiente. Para los análisis de supervivencia, se aplicaron modelos de regresión de riesgos proporcionales de Cox univariados para identificar factores de riesgo de progresión a ERC estadio 5 o muerte, considerando el tiempo hasta el evento (ERC estadio 5, muerte) o censura. Se evaluó la proporcionalidad de los riesgos mediante la prueba de Schoenfeld, y se realizaron análisis de sensibilidad para verificar la robustez de los hallazgos, ajustando umbrales de hipoalbuminemia (< 3 vs. <2,5g/dl) y proteinuria (mediana de 2.318mg/g). No se realizó análisis multivariado debido al tamaño muestral limitado. La significación estadística se definió como p<0,05.
ResultadosCaracterísticas clínicas y analíticasDurante el periodo de estudio, se diagnosticaron 13 casos de GNF en nuestro hospital. La edad media de los pacientes fue de 61,4 años, con un predominio masculino del 69,2%, y de raza blanca (92%). La comorbilidad más frecuente fue la hipertensión arterial, observada en el 92% de los casos, seguida de la diabetes mellitus en el 23,1%. Se identificó un paciente con infección por virus de la hepatitis C, mientras que no se detectaron casos asociados a enfermedades autoinmunes ni a neoplasias (tabla 1).
Características demográficas y clínicas basales
| Variable | Valor |
|---|---|
| Sexo | Varón: 9 (69,2%) |
| Raza | Blanca: 12 (92,3%) |
| Hispánica: 1 (7,7%) | |
| Edad (años) | 61,4±5,51 |
| IMC (kg/m2) | 27,58±8,98 |
| Presión arterial sistólica (PAS, mmHg) | 130,69±16,29 |
| Presión arterial diastólica (PAD, mmHg) | 72,08±9,71 |
| Diabetes mellitus | 3 (23,1%) |
| Malignidad | 0 (0%) |
| Enfermedad autoinmune | 0 (0%) |
| Hepatitis C | 1 (7,7%) |
| Enfermedad cardiovascular | 3 (23,1%) |
| Hipertensión arterial (HTA) | 12 (92,3%) |
IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Dentro de los análisis de laboratorio, los pacientes presentaron una creatinina sérica (sCr) mediana de 1,64mg/dl y una tasa de filtración glomerular mediana de 31ml/min/1,73m2. Todos exhibieron proteinuria al realizarse la biopsia renal, con una mediana de relación proteína/creatinina en orina (UPCR) de 2.318mg/g, alcanzando el rango nefrótico en el 38% de los casos. Tres pacientes mostraron niveles de albúmina sérica inferiores a 3g/dl, y la hematuria se observó en el 38,5%. Cinco pacientes tuvieron anticuerpos antinucleares (ANA) positivos, con títulos de 1/80 en 3, 1/160 en 1 y 1/320 en otro. Los niveles de complemento fueron normales en todos los casos, y las crioglobulinas, evaluadas en 9 pacientes, resultaron negativas (tabla 2).
Hallazgos de laboratorio al momento del diagnóstico en los pacientes con glomerulonefritis fibrilar
| Variable | Valor |
|---|---|
| Creatinina sérica (mg/dl) | 1,64 [1,31-2,27] |
| Filtrado glomerular (ml/min/1,73m2) | 31 [27-58,5] |
| UPCR (mg/g) | 2.318 [1.114,7-5.952,6] |
| UACR (mg/g) | 1072 [604,5-4396,9] |
| Colesterol (mg/dl) | 182,69±57,09 |
| Hemoglobina (g/dl) | 12,33±2,64 |
| HbA1c (%) | 5,65 [5,43-5,88] |
| Albúmina (g/dl) | 3,66±0,71 |
| C3 (mg/dl) | 120,79±23,85 |
| C4 (mg/dl) | 31,75±9,45 |
| Proteinuria, n (%) | 13 (100%) |
| Rango nefrótico (>3,5g/24h), n (%) | 5 (38%) |
| Hipoalbuminemia (<3g/dl), n (%) | 3 (23,1%) |
| Hematuria, n (%) | 5 (38,5%) |
| Leucocituria, n (%) | 5 (38,5%) |
| ANA positivos, n (%) | 5 (38,5%) |
| Título 1/80, n | 3 |
| Título 1/160, n | 1 |
| Título 1/320, n | 1 |
| Crioglobulinas negativas, n/testados | 9/9 (100%) |
ANA: anticuerpos antinucleares; C3: complemento 3; C4: complemento 4; HbA1c: hemoglobina glucosilada; UACR: relación albúmina/creatinina urinaria; UPCR: relación proteína/creatinina urinaria.
En un total de 13 biopsias renales realizadas, la principal indicación fue la presencia de proteinuria con deterioro de la función renal, representando 9 casos (69,2%). Le siguió la proteinuria con función renal preservada, observada en 3 pacientes (23,1%). Finalmente, en un solo caso (7,7%) la biopsia se indicó por una lesión renal aguda. El tiempo mediano desde la primera alteración analítica hasta la realización de la biopsia fue de 224 días [38-316 días].
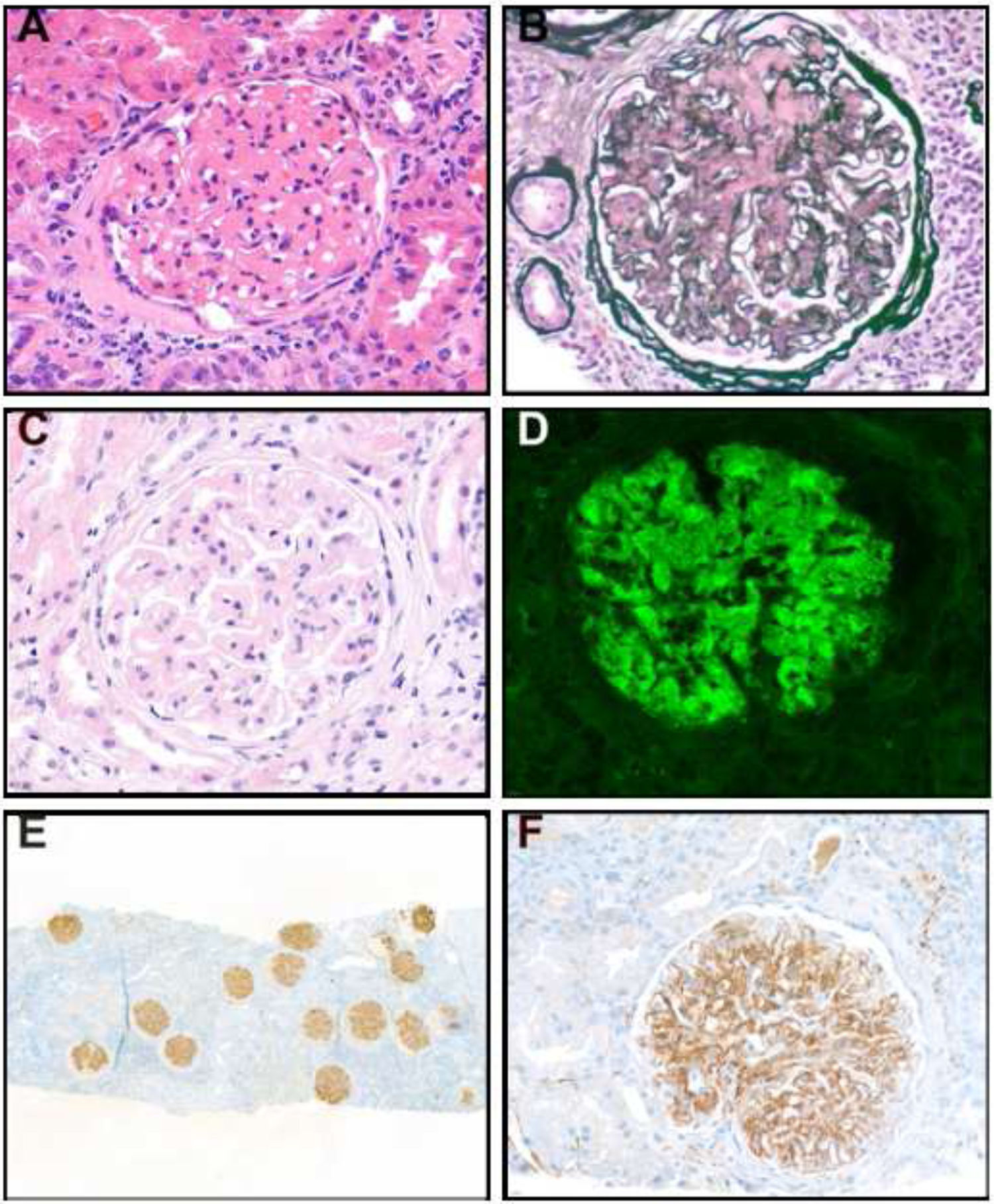
Características histopatológicasEn cuanto a las características de la biopsia renal, las muestras obtenidas presentaron una media de 23 glomérulos por biopsia. Un promedio del 29% de los glomérulos mostró esclerosis global. El patrón histopatológico más frecuente fue el membranoproliferativo, observado en 9 pacientes (61,6%), seguido del mesangial en 3 pacientes (figs. 1A y B) (30,8%) y un patrón membranoso en un paciente (fig. 1C) (7,7%). No se identificaron lesiones crescenticas en ningún caso. En relación con la atrofia tubular, se observó atrofia leve en 5 pacientes (38,5%), moderada en 7 (53,8%) y severa en 1 (7,7%). El 76,9% de los pacientes mostró inflamación intersticial, de los cuales el 70% presentó una inflamación leve y focal. Dos pacientes exhibieron enfermedades concomitantes: uno con nefropatía diabética y otro con nefritis intersticial aguda asociada a nefropatía diabética (tabla 3).
A-F) Imágenes de biopsias renales: A) Expansión mesangial importante por depósito de material eosinofílico, hematoxilina y eosina (H&E); B) Tinción de plata, evidencia áreas mesangiales expandidas por depósito no argirofílico; C) Engrosamiento marcado de las membranas basales por depósito de material eosinofílico, H&E; D) Inmunofluorescencia, tinción mesangial y en asas capilares por IgG; E) Tinción inmunohistoquímica de DNAJB9, predominante en las asas capilares; F) DNAJB9, mesangial y en asas capilares.
Características histopatológicas e inmunofluorescencia de la biopsia renal en los pacientes con glomerulonefritis fibrilar
| Características | Valor |
|---|---|
| Número de glomérulos | 23,38±10,82 |
| Glomérulos escleróticos, % | 28,96±20,46 |
| Patrón histopatológico, n (%) | |
| Mesangial | 4 (30,8) |
| Membranoproliferativo | 8 (61,6) |
| Membranoso | 1 (7,69) |
| Lesiones crescenticas, n (%) | 0 (0) |
| Inflamación intersticial, n (%) | |
| No | 3 (23,08) |
| Leve | 7 (53,85) |
| Moderada | 2 (15,38) |
| Severa | 1 (7,69) |
| Atrofia tubular, n (%) | |
| Leve | 5 (38,46) |
| Moderada | 7 (53,85) |
| Severa | 1 (7,69) |
| Arteriosclerosis hialina, n (%) | |
| No | 3 (23,08) |
| Leve | 5 (38,46) |
| Moderada | 3 (23,08) |
| Severa | 2 (15,38) |
| Localización de fibrillas por ME, n (%) | 6 |
| Mesangial | 1 (7,69) |
| Pared glomerular | 1 (7,69) |
| Mesangial y pared glomerular | 4 (30,77) |
| Otras enfermedades glomerulares, n (%) | |
| Ninguna | 11 (84,62) |
| Nefropatía diabética+NIA | 1 (7,69) |
| Nefropatía diabética | 1 (7,69) |
| DNAJB9, n (%) | 13 (100) |
| IgG IF (media de intensidad, positivos), n (%) | 9 (69,23) (2,5+) |
| IgA IF (media de intensidad, positivos), n (%) | 2 (15,38) (0,75+) |
| IgM IF (media de intensidad, positivos), n (%) | 3 (23,08) (2,05+) |
| C3 IF (media de intensidad, positivos), n (%) | 10 (76,92) (2+) |
| C1q IF (media de intensidad, positivos), n (%) | 4 (30,77) (1,125+) |
| Kappa IF (media de intensidad, positivos), n (%) | 10 (76,92) (2,1+) |
| Lambda IF (media de intensidad, positivos), n (%) | 10 (76,92) (2,05+) |
IF: Inmunofluorescencia; ME: microscopía electrónica.
Respecto a los resultados de inmunofluorescencia, 9 pacientes (69,2%) mostraron positividad para IgG, con una intensidad media de 2,5+ (fig. 1D). Seis pacientes (46,2%) fueron positivos para IgA, con una intensidad media de 1+, y otros 6 (46,2%) para IgM, con una intensidad media de 0,2+. Cuatro pacientes (30,8%) presentaron positividad para C1q, con una intensidad media de 1,1+. Asimismo, 10 pacientes (76,9%) resultaron positivos para cadenas ligeras kappa, con una intensidad media de 2,1+, para lambda, con una intensidad media de 2,05+, y para C3, con una intensidad media de 2+ (tabla 3).
Se realizó microscopía electrónica en 6 pacientes, revelando la presencia de fibrillas exclusivamente en el mesangio en un caso, en la pared glomerular en otro, y en ambos sitios en los 4 restantes. Todos los pacientes analizados fueron positivos para DNAJB9 (figs. 1E y F).
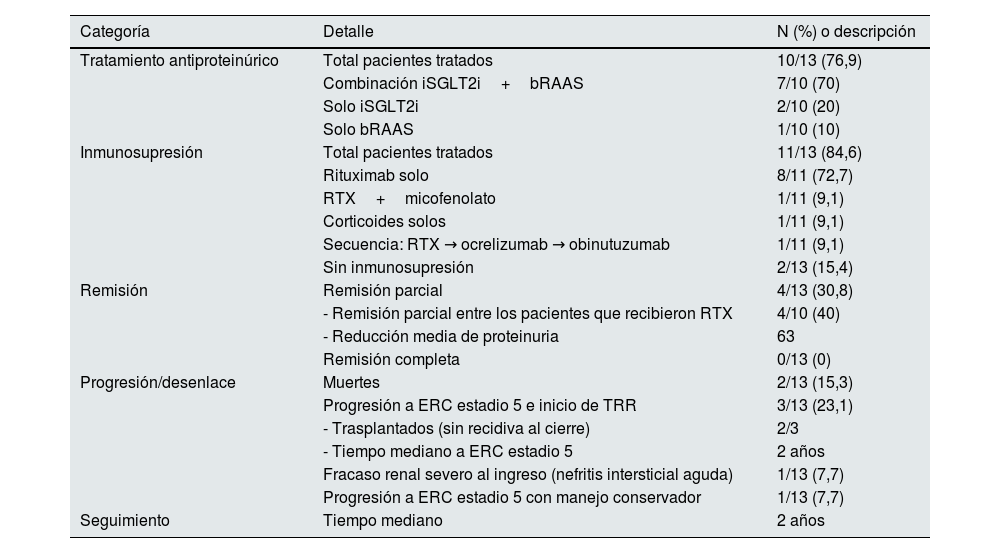
Tratamiento y evoluciónEn cuanto al tratamiento, 10 de los 13 pacientes recibieron terapia antiproteinúrica, siendo la combinación de inhibidores del SGLT2 (iSGLT2) y bloqueadores del sistema renina-angiotensina-aldosterona (bSRA) la estrategia más frecuente (n=7), 2 monoterapia con SGLT2i (n=2), y una monoterapia con bSRA (n=1). Un total de 11 de los 13 pacientes recibieron inmunosupresión: monoterapia con RTX (n=8), RTX combinado con micofenolato (n=1), y monoterapia bolus corticoides (n=1). El tiempo desde el diagnóstico hasta el inicio del tratamiento inmunosupresor fue de 54,5 días [32,3-151,5 días]. De los 9 pacientes tratados con RTX, 7 recibieron el esquema estándar de 2 dosis de 1g separadas por 2 semanas, y un paciente recibió una dosis única de 1g. Además, uno de estos pacientes fue retratado con RTX a los 18 meses debido a un deterioro progresivo de la función renal y aumento de la proteinuria, sin observar mejoría clínica al cierre del seguimiento. Por otro lado, un paciente que inició tratamiento con RTX (1g en 2 dosis), debido al deterioro progresivo de la función renal y persistencia de la proteinuria, recibió tratamiento secuencial con otros anticuerpos anti-CD20: primero ocrelizumab y, posteriormente, obinutuzumab. Al cierre del seguimiento, 24 meses luego de haber administrado el obinutuzumab, el paciente está con una sCr de 3,21mg/dl y proteinuria de 2.300mg/g. Los 2 pacientes restantes no recibieron inmunosupresión. Todos los tratamientos fueron administrados según el criterio del médico tratante.
Durante un seguimiento mediano de 2,0 años [0,9-3,9 años], se registraron 5 eventos de progresión a ERC estadio 5 o muerte. Cuatro pacientes (30,8%) alcanzaron remisión parcial, todos pertenecientes al grupo tratado solo con RTX, aunque ningún paciente logró remisión completa. Los pacientes con remisión parcial presentaban basalmente mediana de UPCR (3.940,5 vs. 4.205,9mg/g) y sCr similar (1,48 vs. 1,64mg/dl) comparado con pacientes que no tuvieron remisión. En el grupo con remisión parcial, se observó una reducción media de la proteinuria del 63%. Entre los pacientes sin remisión, un caso con diagnóstico asociado de nefritis intersticial aguda presentó fracaso renal severo al ingreso, requiriendo inicio de terapia de reemplazo renal, y falleció durante esa hospitalización. Otros 3 pacientes progresaron a ERC estadio 5 e iniciaron terapia de remplazo renal durante el seguimiento en una mediana de 2 años; de estos, 2 fueron trasplantados y, al cierre del seguimiento, no mostraron evidencia de recidiva de la GNF. Un paciente adicional presentó progresión de su enfermedad renal, se decidió un manejo conservador y falleció a lo largo del seguimiento por complicaciones asociadas a múltiples comorbilidades (tabla 4).
Resumen de tratamientos y desenlaces en los pacientes con glomerulonefritis fibrilar (n=13)
| Categoría | Detalle | N (%) o descripción |
|---|---|---|
| Tratamiento antiproteinúrico | Total pacientes tratados | 10/13 (76,9) |
| Combinación iSGLT2i+bRAAS | 7/10 (70) | |
| Solo iSGLT2i | 2/10 (20) | |
| Solo bRAAS | 1/10 (10) | |
| Inmunosupresión | Total pacientes tratados | 11/13 (84,6) |
| Rituximab solo | 8/11 (72,7) | |
| RTX+micofenolato | 1/11 (9,1) | |
| Corticoides solos | 1/11 (9,1) | |
| Secuencia: RTX → ocrelizumab → obinutuzumab | 1/11 (9,1) | |
| Sin inmunosupresión | 2/13 (15,4) | |
| Remisión | Remisión parcial | 4/13 (30,8) |
| - Remisión parcial entre los pacientes que recibieron RTX | 4/10 (40) | |
| - Reducción media de proteinuria | 63 | |
| Remisión completa | 0/13 (0) | |
| Progresión/desenlace | Muertes | 2/13 (15,3) |
| Progresión a ERC estadio 5 e inicio de TRR | 3/13 (23,1) | |
| - Trasplantados (sin recidiva al cierre) | 2/3 | |
| - Tiempo mediano a ERC estadio 5 | 2 años | |
| Fracaso renal severo al ingreso (nefritis intersticial aguda) | 1/13 (7,7) | |
| Progresión a ERC estadio 5 con manejo conservador | 1/13 (7,7) | |
| Seguimiento | Tiempo mediano | 2 años |
Los porcentajes reflejan la proporción dentro de cada subcategoría o del total.
bRAAS: bloqueadores del sistema renina-angiotensina-aldosterona; ERC: enfermedad renal crónica; iSGLT2: inhibidores del SGLT2; RTX: rituximab; TRR: terapia de reemplazo renal.
En esta cohorte, se observaron asociaciones potenciales entre algunas características clínicas y el riesgo de progresión a ERC estadio 5 o muerte. En el análisis de regresión de Cox univariado, la presencia de hipoalbuminemia (<3g/dl) al momento de la biopsia renal se asoció con un mayor riesgo del desenlace compuesto (HR: 6,52; IC 95%: 1,06-40,02; p=0,04). También se observaron tendencias no significativas en los pacientes con proteinuria >3.500mg/g (HR: 6,65; IC 95%: 0,73-60,11; p=0,09) y en aquellos con sCr elevada al diagnóstico (HR: 6,8; IC 95%: 0,64-72,9; p=0,11). Por su parte, el patrón histológico membranoproliferativo, aunque frecuente entre los pacientes que progresaron, no mostró una asociación estadísticamente significativa con el desenlace (HR: 1,56; IC 95%: 0,17-14,04; p=0,69). Debido al reducido tamaño muestral y al bajo número de eventos, y los amplios intervalos de convianza los análisis de regresión de Cox univariados se consideran exploratorios.
El análisis de sensibilidad fue consistente con la asociación observada entre hipoalbuminemia y el evento compuesto (HR: 6,52; p=0,04), aunque un umbral más estricto (<2,5g/dl), la asociación no alcanzó significación (HR: 2,08; IC 95%: 0,23-18,84; p=0,51), probablemente por la escasez de niveles tan bajos. Para la proteinuria, intentamos un análisis de sensibilidad con la mediana de UPCR (2.318mg/g) como umbral, pero no fue posible debido a una relación demasiado fuerte entre este punto de corte y los datos en nuestra cohorte. Por ello, optamos por el umbral clínico de 3.500mg/g en el análisis principal, dado su valor pronóstico establecido y su relevancia en enfermedades glomerulares. El supuesto de riesgos proporcionales se evaluó mediante la prueba de Schoenfeld, sin detectar violaciones significativas (p>0,05 implícito para todas las variables).
DiscusiónEn este estudio, describimos las características clínicas, el manejo y los desenlaces de los pacientes diagnosticados con GNF en nuestro centro. Nuestra cohorte, con una edad media de 61 años, mostró un predominio de pacientes del sexo masculino, lo que resulta interesante porque otras series publicadas suelen reportar una mayor proporción de mujeres14,15. La mayoría de nuestros pacientes tenían hipertensión arterial y diabetes mellitus, lo que destaca un perfil comórbido relevante; sin embargo, no encontramos asociación con malignidades ni enfermedades autoinmunes, a diferencia de lo descrito en la literatura, donde estas condiciones están presentes en un 5-10% y un 5-15% de los casos, respectivamente1,6,9. Este hallazgo es interesante y podría sugerir que nuestra población podría tener características distintivas que valen la pena explorar más a fondo en estudios más amplios.
Similar con lo reportado en otros estudios, nuestros pacientes presentaron una función renal comparable al momento del diagnóstico, junto con una proteinuria significativa, que en un 38% de los casos alcanzó el rango nefrótico, lo que subraya la gravedad de la GNF en el momento de su diagnóstico. Sin embargo, a diferencia de lo descrito en la literatura, solo el 38% de nuestros pacientes mostró hematuria al inicio de la enfermedad, una proporción menor a la usualmente reportada1,6,9.
En nuestra cohorte, el patrón histopatológico más frecuente fue el membranoproliferativo, seguido por el mesangial. En concordancia con otras series, los pacientes con patrón membranoproliferativo presentaron una tendencia a progresión de su enfermedad renal, sin embargo, en nuestro estudio esta diferencia no alcanzó significación estadística2,15,16. Además, contamos con un caso de patrón membranoso que presentó una evolución tórpida, marcada por una progresión significativa de la enfermedad renal y fallecimiento debido a múltiples comorbilidades, un desenlace que se alinea con algunos reportes de casos en la literatura que han descrito una evolución desfavorable asociada a este patrón17,18. Nuestros pacientes presentaron un patrón de inmunofluorescencia caracterizado primordialmente por IgG, kappa, lambda y C3 coincidiendo con lo descrito en otras cohortes1,9,15. Todos nuestros pacientes fueron diagnosticados además con el DNAJB9 resaltando la importancia de este marcador en el diagnóstico de la enfermedad3,8,10,11.
Nuestros hallazgos sobre los desenlaces reflejan la severidad de la GNF en nuestra cohorte, con una progresión de la enfermedad renal o fallecimiento en el 38,4% de los pacientes, un dato que se alinea con las cohortes internacionales más numerosas, las cuales destacan el pobre pronóstico asociado a esta enfermedad1,6. La presencia de hipoalbuminemia se asoció a un peor pronóstico en esta cohorte. Por otro lado, la proteinuria superior a 3.500mg/g y el deterioro de la función renal al momento del diagnóstico mostraron tendencias hacia un mayor riesgo, aunque no alcanzaron significación estadística. Es notable que la proteinuria ha presentado resultados variables en otras cohortes9,15,19, identificándose como factor de riesgo en algunos estudios, pero no así, como reportó Andeen et al. en una cohorte multicéntrica6, lo que añade complejidad a su interpretación. No obstante, el hallazgo relacionado con el grado de deterioro de la función renal al momento del diagnóstico es consistente con los reportados en otros estudios de cohortes1,6,9, similar a lo observado en otras glomerulopatías20,21. No se halló relación estadísticamente significativa con los datos de la biopsia renal, como el grado de atrofia tubular, el porcentaje de esclerosis glomerular o los patrones histopatológicos.
En nuestro centro, la estrategia inmunosupresora más utilizada fue el uso de RTX, generalmente como terapia única y, en algunos casos, combinado con otro inmunosupresor. Se observó remisión parcial en 4 de los 13 pacientes (30,8%), exclusivamente en aquellos tratados con RTX de forma aislada. Este resultado es consistente con hallazgos de otros estudios6,8,12, que han asociado el RTX con una mayor probabilidad de remisión y una reducción en la progresión de la enfermedad, aunque se requiere de estudios más amplios para confirmar su eficacia.
Nuestro estudio tiene varias limitaciones. El tamaño reducido de nuestra cohorte limita el poder estadístico para detectar asociaciones significativas, como se observó con la proteinuria y la función renal. Por ello, todos los hallazgos deben considerarse exploratorios e hipótesis-generadores, evitando extrapolaciones o interpretaciones causales. Además, no se puede descartar confusión residual, por lo que se recomienda precaución en la interpretación de las asociaciones observadas. Además, al ser un estudio retrospectivo de un solo centro, podrían existir sesgos de selección y variabilidad en el manejo clínico, lo que pudo influir en los desenlaces. La heterogeneidad en los tratamientos, la ausencia de un grupo control y la falta de un análisis multivariado para ajustar por factores de confusión también restringen nuestras conclusiones.
En conclusión, nuestros hallazgos reflejan la marcada severidad de la GNF, con una progresión de la enfermedad renal o mortalidad que concuerda con otras cohortes, destacando la relevancia de los factores de riesgo identificados y el potencial terapéutico limitado del RTX, a pesar de nuestra muestra reducida. Estos resultados enfatizan la necesidad de estudios prospectivos multicéntricos, nuevas estrategias terapéuticas y poblaciones más amplias para validar nuestros hallazgos y mejorar el manejo de esta enfermedad.
Identificadores ORCIDMaría José Soler Romeo: 0000-0003-3621-0766
FinanciaciónEste estudio fue financiado mediante una subvención de investigación de Boehringer Ingelheim. J.L.R. cuenta con una beca Río Hortega del Instituto de Salud Carlos III (CM23/00213), e I.M.D. con una beca PFIS del mismo organismo (FI22/00335). Los autores también son beneficiarios de otras subvenciones de investigación del Instituto de Salud Carlos III (PI21/01292, AC22/00029, INT23/00078, PI24/01510). El grupo de Nefrología y Trasplante forma parte de la red RICORS2040 (RD21/0005/31 y RD24/0004/0031) y está reconocido como grupo consolidado por la Agencia de Gestión de Ayudas Universitarias y de Investigación de Cataluña (2021 SGR 00883).
Conflicto de interesesM.J.S. declara honorarios personales de NovoNordisk, Jansen, Mundipharma, AstraZeneca, Esteve, Fresenius, Ingelheim Lilly, Vifor, ICU, Pfizer, Bayer, Travere Therapeutics, Emerald, GE Healthcare, así como subvenciones y honorarios personales de Boehringer Ingelheim, fuera del ámbito de la presente revisión