Las guías de práctica clínica para la prevención, diagnóstico, evaluación y tratamiento de los trastornos minerales y óseos en la enfermedad renal crónica (TMO-ERC) en adultos, de la Sociedad Latinoamericana de Nefrología e Hipertensión (SLANH), comprenden un conjunto de recomendaciones elaboradas para dar apoyo al médico en el manejo de estas anormalidades en pacientes adultos con enfermedad renal estadios 3 a 5. No se incluyen las alteraciones asociadas al trasplante renal. Los temas abordados en las guías están distribuidos en cuatro capítulos: 1) Evaluación de las alteraciones bioquímicas; 2) Evaluación de las alteraciones óseas; 3) Evaluación de las calcificaciones vasculares, y 4) Tratamiento de los TMO-ERC. Las guías tienen como base las recomendaciones propuestas y publicadas por la Kidney Disease: Improving Global Outcomes (KDIGO) para la prevención, diagnóstico, evaluación y tratamiento de los TMO-ERC (KDIGO Clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder [CKD-MBD]), adaptadas a las condiciones de pacientes, instituciones y recursos disponibles en Latinoamérica, con el aval de KDIGO. En algunos casos, las guías corresponden a recomendaciones de manejo definidas directamente por el grupo de trabajo para su aplicación en nuestra región, basadas en la evidencia disponible en la literatura. Cada capítulo contiene las guías propiamente dichas y su fundamentación con base en numerosas referencias bibliográficas actualizadas. Desafortunadamente, existen pocos estudios controlados y con un poder estadístico suficiente en Latinoamérica para dar soporte a recomendaciones específicas para la región, por lo que la gran mayoría de las referencias utilizadas corresponden a estudios realizados en otras regiones. Esto pone en evidencia la necesidad de planificar estudios de investigación dirigidos a establecer la situación actual de los trastornos del metabolismo mineral y óseo en Latinoamérica, así como definir las mejores opciones terapéuticas para nuestra población.
The clinical practice guidelines for the prevention, diagnosis, evaluation and treatment of chronic kidney disease mineral and bone disorders (CKD-BMD) in adults, of the Latin American Society of Nephrology and Hypertension (SLANH) comprise a set of recommendations developed to support the doctor in the management of these abnormalities in adult patients with stages 3-5 kidney disease. This excludes changes associated with renal transplantation. The topics covered in the guidelines are divided into four chapters: 1) Evaluation of biochemical changes, 2) Evaluation of bone changes, 3) Evaluation of vascular calcifications, and 4) Treatment of CKD-MBD. The guidelines are based on the recommendations proposed and published by the Kidney Disease: Improving Global Outcomes (KDIGO) for the prevention, diagnosis, evaluation and treatment of CKD-MBD (KDIGO Clinical practice guidelines for the diagnosis, evaluation, prevention and treatment of Chronic Kidney Disease Mineral and Bone Disorder [CKD-MBD]), adapted to the conditions of patients, institutions and resources available in Latin America, with the support of KDIGO. In some cases, the guidelines correspond to management recommendations directly defined by the working group for their implementation in our region, based on the evidence available in the literature. Each chapter contains guidelines and their rationale, supported by numerous updated references. Unfortunately, there are few controlled studies with statistically sufficient weight in Latin America to support specific recommendations for the region, and as such, most of the references used correspond to studies carried out in other regions. This highlights the need to plan research studies designed to establish the current status of mineral and bone metabolism disorders in Latin America as well as defining the best treatment options for our population.
PREFACIO
La elaboración de las Guías de práctica clínica para la prevención, diagnóstico, evaluación y tratamiento de los trastornos minerales y óseos en la enfermedad renal crónica (TMO-ERC) en adultos es una iniciativa de la Sociedad Latinoamericana de Nefrología e Hipertensión (SLANH). Su elaboración estuvo a cargo del Comité de Metabolismo Mineral y Óseo de la SLANH, constituido por una representación internacional de líderes en el área del metabolismo mineral y óseo en la enfermedad renal (vide supra).
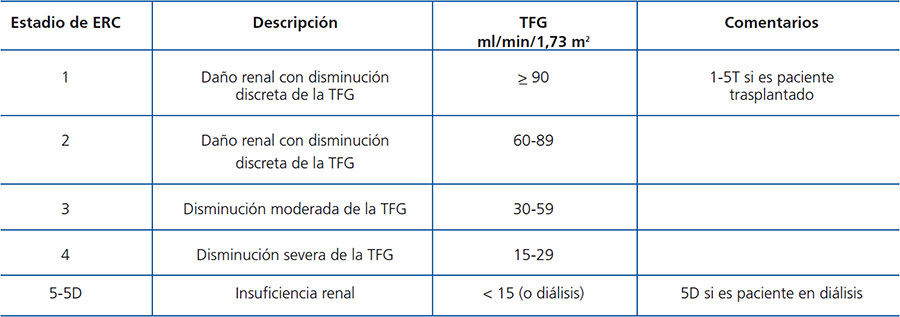
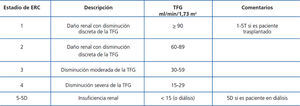
Se trata de una guía práctica para la estandarización del diagnóstico y tratamiento de los trastornos minerales y óseos de la enfermedad renal crónica (ERC) en sus diferentes etapas (tabla A). Siguiendo la misma tendencia de la comunidad nefrológica mundial, estas guías tienen como base las recomendaciones propuestas y publicadas por la Kidney Disease: Improving Global Outcomes (KDIGO) para la prevención, diagnóstico, evaluación y tratamiento de los TMO-ERC (KDIGO Clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder [CKD-MBD])1, así como directrices publicadas por las Sociedades de Nefrología de Argentina, Brasil, México y Uruguay a fin de cubrir necesidades y condiciones de pacientes, instituciones y recursos materiales disponibles en Latinoamérica. Los elementos de las guías KDIGO utilizados en su preparación fueron resumidos, actualizados y adaptados sin alterar su esencia. La utilización de enunciados y conceptos originales de las guías KDIGO ha sido autorizada por dicha organización. En tal sentido, aquellos párrafos correspondientes a estrictas traducciones de las guías han sido marcados con las iniciales KDIGO al final del párrafo respectivo; mientras que los que corresponden a modificaciones o adaptaciones de las guías realizados por el Comité de la SLANH han sido marcados con las iniciales SLANH.
Los razonamientos que soportan las recomendaciones de estas guías han sido actualizados mediante la inclusión de nuevas referencias bibliográficas. Por otra parte, en muchos casos fueron motivo de amplia discusión a fin de buscar una mejor adaptación a las condiciones regionales y facilitar su aplicación.
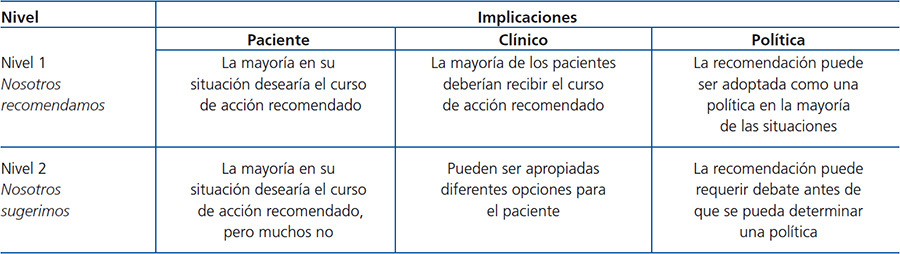
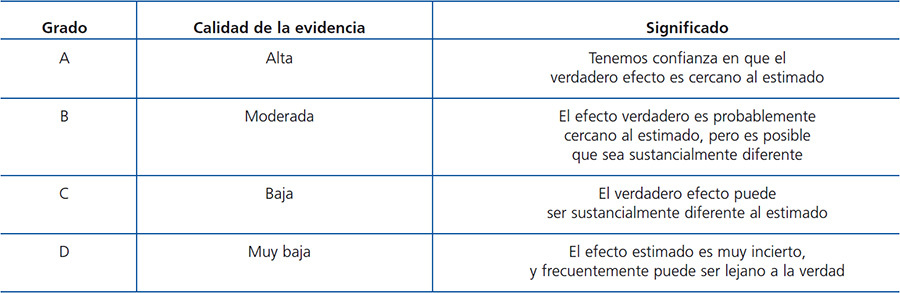
Los temas abordados en las guías están constituidos en cuatro capítulos. Cada capítulo contiene las guías propiamente dichas, seguidas de una fundamentación basada en un número de referencias bibliográficas. El razonamiento representa un resumen de la literatura sobre cada guía en cuestión, dirigido a justificar la recomendación allí vertida. Se utilizó el término evidencia toda vez que la directriz se basó en evidencia publicada en la literatura, independiente de su gradación. Por el contrario, se utilizó el término opinión, de acuerdo a las opiniones contenidas en las directrices consultadas, muchas veces adaptadas a la experiencia personal de los miembros del foro. En la tabla B y la tabla C se encuentran los criterios utilizados para la definir la fortaleza y la calidad de la evidencia1.
Es importante destacar que, como toda guía de práctica clínica, su consulta debe ser hecha con buen tino, pensando siempre que la conducta médica con cada paciente es individual y soberana. Este foro permanecerá abierto a futuras revisiones, y las críticas y sugerencias serán siempre bienvenidas.
INTRODUCCIÓN
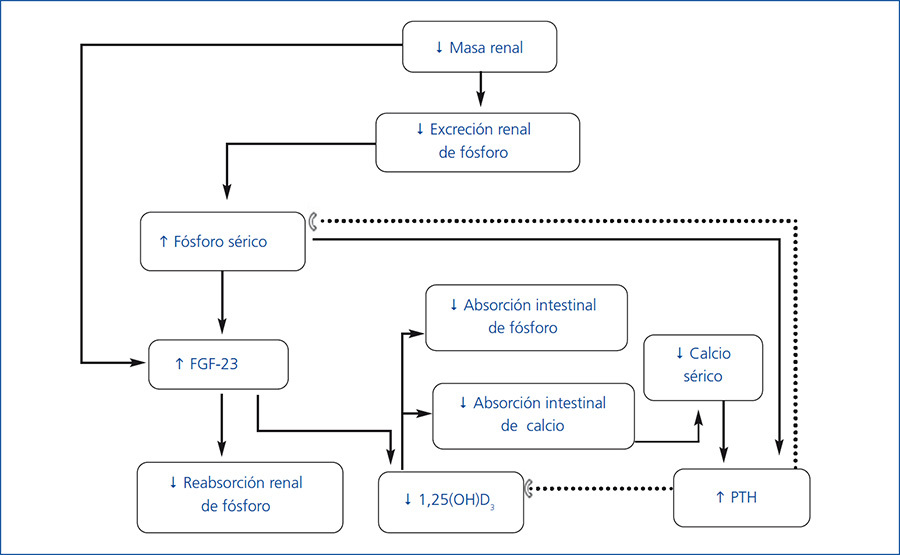
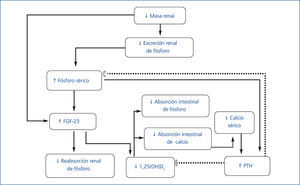
- Los trastornos del metabolismo mineral y óseo asociados a la enfermedad renal crónica (TMO-ERC) incluyen: a) alteraciones bioquímicas (calcio, fósforo, hormona paratiroidea [PTH] y vitamina D); b) alteraciones del recambio, mineralización, volumen, crecimiento lineal y resistencia óseas; y c) presencia de calcificaciones vasculares y de tejidos blandos. El término osteodistrofia renal debe utilizarse solo para definir las alteraciones de la histología ósea que ocurren en pacientes con ERC1. La fisiopatología de esta complicación es compleja y se esquematiza en la figura 1.
- A medida que progresa la ERC, disminuye la excreción renal de fósforo, lo cual lleva a su retención en el organismo2. Sin embargo, bajo condiciones clínicas la carga de fósforo estimula la producción del factor de crecimiento de fibroblastos 23 (FGF-23) por los osteocitos3, el cual a su vez inhibe al cotransportador Na/P del túbulo contorneado proximal y resulta en un aumento de la excreción renal de fósforo. El FGF-23 inhibe la 1-α-hidroxilasa, lo cual reduce la producción de calcitriol por el riñón y consecuentemente eleva la producción de PTH4,5. El hiperparatiroidismo resultante incrementa la excreción renal de fósforo6. Aunque el FGF-23 actúa en las paratiroides suprimiendo la producción de PTH, la elevación de esta última, a pesar de niveles altos de FGF-23 en pacientes con uremia, sugiere resistencia de las paratiroides al efecto supresor de PTH por parte del FGF-237,8.
- Si bien existe una relación directa entre la concentración de fósforo sérico y el aumento de la producción de FGF-23, algunas evidencias recientes indican que este factor se eleva en etapas tempranas de la ERC, cuando aún no se ha producido la hiperfosfatemia. De hecho, la hiperfosfatemia es infrecuente con una filtración glomerular por encima de 20 ml/min. Los mecanismos de la elevación del FGF-23 en estas etapas no están claros. En un estudio reciente en niños se demuestra la presencia de FGF-23 en osteocitos de pacientes con ERC estadios 2-49. La expresión de FGF-23 en osteocitos no mostró diferencias entre pacientes con ERC en etapas tempranas y pacientes en diálisis. Sin embargo, los niveles séricos fueron menores en los pacientes con ERC sin diálisis, probablemente como consecuencia del aclaramiento renal de FGF-23.
- En fases más avanzadas de la ERC, los niveles séricos de calcitriol disminuyen aún más, lo cual lleva a una disminución en la absorción de calcio, constituyendo así un estímulo adicional para la síntesis de PTH6,10,11. La disminución del calcitriol es también el resultado de la reducción del número de nefronas funcionantes y el efecto directo de la sobrecarga de fósforo en el túbulo proximal12. Otros mecanismos adicionales que contribuyen a la producción excesiva de PTH incluyen una reducción del número de receptores de vitamina D y del receptor sensor de calcio en las paratiroides y una mayor resistencia al efecto de PTH en el hueso debida a la disminución de sus receptores10,13.
- El hiperparatiroidismo secundario tiende a mantener la calcemia al estimular la reabsorción subperióstica, la producción renal de 1,25-dihidroxicolecalciferol y la reabsorción tubular de calcio14. Aunque este mecanismo de compensación puede llegar a normalizar la calcemia y la fosfatemia temporalmente, lo hace a expensas de inducir alteraciones del recambio óseo14.
- Otra posible complicación es la calcificación inadecuada de los huesos (osteomalacia) a consecuencia de la deficiencia de calcitriol.
- La biopsia ósea permite distinguir entre los distintos tipos de osteodistrofia renal15.
- El término osteodistrofia renal se refiere al conjunto de lesiones histológicas óseas que resultan de las alteraciones del metabolismo mineral en la ERC, y que incluyen: a) hiperparatiroidismo secundario, b) osteomalacia, c) enfermedad ósea adinámica y d) enfermedad mixta16.
- Aunque la osteodistrofia renal puede estar presente en la mayoría de los pacientes con ERC avanzada, muy pocos tienen síntomas antes de empezar a recibir tratamiento con diálisis1,17-19.
- La osteodistrofia renal se puede prevenir o atenuar con un control adecuado del calcio, fósforo y PTH desde etapas tempranas de la ERC20.
- El hiperparatiroidismo secundario se caracteriza por un recambio óseo acelerado, aumento del número y actividad de los osteoclastos y osteoblastos e incremento de la resorción ósea, lo que resulta en las típicas lesiones de osteítis fibrosa quística15.
- Clínicamente se puede manifestar por dolor óseo, y en las radiografías se puede observar reabsorción subperióstica, la cual es más evidente en el borde radial de las falanges medias de los dedos índice y medio, en el extremo distal de las clavículas y en la sínfisis púbica. En casos graves pueden observarse quistes en los huesos largos o planos, así como lesiones escleróticas en la parte superior e inferior de las vértebras. También se pueden observar lesiones de «sal y pimienta» en el cráneo debido a la combinación de áreas de osteopenia y osteoesclerosis, aunque no son exclusivas del hiperparatiroidismo21,22.
- La osteomalacia en la ERC 3-5D es rara actualmente; se caracteriza por bajo recambio óseo, disminución del número de osteoblastos y osteoclastos, y aumento del volumen de osteoide debido a un defecto en la mineralización15,23. Clínicamente se puede manifestar por dolor óseo y fracturas. Aunque la génesis de la osteomalacia en la ERC 3-5 está relacionada a deficiencia de vitamina D, la acumulación de aluminio en los huesos puede estar implicada cuando se utilizan quelantes de fósforo que contienen este elemento20,24.
- La enfermedad ósea adinámica es otro tipo de osteodistrofia renal de bajo recambio óseo, pero, a diferencia de la osteomalacia, no presenta acumulación de osteoide15. Esta alteración ósea es una de las lesiones más frecuentes en los estadios más tempranos de la ERC25; asimismo, es más prevalente en diabéticos y en personas de edad avanzada. Clínicamente se puede manifestar por hipercalcemia, debido a la captación disminuida de calcio en el hueso, bajas concentraciones séricas de PTH y fosfatasa alcalina, así como por un mayor riesgo de fracturas y calcificación vascular26.
- Otro componente de los TMO-ERC lo constituyen las calcificaciones extraóseas, vasculares y no vasculares27,28. Las calcificaciones arteriales suelen detectarse radiológicamente y pueden afectar cualquier arteria del organismo29,30.
- Las calcificaciones cutáneas pueden manifestarse como pequeñas máculas o pápulas de consistencia firme. Una forma rara pero especialmente grave es la calcifilaxis, que se caracteriza por calcificación de la capa media de las arterias, isquemia distal y desarrollo progresivo de necrosis y úlceras en la piel de los dedos de los pies y manos, muslos, piernas y tobillos31,32. Esta complicación, observada raramente en los estadios iniciales de la ERC, puede presentarse en ERC avanzada en fase de tratamiento sustitutivo; su patogénesis no es del todo conocida.
CAPÍTULO 1. EVALUACIÓN DE LAS ALTERACIONES BIOQUÍMICAS
Guías
1.1. Se recomienda medir los niveles séricos de calcio, fósforo, hormona paratiroidea intacta (PTHi) y fosfatasa alcalina cuando la tasa de filtración glomerular (TFG) es < 60 ml/min (1C) (SLANH).
1.2. La frecuencia de las mediciones de calcio, fósforo y PTHi debe basarse en la presencia de las anormalidades y en la velocidad de progresión de la ERC (tabla 1). En aquellos pacientes que estén recibiendo tratamiento para TMO-ERC y en quienes se han detectado alteraciones bioquímicas, es razonable hacer mediciones más frecuentes para monitorizar las tendencias y evaluar la eficacia del tratamiento y los efectos secundarios (sin grado)(SLANH).
1.3. En pacientes con ERC 3-5D se sugiere medir los niveles séricos de 25-hidroxi-vitamina D [25(OH)D] (calcidiol) y repetirlos dependiendo del valor basal y las intervenciones terapéuticas (2C). También se sugiere tratar la insuficiencia y la deficiencia de vitamina D de acuerdo a las estrategias recomendadas para la población general (2C)(KDIGO).
1.4. Se recomienda que los médicos sean informados de la metodología y los cambios en las técnicas, tipo de muestra (plasma o suero) y procesamiento utilizado por los laboratorios en las determinaciones bioquímicas en los TMO-ERC 3-5D, a fin de lograr una interpretación adecuada de los resultados (1B) (KDIGO).
Guía 1
La detección de las alteraciones bioquímicas del metabolismo mineral es esencial en el diagnóstico de TMO-ERC. Estas alteraciones suelen presentarse a partir del estadio 3 de la ERC. Por esta razón, se recomienda iniciar la determinación de los niveles séricos de calcio, fósforo y PTHi a partir de dicho estadio. Sin embargo, la severidad y velocidad de progresión de las alteraciones bioquímicas del metabolismo mineral es muy variable, por lo que la frecuencia de medición debe estar guiada por la presencia, duración y magnitud de las alteraciones encontradas, así como por el grado y progresión de la ERC y el uso de medicamentos para corregir las anomalías. Así, en un estudio con pacientes incidentes en diálisis, los niveles séricos de calcio y fósforo aumentaron durante los primeros seis meses de terapia de reemplazo renal33.
- Aunque existen numerosos reportes de estudios transversales sobre niveles séricos de calcio, fósforo y PTHi en la población con ERC 5D, el estudio DOPPS (Dialysis Outcomes and Practice Patterns Study) proporciona la mejor visión global de la prevalencia de trastornos del calcio (corregidos por albúmina) fósforo y PTH34. Desafortunadamente, no hay una estandarización global de los ensayos de PTH.
- Recientemente, los niveles elevados de fosfatasa alcalina total en suero se han reconocido como una posible variable independiente asociada con un incremento en el riesgo relativo (RR) de mortalidad en pacientes con ERC estadio 5D35,36. Regidor et al.35 describieron una asociación entre los niveles séricos de fosfatasa alcalina total y mortalidad entre poblaciones prevalentes en hemodiálisis (HD), además de las curvas en U o J para el calcio, fósforo y PTH, enfatizando aún más la complejidad de la relación entre estas anomalías de laboratorio con los resultados, pero no existe evidencia de que una reducción de estos niveles conduzca a mejores resultados.
- Aunque las recomendaciones sobre la frecuencia de medición del calcio, fósforo y PTHi están basadas en opinión, constituyen un marco general útil en la práctica clínica. No existen datos que muestren que la determinación rutinaria mejore los resultados clínicos en el paciente. No obstante, se puede sugerir cuál puede ser la frecuencia razonable para realizar mediciones de laboratorio de estos parámetros en TMO-ERC. El médico deberá ajustar la frecuencia de aquellas según la magnitud de las anomalías y la tasa de progresión de la ERC. La frecuencia de las mediciones debe ser individualizada para aquellos pacientes que reciben tratamiento para TMO-ERC con el fin de monitorizar tanto los efectos benéficos del tratamiento como los efectos secundarios.
- En pacientes con ERC estadios 3-5D, se recomienda que las decisiones terapéuticas se basen en la tendencia y no en un solo valor de laboratorio, tomando en consideración, además, todas las evaluaciones disponibles de TMO-ERC (1C).
- La interpretación de los valores bioquímicos y hormonales en el diagnóstico de TMO-ERC requiere del conocimiento del tipo de ensayo y su precisión, variabilidad interensayo, manejo de la muestra de sangre, así como de las variaciones normales posprandiales, diurnas y estacionales. Es debido a estas variaciones en el ensayo que consideramos que deberían usarse preferencialmente las tendencias encontradas en los valores de laboratorio y no los valores individuales, con el fin de determinar cuándo se debe iniciar y/o ajustar el tratamiento. La tabla 2 describe el origen y magnitud de la variación en las mediciones séricas de calcio, fósforo, PTH y esteroles de vitamina D. Esta tabla sirve como una guía para los médicos y constituye la base de la recomendación de que las pruebas de laboratorio deberían medirse usando los mismos ensayos y en horas similares del día o la semana para un paciente dado. Los proveedores de salud deberán familiarizarse con los problemas del ensayo y sus limitaciones. Esta variabilidad enfatiza la importancia de utilizar las tendencias, en lugar de valores absolutos únicos, cuando se toman decisiones sobre el diagnóstico o tratamiento.
- Calcio: Los niveles séricos de calcio se miden rutinariamente en los laboratorios clínicos en equipos automatizados usando métodos colorimétricos y estándares de control de calidad. De esta manera, el ensayo es generalmente preciso y reproducible. En individuos sanos, el calcio sérico está rígidamente controlado dentro de un rango estrecho, por lo general 8,5-10,0 o 10,5 mg/dl (2,1-2,5 o 2,6 mmol/l), con algunas, aunque mínimas, variaciones diurnas37. Sin embargo, el rango normal puede variar ligeramente entre laboratorios, dependiendo del tipo de mediciones utilizadas. En pacientes con ERC, los niveles séricos de calcio tienen más fluctuación debido a la alteración de la homeostasis y terapias concomitantes. En aquellos pacientes con ERC estadio 5D, existen fluctuaciones adicionales asociadas con cambios inducidos por la diálisis, la hemoconcentración y la subsiguiente hemodilución. Igualmente, existen variaciones de acuerdo al día en que se toma la muestra; así, los días lunes o martes que constituyen el primer día de diálisis de la semana, muestran valores de calcio superiores (0,01 mg/dl) que las medidas en las sesiones en miércoles o jueves34. En consecuencia, es importante enfatizar que las determinaciones bioquímicas en estos pacientes deben hacerse prediálisis a mitad de semana (opinión).
- La concentración de calcio sérico refleja pobremente el calcio corporal total. El compartimiento extracelular solo contiene el 1 % del calcio corporal total; el restante se almacena en los huesos. El calcio sérico ionizado, generalmente 40-50 % del calcio sérico total, es fisiológicamente activo, mientras que el calcio no ionizado está enlazado a la albúmina o aniones como el citrato, bicarbonato y fosfato, siendo por ello fisiológicamente inactivo. En presencia de hipoalbuminemia hay un incremento en el calcio ionizado con relación al calcio total; debido a esto el calcio sérico total podría subestimar el calcio sérico (ionizado) fisiológicamente activo. Comúnmente se usa una fórmula para estimar el calcio ionizado en el calcio sérico total que consiste en añadir 0,8 mg/dl (0,2 mmol/l) por cada gramo de disminución de la albúmina sérica por debajo de 4 g/dl (40 g/l). Esta fórmula para el «calcio corregido» se usa rutinariamente en muchos centros y en muchos ensayos clínicos. Desafortunadamente, algunos datos recientes muestran que este método no es mejor que el calcio total y es menos específico que las mediciones de calcio ionizado38. De forma adicional, el ensayo que se usa para la albúmina podría afectar la medición de calcio corregido. Desafortunadamente, las mediciones de calcio ionizado no están disponibles de forma rutinaria y, en algunos casos, podrían requerir costos adicionales para las mediciones.
- Fósforo: El fósforo inorgánico es crítico para numerosas funciones fisiológicas normales, incluyendo desarrollo esquelético, metabolismo mineral, contenido y función de los fosfolípidos en la membrana celular, comunicación celular, agregación de plaquetas y transferencia de energía a través del metabolismo mitocondrial. Debido a su importancia, el organismo mantiene las concentraciones séricas entre 2,5-4,5 mg/dl (0,81-1,45 mmol/l). Los términos fósforo y fosfato se usan con frecuencia de manera indistinta, pero, estrictamente hablando, el término fosfato significa la suma de dos iones inorgánicos que existen fisiológicamente en el suero y en otros fluidos corporales: el hidrógeno fosfato y el dihidrógeno fosfato. Sin embargo, la mayor parte de los laboratorios reporta como fósforo este componente inorgánico medible. A diferencia del calcio, un componente importante del fósforo es intracelular, y factores como el pH y la glucosa pueden causar desplazamientos de iones fosfatos hacia adentro y afuera de las células, y como consecuencia pueden alterar la concentración sérica sin por ello cambiar el fósforo corporal total.
- El fósforo se mide rutinariamente en laboratorios clínicos en equipos automatizados usando métodos colorimétricos y estándares de control de calidad. De esta manera, el ensayo es, generalmente, preciso y reproducible. La hemólisis durante la recolección de la muestra produce niveles falsamente elevados de fósforo. En individuos sanos, existe una variación diurna, tanto en los niveles séricos como en la excreción urinaria de fósforo. El fósforo sérico alcanza un nivel bajo en las primeras horas de la mañana, aumenta hasta una meseta a las 16:00 horas e incrementa aún más hasta un valor pico entre las 01:00 y 03:00 horas39,40. Sin embargo, en un estudio en pacientes con ERC 5D no se encontró variación diurna de fósforo cuando se estudiaron en un día que no recibieron diálisis41. Generalmente, los niveles son más elevados después de un largo período de diálisis. En el estudio DOPPS, las muestras de pacientes en HD que se recogieron inmediatamente antes de las sesiones de lunes o martes fueron más elevadas que las de sesiones de miércoles o jueves por 0,08 mg/dl (0,025 mmol/l). De manera que la determinación del fósforo es generalmente válida y reproducible, pero podría verse afectada por variaciones diurnas normales y posprandiales. Una vez más, las tendencias a aumento o disminución progresiva podrían ser más exactas que pequeñas variaciones en los valores individuales.
- Fosfatasa alcalina: Las fosfatasas alcalinas son enzimas que digieren el fosfato de las proteínas y de los nucleótidos, y tienen un funcionamiento óptimo en un pH alcalino. La medición del nivel de fosfatasa alcalina total es un ensayo colorimétrico que se realiza rutinariamente en los laboratorios clínicos en equipos automatizados, usando estándares de control de calidad. La enzima se encuentra en el cuerpo en forma de isoenzimas que son características del tejido de origen. Las concentraciones más elevadas se encuentran en el hígado y los huesos, pero también se encuentra en los intestinos, la placenta, los riñones y los leucocitos. La isoenzima fosfatasa alcalina específica para identificar el tejido de donde se origina puede determinarse por fraccionamiento e inactivación por calor, pero no hay gran disponibilidad de estos procedimientos en los laboratorios clínicos. La fosfatasa alcalina específica del hueso se mide con un ensayo inmunorradiométrico; sus niveles elevados se deben generalmente a una función anormal del hígado (en cuyo caso, también otras pruebas son anormales), una elevada actividad ósea o metástasis óseas. Los niveles son normalmente más elevados en niños, con huesos en crecimiento, que en los adultos.
- Es conveniente que los laboratorios reporten el método utilizado, así como cualquier cambio en este, en el tipo de muestra analizada (plasma o suero) o en los requerimientos de manejo de la muestra, pues la correcta interpretación de los resultados requiere el conocimiento de dichas variables, así como de las fluctuaciones normales de los parámetros que se evalúan. Por ejemplo, las determinaciones de PTHi por distintos ensayos detectan en forma diferente el fragmento 7-84 de la PTH, por lo que la medición de esta hormona por dos ensayos diferentes puede dar distintos resultados aun en una misma muestra42.
- Vitamina D: El término vitamina D representa tanto a la vitamina D2 (ergocalciferol) como a la vitamina D3 (colecalciferol). El ergocalciferol es sintetizado en las plantas a partir del ergosterol y, junto con el colecalciferol del aceite de pescado, es una fuente dietética de vitamina D para los humanos. Sin embargo, el 90 % de los requerimientos de vitamina D provienen de la conversión de 7-dehidrocolesterol a colecalciferol, mediante una reacción catalizada por la luz solar en la piel. Tanto la vitamina D2 como la D3 sufren una hidroxilación en el hígado para convertirse en 25(OH)D, y posteriormente en el riñón para transformarse en 1,25(OH)2D3 o calcitriol, la forma más activa de la vitamina D. El calcitriol (hormona) de la vitamina D juega un papel importante en la homeostasis mineral y en la función músculo-esquelética. Además, se han descrito efectos moduladores de la función endotelial e inmunológica y en la regulación del ciclo celular, entre otros efectos pleiotrópicos.
- En los pacientes con ERC hay una disminución en la actividad de la 1-α-hidroxilasa renal con la consiguiente reducción en los niveles séricos de calcitriol, lo cual contribuye a la hipocalcemia que puede acompañar a esta enfermedad. La deficiencia de calcitriol favorece el desarrollo de hiperparatiroidismo secundario, ya que esta hormona regula la producción y liberación de PTH a través de receptores específicos.
- La mayoría de los estudios considera como deficiencia una concentración sérica de 25(OH)D menor de 15 ng/ml y como insuficiencia los niveles entre 15 y 30 ng/ml. Sin embargo, no existe consenso respecto a la definición de niveles «adecuados» y «tóxicos» de vitamina D. La deficiencia de 25(OH)D ha sido asociada con mayor riesgo de mortalidad en pacientes con ERC43,44 y es uno de los factores que intervienen en la patogénesis del hiperparatiroidismo secundario. Sin embargo, no se ha comprobado que el tratamiento con vitamina D hasta lograr una concentración sérica determinada disminuya la mortalidad, ni se han establecido las cifras óptimas de esta. A pesar de que el beneficio de la corrección de las concentraciones séricas de 25(OH)D no se ha demostrado, consideramos que la medición de vitamina D en los pacientes con estadios 3-5 de ERC puede ser útil45,46 (Tabla 3).
CAPÍTULO 2. EVALUACIÓN DE LAS ALTERACIONES ÓSEAS
Guías
2.1. El método diagnóstico más preciso para determinar el tipo de enfermedad ósea asociada a la ERC (osteodistrofia renal) es la biopsia ósea con análisis histomorfométrico (1A) (SLANH).
2.2. Es razonable realizar una biopsia ósea en pacientes con estadios 3-5D de ERC en ciertas situaciones, entre las que se incluyen (sin grado)(SLANH):
- Fracturas o dolor óseo sin causa aparente.
- Sospecha de enfermedad ósea asociada al aluminio.
- Sospecha de osteomalacia.
- Hipercalcemia o hipofosfatemia no explicadas.
- Antes de comenzar tratamiento con bisfosfonatos.
- Antes de paratiroidectomía.
2.3. En pacientes con ERC 3-5D con evidencia de TMO-ERC, se sugiere que no se realicen rutinariamente las pruebas para determinación de la densidad mineral ósea (DMO), debido a que no predicen los riesgos de fractura como en la población general y, por otra parte, no permiten predecir el tipo de osteodistrofia renal (2B)(KDIGO).
2.4. En pacientes con ERC estadios 3-5D, se sugiere utilizar las mediciones de PTH sérica o de la fosfatasa alcalina específica del hueso para la evaluación de enfermedad ósea debido a que valores marcadamente altos o bajos permiten predecir el recambio óseo subyacente (2B)(KDIGO).
2.5. En pacientes con ERC estadios 3-5D, se sugiere no medir rutinariamente los marcadores específicos de recambio óseo basados en la síntesis de colágeno (como el propéptido C-terminal de procolágeno tipo I) y su catabolismo (tales como el telopéptido de colágeno tipo I, piridinolina o desoxipiridinolina) (2C)(KDIGO).
2.6. En pacientes con ERC 3-5D, la medición de PTHi y fosfatasa alcalina no ha demostrado consistentemente una correlación con los cambios histológicos de la osteodistrofia renal (2B)(SLANH).
2.7. Se sugiere detectar la acidosis metabólica y eventualmente corregirla para evitar la pérdida de masa ósea y muscular en el paciente con ERC 3-5 (sin grado)(SLANH).
Guía 2
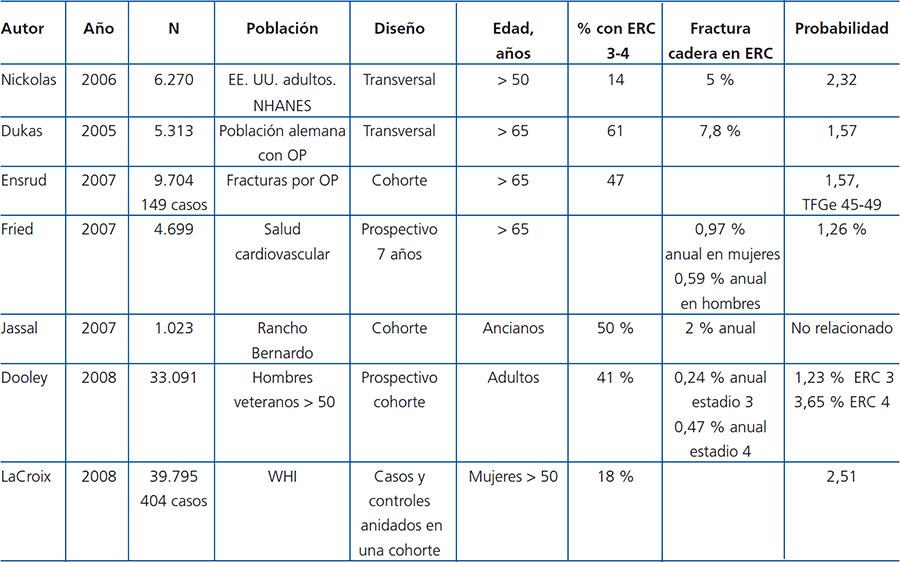
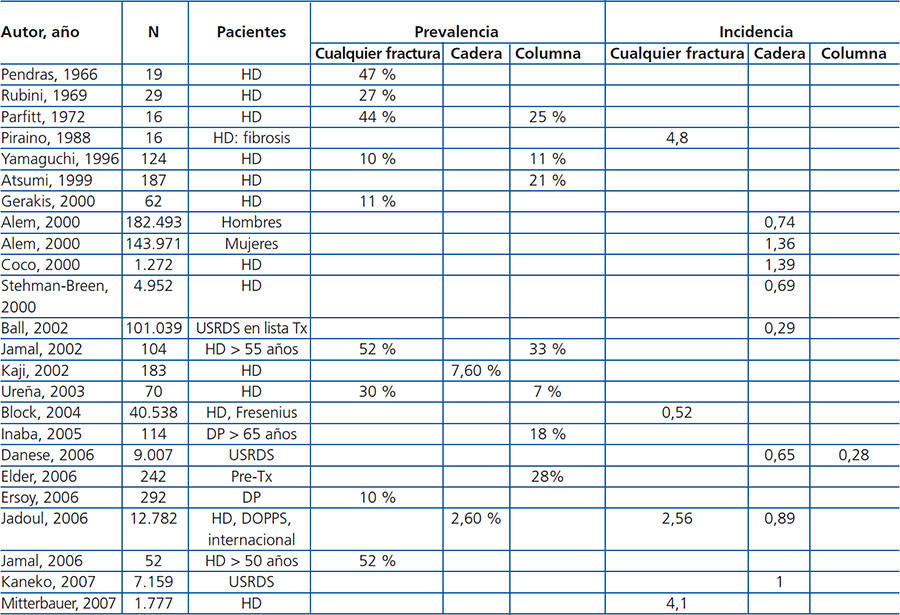
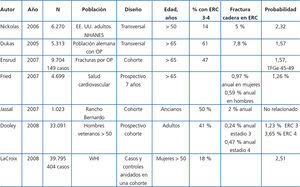
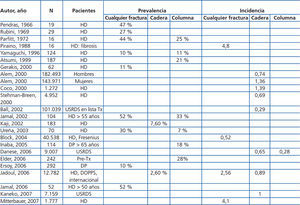
Los pacientes con ERC 3-5D tienen mayor frecuencia y riesgo de fracturas en comparación con la población general (tabla 4 y tabla 5) y se asocian con un aumento en la morbimortalidad.
- Los principales métodos que se han utilizado para el estudio de la enfermedad ósea asociada a la ERC son la biopsia ósea y la densitometría ósea. Los marcadores bioquímicos de formación y resorción ósea constituyen otros indicadores potenciales de dichas alteraciones.
- La fragilidad ósea puede ser secundaria a alteraciones de la masa y/o de la calidad del hueso. Los distintos tipos de osteodistrofia renal pueden estar asociados con cualquiera de estas alteraciones.
- El análisis histomorfométrico de una biopsia ósea constituye el estándar de oro para el diagnóstico de la osteodistrofia renal, por lo que debe considerarse su realización en aquellos pacientes con síntomas óseos o anomalías bioquímicas sin una etiología clara. También se recomienda en quienes se sospeche enfermedad ósea por aluminio, osteomalacia y previo al inicio de tratamiento con bisfosfonatos, ya que estos fármacos pueden agravar la enfermedad de bajo recambio.
- La biopsia de hueso permite evaluar la calidad ósea y el tipo de alteración predominante, de acuerdo a la fisiopatología (osteítis fibrosa, osteomalacia, enfermedad ósea adinámica y enfermedad mixta). Los parámetros que permiten dicha clasificación son: recambio óseo, mineralización y volumen. Sin embargo, los diferentes tipos de osteodistrofia renal guardan poca relación con las repercusiones clínicas, con el riesgo de fracturas y calcificación arterial47,48. El volumen es otro de los parámetros evaluados en la biopsia ósea, y aunque no forma parte de la clasificación tradicional de la osteodistrofia renal, se ha determinado que constituye una variable que influye de manera independiente en la fragilidad ósea. Por lo tanto, el volumen óseo ha sido incluido dentro de los nuevos parámetros de la clasificación TMV (recambio, mineralización y volumen, por sus siglas en inglés) sugeridos por KDIGO.
- La forma más precisa de determinar la tasa de formación ósea, y por tanto el recambio, es el doble marcaje con tetraciclina, el cual permite también calcular el tiempo de mineralización del osteoide (el segundo parámetro utilizado para clasificar los distintos tipos de osteodistrofia renal) (tabla 6). En América Latina existen pocos laboratorios con capacidad para realizar estudios histomorfométricos de biopsias óseas. Hoy en día, estos están limitados a Brasil (Universidad del Estado de Sao Paulo y Universidad Federal de Sao Paulo) y Venezuela (Hospital Universitario de Caracas).
- La capacidad de la DMO para predecir el riesgo de fracturas o el tipo de osteodistrofia renal en pacientes con ERC 4-5D es débil e inconsistente49-52. Por esto, no se sugiere realizar este estudio en forma rutinaria a los pacientes que tengan evidencia de TMO-ERC.
- La PTH juega un papel esencial en la fisiopatología de los TMO-ERC por su efecto en la regulación del fósforo y el remodelado óseo. La fosfatasa alcalina total es un indicador que refleja actividad osteoblástica si no hay alteración hepática. Los niveles séricos anormales de estos dos indicadores guardan relación, aunque débil, con el grado de recambio óseo, riesgo de fracturas y otros eventos clínicos, incluyendo la mortalidad53-55. Aunque la biopsia de hueso sigue siendo el estándar de oro para el diagnóstico del tipo de osteodistrofia renal, no es fácilmente accesible para la mayoría de los pacientes; la determinación de PTHi fosfatasa alcalina total u ósea puede ser utilizada para estimar el recambio óseo50,56-58.
- Otros marcadores de recambio óseo basados en la síntesis de colágeno (propéptido C-terminal de procolágeno tipo 1) o en su catabolismo (como el telopéptido de colágeno tipo 1, piridinolina o desoxipiridinolina) no han sido evaluados de manera extensa en pacientes con ERC 3-5. Los estudios existentes indican que estos y otros marcadores bioquímicos no aportan mayor información que la PTH o la fosfatasa alcalina total para predecir los hallazgos en la biopsia de hueso o los eventos clínicos. Por lo tanto, actualmente no se recomienda su uso en la evaluación de los TMO-ERC.
CAPÍTULO 3. EVALUACIÓN DE LAS CALCIFICACIONES VASCULARES
Guías
3.1. En pacientes con ERC 3-5D se sugiere realizar una radiografía lateral de abdomen para detectar la presencia de calcificaciones vasculares. El ecocardiograma también pudiera ser utilizado para detectar calcificaciones valvulares. Estos métodos diagnósticos pueden ser alternativas razonables a otros métodos más complejos que pudieran no estar disponibles, tales como la tomografía axial computada (TAC) o la tomografía de emisión de electrones (EBCT) (2C)(KDIGO). Es razonable usar esta información para decidir el tratamiento de TMO-ERC (sin grado)(SLANH).
3.2. Se sugiere que los pacientes con ERC 3-5D con calcificaciones vasculares o valvulares sean considerados de alto riesgo cardiovascular (2A)(KDIGO).
Guía 3
- Las calcificaciones cardiovasculares pueden ocurrir en la capa íntima o media de las arterias, así como en las válvulas cardíacas, con diversas consecuencias que incluyen: cardiopatía isquémica, accidente vascular cerebral, disfunción valvular, hipertrofia y disfunción ventricular izquierda. En la población general, la magnitud de la calcificación coronaria, determinada por tomografía computada multicorte o EBCT, tiene un alto valor predictivo del riesgo de eventos cardiovasculares59,60. En los pacientes con ERC, la calcificación cardiovascular generalizada es mucho más prevalente, más severa y sigue un curso más acelerado, en comparación con la población general61,62.
- El estándar de oro para la detección de calcificaciones cardiovasculares, tanto en la población general como en los pacientes con ERC, es el índice de calcificación coronaria basado en la TAC. Sin embargo, otros estudios más fácilmente accesibles, como la radiografía lateral de abdomen, la medición de la velocidad de onda de pulso y la ecocardiografía, pueden proporcionar información comparable63-65. La presencia y severidad de las calcificaciones predice fuertemente la morbilidad y mortalidad de etiología cardiovascular en los sujetos con ERC. La evidencia de ensayos clínicos aleatorizados respecto al impacto de las intervenciones para reducir la progresión de las calcificaciones vasculares sobre la mortalidad es aún limitada. Por todo esto, aunque actualmente no se puede recomendar el tamizaje para la detección de calcificaciones cardiovasculares en todos los sujetos con ERC de manera indiscriminada, pudiera estar justificado en aquellos pacientes con hiperfosfatemia significativa, los que reciben quelantes de fósforo a base de calcio en dosis altas, en pacientes en lista de espera para trasplante renal o en otros casos a juicio del médico.
- Finalmente, una forma poco frecuente pero muy severa de calcificación de la capa media de pequeñas arterias (cutáneas) es la calcifilaxis, llamada también arteriopatía urémica. Esta complicación está fuertemente asociada (en aproximadamente un tercio de los casos) con alteraciones del metabolismo mineral relacionadas con ERC, incluyendo, en un tercio de los casos, el hiperparatiroidismo secundario. Se caracteriza por ulceraciones isquémicas de la piel, muy dolorosas, seguida de superinfecciones. Esta alteración se asocia con una alta mortalidad. Los inhibidores de calcificación (fetuina-A y proteína Gla de la matriz ósea) se han implicado en la patogénesis de la calcifilaxis, pero, debido a la relativamente baja incidencia de la enfermedad, no existen datos concluyentes disponibles que nos permitan comentar sobre la naturaleza del proceso y opciones de tratamiento.
- Se ha señalado que el tratamiento con estatinas tiene un impacto beneficioso en el perfil aterogénico, la progresión del ateroma y eventos cardiovasculares en pacientes sin ERC66-68. En pacientes con ERC, no existen datos sobre los efectos de las estatinas en la calcificación arterial comparados con los de placebo. Aún más, el estudio 4D69 (Die Dutch Diabetes Dialysis Study) con atorvastatina y el estudio AURORA70 (A Study to Evaluate the Use of Rosuvastatin in Subjects On Regular Haemodialysis) con rosuvastatina no pudieron demostrar el beneficio del tratamiento con dichas drogas en el punto final primario de muerte por causas cardiovasculares, infartos al miocardio no-fatales o accidentes cerebrovasculares, tanto en pacientes diabéticos como no diabéticos sometidos a hemodiálisis crónica. Recientemente, un estudio con ezetimiba y simvastatina combinados mostró una reducción en el colesterol LDL y en la incidencia de eventos ateroscleróticos severos en pacientes con ERC avanzada, seguidos por un período promedio de 4,9 años71. Sin embargo, la Food and Drug Administration de Estados Unidos (FDA)72 no aprobó una nueva indicación de estas dos drogas para enfermedad renal avanzada, ya que el estudio no fue diseñado para determinar el efecto de los dos medicamentos por separado.
CAPÍTULO 4. TRATAMIENTO DE LOS TMO-ERC
Guías
Recomendaciones generales
4.1. Se recomienda que las decisiones terapéuticas se basen en tendencias, más que en resultados individuales de laboratorio, y que se considere de manera conjunta toda la información disponible de las alteraciones del metabolismo óseo y mineral asociadas a la ERC (1C)(KDIGO).
4.2. Se recomienda que las decisiones terapéuticas de TMO-ERC se basen en las concentraciones séricas de calcio y fósforo consideradas individualmente, en vez del producto calcio x fósforo (Ca x P) (2D)(KDIGO).
4.3. En pacientes con ERC 3-5D, se recomienda que las concentraciones séricas de calcio (ionizado o total corregido) se mantengan dentro del rango normal para el método utilizado (2C)(KDIGO).
4.4. En pacientes con ERC estadios 3-5, se sugiere mantener el fósforo sérico en el rango normal (2C). En pacientes con ERC estadio 5D, se sugiere disminuir los niveles elevados de fósforo hacia el rango normal (2C)(KDIGO).
4.5. En pacientes con ERC estadio 5D, se sugiere usar una concentración de calcio en el líquido de hemodiálisis entre 1,25 y 1,50 mmol/l (2,5 y 3,0 mEq/l) (2D)(KDIGO).
4.6. En pacientes con ERC estadios 3-5 (2D) y 5D (2B), se sugiere usar quelantes de fosfato para el tratamiento de la hiperfosfatemia. Es razonable que la selección del quelante de fosfato tenga en consideración el estadio de la ERC, la presencia de otros componentes de TMO-ERC, terapias concomitantes y perfil de efectos secundarios (sin grado)(KDIGO).
4.7. En pacientes con ERC estadios 3-5D e hiperfosfatemia, se recomienda restringir la dosis de quelantes de fosfato a base de calcio y/o la dosis de calcitriol o análogos de la vitamina D en presencia de hipercalcemia persistente o recurrente (1B)(KDIGO).
4.8. En pacientes con ERC estadios 3-5D e hiperfosfatemia, se sugiere restringir la dosis de quelantes de fosfato a base de calcio en presencia de calcificación arterial (2C) y/o enfermedad ósea dinámica (2C) y/o si los niveles séricos de PTHi son persistentemente bajos (2C)(KDIGO).
4.9. En pacientes con ERC estadio 5D, se sugiere incrementar la eliminación de fósforo través de la diálisis en el tratamiento de hiperfosfatemia persistente (2C)(KDIGO).
Tratamiento dirigido a controlar las concentraciones séricas de fósforo y calcio
4.10. Los quelantes de fósforo que contienen calcio son efectivos para disminuir las concentraciones séricas de fósforo. Sin embargo, su uso puede asociarse con hipercalcemia y con una mayor incidencia de calcificación vascular (2C)(SLANH).
4.11. Se recomienda restringir la dosis de quelantes de fósforo que contienen calcio hasta un máximo de 1.500 mg de calcio elemental/día (1B)(SLANH). También se recomienda restringir o evitar el uso de quelantes de fósforo con calcio en presencia de hipercalcemia, calcificaciones vasculares, enfermedad ósea adinámica o niveles persistentemente bajos de PTHi (2C)(KDIGO).
4.12. Los quelantes de fósforo que contienen aluminio no deberían usarse (1C)(SLANH).
4.13. En pacientes con ERC 3-5 con fósforo sérico normal o elevado, sugerimos no exceder la ingesta de fósforo en la dieta de 800-1.000 mg/día, de forma aislada o en combinación con otros tratamientos (2D)(SLANH).
Tratamiento de las concentraciones séricas anormales de PTHi
4.14. Se desconoce el nivel óptimo de PTHi en pacientes con ERC 3-5. No obstante, sugerimos que aquellos pacientes con niveles de PTHi por encima de lo normal para el ensayo empleado sean evaluados para determinar la presencia de hiperfosfatemia, hipocalcemia y valores bajos (deficiencia) de 25(OH)D (2C)(KDIGO). Si están presentes, es razonable corregir estas anormalidades con una dieta baja en fósforo, quelantes de fósforo, suplementos de calcio y/o vitamina D (sin grado)(SLANH).
4.15. En pacientes con ERC 3-5D que muestren un incremento progresivo y sostenido de los niveles de PTHi por encima del límite superior del ensayo empleado, a pesar de la corrección de factores arriba mencionados, sugerimos iniciar tratamiento con calcitriol o análogos de la vitamina D (2C)(KDIGO).
4.16. En pacientes con ERC 5D, sugerimos mantener los niveles de PTHi en un rango aproximado de entre 2 y 9 veces el límite superior normal del ensayo (sin grado)(KDIGO).
4.17. En pacientes con ERC 5D que presenten cambios importantes en los niveles de PTHi en ambas direcciones (superior e inferior) dentro del rango sugerido (2 a 9 veces el límite superior normal del ensayo), se sugiere el inicio o un cambio en la terapia para evitar la progresión de las alteraciones hacia niveles fuera de este rango (2C)(KDIGO).
4.18. En aquellos pacientes con ERC 5D que presenten una elevación o un incremento progresivo de la PTHi sérica, sugerimos iniciar el uso de calcitriol, análogos de vitamina D, calcimiméticos o la combinación de estos dos grupos de agentes con el fin de reducir los niveles de PTHi (2B)(KDIGO).
- Es razonable que la selección inicial del fármaco para el control de la PTHi elevada esté basada en las concentraciones séricas de calcio y fósforo, así como otros aspectos de la TMO-ERC (sin grado)(KDIGO).
- Es razonable que las dosis de los quelantes de fósforo, cálcicos y no cálcicos, sean ajustadas de manera que no comprometan las concentraciones séricas normales de fósforo y calcio (sin grado)(KDIGO).
- Se recomienda que, en aquellos pacientes con hipercalcemia (1B)(KDIGO) o hiperfosfatemia (2D)(KDIGO), el uso de calcitriol y/o análogos de vitamina D sea reducido u omitido.
- Se sugiere que, en pacientes con hipocalcemia, el uso de calcimiméticos sea reducido u omitido, dependiendo de su severidad, de la medicación concomitante y de la presencia de síntomas y signos clínicos (2D)(KDIGO).
- Se sugiere que, si los niveles de PTHi disminuyen por debajo de 2 veces el límite superior normal del ensayo, el uso de calcitriol, análogos de vitamina D y/o calcimiméticos sea reducido u omitido (2C)(KDIGO).
4.19. En pacientes con ERC 3-5D e hiperparatiroidismo severo que no responda al tratamiento médico/farmacológico, se sugiere considerar la paratiroidectomía (2B)(KDIGO).
Guía 4
Recomendaciones generales
- La medición de los parámetros bioquímicos y hormonales que guían el manejo de los TMO-ERC está sujeta a variaciones dependientes del tipo de ensayo, así como del manejo y momento de toma de la muestra (fluctuación circadiana, posprandial, estacional o posdialítica). En consecuencia, se recomienda basar las decisiones terapéuticas en tendencias más que en valores únicos de dichas determinaciones, las cuales deben realizarse idealmente con el mismo método de laboratorio y a la misma hora del día para un paciente determinado73.
- En cuanto al producto Ca x P, actualmente se considera que su utilidad es limitada en la práctica clínica, pues su valor es determinado principalmente por el fósforo sérico y por lo general no brinda información adicional a la proporcionada por los valores individuales de sus dos componentes. Además, existen múltiples situaciones en las que un producto Ca x P normal se asocia con eventos clínicos adversos y viceversa74,75.
El uso del calcio sérico total tiene ciertas limitaciones desde el punto de vista clínico, particularmente en aquellos pacientes con una disminución en la concentración de albúmina sérica. A un pH fisiológico, la albúmina se une aproximadamente al 45 % del calcio total. Por lo tanto, las variaciones de la concentración de albúmina alteran la concentración del calcio sérico total, aun cuando el calcio ionizado permanezca inalterable. Por tales motivos, se han desarrollado algunas fórmulas para corregir los valores de calcio sérico de acuerdo a las concentraciones de albúmina a fin de hacer un estimado de la concentración de dicho elemento en los pacientes con hipoalbuminemia. Sin embargo, cambios en las técnicas de laboratorio para medir la albúmina con bromocresol púrpura (ahora en uso en muchos laboratorios) han cuestionado la utilidad de hacer correcciones del calcio sérico total por la concentración de albúmina76. Más aún, la evidencia reciente indica que, dependiendo de los agentes utilizados, pueden verse variaciones tan grandes como 30 % a 40 % en el valor corregido de calcio77. Por otra parte, las concentraciones de calcio sérico están sujetas a variaciones importantes relacionadas con la técnica utilizada en la toma de muestra. Así, por ejemplo, el uso de una vena periférica, el torniquete y la práctica de facilitar el llenado venoso mediante el cierre intermitente del puño pueden alterar hasta en un 10 % los valores de calcio. A esto se añade el efecto del tipo de anticoagulante utilizado para la preservación de la muestra77. En consecuencia, muchos autores sugieren abandonar la práctica de ajustar los valores de calcio por la albúmina sérica, ya que, salvo en condiciones especiales, puede llevar a una toma de decisiones errónea y potencialmente peligrosa sobre la medicación del paciente. Por tales motivos, consideramos razonable no utilizar las fórmulas disponibles de corrección del calcio sérico por albúmina, sino insistir en mejorar las condiciones de determinación del calcio total y, siempre que sea posible, utilizar las determinaciones del calcio ionizado.
Tratamiento dirigido a controlar los niveles de fósforo y calcio
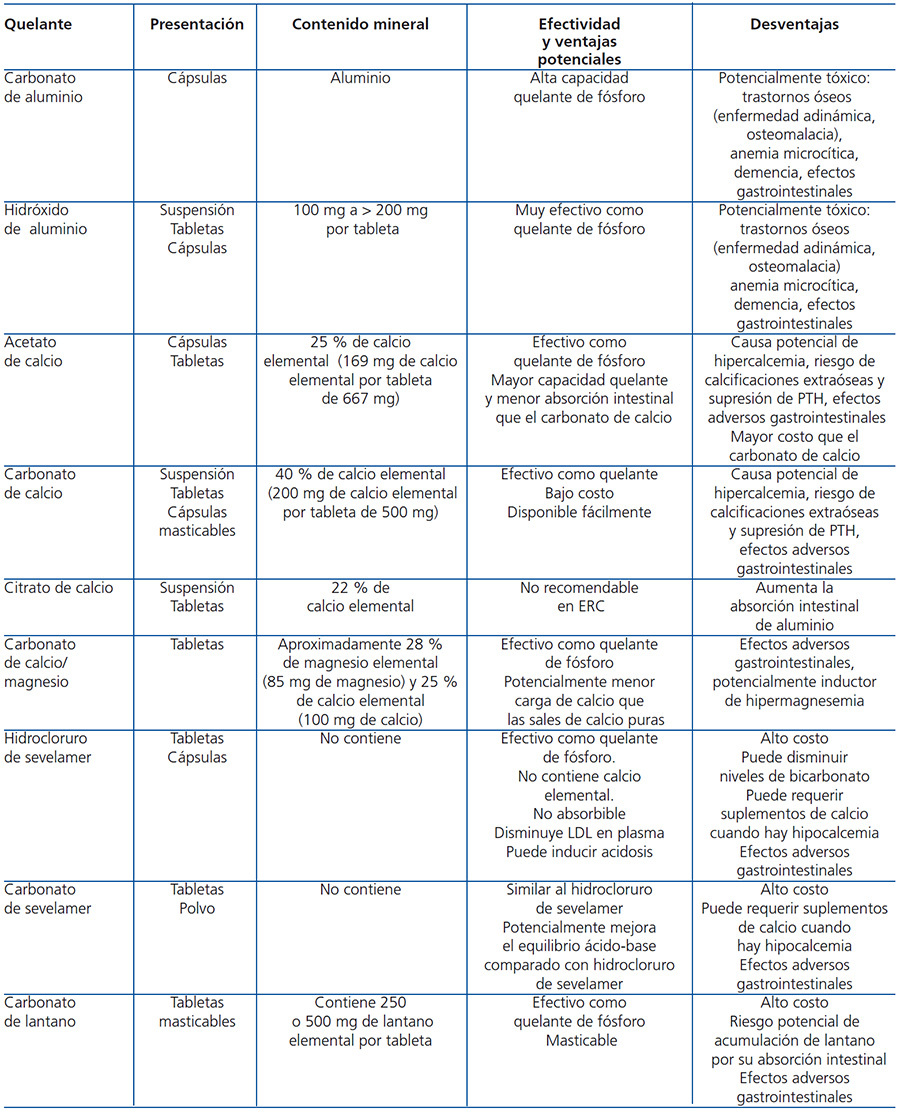
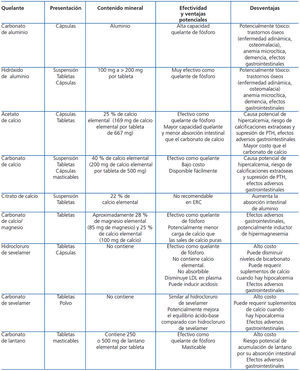
- A pesar de que la sobrecarga de fósforo es importante en estadios avanzados de la ERC, pocos pacientes con ERC 3-5 presentan concentraciones elevadas de fósforo en sangre en etapas tempranas de la enfermedad. La sobrecarga de fósforo ha sido asociada al desarrollo y progresión del hiperparatiroidismo secundario, niveles séricos reducidos de calcitriol, anomalías en el remodelado óseo y calcificación de tejidos blandos y arterias. También en pacientes con ERC 3-4, los niveles de fósforo sérico en el límite alto de lo normal han sido asociados a un mayor riesgo de mortalidad78,79. Aunque no existen ensayos clínicos aleatorizados que demuestren el impacto de la disminución de la sobrecarga de fósforo en estos estadios, se sugiere mantener sus concentraciones séricas dentro de valores normales. Las medidas sugeridas para dicho control incluyen restricción de fósforo en la dieta (asegurando una ingesta proteica adecuada) y posiblemente el uso de quelantes de fósforo. La elección del quelante debe ser individualizada y se sugiere tomar en cuenta el perfil de efectos adversos de cada quelante. En la tabla 7 se resume la información esencial de los principales quelantes de fósforo actualmente en uso.
- En múltiples estudios realizados en diferentes partes del mundo se ha mostrado una asociación entre la elevación del fósforo sérico y un incremento en el RR de muerte. En la mayoría de estos estudios, las asociaciones encontradas fueron consistentes y dependientes de la dosis, observándose aumentos progresivos en el riesgo al incrementar los niveles de fósforo sérico. El punto de inflexión, o rango en el que la concentración de fósforo se asocia de manera significativa con una elevada mortalidad por todas las causas, varía entre los diferentes estudios por las razones mencionadas anteriormente, 5,0-5,5 mg/dl (1,6-1,8 mmol/l), > 5,5 mg/dl (> 1,8 mmol/l) 6,0-7,0 mg/dl (1,9-2,3 mmol/l) y > 6,5 mg/dl (> 2,1 mmol/l)34,80-82. El estudio DOPPS mostró que la relación entre la elevación del fósforo sérico y el RR de mortalidad es consistente en todos los países analizados34. El estudio de Noordzij et al.80 también encontró relaciones similares en pacientes de diálisis peritoneal (DP) y HD. Estos datos observacionales son consistentes con datos provenientes de estudios experimentales y en animales, lo cual hace biológicamente factible esta asociación. Con base en estas observaciones, se recomienda realizar intervenciones que reduzcan el nivel de fósforo hacia el rango normal.
- La hipofosfatemia también puede ser causa de complicaciones del metabolismo óseo porque ocasiona un trastorno de la mineralización pudiendo llegar en casos extremos a la osteomalacia carencial, y a nivel sistémico porque en general se asocia con desnutrición. En la serie DOPPS fue evidente un riesgo creciente de mortalidad en pacientes con ERC estadio 5D con niveles de fósforo menores de 2,0 mg/dl (0,65 mmol/l), aunque menos del 5 % de los pacientes caen en esta categoría de riesgo.
En síntesis, aun cuando no se han estudiado los beneficios de disminuir el nivel de fósforo sérico en los resultados clínicos a nivel del paciente (por ejemplo, hospitalización, fracturas óseas, eventos cardiovasculares, y mortalidad), numerosos datos epidemiológicos muestran asociación positiva, si bien no una relación causal, entre niveles elevados de fósforo sérico y mayor RR de mortalidad, independientemente del estadio de la ERC. Existen datos experimentales que muestran un efecto directo del fósforo en la secreción de PTH, en la proliferación de células paratiroideas y en la calcificación vascular83-85. Si bien no existen estudios prospectivos aleatorizados y controlados que muestren los beneficios en los resultados a cualquier nivel de control de fosfato, en pacientes con ERC 3-5D se recomienda descender los niveles elevados de fósforo sérico al rango normal en un esfuerzo para controlar las complicaciones de TMO-ERC. El tratamiento siempre debe ser individualizado.
El balance de calcio durante la HD es importante para determinar la función cardiovascular a corto plazo, ya que este influye en la tolerabilidad hemodinámica de la diálisis. A largo plazo, el flujo de calcio durante la HD es un determinante importante del balance de calcio total. La concentración de calcio del dializado debería ajustarse para optimizar la carga total de calcio corporal86. Teóricamente, esta estrategia debería ayudar a mejorar la salud ósea determinando un balance negativo de calcio en pacientes con enfermedad ósea adinámica y calcificación, e induciendo un flujo positivo de calcio durante la diálisis en pacientes con hipocalcemia. Sin embargo, estas posibilidades no han sido comprobadas de manera prospectiva. El porcentaje dializable del calcio corporal es muy pequeño y son limitados los estudios que evalúan el balance de calcio. La cantidad total de calcio eliminada con cada tratamiento de diálisis dependerá no solamente de su concentración, sino también del nivel sérico de calcio ionizado, del intervalo interdialítico y de la tasa de ultrafiltración87. Los estudios que han medido el flujo neto de calcio durante la hemodiálisis han mostrado que este es casi nulo en pacientes que se dializan con una concentración de calcio de 1,25 mmol/l (2,5 mEq/l) en el dializado88,89. En un estudio más reciente se usaron evaluaciones más frecuentes del dializado drenado y se encontró un flujo medio de calcio en cada sesión de diálisis de –187 ± 232 mg (–46 ± 58 mmol) cuando se utilizó una concentración de calcio de 1,25 mmol/l (2,5 mEq/l). Sin embargo, 6 de los 52 pacientes estudiados tuvieron un balance positivo de calcio, apoyando el hecho de que el flujo de calcio en la hemodiálisis no es uniforme en todos los pacientes90. En consecuencia, se considera que, en general, el dializado con una concentración de calcio de 1,25 mmol/l (2,5 mEq/l) podría permitir un balance de calcio casi neutro para la mayoría de los pacientes. No obstante, es importante destacar que una baja concentración de calcio en el dializante podría también causar predisposición a arritmias cardíacas e inestabilidad hemodinámica durante las sesiones de diálisis91,92. Se sugiere mantener flexibilidad en las concentraciones del calcio en el dializado, las cuales deberían ser individualizadas en lo posible según las características del paciente.
- Consideraciones similares se aplican a la DP, en la que la concentración de calcio del dializado debe estar ajustada, en la medida de lo posible, a las necesidades individuales de cada paciente. En comparación con los pacientes que reciben HD, aquellos que reciben DP están expuestos a una concentración de calcio en el dializado por períodos más largos. Por lo tanto, deben evitarse concentraciones de calcio en el líquido de diálisis peritoneal superiores a 3,5 mEq/l (1,75 mmol/l) con el fin de prevenir una sobrecarga de calcio y la inducción de enfermedad ósea adinámica. Se recomiendan concentraciones de entre 2,5 y 3,0 mEq/l (1,25 y 1,50 mmol/l).
- En una revisión sistemática de los estudios aleatorizados controlados que examinan quelantes de fosfato93, se mostró que todas las medicaciones actualmente en uso como quelantes de fosfatos (sales de calcio, sales de aluminio, sevelamer y carbonato de lantano) son efectivas para reducir las concentraciones de fósforo sérico.
- En 3 ensayos clínicos aleatorizados, uno de ellos en pacientes con ERC 3-5 y dos en pacientes con ERC estadio 5D94-96, se encontró que el sevelamer puede atenuar la progresión de la calcificación arterial en comparación con los quelantes a base de calcio. Sin embargo, dicho efecto no fue observado en ensayos clínicos más recientes que compararon el sevelamer con acetato de calcio97,98. Es de hacer notar que las diferencias en el diseño de los estudios pudieran resultar en algunas de las disparidades observadas entre ellos. Aun así, y dado el elevado riesgo cardiovascular de estos pacientes, se sugiere limitar la dosis de quelantes que contienen calcio en los sujetos con evidencia de calcificación vascular, así como en aquellos que presentan PTH persistentemente disminuida o enfermedad ósea adinámica, ya que esto parece favorecer la progresión de la calcificación vascular.
- El uso de carbonato de lantano y sevelamer-HCl97,98 no afectó adversamente la histología ósea en estudios a corto plazo y, cuando se comparan con quelantes a base de calcio, podría ser menos probable que conduzcan a enfermedad ósea adinámica. Estudios comparativos con diferentes quelantes de fosfato han mostrado diferencias en los efectos sobre los parámetros bioquímicos de TMO-ERC. Por ejemplo, el uso de sales de calcio se asocia generalmente con niveles más altos de calcio sérico (y más episodios de hipercalcemia) y niveles séricos de PTH más bajos que cuando se usa sevelamer-HCl o carbonato de lantano. En resumen, no existen suficientes datos comparativos de eficacia en resultados clínicos que permitan recomendar el uso de un quelante específico en todos los pacientes. No obstante, existen datos consistentes con respecto al riesgo de inducir hipercalcemia y sobrecarga de calcio con el uso de quelantes que contienen calcio, por lo que en este caso se necesitaría una reducción en la dosis. Por otra parte, los datos disponibles en biopsias óseas sugieren que aquellos pacientes que reciben quelantes que contienen calcio son más susceptibles de desarrollar enfermedad ósea adinámica.
- Hasta el momento, la evidencia sobre el posible papel de los quelantes a base de calcio comparados con los que no contienen calcio en la patogénesis de la calcificación vascular no es concluyente, por lo que se requiere continuar la investigación para esclarecer este problema. El estudio Dialysis Clinical Outcomes Revisited DCOR99 fue realizado en 2.103 pacientes con ERC estadio 5D, aleatorizados para recibir sevelamer-HCl o quelantes cálcicos (70 % con acetato de calcio y 30 % con carbonato de calcio), seguidos por 20 meses aproximadamente. Solo 1.068 pacientes completaron el estudio y no se encontraron diferencias en la mortalidad por todas las causas o por mortalidad específica cuando se compararon los pacientes tratados con hidrocloruro de sevelamer con los quelantes con calcio. Tampoco se observaron diferencias en la mortalidad cardiovascular y hospitalización, aunque el sevelamer se asoció con mejor sobrevida en pacientes mayores de 65 años de edad99. El estudio ha sido cuestionado, sin embargo, por su alta tasa de discontinuación del tratamiento: el porcentaje total de pacientes retirados del estudio fue de 47 % en la rama de sevelamer-HCl y 51 % en la de quelantes cálcicos. Un segundo análisis del estudio DCOR100, usando datos de los reclamos a Medicare, no mostró un efecto sobre la mortalidad total, mortalidad por causas específicas, morbilidad, primera hospitalización u hospitalización por causa específica. Sin embargo, este estudio mostró un efecto benéfico del sevelamer-HCl sobre los resultados secundarios de múltiples hospitalizaciones por cualquier causa y días en el hospital100. No obstante, la información de ambos análisis no ha sido considerada de suficiente calidad como para catalogarla como concluyente.
Un segundo estudio96 aleatorizó 148 pacientes incidentes (pacientes nuevos) en hemodiálisis para recibir sevelamer-HCl o quelantes cálcicos, seguidos por un período medio de 44 meses. Solo 127 de estos pacientes tuvieron una EBCT y los pacientes retirados del estudio alcanzaron el 26 % en el grupo tratado con sevelamer-HCl y el 27 % en el grupo con quelantes cálcicos. En el análisis univariado se encontró una tasa de mortalidad no ajustada marginalmente mayor en los pacientes asignados a quelantes que contenían calcio, comparada con los pacientes tratados con sevelamer-HCl. No obstante, en el análisis multivariado, la diferencia entre los grupos fue significativa, lo que sugiere un desbalance de covariables que formaron parte del modelo, incrementando la posibilidad de una aleatorización no exitosa. Como consecuencia, la calidad metodológica de este estudio se ha considerado como moderada. Los estudios anteriores no arrojan datos de eventos cardiovasculares, aparte de las tasas de decesos, fracturas o paratiroidectomía, haciendo imposible obtener conclusiones a este respecto. Por otra parte, no hay estudios que hayan examinado los efectos del carbonato de lantano o cualquier otro quelante de fosfato (incluyendo compuestos que contienen calcio o aluminio) en los resultados a nivel del paciente. Dados los hallazgos de los estudios analizados, consideramos que se justifica limitar el consumo de calcio, bajo la forma de quelantes de fosfato, hasta tanto no se disponga de mayor información en pacientes con ERC.
Tratamiento de los niveles anormales de PTHi
Opciones terapéuticas
- Las formas terapéuticas de esteroles de la vitamina D disponibles para su uso en pacientes con ERC en nuestra región incluyen: ergocalciferol, colecalciferol y calcitriol. También se cuenta con análogos de vitamina D activa, derivados sintéticos de vitamina D2 (paricalcitol y doxercalciferol) y de vitamina D3 (alfacalcidol). El doxercalciferol y alfacalcidol requieren de la 25-hidroxilación a nivel hepático para convertirse en análogos activos.
La vitamina D y sus análogos han sido empleados en sujetos con ERC 3-5D con el propósito de mejorar las anomalías en la homeostasis mineral y reducir el desarrollo o progresión del hiperparatiroidismo secundario. El uso de ergocalciferol y colecalciferol ha recibido poca atención hasta el momento, pues se consideraba que los niveles de 25(OH)D no tenían gran relevancia en los pacientes con ERC, dada su limitada conversión a calcitriol por la 1-α-hidroxilasa renal. Sin embargo, la prevalencia de niveles deficientes (< 15 ng/ml) o insuficientes (15-30 ng/ml) de 25(OH)D se eleva en pacientes en todos los estadios de ERC101-103. Alternativamente, algunos estudios recientes sugieren una hidroxilación local importante de vitamina D en diferentes tejidos (por la presencia de 1-α-hidroxilasa), independientemente de la renal. Los calcimiméticos (cinacalcet es el único disponible actualmente en algunos de nuestros países) son moduladores alostéricos del receptor de calcio en las paratiroides, que ocasionan una disminución en la síntesis y liberación de PTH104. Sin embargo, su uso no está suficientemente documentado en etapas prediálisis.
Recomendaciones de tratamiento
- El hiperparatiroidismo que acompaña a la ERC representa una respuesta adaptativa a las alteraciones del metabolismo mineral asociadas con la disminución en el filtrado glomerular. Dicha respuesta permite mantener temporalmente un estado de homeostasis. Sin embargo, cuando la respuesta de las paratiroides es excesiva o inapropiada, tiene consecuencias clínicas adversas. Actualmente, no está claro cómo diferenciar de manera precisa una elevación compensadora en los niveles de PTH de una respuesta excesiva, y no existen ensayos clínicos que evalúen las ventajas y riesgos de suprimir una elevación moderada de los niveles de esta hormona en los pacientes con ERC moderada o grave que aún no inician diálisis. Por lo tanto, no existen datos que permitan establecer un nivel óptimo de PTH en estos pacientes.
- Aunque la evidencia es escasa, con base en la fisiopatología es razonable sugerir la búsqueda y corrección de los factores modificables que puedan contribuir al hiperparatiroidismo secundario (hipocalcemia, hiperfosfatemia y deficiencia de vitamina D) en aquellos pacientes con niveles de PTH por encima del límite superior de lo normal para el ensayo empleado. Algunos estudios en pacientes con ERC 3-5 sugieren que la suplementación de colecalciferol y calcio puede reducir las concentraciones de PTH103.
- En los pacientes con ERC 3-5D e hiperparatiroidismo secundario, el calcitriol y los análogos de la vitamina D han demostrado ser útiles para disminuir los niveles de PTH y mejorar la histología ósea en comparación con placebo105-108. Por lo tanto, se sugiere su empleo en aquellos sujetos que persisten con niveles por encima del límite superior del método utilizado, a pesar de la corrección de los factores modificables mencionados anteriormente.
- Tanto el calcitriol como los análogos de la vitamina D pueden incrementar el calcio y el fósforo séricos en pacientes con ERC109, por lo que es pertinente suspender su uso en caso de hipercalcemia o hiperfosfatemia que no responda a quelantes de fósforo.
- En estudios experimentales que comparan el uso de calcitriol y diferentes análogos sintéticos de la vitamina D, se han encontrado diferencias en el grado de supresión de la PTH, histología ósea e incidencia de hipercalcemia, hiperfosfatemia y calcificación vasculares110-113. Sin embargo, no existe evidencia a favor de ninguno de estos estudios114.
Vitamina D, análogos de vitamina D y calcimiméticos
- Vitamina D: Las formas terapéuticas de esteroles de la vitamina D disponibles para su uso en pacientes con ERC en nuestra región incluyen: ergocalciferol, colecalciferol y calcitriol. También se cuenta con análogos de vitamina D activa, derivados sintéticos de vitamina D2 (paricalcitol y doxercalciferol) y de vitamina D3 (alfacalcidol). El doxercalciferol y alfacalcidol requieren de la 25-hidroxilación a nivel hepático para convertirse en análogos activos, mientras que el paricalcitol es considerado un activador selectivo del receptor de vitamina D (ASRVD) y no requiere un metabolismo previo para su acción.
- La vitamina D y sus análogos han sido empleados en sujetos con ERC 3-5D con el propósito de mejorar las anomalías en la homeostasis mineral y reducir el desarrollo o progresión del hiperparatiroidismo secundario. Como se mencionó previamente, la prevalencia de niveles deficientes o insuficientes de 25(OH)D es alta en pacientes en todos los estadios de ERC101,115,116
Una serie de estudios demuestra que en pacientes con ERC 5D los niveles elevados de PTHi pueden ser suprimidos efectivamente por el calcitriol, comparado con placebo50. Sin embargo, es relativamente frecuente el desarrollo de hipercalcemia en los pacientes tratados con calcitriol. Este problema puede ser limitado con el uso de análogos de la vitamina D. El soporte para el uso de análogos de la vitamina D (paricalcitol y doxercalciferol) se basa en estudios experimentales que muestran una supresión dosis-equivalente de la PTH similar o superior al calcitriol, pero con menos respuesta calcémica y/o actividad fosfatémica37,117. El paricalcitol es un análogo sintético de la vitamina D con modificaciones en la cadena lateral (D2) y el anillo A (19-nor) que le confieren mayor selectividad al interactuar con el ASRVD. El paricalcitol suprime la síntesis y la secreción de PTH, pero se ha demostrado que tiene una menor respuesta calcémica y fosfatémica que el calcitriol, por lo que ha sido utilizado con frecuencia creciente para el control del hiperparatiroidismo secundario de la ERC37. El doxercalciferol es un análogo sintético de la vitamina D que requiere un proceso metabólico de activación por la CYP27 en el hígado para formar la 1-α-25(OH)2D2, metabolito mayor, y la 1-α-24(OH)2D2, metabolito menor. La activación del doxercalciferol no requiere activación por el riñón. La 1-α-25(OH)2D2 tiene la capacidad de suprimir la síntesis y secreción de PTH mediante la activación del receptor de vitamina D (RVD), con una menor respuesta calcémica y fosfatémica que el calcitriol, el compuesto natural. Por estos motivos se usa para el control de hiperparatiroidismo secundario38. Hasta el momento no existe consenso amplio sobre las dosis iniciales de paricalcitol y doxercalciferol. En el caso del paricalcitol, se han utilizado diferentes esquemas de dosificación que incluyen un cálculo según el peso seco del paciente y fórmulas basadas en el valor inicial de la PTHi. Así, por ejemplo, en algunos estudios se han utilizado las fórmulas basadas en el cociente del valor inicial de PTHi dividido entre 80 y hasta 120 a fin de limitar los posibles efectos secundarios en el desarrollo de hipercalcemia o hiperfosfatemia, o una supresión exagerada de los niveles de PTHi118.
- Calcimiméticos: Los calcimiméticos actúan como moduladores alostéricos del receptor de calcio, incrementado la sensibilidad del receptor de calcio en la célula paratiroidea al calcio extracelular119. La administración de calcimiméticos disminuye la síntesis y secreción de la PTH, reduce la proliferación de las células de la glándula paratiroidea, modula la regulación de genes involucrados en sobreexpresión de los receptores de calcio y del RVD39. Sin embargo, se requieren estudios adicionales sobre el impacto del uso de los calcimiméticos en la morbimortalidad en pacientes con ERC. El cinacalcet es el único calcimimético disponible para uso clínico, no aumenta la absorción de calcio y fósforo en el intestino. Esta característica lo diferencia de los esteroles de vitamina D, puesto que puede disminuir los niveles de PTH sin incrementar las concentraciones de calcio y fósforo. En consecuencia, el compuesto puede ser utilizado en pacientes con hiperparatiroidismo secundario cursando con hipercalcemia40.
Los estudios controlados sobre calcimiméticos son relativamente escasos y la mayoría de los trabajos publicados se refieren a pacientes en diálisis. En un estudio aleatorizado, doble ciego, controlado con placebo, se evaluó el efecto del tratamiento con cinacalcet en pacientes con ERC que no estaban recibiendo diálisis120. No obstante, requieren más estudios en poblaciones que no estén en diálisis antes de poder sugerir su uso en la ERC estadios 3-5. Existe un solo estudio controlado y aleatorizado que compara los resultados histomorfométricos de un año de tratamiento con cinacalcet con el tratamiento estándar en pacientes con ERC estadio 5D, usando biopsias de hueso repetidas a tiempo cero y a 12 meses121. En las biopsias del grupo placebo, el 45 % mostró un mejor recambio y el 23 % mostró un mayor recambio (empeoró). Ninguno de los pacientes mostró osteomalacia, y el cambio en la media del tiempo de mineralización (MLT) fue el mismo en el grupo placebo que en el de cinacalcet. Algunas de las biopsias mostraron un MLT anormalmente alto, pero no se suministraron detalles. El volumen óseo aumentó ligeramente pero no de manera significativa en el grupo con cinacalcet y no hubo cambio en el grupo placebo. En resumen, en este estudio no hubo diferencias significativas con respecto a la histomorfometría ósea, pero estuvo limitado por un pequeño número de pacientes. Los efectos adversos secundarios reportados más frecuentemente con el uso de cinacalcet han sido náuseas y vómitos122-124. En los pacientes tratados con cinacalcet, las náuseas se presentaron consistentemente, con una frecuencia de más de una vez y media que lo habitual, y los vómitos, el doble. En el estudio de Lindberg123, aproximadamente un cuarto de los pacientes presentaron algunos eventos adversos graves, tanto en el grupo con tratamiento como en el grupo placebo, los cuales podrían o no estar relacionados con el tratamiento. Tanto en el estudio de Block122 (15 %) como en el de Lindberg123 (9 %), aproximadamente el doble de pacientes suspendieron el tratamiento en el grupo con cinacalcet debido a los efectos secundarios, principalmente vómitos, náuseas y otros eventos gastrointestinales. En ambos estudios también, el 5 % de los pacientes tratados con cinacalcet y menos del 1 % de los pacientes en los grupos control tuvieron valores de calcio sérico por debajo de 7,5 mg/dl (1,9 mmol/l). Los episodios hipocalcémicos fueron transitorios y raramente asociados con síntomas. En otro estudio de efectividad y seguridad, de 26 a 52 semanas de duración125, se consideró que el tratamiento con cinacalcet era seguro y efectivo. Los efectos adversos secundarios (principalmente náuseas y vómitos) provocaron la interrupción de la terapia en un 10 % de los pacientes tratados con cinacalcet y en ninguno del grupo de control, mientras que al 3 % de estos últimos se les tuvo que realizar paratiroidectomía, lo que no sucedió con ninguno de los tratados con cinacalcet. A los 12 meses, no se observó diferencia alguna entre grupos cuando se usó vitamina D (cinacalcet 64 % vs placebo 63 %) o quelantes de fosfato (92 % vs 96 %, respectivamente) y tampoco hubo diferencia en el calcio elemental ingerido con las comidas.
- En pacientes con ERC estadios 3-5D con hiperparatiroidismo severo que no respondan a terapia médica/farmacológica, sugerimos la paratiroidectomía (2B).
No existen estudios que evalúen resultados de mortalidad, enfermedad cardiovascular, hospitalización, fracturas, evolución de la enfermedad ósea, parámetros bioquímicos o calidad de vida posparatiroidectomía. Sin embargo, cuando la paratiroidectomía es ejecutada por un cirujano con experiencia, resulta en una reducción marcada y sostenida de los niveles séricos de PTHi, calcio y fósforo. Una paratiroidectomía subtotal o total con autotrasplante reduce de manera efectiva los niveles elevados de PTHi, calcio, fósforo y fosfatasa alcalina total. No existe evidencia de que una paratiroidectomía total con reimplante inmediato del tejido paratiroideo ectópico tenga mejor resultado que la paratiroidectomía subtotal 7/8, por lo que se sugiere esta última. No aconsejamos la paratiroidectomía total sin la implantación inmediata del tejido paratiroideo por el riesgo de desarrollar hipoparatiroidismo de muy difícil manejo. La mayor parte de los pacientes que fueron sometidos a una paratiroidectomía muestra mejoría en los parámetros bioquímicos, pero es difícil evaluar las comparaciones entre las terapias médicas y quirúrgicas con relación a resultados de morbilidad y mortalidad. En ausencia de estudios controlados, los estudios observacionales disponibles en los que se comparan pacientes tratados quirúrgica o médicamente están expuestos a una selección sesgada que limita la validez de los resultados encontrados. Los individuos que son candidatos a una paratiroidectomía difieren de los que se seleccionaron para estudios con cinacalcet. El estudio con la mayor muestra es el de Kestenbaum et al.126, el cual mostró una mortalidad inferior a largo plazo en pacientes que fueron tratados con paratiroidectomía comparados con una cohorte no tratada quirúrgicamente; sin embargo, se trató de un estudio retrospectivo observacional, en el que la mortalidad posoperatoria a corto plazo fue alta (3,1 %), y el mejor resultado que se obtuvo a largo plazo después de la paratiroidectomía podría ser debido a una selección sesgada, como en el estudio de Trombetti et al.127, en el que los pacientes que tuvieron paratiroidectomía eran más jóvenes y tenían menos comorbilidades.
Debido a la falta de estudios controlados y al azar que permitan una adecuada comparación entre la terapia médica vs la quirúrgica del hiperparatiroidismo secundario, estas estrategias de manejo son difíciles de comparar. En pacientes no aptos para cirugía o que estén en espera de cirugía puede pensarse en las terapias médicas, incluyendo tratamiento con cinacalcet. En pacientes aptos para cirugía, generalmente se plantea una paratiroidectomía cuando el hiperparatiroidismo es grave y refractario al control por fármacos, usualmente después de un ensayo terapéutico con calcitriol, un análogo de la vitamina D o cinacalcet.
La paratiroidectomía también puede plantearse cuando el control médico para reducir los niveles de PTHi trae como resultado aumento inaceptable de los niveles séricos de calcio y/o de fósforo (como ocurre con frecuencia cuando se usa calcitriol o análogos de la vitamina D) o cuando no hay tolerancia debido a los efectos adversos. Puede ser difícil determinar lo que constituye un «hiperparatiroidismo refractario». Está claro que, mientras más elevada sea la PTH, es menos probable que la glándula involucione en respuesta a la terapia médica124. En suma, ante un hiperparatiroidismo secundario en pacientes con ERC 3-5D, el manejo debe comenzar con tratamiento médico (control del calcio, fósforo, vitamina D, análogos de vitamina D y/o calcimiméticos), y solo ante el fracaso del tratamiento médico o por la presencia de calcifilaxis está indicada la paratiroidectomía.
Conflictos de interés
En la elaboración del presente trabajo, la Sociedad Latinoamericana de Nefrología e Hipertensión (SLANH) ha tomado especial cuidado en evitar cualquier influencia o interferencia de la industria o de grupos privados a fin de impedir posibles situaciones que pudieran ser percibidas como conflictos de interés institucional, personal o comercial que pudieran producirse como consecuencia de las relaciones normales de la SLANH como sociedad científica.
En lo individual, todos los miembros del Comité de Metabolismo Mineral y Óseo de la SLANH que participaron en la elaboración de las presentes guías han hecho una declaración de conflictos de interés donde se exponen las relaciones que pudieran ser percibidas como conflictos de interés, tal como se describe a continuación.
Dr. Ezequiel Bellorin-Font: Conferencista/consultante: Sanofi, Abbott. Conferencista: Amgen.
Dr. Pablo Ambrosoni: No tiene conflictos de interés que declarar.
Dr. Raúl G. Carlini: Conferencista/consultante: Laboratorios Abbott, Sanofi-Genzyne. Conferencista: Novartis, Laboratorio Merck Sharp & Dohme.
Dr. Aluizio B. Carvalho: Asesor/consultante: Sanofi; Laboratorios Abbott, Amgen. Conferencista: Abbott, Amgem, Lilly.
Dr. Ricardo Correa-Rotter: Conferencista: Laboratorios Abbott, Sanofi-Genzyme, Amgen, Novartis. Miembro del comité ejecutivo del estudio de investigación Evolve, auspiciado por Amgen.
Dr. Alfonso Cueto-Manzano: No tiene conflictos de interés que declarar.
Dr. Aquiles Jara: Asesoría: Laboratorios Abbott, Diaverum.
Dra. Vanda Jorgetti: Asesora/consultante: Sanofi-Abbott; Amgem. Conferencista: Sanofi-Genzyme, Laboratorios Abbott, Amgem.
Dr. Armando L. Negri: Conferencista: Laboratorios Abbott, Sanofi-Genzyme.
Dra. Inés Olaizola: No tiene conflictos de interés que declarar.
Dr. Isidro Salusky: Financiamiento de investigación: Laboratorios Abbott, Sanofi-Genzyme, Amgen. Consultante: Kureha America Inc. y Cytochroma.
Dr. Eduardo Slatopolsky: Conferencista/financiamiento de investigación: Laboratorios Abbott, Genzyme-Sanofi.
Dr. José R. Weisinger: Conferencista/asesor: Sanofi-Genzyme, Amgen.
RESUMEN DE RECOMENDACIONES
CAPÍTULO 1. EVALUACIÓN DE LAS ALTERACIONES BIOQUÍMICAS
Guías
1.1. Se recomienda medir los niveles séricos de calcio, fósforo, hormona paratiroidea intacta (PTHi) y fosfatasa alcalina cuando la tasa de filtración glomerular (TFG) es < 60 ml/min (1C) (SLANH).
1.2. La frecuencia de las mediciones de calcio, fósforo y PTHi debe basarse en la presencia de las anormalidades y en la velocidad de progresión de la ERC (tabla 1). En aquellos pacientes que estén recibiendo tratamiento para TMO-ERC y en quienes se han detectado alteraciones bioquímicas, es razonable hacer mediciones más frecuentes para monitorizar las tendencias y evaluar la eficacia del tratamiento y los efectos secundarios (sin grado)(SLANH).
1.3. En pacientes con ERC 3-5D se sugiere medir los niveles séricos de 25-hidroxi-vitamina D [25(OH)D] (calcidiol) y repetirlos dependiendo del valor basal y las intervenciones terapéuticas (2C). También se sugiere tratar la insuficiencia y la deficiencia de vitamina D de acuerdo a las estrategias recomendadas para la población general (2C)(KDIGO).
1.4. Se recomienda que los médicos sean informados de la metodología y los cambios en las técnicas, tipo de muestra (plasma o suero) y procesamiento utilizado por los laboratorios en las determinaciones bioquímicas en los TMO-ERC 3-5D, a fin de lograr una interpretación adecuada de los resultados (1B) (KDIGO).
CAPÍTULO 2. EVALUACIÓN DE LAS ALTERACIONES ÓSEAS
Guías
2.1. El método diagnóstico más preciso para determinar el tipo de enfermedad ósea asociada a la ERC (osteodistrofia renal) es la biopsia ósea con análisis histomorfométrico (1A) (SLANH).
2.2. Es razonable realizar una biopsia ósea en pacientes con estadios 3-5D de ERC en ciertas situaciones, entre las que se incluyen (sin grado)(SLANH):
- Fracturas o dolor óseo sin causa aparente.
- Sospecha de enfermedad ósea asociada al aluminio.
- Sospecha de osteomalacia.
- Hipercalcemia o hipofosfatemia no explicadas.
- Antes de comenzar tratamiento con bisfosfonatos.
- Antes de paratiroidectomía.
2.3. En pacientes con ERC 3-5D con evidencia de TMO-ERC, se sugiere que no se realicen rutinariamente las pruebas para determinación de la densidad mineral ósea (DMO), debido a que no predicen los riesgos de fractura como en la población general y, por otra parte, no permiten predecir el tipo de osteodistrofia renal (2B)(KDIGO).
2.4. En pacientes con ERC estadios 3-5D, se sugiere utilizar las mediciones de PTH sérica o de la fosfatasa alcalina específica del hueso para la evaluación de enfermedad ósea debido a que valores marcadamente altos o bajos permiten predecir el recambio óseo subyacente (2B)(KDIGO).
2.5. En pacientes con ERC estadios 3-5D, se sugiere no medir rutinariamente los marcadores específicos de recambio óseo basados en la síntesis de colágeno (como el propéptido C-terminal de procolágeno tipo I) y su catabolismo (tales como el telopéptido de colágeno tipo I, piridinolina o desoxipiridinolina) (2C)(KDIGO).
2.6. En pacientes con ERC 3-5D, la medición de PTHi y fosfatasa alcalina no ha demostrado consistentemente una correlación con los cambios histológicos de la osteodistrofia renal (2B)(SLANH).
2.7. Se sugiere detectar la acidosis metabólica y eventualmente corregirla para evitar la pérdida de masa ósea y muscular en el paciente con ERC 3-5 (sin grado)(SLANH).
CAPÍTULO 3. EVALUACIÓN DE LAS CALCIFICACIONES VASCULARES
Guías:
3.1. En pacientes con ERC 3-5D se sugiere realizar una radiografía lateral de abdomen para detectar la presencia de calcificaciones vasculares. El ecocardiograma también pudiera ser utilizado para detectar calcificaciones valvulares. Estos métodos diagnósticos pueden ser alternativas razonables a otros métodos más complejos que pudieran no estar disponibles, tales como la tomografía axial computada (TAC) o la tomografía de emisión de electrones (EBCT) (2C)(KDIGO). Es razonable usar esta información para decidir el tratamiento de TMO-ERC (sin grado)(SLANH).
3.2. Se sugiere que los pacientes con ERC 3-5D con calcificaciones vasculares o valvulares sean considerados de alto riesgo cardiovascular (2A)(KDIGO).
CAPÍTULO 4. TRATAMIENTO DE LOS TMO-ERC
Guías:
Recomendaciones generales
4.1. Se recomienda que las decisiones terapéuticas se basen en tendencias, más que en resultados individuales de laboratorio, y que se considere de manera conjunta toda la información disponible de las alteraciones del metabolismo óseo y mineral asociadas a la ERC (1C)(KDIGO).
4.2. Se recomienda que las decisiones terapéuticas de TMO-ERC se basen en las concentraciones séricas de calcio y fósforo consideradas individualmente, en vez del producto calcio x fósforo (Ca x P) (2D)(KDIGO).
4.3. En pacientes con ERC 3-5D, se recomienda que las concentraciones séricas de calcio (ionizado o total corregido) se mantengan dentro del rango normal para el método utilizado (2C)(KDIGO).
4.4. En pacientes con ERC estadios 3-5, se sugiere mantener el fósforo sérico en el rango normal (2C). En pacientes con ERC estadio 5D, se sugiere disminuir los niveles elevados de fósforo hacia el rango normal (2C)(KDIGO).
4.5. En pacientes con ERC estadio 5D, se sugiere usar una concentración de calcio en el líquido de hemodiálisis entre 1,25 y 1,50 mmol/l (2,5 y 3,0 mEq/l) (2D)(KDIGO).
4.6. En pacientes con ERC estadios 3-5 (2D) y 5D (2B), se sugiere usar quelantes de fosfato para el tratamiento de la hiperfosfatemia. Es razonable que la selección del quelante de fosfato tenga en consideración el estadio de la ERC, la presencia de otros componentes de TMO-ERC, terapias concomitantes y perfil de efectos secundarios (sin grado)(KDIGO).
4.7. En pacientes con ERC estadios 3-5D e hiperfosfatemia, se recomienda restringir la dosis de quelantes de fosfato a base de calcio y/o la dosis de calcitriol o análogos de la vitamina D en presencia de hipercalcemia persistente o recurrente (1B)(KDIGO).
4.8. En pacientes con ERC estadios 3-5D e hiperfosfatemia, se sugiere restringir la dosis de quelantes de fosfato a base de calcio en presencia de calcificación arterial (2C) y/o enfermedad ósea dinámica (2C) y/o si los niveles séricos de PTHi son persistentemente bajos (2C)(KDIGO).
4.9. En pacientes con ERC estadio 5D, se sugiere incrementar la eliminación de fósforo través de la diálisis en el tratamiento de hiperfosfatemia persistente (2C)(KDIGO).
Tratamiento dirigido a controlar las concentraciones séricas de fósforo y calcio
4.10. Los quelantes de fósforo que contienen calcio son efectivos para disminuir las concentraciones séricas de fósforo. Sin embargo, su uso puede asociarse con hipercalcemia y con una mayor incidencia de calcificación vascular (2C)(SLANH).
4.11. Se recomienda restringir la dosis de quelantes de fósforo que contienen calcio hasta un máximo de 1.500 mg de calcio elemental/día (1B)(SLANH). También se recomienda restringir o evitar el uso de quelantes de fósforo con calcio en presencia de hipercalcemia, calcificaciones vasculares, enfermedad ósea adinámica o niveles persistentemente bajos de PTHi (2C)(KDIGO).
4.12. Los quelantes de fósforo que contienen aluminio no deberían usarse (1C)(SLANH).
4.13. En pacientes con ERC 3-5 con fósforo sérico normal o elevado, sugerimos no exceder la ingesta de fósforo en la dieta de 800-1.000 mg/día, de forma aislada o en combinación con otros tratamientos (2D)(SLANH).
Tratamiento de las concentraciones séricas anormales de PTHi
4.14. Se desconoce el nivel óptimo de PTHi en pacientes con ERC 3-5. No obstante, sugerimos que aquellos pacientes con niveles de PTHi por encima de lo normal para el ensayo empleado sean evaluados para determinar la presencia de hiperfosfatemia, hipocalcemia y valores bajos (deficiencia) de 25(OH)D (2C)(KDIGO). Si están presentes, es razonable corregir estas anormalidades con una dieta baja en fósforo, quelantes de fósforo, suplementos de calcio y/o vitamina D (sin grado)(SLANH).
4.15. En pacientes con ERC 3-5D que muestren un incremento progresivo y sostenido de los niveles de PTHi por encima del límite superior del ensayo empleado, a pesar de la corrección de factores arriba mencionados, sugerimos iniciar tratamiento con calcitriol o análogos de la vitamina D (2C)(KDIGO).
4.16. En pacientes con ERC 5D, sugerimos mantener los niveles de PTHi en un rango aproximado de entre 2 y 9 veces el límite superior normal del ensayo (sin grado)(KDIGO).
4.17. En pacientes con ERC 5D que presenten cambios importantes en los niveles de PTHi en ambas direcciones (superior e inferior) dentro del rango sugerido (2 a 9 veces el límite superior normal del ensayo), se sugiere el inicio o un cambio en la terapia para evitar la progresión de las alteraciones hacia niveles fuera de este rango (2C)(KDIGO).
4.18. En aquellos pacientes con ERC 5D que presenten una elevación o un incremento progresivo de la PTHi sérica, sugerimos iniciar el uso de calcitriol, análogos de vitamina D, calcimiméticos o la combinación de estos dos grupos de agentes con el fin de reducir los niveles de PTHi (2B)(KDIGO).
- Es razonable que la selección inicial del fármaco para el control de la PTHi elevada esté basada en las concentraciones séricas de calcio y fósforo, así como otros aspectos de la TMO-ERC (sin grado)(KDIGO).
- Es razonable que las dosis de los quelantes de fósforo, cálcicos y no cálcicos, sean ajustadas de manera que no comprometan las concentraciones séricas normales de fósforo y calcio (sin grado)(KDIGO).
- Se recomienda que, en aquellos pacientes con hipercalcemia (1B)(KDIGO) o hiperfosfatemia (2D)(KDIGO), el uso de calcitriol y/o análogos de vitamina D sea reducido u omitido.
- Se sugiere que, en pacientes con hipocalcemia, el uso de calcimiméticos sea reducido u omitido, dependiendo de su severidad, de la medicación concomitante y de la presencia de síntomas y signos clínicos (2D)(KDIGO).
- Se sugiere que, si los niveles de PTHi disminuyen por debajo de 2 veces el límite superior normal del ensayo, el uso de calcitriol, análogos de vitamina D y/o calcimiméticos sea reducido u omitido (2C)(KDIGO).
4.19. En pacientes con ERC 3-5D e hiperparatiroidismo severo que no responda al tratamiento médico/farmacológico, se sugiere considerar la paratiroidectomía (2B)(KDIGO).
Tabla A. Estadios de la enfermedad renal crónica
Tabla B. Fortaleza de la evidencia
Tabla C. Calidad de la evidencia
Figura 1. Mecanismos de las alteraciones del metabolismo del calcio, fósforo y hormona paratiroidea en la enfermedad renal crónica
Tabla 1. Frecuencia sugerida de mediciones de calcio, fósforo y hormona paratiroidea intacta
Tabla 2. Origen y magnitud de la variación en la medición sérica de calcio, fósforo, hormona paratiroidea intacta y esteroles de vitamina D
Tabla 3. Niveles de vitamina D en suero y dosis sugeridas de tratamiento
Tabla 4. Fracturas en pacientes con enfermedad renal crónica estadio 3-4
Tabla 5. Fracturas en pacientes con enfermedad renal crónica estadio 5D
Tabla 6. Características de la biopsia ósea en los diferentes tipos de osteodistrofia renal.
Tabla 7. Comparación de quelantes de fósforo disponibles actualmente