La acidosis tubular renal distal (ATRD) o ATR tipo I se caracteriza por una disminución en la excreción urinaria de los hidrogeniones H+ y del amonio. En los niños afectados por ATRD hay retraso en el crecimiento, vómito, estreñimiento, falta de apetito, polidipsia y poliuria, nefrocalcinosis, debilidad y hasta parálisis muscular por la hipopotasemia. En este trabajo se resumen los avances en el estudio genético de la ATRD en las poblaciones hasta ahora estudiadas. La ATRD es heterogénea, por lo que también se analizan los transportadores y canales iónicos que se han identificado hasta ahora en las células intercaladas alfa del túbulo colector, y que podrían explicar los casos de ATRD que no se asocian con los genes hasta ahora estudiados. La ATRD puede ser autosómica dominante o autosómica recesiva. La ATRD autosómica recesiva se manifiesta en los primeros meses de vida, cursa con nefrocalcinosis y sordera temprana o tardía. La ATRD autosómica dominante es menos severa y aparece en la adolescencia o en la etapa adulta, y puede o no presentar nefrocalcinosis. En las células intercaladas alfa de los túbulos colectores se lleva a cabo la excreción urinaria de la carga ácida: los ácidos titulables (fosfatos) y el amonio. La ATRD autosómica recesiva se asocia con mutaciones en los genes ATP6V1B1, ATP6V0A4 y SLC4A1, los cuales codifican las subunidades a4 y B1 de la V-ATPasa y el intercambiador de bicarbonato/cloruro AE1, respectivamente. En contraste, la ATRD autosómica dominante se relaciona con mutaciones solo en AE1.
Distal renal tubular acidosis (dRTA) or RTA type I is characterised by reduced H+ hydrogen ions and ammonium urinary excretion. In children affected by dRTA there is stunted growth, vomiting, constipation, loss of appetite, polydipsia and polyuria, nephrocalcinosis, weakness and muscle paralysis due to hypokalaemia. This work summarises progress made in dRTA genetic studies in populations studied so far. DRTA is heterogeneous and as such, transporters and ion channels are analysed which have been identified in alpha-intercalated cells of the collecting duct, which could explain cases of dRTA not associated with the hitherto studied genes. DRTA can be autosomal dominant or autosomal recessive. Autosomal recessive dRTA appears in the first months of life and progresses with nephrocalcinosis and early or late hearing loss. Autosomal dominant dRTA is less severe and appears during adolescence or adulthood and may or may not develop nephrocalcinosis. In alpha-intercalated cells of the collecting duct, the acid load is deposited into the urine as titratable acids (phosphates) and ammonium. Autosomal recessive dRTA is associated with mutations in genes ATP6V1B1, ATP6V0A4 and SLC4A1, which encode subunits a4 and B1 of V-ATPase and the AE1 bicarbonate/chloride exchanger respectively. By contrast, autosomal dominant dRTA is only related to mutations in AE1.
En la práctica médica diaria el diagnóstico de una enfermedad se basa habitualmente en el estudio de sus manifestaciones clínicas, bioquímicas, radiológicas y anatomopatológicas. Sin embargo, dependemos del desarrollo de la investigación básica para identificar y comprender los mecanismos celulares y moleculares involucrados en la etiología de una enfermedad.
A pesar de los avances en la comprensión de muchas enfermedades, la patogénesis de muchas otras ha permanecido en el desconocimiento. En muchos casos, aunque existan factores específicos que se asocien con la enfermedad, no logramos distinguir si estos están casualmente relacionados con ella o en realidad son una consecuencia.
Actualmente los estudios genéticos pueden revelarnos los genes involucrados en una enfermedad cuyo origen es desconocido. La importancia de esta estrategia es que no hay que hacer hipótesis acerca de la patogénesis de la enfermedad, excepto que la variación genética contribuye a la enfermedad y que los genes, que están causalmente relacionados con la enfermedad, pueden identificarse de forma fácil. Durante los últimos 20 años se ha demostrado el enorme poder de este concepto con la identificación de más de 2000 genes relacionados con enfermedades, y que ha revolucionado nuestra visión sobre su origen.
Existen varias enfermedades genéticas en por lo menos el 10 % de los pacientes con insuficiencia renal1, así como factores genéticos que influyen en la progresión del daño crónico en las enfermedades renales adquiridas2-4. Las enfermedades renales hereditarias tienen frecuencias variables; por ejemplo, la enfermedad poliquística del riñón autosómica dominante es la más frecuente y afecta a 1 de cada 1000 personas. En contraste, el resto de las enfermedades renales hereditarias son poco frecuentes, lo que significa que estas solo impactan en menos de 5 personas por cada 10,0001.
No hay duda de que las enfermedades renales hereditarias deterioran la calidad de vida de los pacientes. Desafortunadamente, nuestro conocimiento de la mayoría de estas enfermedades está limitado por su baja incidencia, la variabilidad fenotípica, la falta de procedimientos diagnósticos estandarizados y la fragmentación de la información clínica y biológica que se obtiene de los estudios con grupos reducidos. Por otra parte, la baja prevalencia de estas enfermedades no atrae el interés de la industria farmacéutica y el financiamiento para su investigación es escaso. No obstante, el estudio de las enfermedades «raras» representa una oportunidad única para elucidar su origen y comprender el complejo andamiaje molecular que explica el funcionamiento de un órgano y lo que provoca su deterioro.
El desarrollo vertiginoso de las tecnologías para la secuenciación del exoma y de todo el genoma abre nuevas perspectivas para el diagnóstico de las más de 17.000 enfermedades mendelianas o monogénicas. Por otra parte, el estudio funcional de las proteínas mutadas en modelos animales y en modelos celulares permite comprender la etiología de la enfermedad y constituye el marco de referencia para el diseño farmacológico y/o la prevención de los efectos tóxicos de algunas drogas5,6.
ACIDOSIS METABÓLICA
La acidosis metabólica se caracteriza por una disminución del pH sanguíneo con caída en las concentraciones plasmáticas del bicarbonato. En individuos con respuesta respiratoria intacta, la acidosis metabólica causa hiperventilación compensatoria que mitiga la caída del pH sanguíneo. En consecuencia, la homeostasis del pH sanguíneo se mantiene como resultado del cociente de concentración: bicarbonato/CO2, el cual es el amortiguador celular y sanguíneo por excelencia.
El pH extracelular se debe mantener dentro de un margen muy estrecho de 7,38-7,42. La homeostasis del pH es crítica para el funcionamiento de las células y, en consecuencia, de nuestros órganos. Un pH sanguíneo más ácido del normal puede ser el resultado de: una acumulación de ácidos (acidosis láctica, cetoacidosis, insuficiencia renal), la pérdida de bicarbonato por el tracto gastrointestinal (como es el caso de una diarrea crónica o mala absorción7) y la pérdida de bicarbonato por un defecto en su reabsorción renal o por su consumo, como consecuencia de un defecto de la excreción urinaria de los hidrogeniones por el riñón (acidosis hiperclorémica o acidosis tubular renal distal, ATRD)8-13.
El catabolismo de los alimentos ingeridos y el de los metabolitos de nuestras propias células produce dos tipos de ácidos: volátiles (CO2) y no volátiles (sulfúrico, fosfórico y amonio). La ingesta de las proteínas produce una carga ácida que se traduce en iones H+: de 1 mEq/kg/día en el adulto y del doble en el niño12,14. Los ácidos circulantes consumen el bicarbonato presente en el plasma; sin embargo, el riñón puioneede compensar esta pérdida gracias a que produce y reabsorbe el bicarbonato.
BALANCE ÁCIDO-BASE EN EL RIÑÓN
El riñón mantiene y controla el equilibrio ácido-base de la sangre a través de tres mecanismos: la filtración y la reabsorción del bicarbonato, la excreción de los ácidos (o de álcali) y la síntesis de amonio y de bicarbonato. En el riñón se llevan a cabo dos procesos bioquímicos acoplados: la reabsorción del bicarbonato y la síntesis, secreción, reciclaje y excreción urinaria del amonio.
La presencia de múltiples sistemas de transporte en los diferentes segmentos de los túbulos de la nefrona hace posible recuperar todo el bicarbonato (HCO3-) filtrado (4320 mmol/día) en el glomérulo14. En los primeros segmentos tubulares de la nefrona, los túbulos proximales reabsorben cerca del 80 % del bicarbonato. En este segmento tubular la reabsorción del bicarbonato ocurre a través del cotransportador Na+/HCO3- (NBCe1); esta absorción esta acoplada a la secreción de ácido en la orina por el intercambiador Na+/H+ (NHE3)15. En los túbulos proximales se reabsorbe la glutamina circulante a partir de la cual se sintetizan simultáneamente amonio y bicarbonato.
La reabsorción del 15 % del bicarbonato ocurre en el asa gruesa ascendente de Henle y solo cerca del 5 % del bicarbonato se recupera en los túbulos distales de la nefrona16,17. Por último, el riñón elimina la carga ácida en la orina: el fosfato diácido H2PO4- (ácido titulable) y el sulfato de amonio.
IMPORTANCIA DE LA ACIDIFICACIÓN URINARIA
La acidificación de la orina, junto con la excreción de citratos, es fundamental en la eliminación de las sales inorgánicas y orgánicas en forma soluble. Los amortiguadores urinarios son los fosfatos, pero en mayor grado lo es el amonio/amoníaco.
La ingesta de una carga ácida como es una comida rica en proteínas provoca que los riñones produzcan una orina más ácida (pH < 5,5); también disminuye la velocidad de excreción del bicarbonato y aumenta la de los fosfatos y la del amonio18-21.
MECANISMOS DE TRANSPORTE QUE PARTICIPAN EN LA HOMEOSTASIS ÁCIDO-BASE EN LAS CÉLULAS INTERCALADAS ALFA
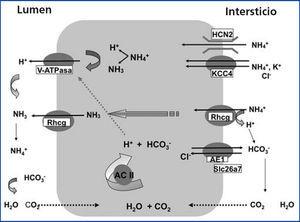
La secreción de hidrogeniones H+ en la orina se lleva a cabo en las células intercaladas alfa de los túbulos colectores corticales y medulares (figura 1). La ATPasa de H+, V-ATPasa, cataliza el paso de H+ del citoplasma a la luz tubular. La anhidrasa carbónica CA2 produce los hidrogeniones H+, y simultáneamente el bicarbonato se reabsorbe a través del intercambiador de Cl-/HCO3-, correspondiente a la isoforma AE1. El mecanismo de excreción del amonio se lleva a cabo en dos etapas: primero se captura del espacio intersticial al citoplasma por canales de amonio activados por el voltaje HCN221 y por los canales de amoníaco Rhcg20. Los canales HCN2 son constitutivos, pueden captar amonio y/o sodio y no se regulan por acidosis metabólica21. En contraste, los canales de amoníaco Rhcg se localizan tanto en membranas apicales como en membranas basolaterales22, y su tráfico a las membranas se regula por acidosis metabólica20.
INTERCAMBIADOR DE Cl-/HCO3- AE1
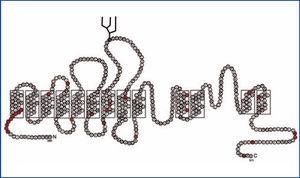
El gen SLC4A1 codifica el intercambiador AE1, una glicoproteína dimérica con 12-14 dominios transmembrana23-25 (figura 2). Hay tres genes en la familia AE1 y en los tejidos en los que se expresa, AE1; participa en la regulación del pH, el volumen celular y el transporte transcelular de ácido y de base en las células epiteliales26-28.
AE1 presenta una isoforma específica de los eritrocitos y una isoforma corta específica del riñón29. En los eritrocitos AE1, además de intercambiar cloruro por el bicarbonato del plasma, tiene un papel estructural al interactuar con proteínas del citoesqueleto que contribuyen al tráfico de AE1 y a su estabilidad en la membrana plasmática23. En consecuencia, AE1 juega un papel central en la respiración al transportar y eliminar el CO2 por los pulmones y en la homeostasis ácido-base en el riñón30. En el riñón, AE1 lleva a cabo la reabsorción del bicarbonato hacia el espacio intersticial y los vasos sanguíneos31. Hay un grupo de mutaciones en AE1 que producen deformaciones en el eritrocito y cuyo origen es hereditario autosómico dominante: la anemia esferocítica hereditaria, la ovalocitosis del sur de Asia y otras estomatocitosis con una función normal del riñón32. Hay otra serie de mutaciones en AE1 que generan ATRD asociada a problemas en los eritrocitos10,33,34. Se pueden consultar las mutaciones en AE1 en: www.ensembl.org y www.hgmd.org
V-ATPasa
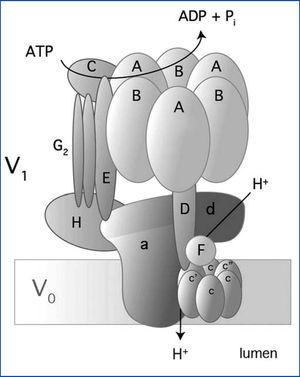
La H-ATPasa vacuolar (V-ATPasa) pertenece a una familia de bomba de hidrogeniones H+ y se localiza en una variedad de membranas: endosomas, lisosomas, vesículas secretoras y en las membranas plasmáticas de eucariontes35-37. La V-ATPasa es una enzima compleja multimérica que consta de 14 subunidades (figura 3); tiene dos dominios: uno en el citoplasma (V1) y otro en la membrana (V0). V1 es el dominio catalítico y consta de 8 subunidades (A-H). El dominio V0 abarca 6 subunidades (a, c, c”, d, e, y Ac45 en mamíferos) y transloca los H+ a través de la membrana35-37. Hay tres copias de las subunidades A y B que se alternan en un arreglo en forma de anillo (figura 3). Los sitios catalíticos están en la subunidad A1 y la interfase entre las subunidades A-B regula la actividad de la enzima38,39. La subunidad «a» en V0 permite el acceso a los hemicanales por los que se exportan los hidrogeniones H+ al espacio luminal37. Hay cuatro isoformas de la subunidad «a» (a1-a4) y tienen un 47-61 % de identidad en los humanos35. La subunidad «a» además participa en el tráfico de la V-ATPasa en las células de mamíferos37.
En las células intercaladas alfa del túbulo colector, la V-ATPasa se localiza en las membranas apicales y secreta H+ en la orina (figura 1)35. Las subunidades, B1 y a4 de la V-ATPasa son específicas de las células intercaladas alfa del túbulo colector. Los defectos en estas dos subunidades dan lugar a la «acidosis tubular renal distal» o ATRD9,40. Como la subunidad B1 además se expresa en las células ciliares del oído interno9, las mutaciones en la subunidad B1 producen ATRD con sordera.
El gen ATP6V1B1 codifica la subunidad B1 y comprende 14 exones que producen una proteína de 513 aminoácidos. El gen ATP6V0A4 tiene 24 exones de los cuales 20 codifican la subunidad a4 con 840 aminoácidos35.
Existen otros sistemas de transporte en las células intercaladas alfa de la nefrona distal que también participan en la homeostasis ácido-base, como son: la anhidrasa carbónica II41, el cotransportador de potasio/cloruro KCC442,43, el canal de amoníaco Rhcg20,44 y el canal de amonio HCN2 (figura 1)21. La H-K-ATPasa presente en la membrana apical de las células intercaladas alfa no parece participar en la secreción de ácido, sino en la reabsorción de K+ en condiciones de hipopotasemia40,45.
En la figura 1 se ilustran los transportadores, canales iónicos y la V-ATPasa en las células intercaladas alfa del túbulo colector. Es importante subrayar que la transcripción, la traducción y el tráfico a la membrana de muchos de los transportadores y canales iónicos dependen de las condiciones metabólicas.
Los ensayos de microperfusión de túbulos y los modelos knockout en ratón han ayudado a dilucidar las vías de transporte que participan en la homeostasis ácido-base en las células intercaladas alfa. Por ejemplo, el ratón que no expresa KCC4 desarrolla sordera neurosensorial, además de ATRD42. Hay otro intercambiador de Cl/bicarbonato que opera también como canal de Cl-, el Slc26a7, que se activa por hipertonicidad46. El ratón Slc26a7 -/- desarrolla ATRD47. Llama la atención que los ratones que no expresan el canal de amoníaco (Rhcg -/-) tienen problemas en excretar el amonio solo en condiciones de acidosis metabólica, como es el caso de una ATRD incompleta44. El canal de amonio HCN2 es un canal iónico constitutivo que participa en la excreción basal de amonio pero no parece estar regulado por acidosis metabólica21.
ACIDOSIS TUBULAR RENAL DISTAL
La ATRD pertenece al grupo de enfermedades renales de baja frecuencia en la población.
En la ATRD se pierde la capacidad para acidificar la orina por un defecto en la excreción de la carga ácida (iones H+ y amonio) en las células intercaladas alfa del túbulo colector. La acumulación de la carga ácida en la nefrona distal tiene como consecuencia el consumo y disminución del amortiguador bicarbonato/CO2 en la sangre. Los síntomas que acompañan a la ATRD son: retraso en el crecimiento, vómito, diarrea y/o estreñimiento, falta de apetito, polidipsia y poliuria, nefrocalcinosis; también puede presentarse debilidad y parálisis muscular por la pérdida de potasio (hipopotasemia).
Para poder diagnosticar la ATRD en la clínica es necesario determinar la creatinina plasmática y las excreciones fraccionales de sodio, potasio y cloro, la calciuria y la citraturia. Generalmente se observa acidosis en la sangre (pH < 7,35) y una disminución pronunciada de la concentración del bicarbonato y del CO2 (< 15 mEq/l). En la ATRD el pH de la orina es mayor de 6 en presencia de acidosis metabólica sistémica.
Para los casos cuyo diagnóstico está en duda, como en la ATRD incompleta, es recomendable aplicar pruebas de acidificación. Estas pruebas consisten en la administración de NH4Cl, determinándose a continuación: el pH, la acidez titulable y la excreción urinaria de amonio48. Debido a las complicaciones de esta prueba en los niños, se puede evaluar la capacidad de acidificación con la determinación de la pCO2 urinaria máxima (UpCO2) con la ingesta de bicarbonato de sodio (4 mEq/kg)49. La prueba de la pCO2 urinaria se puede realizar con estímulos de bicarbonato sodio, acetazolamida o ambos juntos, en este caso administrados a la mitad de las dosis habituales. Otra prueba es la de furosemida con fludrocortisona49-52.
Las pruebas diagnósticas confirman la imposibilidad de excretar la carga ácida al observarse un pH urinario mayor a 5,5.
Los estudios de ultrasonido en los pacientes con ATRD muestran la presencia de depósitos de calcio en el tejido renal (nefrocalcinosis) y/o de cálculos en las vías urinarias (nefrolitiasis).
La acidosis crónica y los problemas secundarios intercurrentes (vómitos, poliuria, crisis de deshidratación, rechazo de tomas, etc.) afectan el crecimiento y, en consecuencia, hay una disminución de la talla y el peso de los pacientes.
La ATRD se acompaña de hipercloremia como consecuencia de la disminución del HCO3- en la sangre. En la ATRD se observa hipopotasemia ([K] < 3,5 mEq/l), hipercalciuria e hipocitraturia. La hipercalciuria se produce cuando la excreción urinaria de calcio es mayor de 4 mg/kg/día tanto en adultos como en niños. Hay que considerar que el cociente urinario calcio/creatinina en lactantes varía con la edad. Los valores normales según la edad son: de 0-6 meses, < 0,8 mg/mg; de 6 a 12 meses, < 0,6 mg/mg; de 1 a 2 años, < 0,5 mg/mg53. En adultos se considera hipocitraturia un valor inferior a 300 mg/día para ambos sexos y/o un valor del cociente citrato/creatinina inferior a 250 mg/g. En niños se considera hipocitraturia valores inferiores a 8 mg/kg/día y/o un cociente citrato/creatinina menor de 400 mg/g53.
Es importante destacar que la eliminación de calcio en la orina es alta en los lactantes y disminuye progresivamente con la edad. Por consiguiente, es más relevante la hipocitraturia en el desarrollo de la nefrocalcinosis y de la urolitiasis, en las que se depositan principalmente sales de fosfatos de calcio. Llama la atención que también se han encontrado casos de ATRD sin hipercalciuria54.
Los pacientes con ATRD cursan con una brecha aniónica (anión restante) urinaria positiva y una brecha aniónica del plasma normal ([Na+] + [K+] - [Cl-]), que la distingue de otro tipo de acidosis, como son la cetoacidosis, la acidosis láctica y la acidosis por intoxicación con solventes o medicamentos, con brecha aniónica del plasma mayor de la normal7.
Sin tratamiento, la ATRD provoca la detención del crecimiento, el raquitismo en los niños y la osteomalacia en los adultos, y el deterioro de la función renal a través de los años.
Afortunadamente, la ATRD tiene un buen pronóstico si se diagnostica a edades tempranas y se sigue el tratamiento alcalino, el cual consiste en dosis periódicas de bicarbonato de sodio y/o de citrato de potasio durante el día.
FORMAS HEREDITARIAS DE LA ACIDOSIS TUBULAR RENAL
Las mutaciones en un gen producen efectos variables: codones de terminación prematuros, corrimiento del marco abierto de lectura, procesamiento alternativo del ARN y cambios en la naturaleza química de más de uno de los aminoácidos. Las mutaciones provocan alteraciones estructurales en las proteínas que pueden conducir a la pérdida de su función.
En la ATRD autosómica dominante, uno de los padres padece y es el portador de la enfermedad. Los grupos de Michael Tanner de la Universidad de Bristol y de Fiona Karet del Instituto de Investigación Médica de Cambridge, Reino Unido, fueron los primeros en identificar mutaciones en el gen SLC4A1 en familias con ATRD autosómica dominante55,56. Las mutaciones de AE1 en la ATRD autosómica dominante son siempre heterocigotas. La pérdida de la función del AE1 en el eritrocito produce las enfermedades esferocitosis hereditaria y la ovalocitosis55.
La isoforma AE1 específica del riñón es más corta: no tiene los primeros 65 aminoácidos del NH2-terminal del AE1 del eritrocito. En consecuencia, en la ATRD autosómica dominante solo se afecta la función renal del paciente cuando las mutaciones en AE1 se localizan en el dominio transmembrana y en el carboxilo terminal (figura 2)23,25,32,57-59.
La ATRD autosómica dominante aparece en la infancia tardía o en la edad adulta.
LA ACIDOSIS TUBULAR RENAL DISTAL AUTOSÓMICA RECESIVA ES HETEROGÉNEA
En la ATRD autosómica recesiva, los padres no padecen la enfermedad; solo son portadores. Los síntomas se presentan desde los primeros meses de vida. La ATRD autosómica recesiva se asocia con mutaciones en alguno de los genes siguientes: SLC4A160, ATP6V0A4 y ATP6V1B110,54,61.
El grupo de Fiona Karet fue pionero en llevar a cabo los estudios de linaje en familias con ATRD autosómica recesiva9. Las familias que se analizaron fueron de origen turco y, en su mayoría, de matrimonios consanguíneos. La edad de los niños con ATRD autosómica recesiva que participaron en el estudio se mantuvo en un rango de 1 mes hasta 3 años; todos presentaron nefrocalcinosis e hipercalciuria, y más del 50 %, sordera neurosensorial. Hasta ahora se han encontrado cerca de 20 mutaciones en el gen ATP6V1B19,54,61,62. La mayoría de las mutaciones son homocigotas y excepcionalmente heterocigotas compuestas. Estos hallazgos revelaron además que la enzima H-K-ATPasa, presente en las células intercaladas alfa, no puede compensar la falta del funcionamiento de la V-ATPasa9.
Es interesante un caso de gemelos dicigotos con sordera en el que solo uno de ellos desarrolló ATRD autosómica recesiva63.
Hay ATRD en la que la sordera aparece a partir de la segunda década de la vida y está asociada con mutaciones en el gen ATP6V0A440,61,64. Hasta ahora se conocen más de 20 mutaciones en ATP6V0A4 (www.ensembl.org y www.hgmd.org).
Aproximadamente, el 20 % de los casos con ATRD no se asocia con mutaciones en ninguno de estos genes: hay pacientes con ATRD con sordera que no tienen mutaciones en el gen ATP6V1B1, y otros con audición normal que no presentan mutaciones en el gen ATP6V0A4. Estos hallazgos sugieren que otro de los transportadores o canales de las células intercaladas alfa (figura 1) estaría mutado. Por consiguiente, la ATRD recesiva es heterogénea porque puede producirse por mutaciones en más de un gen.
Se han encontrado mutaciones en los genes ATP6V1B1 y ATP6V0A4 en grupos de origen árabe10,61 e italiano65; y solo mutaciones en ATP6V1B1 en españoles54, griegos66, iraníes67 y serbios68.
Las mutaciones en el gen SLC4A1 que codifica el intercambiador de Cl-/HCO3- AE1 también producen ATRD autosómica recesiva. Hasta ahora se conocen 11 mutaciones del gen SLC4A1 que producen ATRD, además de ovalocitosis o esferocitosis13 (figura 3). Las mutaciones en AE1 se han encontrado en su mayoría en la población de origen asiático. Los casos de ATRD en Asia son un ejemplo de la selección natural debido a que estos son resistentes a la malaria.
En conclusión, los estudios genéticos han contribuido a la identificación de tres de los genes afectados en la ATRD. El estudio genético de nuevos marcadores moleculares, como son los transportadores Slc26a7 y KCC4 o los canales Rhcg y HCN2 en los pacientes con ATRD, constituye un reto en la identificación de nuevos blancos moleculares que ayuden a la comprensión de esta enfermedad y, en consecuencia, de la homeostasis ácido-base en el riñón.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Laura Escobar recibe bolsas de viaje y financiación de la Dirección General de Asuntos del Personal Académico (DGAPA) de la Universidad Nacional Autónoma de México y de la Fundación Carolina.
Figura 1. Modelo de una célula intercalada alfa secretora de ácido
Figura 2. Topología del intercambiador Cl-/HCO3- AE1 del eritrocito
Figura 3. Estructura y composición de la V-ATPasa de humano