Objetivo: Evaluar la determinación de Kt (KtOCM) por dialisancia iónica en los pacientes sometidos a terapia de reemplazo renal (TRR) por insuficiencia renal aguda (IRA) atendidos en una unidad de cuidados intensivos (UCI), comparándola con el Kt obtenido mediante el cálculo del índice de remoción de urea obtenido por recogida del dializado (Kturea). Materiales y métodos: Se incluyeron 18 pacientes adultos, con IRA oligúrica ingresados en la UCI, con requerimiento de TRR, tratados con hemodiálisis intermitente y/o diálisis extendida. Las TRR fueron realizadas con equipos Fresenius 4008E equipados con un monitor de aclaramiento «on-line» (OCM Fresenius). La determinación de KtOCM fue realizada automáticamente por el monitor. Se efectuaron la correlación y la comparación entre KtOCM y Kturea utilizando el análisis de correlación de Spearman y el test de la t, respectivamente. Resultados: Sobre 35 tratamientos efectuados, la media de KtOCM no fue estadísticamente diferente de la del Kturea (34,9 ± 10,69 frente a 32,78 ± 11,31; NS). Se obtuvo una importante correlación y una relación lineal significativa entre los dos métodos (r = 0,87; p <0,001; intervalo de confianza [IC] 95%, 0,76-0,94%). Conclusiones: La determinación del Kt por dialisancia iónica es un método simple para estimar la dosis de diálisis en pacientes críticos y es una herramienta útil para monitorizar y ajustar las TRR en tiempo real de acuerdo con una dosis objetivo.
Aim: To evaluate the Kt assessed through ionic dializance (KtOCM) in UCI patients undergoing renal replacement therapy for acute kidney injury, comparing the results with those obtained through the urea removal rate method determined by dialyzate collection (Kturea). Material and methods: 18 adult UCI staying individuals suffering from renal replacement therapy requiring oliguric acute kidney injury were included in this study. RRT consisted in intermitent or extended hemodialysis performed through a Fresenius 4008E dialysis machine equiped with an on-line clearance monitor (OCM Fresenius). The KtOCM results were provided automatically. The Spearman correlation test was used to assess the relationship between the two exploratory methods and the Student´s t test to compare the results obtained by the KtOCM and the Kturea. Results: 35 treatments were analyzed. There were not statistically significant differences between the results form the KtOCM and the Kturea (34.9 ± 10.69 vs 32.78 ± 11.31, p = NS). A remarkable association was find between both methods (r = 0.87; 95CI, 0.76-0.94; p <0.001). Conclusions: The assessment of Kt through ionic dialyzance is a simple method to estimate the dose of dialysis in critically ill patients and is and useful tool to monitor and adjust the RRT in real time according to a target dose.
INTRODUCCIÓN La dosis óptima de terapia de reemplazo (TRR) en pacientes con insuficiencia renal aguda (IRA) ingresados en la unidad de cuidados intensivos (UCI) aún no ha sido establecida1-3. En la práctica clínica habitual, a diferencia de los pacientes con insuficiencia renal crónica terminal, la dosis obtenida no se controla y, en general, no logramos la dosis prescrita4,5. La fórmula de Kt/V empleada sistemáticamente en pacientes con enfermedad renal crónica (ERC) presenta limitaciones para su aplicación en pacientes críticos, dado que éstos tienen un volumen de distribución de urea variable y no predecible6. La determinación del porcentaje de reducción de urea (PRU), si bien es simple, se calcula de forma retrospectiva y no permite monitorizar durante el tratamiento el objetivo alcanzado de la dosis prescrita7. El cálculo de la dosis de diálisis mediante la cuantificación directa del líquido de diálisis constituiría la técnica más fiable para aplicar en la IRA en comparación con otros métodos8. La medición del Kt, que evita el uso del volumen de distribución de urea9, puede obtenerse por cuantificación de la concentración de urea en el líquido de diálisis, pero requiere la recogida del líquido de diálisis, lo que resulta difícil de llevar a cabo en la práctica diaria. La determinación del Kt por dialisancia iónica provee una cuantificación directa de la dosis de diálisis sin el uso de muestras de sangre o recogida del líquido de diálisis para la determinación de urea, y se ha aplicado con éxito en pacientes con ERC10. Nuestro objetivo ha sido, pues, evaluar la determinación de Kt por dialisancia iónica en los pacientes con IRA ingresados en la UCI, comparándola con el Kt obtenido mediante el cálculo del índice de depuración de urea obtenido por recogida del líquido de diálisis.
MATERIALES Y MÉTODOS
Estudio prospectivo en el que se incluyeron pacientes adultos, con IRA oligúrica, internados en la UCI, con requerimiento de TRR, tratados con hemodiálisis intermitente y/o con hemodiálisis extendida. Se registraron las características basales de los pacientes, incluyendo la gravedad de la IRA, utilizando el índice de gravedad individualizada11.
El tipo y la duración de la diálisis no se modificaron para la realización del estudio, y se hicieron de acuerdo con la indicación del médico responsable del tratamiento. Los pacientes fueron dializados con monitores Fresenius 4008 S equipados con los biosensores OCM (on-line clearance monitoring, Fresenius Medical Care AG), dispositivo que mide de forma no invasiva, utilizando dos sondas de conductividad, la dialisancia iónica efectiva. El agua tratada para hemodiálisis fue provista por ósmosis inversa portátil (Apema S.R.L.®). Los flujos de baño de diálisis para la hemodiálisis intermitente y para la diálisis extendida fueron de 500 y de 300 ml/min, respectivamente. Se empleó bicarbonato estéril en polvo. En todas las TRR se utilizaron filtros de helixona de 1,4 m2. Como accesos vasculares se usaron catéteres venosos centrales no tunelizados de 11,5 Fr, colocados por técnica de Seldinger en las venas femoral o yugular interna, de 19 o 16 cm de longitud, respectivamente. De no existir contraindicación, los pacientes fueron sometidos a anticoagulación con heparina sódica en infusión continua con una dosis de carga de 1.000 U y una dosis de mantenimiento de 500 U/h. En cada sesión de diálisis se tomaron muestras de sangre para la determinación de urea sérica (Up) y proteínas totales al inicio y al final del tratamiento (según la técnica slow-stop flow), para calcular el promedio de la concentración de urea en el componente acuoso de la sangre (Upmedia)12.
Upmedia = (Upinicio-Upfinal)/ln(Upinicio/Upfinal)
siendo Upinicio y Upfinal la concentración de urea en el componente acuoso de la sangre al inicio y al final del tratamiento.
La recogida del baño del líquido de diálisis se obtuvo con el método de recogida parcial del líquido de diálisis13. Se midieron los niveles de urea (Ud) y el volumen (Vd) del líquido de diálisis.
Para el cálculo del Kt mediante el índice de depuración de urea obtenido por recogida del líquido de diálisis (Kturea), empelamos la siguiente fórmula:
Kturea = (Vd Ud)/Upmedia
siendo Vd = volumen del líquido de diálisis; Ud = urea del líquido de diálisis, y Upmedia = concentración promedio de urea en el componente acuoso de la sangre. La determinación del Kt por OCM (KtOCM) fue realizada automáticamente por el monitor al final de la diálisis.
Los datos utilizados para el análisis estadístico se expresan como media ± desviación estándar (DE). Se efectuaron la correlación y la comparación entre KtOCM y Kturea utilizando el análisis de correlación de Spearman y el test de la t, respectivamente.
RESULTADOS
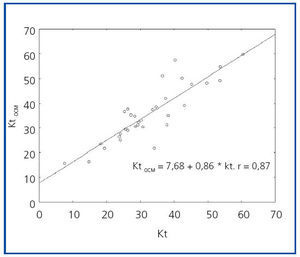
Se incluyeron 18 pacientes que recibieron 35 tratamientos. Los pacientes tenían 69 ± 16 años de edad, y 14 eran hombres. La etiología más frecuente de IRA fue el shock séptico, seguida por la posquirúrgica asociada con cirugía cardiovascular. Los pacientes tenían una gravedad medida por ISI score de 0,67 ± 0,38; 13 precisaban asistencia respiratoria mecánica y 12 estaban recibiendo inotrópicos en el momento de la consulta. Del total de los tratamientos realizados, 24 fueron hemodiálisis intermitentes y 11 fueron hemodiálisis extendidas. Las hemodiálisis extendidas tuvieron una duración promedio de 428 ± 36 minutos (rango, 390-480 minutos). Las características de los pacientes y de los tratamientos se presentan en la tabla 1.
La media de dosis de diálisis (Kt) medida por dialisancia iónica (KtOCM) no fue estadísticamente diferente de la obtenida del líquido de diálisis (Kturea) (KtOCM frente a Kturea, 34,9 ± 10,69 frente a 32,78 ± 11,31 l [NS]).
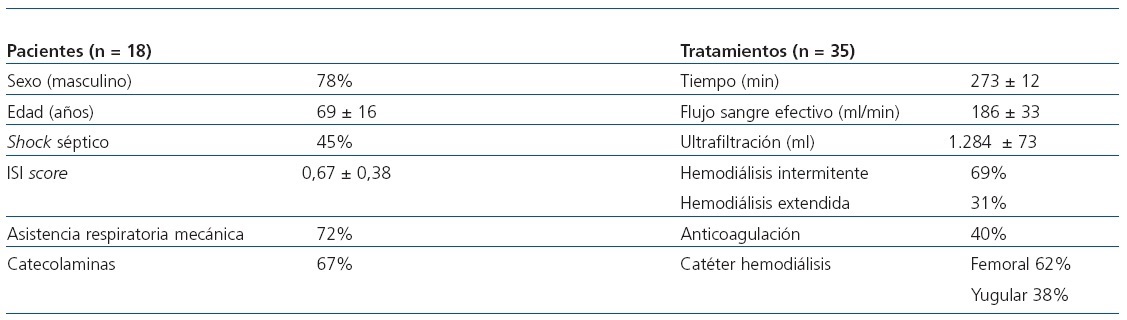
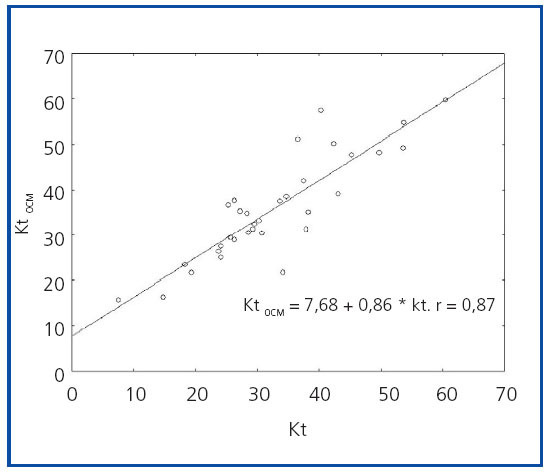
Se obtuvo una importante correlación y una relación lineal significativa entre los dos métodos (r = 0,87; p <0,001; intervalo de confianza [IC] 95%, 0,76-0,94%) (figura 1).
DISCUSIÓN Y CONCLUSIONES
La IRA grave se presenta entre el 5-15% de los pacientes internados en la UCI, de acuerdo con la población de riesgo estudiada y la definición de IRA utilizada14. La mortalidad asociada con la IRA en pacientes críticos ingresados en la UCI se encuentra comprendida entre el 30 y el 60%, según las series14. Aunque han pasado más de 60 años desde la realización de la primera hemodiálisis con éxito en pacientes con IRA, algunos aspectos de importancia del reemplazo renal continúan siendo objeto de controversia, como cuándo iniciar la TRR y cuál es la dosis apropiada1.
Tanto en pacientes con ERC como en pacientes con IRA, las TRR se cuantifican en su mayor parte en términos de la cinética de la urea, que sirve como sustituta de otros solutos de bajo peso molecular. En pacientes con ERC, el PRU y el Kt/V de urea son los índices empleados con mayor frecuencia. El modelo cinético de la urea asume una estabilidad caracterizada por un balance de nitrógeno neutral y valores de urea prediálisis similares en cada ciclo del tratamiento (hemodiálisis). Sin embargo, esto no es válido para los pacientes con IRA, dado que la mayoría de los pacientes críticos son hipercatabólicos y se encuentran con balance nitrogenado negativo15. Las alteraciones del flujo sanguíneo regional, en especial cuando los pacientes están hemodinámicamente inestables y con requerimiento de fármacos vasoactivos, pueden producir un desequilibrio en la distribución de la urea intercompartimental, lo que invalidaría los modelos normales unicompartimentales de urea15. Este desequilibrio sería menor en el caso de los pacientes tratados con diálisis extendida16, por lo que el cálculo de la diálisis obtenido por el modelo cinético de la urea no podría utilizarse para comparar las dosis entre terapias intermitentes y extendidas. Por otro lado, el volumen de distribución de urea en los pacientes con IRA se encuentra alterado, y varía ampliamente (entre un 7 y un 50%) si se compara con el hallado en pacientes con ERC7. La medición de la cantidad de urea removida durante la diálisis basada en la cuantificación o índice de depuración de solutos (de urea) ha demostrado tener una buena correlación con el Kt/V en pacientes con ERC. Por el contrario, en los pacientes con IRA se evidencian diferencias en el balance de masa cuando se compara la dosis de diálisis calculada mediante la cuantificación del líquido de diálisis con la obtenida por medición en la sangre, mostrando que esta última (medición en sangre) sobrestima la cantidad de soluto (urea) removida18. Es por ello que las mediciones obtenidas por medición directa de depuración del soluto (cuantificación en el líquido de diálisis) constituyen la modalidad indicada en pacientes críticos con IRA, aunque esto resulta de difícil aplicación en la práctica clínica9,18.
Se ha propuesto el uso del Kt en pacientes con ERC, y ha demostrado tener una excelente correlación con la mortalidad de dichos pacientes9, y su determinación mediante el empleo de la dialisancia iónica se ha realizado con éxito en dicha población10.
El uso del Kt obtenido por dialisancia iónica no requiere del uso del volumen de distribución para su cálculo, no se ve influido por el desequilibrio de urea, no necesita extracción alguna de sangre del paciente, y se calcula por la medición directa de depuración del soluto en el líquido de diálisis, por lo que constituiría una alternativa para la determinación de la dosis de diálisis en pacientes con IRA ingresados en la UCI. Permitiría, además, poder comparar la dosis obtenida entre la hemodiálisis intermitente y la diálisis extendida.
En nuestro trabajo, la evaluación del Kt por dialisancia iónica se hizo a través de la comparación con el método de referencia para la evaluación de la dosis de diálisis en pacientes con IRA, demostrando una óptima correlación y sin diferencias significativas de los valores obtenidos entre ambos métodos. Una única experiencia previa en IRA referida en la bibliografía se realizó con otro módulo distinto al que utilizamos y este estudio sólo se limitó a la hemodiálisis intermitente18. En nuestra experiencia se incluyeron, además, las diálisis extendidas, demostrando también la posibilidad de utilizarlas en este tipo de TRR. Sería de utilidad comparar en estudios posteriores la influencia de los diversos monitores de dialisancia iónica para la determinación del Kt, como se ha hecho para los pacientes con ERC19.
Nuestro estudio no incluyó como objetivo la evaluación de la diferencia de la dosis obtenida con respecto a la prescrita, aunque evidenciamos un bajo valor de Kt en nuestros resultados obtenidos con respecto a los que se toman como referencia en pacientes con ERC9,10; ya se sabe que en pacientes con IRA las dosis obtenidas son inferiores a las prescritas, y que habitualmente éstas no se monitorizan4,5. Entre otros factores es conocido que el uso de catéteres exige aumentar el tiempo de diálisis en pacientes con ERC para lograr el objetivo de Kt20; esto sería de mayor magnitud en el caso de la IRA, en la que todos los pacientes emplean catéteres no tunelizados de flujo limitado.
A la luz de las publicaciones recientes1-3, los expertos aconsejan utilizar una dosis mínima objetivo de diálisis, acompañada del uso de herramientas de control de calidad1. El uso del Kt por dialisancia iónica podría incluirse entre dichas herramientas, permitiendo el control local de cada UCI, como posibilidad de obtener de forma simple un valor objetivo en el momento de comparar la dosis entre diversos tratamientos o diferentes UCI. En conclusión, consideramos que la determinación del Kt por dialisancia iónica es un método simple para estimar la dosis de diálisis en pacientes críticos, y es una herramienta útil para monitorizar y ajustar las TRR en tiempo real de acuerdo con una dosis objetivo.
Tabla 1. Características de los pacientes y de las terapias de reemplazo renal
Figura 1. Correlación entre el Kt obtenido por dialisancia iónica (KtOCM) y el Kt obtenido por recogida del líquido de diálisis.