INTRODUCCIÓN
La sostenibilidad de nuestro Sistema Sanitario es un tema cada vez más debatido, y no solo por la actual crisis económica. Los nefrólogos hemos sido desde hace tiempo sensibles a este problema (1, 2), que ha motivado un Suplemento Extraordinario de Nefrología en el 2010, además de otros artículos más recientes (3-5)
La tabla 1 da una idea de la magnitud del problema. Comparativamente, el coste anual por paciente sometido a Terapia Sustitutiva Renal (TSR) con diálisis es muy superior al de muchas otras enfermedades crónicas, y su impacto en el presupuesto del sistema nacional de salud es muy alto. Tan solo 46.000 pacientes, el 0,1% de la población, consumen el 2,5% del presupuesto sanitario.
Conseguir dicha sostenibilidad es un tema prioritario que debería ocupar a los responsables de los servicios de nefrología, a las sociedades científicas, a los gestores sanitarios públicos y privados, a la Administración y, desde luego, a los pacientes.
Pero hay detalles que no se quieren ver. Es cierto que en España somos referencia en Trasplante Renal, pero esta es una terapia que no se aplica al 80% de los pacientes, cada vez más ancianos, que inician diálisis. Aunque mucho menos mediática, la terapia más eficiente de la Enfermedad Renal Crónica es la prevención secundaria que evite o reduzca la llegada de pacientes a diálisis o trasplante. No vamos tampoco a discutir que el trasplante renal es la terapia sustitutiva más eficiente. Pero limitándonos a la diálisis, o sea a la terapia de elección para el 80% de los incidentes en TSR, deberíamos intentar aclarar ciertos errores sobre costes y efectividades.
EFECTIVIDAD DEL TSR
Al margen del trasplante renal, la mayoría de los registros de todo el mundo muestran que la Hemodiálisis (HD) y la Diálisis Peritoneal (DP) domiciliaria ofrecen resultados de supervivencia muy similares a largo plazo, aunque la DP presenta mejores resultados que la HD durante los primeros años de tratamiento (6,7), seguramente relacionados con el mejor mantenimiento de la función renal residual que ofrece la DP.
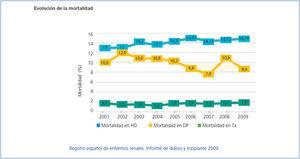
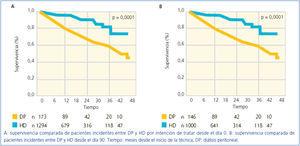
Algo similar podemos observar en nuestro país. En la Figura 1, obtenida del último registro nacional, se muestra la evolución de la mortalidad y que consistentemente, año tras año, indica la mejor supervivencia del trasplante frente a las modalidades de diálisis. Pero también se puede apreciar que la DP domiciliaria supera siempre en supervivencia a la HD. En un tratamiento sustitutivo vital, sólo la supervivencia ajustada por calidad de vida es un indicador definitivo. Puede argumentarse que los datos del registro nacional no están ajustados. Pero recientemente, esta misma revista publicaba datos del Registro de las Islas Canarias con todos los pacientes incidentes entre 2006 y 2009. (Figura 2 – ref 7). Puede comprobarse que los pacientes en DP tienen mayor supervivencia, no solo al inicio del tratamiento, sino mantenida a los 46 meses de seguimiento. Y esta situación se mantiene en todos los subgrupos analizados, mayores y menores de 65 años, hombres y mujeres, diabéticos o no.
CALIDAD DE VIDA EN DIÁLISIS
La Calidad de Vida percibida por el paciente suele ser mejor en DP, incluso en los ancianos (8,9). También es mejor en HD domiciliaria, en ambos casos con una estrecha relación con un sesgo de selección de pacientes (10). En el estudio de NECOSAD (11) los Coeficientes de Calidad de Vida eran 59.1 y 54.0, limitándose a la calidad estrictamente relacionada con la salud (no la adaptación social, familiar o laboral, que son mejores en terapias domiciliarias).
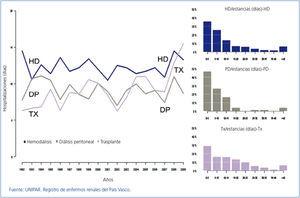
Uno de los factores más importantes en el ajuste por calidad de vida son los ingresos y estancias hospitalarias. Durante estos días el coeficiente de ajuste por calidad de los años de vida ganados es nulo. Y la DP domiciliaria tiene unos 3 días menos por paciente y año de estancias hospitalarias (Figura 3).
CÁLCULO DE COSTES EN DIÁLISIS
Dejando de nuevo a un lado el trasplante renal, modalidad de Tratamiento Sustitutivo Renal (TSR) que debe ser utilizada siempre que existan órganos y que las características del paciente lo permitan, es un hecho demostrado en múltiples publicaciones realizadas tanto en España como en el resto del mundo, que la Diálisis Peritoneal domiciliaria es la alternativa de diálisis que mejor contribuye a la sostenibilidad de dicho tratamiento (5, 12, 13).
Los análisis de costes suelen tener muchos problemas metodológicos, que se resumen en un editorial reciente (14). El primer punto a tener en cuenta es que al evaluar los diferentes costes del tratamiento con diálisis, cuando se conocen, hay que incluirlos todos. En un tratamiento sustitutivo vital, cuya alternativa es la muerte (y por tanto el coste sanitario = 0), casi la totalidad de los costes sanitarios el enfermo se podrían atribuir a la diálisis que es “la responsable” de la supervivencia del paciente y por tanto de los costes de su comorbilidad. Sin ser tan puristas, no debemos olvidar de incluir los costes de realización del acceso (también de los accesos no programados, los temporales, y sus ingresos derivados), las amortizaciones, los consumos, los gastos generales aplicables de los servicios de nefrología, los mantenimientos de los aparatajes, los servicios externos, los fármacos intrahospitalarios y extrahospitalarios, los costes derivados de complicaciones (al menos las directamente derivadas de la TSR o de la Insuficiencia Renal), los transportes, los entrenamientos, los costes indirectos derivados de la mortalidad y morbilidad de los pacientes, en especial los ingresos y estancias hospitalarios ordinarios y en unidades de cuidados intermedios e intensivos, y los costes del tratamiento de diálisis en sí (de las sesiones).
Sin embargo, en ocasiones, cuando se presentan los costes relacionados con la diálisis se incurre en simplificaciones que pueden confundir. Utilizaremos algunos ejemplos para aclarar aspectos que son importantes:
En efecto, con alguna frecuencia se ve incluir unos datos sobre costes medios de la diálisis de forma incompleta y sesgada (en interés de la fuente) comparando la DPCA y las DPAs con todos sus complementos, frente a la HD concertada sin ninguno de ellos (HDF-on-line, frecuencias superiores a 3 sesiones por semana, etc). No se valora el soporte de guardia o reserva de puestos del hospital de referencia, los accesos, entrenamientos, ingresos, medicación, etc.
Es frecuente que se asuma que todos los pacientes en DP, tanto en DPCA como en DPA, utilizan suplemento por uso de soluciones de bicarbonato y de icodextrina. En realidad, un gran número de pacientes no utilizan estos suplementos. Por ejemplo, la icodextrina no está disponible en la oferta de dos de las tres firmas de la industria que realizan estos servicios. Esta desviación estaría aumentando erróneamente la estimación del costo anual de todas modalidades de diálisis peritoneal domiciliaria entre 2.000 y 3.000 euros. Del mismo modo se asume que todos los pacientes de DPA utilizan una tarifa de DPA de alto volumen, cuando es exactamente al contrario.
En España, la mayoría de los pacientes que inician Tratamiento Sustitutivo Renal con DP lo hacen con DPCA, que tiene la tarifa más económica. Por preferencia de estilo de vida o por necesidades sociales (por ejemplo para continuar con su actividad laboral o escolar), hay pacientes que inician su tratamiento con DPA. Cuando esto sucede, la práctica totalidad lo hacen utilizando una tarifa de DPA mucho más económica, la DPA de bajo volumen. Esta tarifa anual es inferior, en más de 4.000 euros, a la mostrada en una editorial reciente (3).
Sin embargo, cuando en el mismo trabajo se presenta la HD, se considera que el coste de transporte para todos los pacientes en HD es de 10 euros por sesión, 5 euros por la ida y 5 por el regreso. Es obvio que, aunque haya pacientes en los que su desplazamiento pueda ser realizado por ese precio, este no es el caso general y muchos pacientes tienen que gestionarse por un costo claramente superior. En otro estudio reciente (15) se recogen costes muy superiores. Calculan un coste medio de transporte que supone el 8,1% del total (2.700 euros paciente año), siendo del 9,7% (3.200 euros paciente año) en los centros concertados, el doble de lo indicado por “la Industria” (3).
Teniendo en cuenta las diferencias entre CCAA, tanto en dispersión geográfica como en tarifas de conciertos y sistemas de transporte sanitario, creemos incluso que estos últimos costes están infravalorados.
Aún hay Comunidades en las que se sigue aplicando el suplemento por bicarbonato en HD, que tiene tarifas entre 8 y 15 euros por sesión, lo que supone entre 1.248 y 2.340 euros por paciente y año. En algunas se aplican suplementos por la utilización de membranas biocompatibles o de alto flujo, con tarifas entre 6 y 23 euros por sesión, entre 936 y 3.588 euros paciente año.
La Hemodiafiltración en línea (HDF-on-line) supone en algunas CCAA, una tarifa suplementaria entre 25 y 33 euros por sesión. Este coste supone un 20% adicional para cada sesión de HD, entre 3.900 y 5.148 euros por paciente y año.
Muchos estudios de costes consideran que todos los pacientes en HD se dializan tres veces por semana, cuando no es así. Según el último registro de la SEN, aunque incompleto, se puede estimar que habría 687 pacientes dializándose 4 veces por semana, 138 dializándose 5 veces por semana y unos 200 haciendo 6 sesiones. Casi 1.000 pacientes en total. Cada sesión adicional aumenta los costes de esos pacientes en un 30%, 7.120 euros / paciente / año.
OTRAS IMPRECISIONES Y ESTIMACIONES INCORRECTAS EN LOS CÁLCULOS DE COSTES
En la comparación HD-DP, se incurre a menudo en el error de no incluir el coste de la HD pública, dato absolutamente necesario. La provisión de HD concertada se apoya enormemente en los recursos públicos, que son su soporte, sin el cual no podría realizarse.
No sólo los accesos vasculares, sino también problemas de todo tipo que los pacientes de HD pueden presentar tienen siempre a su disposición, 24 horas al día, 365 días al año, los recursos públicos, los médicos y enfermeras públicos, las camas públicas, etc. Todo ese arsenal clínico, las construcciones, los aparatajes, los otros especialistas están a disposición de los pacientes de HD concertada y, por tanto, también hay que repercutirles parte de esos costes en los cálculos. Se podría contraargumentar que también habría que repercutir este tipo de costes de infraestructura a las técnicas domiciliarias, pero ya ha quedado expuesto más arriba que la utilización de estos recursos (por ejemplo, el principal componente del coste: los ingresos hospitalarios) es mucho menor en el caso de la DP.
Por este motivo, al calcular los costes de HD (y también los de DP) hay que promediar también los de la HD en hospitales públicos, ya que gracias a ellos se puede realizar la HD concertada. Si no hubiera hospitales públicos que tratan pacientes en HD y en DP, tampoco podría realizarse la HD concertada, ni la DP domiciliaria.
En el último estudio comparativo más completo realizado en nuestro país (13), se calcula que la HD es un 47% más costosa, como promedio, que la DP. Y también a este estudio le faltan algunos datos.
MÁS DATOS QUE AÑADIR A LA DIFERENCIA DE COSTES
Como se ha indicado más arriba, cuando se tienen en consideración todos los costes de la HD, en nuestro país, con el reparto público–privado actual, frente a la DP, con el reparto CAPD-DPA existente, el resultado es (como lo es en todo el mundo), favorable a la DP por más de 12.000 € por paciente y año.
El citado artículo (13) indica que esta diferencia aumenta todavía más, en 2.300 euros anuales, cuando se tiene en cuenta el coste del paciente incidente y los costes indirectos, hasta completar un ahorro anual de 14.300 euros por paciente y año, a favor de la DP domiciliaria. Esta diferencia en los costes indirectos es muy destacable ya que, como pronto podrá demostrar una encuesta realizada a pacientes en edad laboral y todavía no publicada por ALCER, indica que los pacientes en DPA trabajan en mucha mayor proporción que los de HD.
Los fármacos son un punto importante en los costes de los pacientes en diálisis. Habitualmente se consideran solo los de uso hospitalario, y entre ellos la EPO, cuyos costes se duplican en HD vs DP (2.382 vs 1.245 €/año), aunque los quelantes no cálcicos pueden suponer hasta 2.000 euros de diferencia sobre los cálcicos (16-18). Pero estos cálculos están publicados sólo en HD. No hemos encontrado referencias a los costes de quelantes del fosfato en DP, pero es bien sabido que el sevelamer apenas se usa en DP, donde se usan preferentemente los quelantes cálcicos y a baja dosis. Esto puede aportar una ventaja económica entre la DP y la HD de hasta 2.000 euros anuales, dependiendo del uso de quelantes no cálcicos en la unidad de HD evaluada. Los antihipertensivos, también menos usados en DP pueden suponer unos 500 euros adicionales.
Otro factor insuficientemente analizado es el de los costes de hospitalización. Según se observa en el registro del País Vasco, único que publica desde hace 15 años dicho dato en nuestro país, la DP domiciliaria tiene siempre, en todo el histórico recogido, menos días de ingreso por paciente y año que la HD (Figura 3). Y también, en los últimos años, menos días de ingreso que los pacientes trasplantados. Mientras que las estancias de pacientes en HD y DP se mantienen constantes, con una diferencia de 3 a 4 días entre ambas técnicas, los días de ingreso de los paciente trasplantados muestran una tendencia creciente, probablemente derivada del aumento de edad de este grupo.
Utilizando como media de coste por paciente y día de estancia en un Hospital Público, la cantidad de 600 euros, la DP domiciliaria ahorraría otros 1.800 euros anuales frente a la HD, dando un total aproximado de 18.000 euros de ahorro por paciente y año a favor de la DP domiciliaria.
LA DIÁLISIS PERITONEAL COMO UNA TERAPIA CON CADUCIDAD
Es un error que persistentemente se sigue escribiendo. Sin referencias, o al menos sin referencias recientes, se sigue afirmando que la DP solo dura dos años, refiriéndose a la pérdida de capacidad del peritoneo, a las infecciones peritoneales, al cansancio de paciente o cuidador, etc.
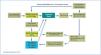
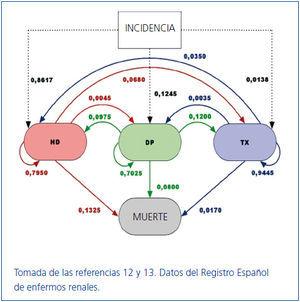
Sin embargo, al analizar las transiciones entre diferentes estados (o terapias) (Figura 4) en el modelo de Markov que usamos en el análisis de costes (con datos extraídos del Registro Español), podemos ver que la principal salida de DP es hacia el trasplante (por cierto, el doble que desde HD). Y si bien la tasa de paso de DP a HD es el doble que a la inversa, los pacientes que pasan de DP a HD presentan una buena supervivencia, al contrario de los que pasan de HD a DP (19, 20). La mortalidad es también inferior en DP.
La mediana del tiempo de supervivencia en la técnica de DP en España (datos internos de Baxter) es de 65 meses. A falta de ajustes por edad y comorbilidad, parece similar a la de HD. Las salidas de DP, exceptuando las que son hacia el Trasplante (que son buenas y deseables) tienen una conocida correlación con las infecciones peritoneales. Parece que en el año 2011 no deberíamos tener que recordar que la tasa de infecciones peritoneales en DP es inferior a 1 episodio cada 2 años por paciente, y que la mayoría de los pacientes no tienen ningún episodio en muchos años.
Los cansancios del cuidador, y otros problemas sociales no es que sean más frecuentes en los pacientes en DP que en los de HD, pero si que repercuten más o que “se perciben más” en pacientes en DP. Pero los sanitarios no nos fijamos en los perniciosos efectos de la HD en centro sobre la vida laboral de los pacientes jóvenes, que tras un período en HD, se trasplantan y continúan en el paro laboral que se derivó de la HD. En los cálculos de costes sociales no se tiene en cuenta la dificultad de encontrar empleo tras la curación. Es porque las metódicas de cálculo de costes se hicieron en países sin tanto paro laboral como el nuestro.
CENTRARSE EN EL PACIENTE Y NO EN EL TRATAMIENTO
En cualquier caso, esta frase que tantas veces hemos escuchado, “centrarse en el paciente”, es la que aporta más luz e indica mejor el camino a seguir. Hay que proveer a todos los pacientes, pero también a cada paciente, de modo individual, la mejor calidad de vida, con el mejor tratamiento, al menor coste y en cada momento de su evolución en un tratamiento que es crónico. Así ayudaremos, además, a la sostenibilidad del sistema.
Las consultas de prediálisis, con mínimos recursos (un médico y una enfermera a tiempo parcial y dos locales también a tiempo parcial) generan unos ahorros inmensos al SNS: disminución de la progresión de la IRC a estadios avanzados (21), posibilidad de Trasplante sin pasar por diálisis, de elección de una técnica de diálisis domiciliaria, etc. Y además mejoran la supervivencia si evitan que la diálisis se inicie de forma no programada.
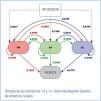
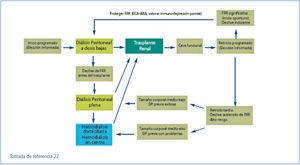
De modo que trasplantar cuanto antes a los pacientes que sean candidatos, tratando de incluirlos en lista de espera en la etapa previa a diálisis, en la consulta ERCA y utilizar modelos eficientes admitidos por la mayoría, como el que se resume en la Figura 5, que propone una estrategia ordenada de TSR para pacientes candidatos a trasplante renal (22), es la mejor manera de hacer bien las cosas.
La DP domiciliaria es una excelente modalidad de inicio de tratamiento para cualquier paciente que la elija, tiene claros beneficios para muchos, pero es especialmente recomendable para ese grupo de pacientes que tienen la oportunidad de optar al trasplante renal. Los mejores resultados del trasplante renal en los pacientes en DP también son un factor de eficiencia achacable a la modalidad de diálisis.
Hay evidencias recogidas en nuestro país (23-25) que apuntan a un exceso de despotismo en la prescripción de la TSR. Cuando se informa adecuadamente a los pacientes sobre sus opciones terapéuticas, la mitad escogen terapias domiciliarias. Sin embargo, la prescripción forzada de una terapia domiciliaria conlleva lógicamente malos resultados (26). Hay que planificar los tratamientos y hacerlos “realmente” complementarios, ofreciendo el mejor al mejor coste, en cada momento.
PLANIFICAR MEJOR
Las recientes aperturas simultáneas de hospitales con Unidades de HD a menudo sobredimensionadas son otro problema a considerar. La percepción de ineficiencia que se desprende de los “puestos vacíos” en HD motiva a los nefrólogos a completar esos puestos vacíos, precisamente para que el coste de la HD no se dispare. No se permite tener personal a medio rendimiento, atendiendo solo dos máquinas de HD, ni máquinas paradas (se ignora a menudo que la máquina y su mantenimiento son una fracción del coste inferior a la del transporte a HD).
Además, en el tratamiento de HD se realizan acciones que en otros campos de la Sanidad serían incomprensibles. Cuando se abren nuevas salas de HD, nuevos centros de tratamiento, se suele hacer de manera “masiva”. Es práctica común que las infraestructuras creadas para atender pacientes en HD desborden las necesidades reales en porcentajes increíbles. Y claro, para no disparar los costes, hay que llenar esa capacidad sobredimensionada, con más personal y más pacientes, perjudicando la posibilidad de que los pacientes tengan equidad en el acceso a las terapias domiciliarias.
Lo que ha sucedido, con el correr del tiempo, es que se han ido creando más centros y más grandes, porque la HD se beneficia mucho de las economías de escala. En la actualidad, en determinadas áreas, hay demasiados puestos de HD. Y es conocida la influencia que este número de puestos disponibles de HD tiene en el resultado final de proporción de uso de la DP domiciliaria.
En un editorial reciente (27), se resumían las causas estructurales que producen que haya una utilización de la HD muy superior e injustificada frente a la de la DP, siendo las más demostrativas por ser generalizadas en todo el mundo, la mucho mayor utilización de la DP en los países con provisión pública (Reino Unido, Canadá, Australia, Nueva Zelanda o los escandinavos) que en los de práctica privada con reembolso por tasa-servicio (Bélgica o Alemania) (28-30).
Otro factor en algunos países ha sido la expansión de los grandes proveedores de (hemo)diálisis (31). Por ejemplo, el descenso en la utilización de DP desde 1996 en EEUU del 14% al 8% de los pacientes dializados ha corrido parejo al cambio en la propiedad de las Unidades de diálisis (del 39% en 1996 al 63% a grandes proveedores en 2005) (28).
La HD domiciliaria ha sido también perjudicada por estos mismos planteamientos. No se ofrece esta posibilidad en muchos centros cuando se dispone de puestos vacíos y enfermeras que podrían enseñar la técnica a pacientes que deseen dializarse en casa.
DISCUSIÓN
No cuestionamos que el trasplante es más eficiente que la diálisis, a pesar de que sus costes reales están lejos de conocerse bien (sobre todo los derivados de sus ingresos hospitalarios). Sin embargo, aunque la realidad muestra una y otra vez que la supervivencia y los costes favorecen a la DP domiciliaria, y aunque este dato está demostrado en muchos estudios de muchos países, de cuando en cuando hay que volver a aclararlo, porque hábitos e intereses coinciden a menudo en negar las evidencias.
Esto ocurre seguramente por razones que tienen que ver con el desconocimiento de la modalidad de DP (32-35), que siempre ha estado en inferioridad frente a la HD, y también puede tener que ver con el carácter domiciliario e individualizado de una, la DP domiciliaria, frente a la apariencia “más tecnológica” de la HD (36).
No obstante, la sostenibilidad es un problema que no siempre ha preocupado. Incluso hace 10 años se argumentaba que una de las cualidades de la HD hospitalaria era que creaba más puestos de trabajo sanitarios (36). Aún estamos en proceso de aprendizaje, y la repetición forma parte de ese proceso. Hay que repetirlo una vez más. Aún así, en la situación actual, la DP domiciliaria, es más eficiente que la HD. Si sumamos los datos anteriormente expuestos, podríamos alcanzar diferencias de hasta 25.000 € a favor de la DP. Esto supondría más de 40.000 euros de diferencia por Año de Vida Ganado Ajustado por Calidad (AVAC). Son cifras que deben ser consideradas. Conceptos económicos como “límite que la Sociedad está dispuesta a pagar por un año de vida ganado” aún nos parecen muy duros de asumir. En el metaanálisis de Winkelmayer (37) se sugería un límite de 55.000 $/año de vida sin ajuste por calidad, cantidad que más de un tercio de nuestros pacientes rebasan.
¿Qué es lo que podemos hacer? Planificar, cerrar el círculo, volver al principio de este trabajo. Conseguir la sostenibilidad del TSR es un tema prioritario que debería ocupar a los responsables de los servicios de nefrología, a las sociedades científicas, a los gestores sanitarios públicos y privados, a la Administración y, desde luego, a los pacientes. La falta de información sobre las alternativas terapéuticas sigue siendo una queja de los pacientes y sus asociaciones. Pero no se puede informar adecuadamente sobre terapias que no se conocen en profundidad. Y volvemos al tema del desconocimiento de la DP, tanto por muchos nefrólogos como por nuestros gestores sanitarios, y como consecuencia, por los enfermos y la población general.
La reforma del aprendizaje de la DP por los MIR, el reciclaje del staff, la inclusión de la DP en nivel de igualdad en los Congresos de Nefrología, y muchas cosas más, las podemos hacer los nefrólogos. No adjudiquemos la totalidad de la culpa a nuestras Autoridades Sanitarias. Las diferencias regionales y el despegue de algunas CCAA en el último año nos indican que una parte importante del problema está en nosotros mismos.
CONCEPTOS CLAVE:
La diálisis es la terapia crónica más cara. 6 a 7 veces más que el tratamiento de un paciente con SIDA, 30 a 40 veces más que el de la EPOC.
Cada año de vida ganado ajustado por calidad supone un coste de más de 80.000 €.
La diálisis peritoneal supone un ahorro considerable respecto a la hemodiálisis (más de 25.000 €/año, más de 40.000 €/AVAC).
El menor uso de la DP se debe a factores estructurales y sociales, pero también a deficiencias formativas y falta de interés de los nefrólogos.
La sostenibilidad de nuestro sistema sanitario exige de nosotros una profunda reflexión sobre los costes y eficacias de nuestras prescripciones.
Tabla 1. Costes sanitarios de diferentes enfermedades crónicas, en España.
Figura 1. Mortalidad bruta en diferentes modalidades de TSR.
Figura 2. Supervivencia comparada HD y DP. Registro Canario de Enfermos Renales.
Figura 3. Días de estancia hospitalaria (por cualquier causa) en pacientes en TSR
Figura 4. Transiciones entre estados (terapias). Refs 12 y 13
Figura 5. Estrategia global de Tratamiento Sustitutivo Renal. Ref 22.