La sobrehidratación (SH) es frecuente, y a menudo persistente, en pacientes tratados con diálisis peritoneal (DP), y mantiene una asociación controvertida con el riesgo de infección peritoneal. El objetivo principal de este estudio fue desvelar una posible asociación entre la presencia de SH y el riesgo subsiguiente de infección peritoneal por gérmenes entéricos, en una población relativamente amplia de pacientes tratados con DP.
MétodoSegún diseño prospectivo, monitorizamos de manera sistemática la composición corporal de pacientes tratados con DP en nuestra unidad (2011-2016), buscando una posible correlación con el riesgo de peritonitis durante el seguimiento, con un interés particular en la asociación entre SH persistente (variable de estudio principal) y el riesgo de infección peritoneal por patógenos entéricos (variable resultado principal). Para el análisis tuvimos en cuenta variables demográficas, clínicas y de laboratorio con influencia potencial en el riesgo de infección peritoneal. Utilizamos técnicas de análisis multivariante para clarificar el efecto específico de diferentes parámetros de composición corporal sobre la variable resultado principal.
Resultados principalesIncluimos 139 pacientes, con seguimiento medio de 24 meses. Sesenta y tres pacientes sufrieron al menos una peritonitis, y 17 al menos una infección por gérmenes entéricos. El análisis univariante mostró una tendencia general a mayor riesgo de infección peritoneal entérica en pacientes sobrehidratados, que se hacía evidente cuando se usaba el cociente agua extracelular/agua intracelular (AEC/AIC) (p=0,007), el cociente SH/AEC (SH/AEG) (p=0,033), o el cociente AEC/agua corporal total (AEC/ACT) (p=0,004), pero no cuando se usaba la SH absoluta, como variable de estudio. El análisis multivariante confirmó estas asociaciones o tendencias (RR: 3,48; IC 95%: 1,03-14,59; p=0,046, tercil mayor versus menor para AEC/AIC, RR: 2,31; IC 95%: 0,98-6,56; p=0,061, tercil mayor versus menor para SH/AEC, y RR: 6,33; IC 95%: 1,37-19,37; p=0,011, tercil mayor versus menor para AEC/ACT). Por el contrario, no observamos asociación consistente entre SH y riesgo general de infección peritoneal.
ConclusiónLa SH persistente asocia un riesgo significativo de infección peritoneal por patógenos entéricos, en pacientes tratados con DP.
Overhydration (OH) complicates frequently the clinical course of Peritoneal Dialysis (PD) patients, and keeps a controversial association with the risk of peritoneal infection. The main objective of this study was to disclose an association between persistent OH and the risk of enteric peritonitis in a relatively large sample of patients undergoing PD.
MethodFollowing a prospective design, we monitorized systematically body composition of patients treated with PD in our unit (2011-2016), searching for a correlation with the ensuing risk of peritonitis, with an emphasis on the association between persistent OH (main study variable) and the risk of infection by enteric pathogens (main outcome). Essential demographic, clinical and laboratory variables with a potential influence on the risk of peritonitis were recorded. We used multivariate survival analysis to clarify the specific effect of different body composition parameters on the main outcome.
Main resultsWe included 139 patients for analysis (mean follow-up 24 months). Sixty-three patients suffered at least one peritonitis, and 17 had at least one diagnosis of enteric peritonitis. Univariate analysis disclosed a general trend to an increased risk of enteric peritonitis in overhydrated patients, as evidenced by associations of this outcome with mean extracellular water/intracellular water (ECW/ICW) (p=.007), OH/ECW (p=.033) and ECW/total body water (ECW/TBW) (p=.004) ratios, but not with absolute OH values. Multivariate analysis confirmed similar associations or trends (RR: 3.48, 95% CI: 1.03-14.59; p=.046, highest versus lowest tertile of ECW/ICW, RR: 2.31, 95% CI: 0.98-6.56; p=.061, highest versus lowest tertile of OH/ECW, and RR: 6.33, 95% CI: 1.37-19.37; p=.011, highest versus lowest tertile of ECW/TBW). On the contrary, no apparent association was detected between OH and the overall risk of peritoneal infection.
ConclusionPersistent overhydration portends a significant risk of peritoneal infection by enteric pathogens, among patients undergoing chronic PD.
La sobrecarga de volumen (SV) persistente o recurrente es muy frecuente en diálisis, afectando a pacientes incidentes y prevalentes, tanto tratados con hemodiálisis como con diálisis peritoneal (DP)1. Más de la mitad de los pacientes en DP crónica sufren algún grado de SV, a menudo desde el inicio mismo del tratamiento2–4. Se considera a esta complicación una fuente significativa de riesgo cardiovascular5–7 y, en general, de mal pronóstico para estos pacientes8–11.
El diagnóstico correcto y el tratamiento eficaz de la hipervolemia se han convertido en objetivos relevantes, dentro del manejo general del paciente con DP. Sin embargo, detectar y cuantificar la SV plantea importantes retos, en la práctica clínica diaria. El diagnóstico de la SV es relativamente fácil solo cuando esta es importante y asocia signos clínicos (ganancia ponderal rápida, edema periférico, hipertensión arterial progresiva, insuficiencia cardíaca izquierda). Sin embargo, un diagnóstico y manejo más precoces de esta complicación demandan instrumentos más precisos12. En los últimos años, la valoración de composición corporal mediante bioimpedancia multifrecuencia (BIA) ha conseguido una notable aceptación como método de evaluación de la composición corporal y el estado de hidratación, debido a su simplicidad, mínimos efectos secundarios y precisión razonable13,14. Los dispositivos BIA miden la resistencia y la reactancia corporal a corrientes eléctricas, y utilizan estas estimaciones para calcular los volúmenes de agua corporal total (ACT) y sus fracciones intracelular (AIC) y extracelular (AEC). Estos cálculos pueden ser utilizados para detectar y cuantificar la SV15. Una amplia mayoría de los estudios clínicos con estimación de volemia en pacientes con enfermedad renal terminal publicados en la última década se han basado en análisis de BIA1,2,4,8,16,17.
La infección peritoneal es una de las complicaciones más temidas de la DP, con efectos significativos sobre las tasas de mortalidad y fallo de la técnica18–21. La aplicación de diferentes medidas de prevención ha conseguido reducir de manera progresiva la incidencia general de esta complicación, a lo largo de las últimas décadas. Desafortunadamente, las citadas medidas han impactado de manera muy desigual en la incidencia de infecciones peritoneales de diferentes etiologías. En particular, las infecciones por microorganismos de origen entérico han mantenido una incidencia significativa22. El diseño de estrategias destinadas a reducir la incidencia de las peritonitis entéricas demanda un adecuado conocimiento de sus mecanismos patogénicos y factores precipitantes18. Resulta de especial interés la posibilidad de que un edema persistente de la pared intestinal pueda permitir la transmigración de toxinas y bacterias a través de la misma, con consecuencias sistémicas en diferentes contextos clínicos23. Esta idea ha alimentado la hipótesis de que la SV podría favorecer el desarrollo de peritonitis por gérmenes de origen entérico, en pacientes tratados con DP.
Presentamos los resultados de un estudio prospectivo, orientado a investigar la posible asociación entre la SV persistente (estimada mediante análisis seriados de composición corporal por BIA) y el riesgo de infección peritoneal en pacientes en DP, con un énfasis particular en el riesgo de infección por gérmenes de origen entérico.
Población y métodoDiseño generalSiguiendo un diseño prospectivo y observacional, monitorizamos el estado de volemia y la evolución clínica de los pacientes incidentes en DP en nuestro centro en el período 2011-16. Las variables de estudio fueron los parámetros esenciales de composición corporal obtenidos mediante análisis seriados realizados con BIA, con énfasis particular en los marcadores de SV (sobrehidratación [SH], estimada tanto en términos absolutos como en forma de cocientes o fracciones AEC/AIC, SH/AEC y AEC/ACT) (variables principales de estudio). La principal variable resultado fue la supervivencia al primer episodio de infección peritoneal por gérmenes entéricos.
El protocolo del estudio fue aprobado por el comité de ética de nuestro centro, y se obtuvo consentimiento informado oral de los participantes. El estudio se ajustó a los principios generales de la Declaración de Helsinki.
Población del estudioFueron considerados elegibles todos los pacientes mayores de 18 años incidentes en DP durante el período de reclutamiento. Excluimos del análisis aquéllos que no tuvieran, al menos, un estudio de composición corporal durante los primeros 3 meses de tratamiento con DP, así como los que no tuvieran un período de exposición mínimo de 3 meses en riesgo de infección peritoneal. Ningún paciente negó su consentimiento para participar en el estudio.
Variables del estudioLos estudios de composición corporal se llevaron a cabo con ayuda de un dispositivo de BIA disponible comercialmente (BCM, Fresenius, RFA), basalmente y cada 3 meses, hasta el final del primer año. No se tuvieron en cuenta las estimaciones realizadas en condiciones de inestabilidad (por ejemplo, durante eventos cardiovasculares). Registramos para el estudio los siguientes parámetros: índice de masa magra (IMM) (masa magra/talla2), índice de masa grasa (IMG) (masa grasa/talla2) y SH, definida por la diferencia entre el AEC esperada en condiciones fisiológicas normales y la estimada por BIA (SH absoluta) y mediante los cocientes AEC/AIC, SH/AEC y AEC/ACT (SH relativa). Para los análisis se utilizaron los valores medios de las estimaciones obtenidas a lo largo del primer año en DP, o de todas las estimaciones disponibles, en el caso de pacientes con menos de un año de seguimiento.
Las variables de resultado fueron la supervivencia al primer episodio de peritonitis entérica (principal) o de peritonitis de cualquier etiología (secundaria). Se definió la infección peritoneal de acuerdo a criterios de la Sociedad Internacional de Diálisis Peritoneal24. Se definieron como peritonitis entéricas todas aquéllas con al menos un aislamiento de Enterobacteriaceae y/o Enterococcus spp y/o anaerobios intestinales, tanto en contexto mono- como polimicrobiano.
Se registraron las principales variables clínicas y demográficas con asociación potencial a los resultados clínicos, incluyendo el riesgo de infección peritoneal (tabla 1).
Población del estudio. Principales variables demográficas y de laboratorio al inicio de DP
| N.° | 139 |
|---|---|
| Edad; años | 61,1±14,4 |
| Sexo (varones/mujeres); % | 93/46 (66,9/33,1) |
| Modalidad de DP (DPCA/automática); % | 118/21 (84,9/15,1) |
| Diabetes; % | 58 (41,8) |
| Comorbilidades; n.° | 1,39±1,51 |
| Inmunosupresión previa; % | 20 (14,4) |
| Filtrado glomerular (aclaramiento renal medio); ml/min | 8,6±4,0 |
| D/P240’ creatinina, PEP basal | 0,71±0,09 |
| Ultrafiltración a los 240’, PEP basal; ml | 525±270 |
| Índice de masa corporal; kg/m2 | 27,4±4,2 |
| Hemoglobina; g/dl | 10,9±1,3 |
| Albúmina plasmática; g/l | 37,5±5,7 |
| Proteína C reactiva; mg/dl | 0,42 (0,01-15,86) |
| Seguimiento; meses | 24,0±17,2 |
DP: diálisis peritoneal; PEP: prueba de equilibrio peritoneal.
Las cifras expresan medias±desviación estándar para variables numéricas (excepto la proteína C reactiva, presentada como mediana con amplitud), y n (%) para variables categóricas.
Las variables de estudio fueron categorizadas por terciles, para su mejor comprensión en términos clínicos. Las comparaciones univariantes básicas fueron realizadas utilizando las pruebas de la t de Student, ANOVA, distribución χ2 y coeficiente de correlación de Spearman. Los análisis univariantes de supervivencia se llevaron a cabo mediante el método de Kaplan-Meier (prueba log-rank). El análisis multivariante se llevó a cabo mediante modelos de Cox por pasos, controlando para otras variables demográficas, clínicas o de laboratorio con impacto reconocido en las variables resultado (edad, presencia de diabetes, filtrado glomerular, albúmina, proteína C reactiva), independientemente de que se observara asociación significativa en nuestra población. Se utilizó el software SPSS® v.19.0 para el análisis de datos.
ResultadosVisión generalSe incluyeron 139 pacientes en el análisis final. Las características de la población del estudio al inicio de DP se presentan en la tabla 1. Las enfermedades renales más frecuentes fueron la nefropatía diabética (n=45) y las nefropatías glomerulares crónicas (n=20). De acuerdo al protocolo de estudio, todos los pacientes disponían de al menos un análisis de composición corporal, el 87,1% tenían al menos 2 análisis, el 67,4% al menos 3 análisis y el 57,6% 4 análisis, durante el primer año en DP. Cuarenta pacientes (28,8%) no alcanzaron un año de seguimiento, siendo causas más esporádicas para no disponibilidad de 4 valores de composición corporal las inconsistencias en los valores obtenidos, las vulneraciones de protocolo y la inestabilidad clínica en el momento de la estimación programada. Los parámetros de composición corporal se presentan en la tabla 2.
Estudios de composición corporal
| Basal | Media de primer año | |
|---|---|---|
| Peso corporal; kg | 74,7±12,9 | 75,6±13,1 |
| SH; l | 1,17±1,79 (−2,6/8,5) | 1,12±1,56 (−2,7/5,4) |
| Agua extracelular; l | 16,8±3,1 | 16,9±3,0 |
| Agua intracelular; l | 18,2±3,9 | 18,3±3,8 |
| Cociente AEC/AIC | 0,94±0,14 | 0,94±0,13 |
| Cociente SH/AEC | 0,07±0,12 | 0,07±0,16 |
| Cociente AEC/ACT | 0,48±0,04 | 0,48±0,04 |
| Índice de masa grasa; kg/m2 | 10,0±3,8 | 10,3±3,6 |
| Índice de masa magra; kg/m2 | 13,1±3,0 | 13,1±2,8 |
ACT: agua corporal total; AEC: agua extracelular; AIC: agua intracelular; SH: sobrehidratación.
Las cifras expresan medias±desviación standard (amplitud). «Basal» se refiere al primer análisis BIA realizado tras el inicio de DP. «Media» indica la media de las estimaciones durante el primer año (o hasta final de seguimiento si éste fuera inferior a un año).
Las estimaciones seriadas de composición corporal se mostraron bastante coherentes en lo relativo a los IMM (siempre r>0,85; p<0,0005, Spearman), IMG (siempre r>0,75; p<0,0005) y, en menor grado, SH (r=0,57 primera versus segunda, r=0,44 primera versus tercera, p<0,0005), y AEC/AIC (r=0,63 primera versus segunda, r=0,66 primera versus tercera, p<0,0005), SH/AEC (r=0,65 primera versus segunda, r=0,58 primera versus tercera, p<0,0005) y AEC/ACT (r=0,63 primera versus segunda, r=0,61 primera versus tercera, p<0,0005).
Sesenta y tres pacientes (45,3%) sufrieron al menos un episodio de infección peritoneal, una media de 15,2±13,5 meses tras el inicio de DP, para un total de 134 episodios. Los principales agentes etiológicos fueron los gérmenes grampositivos (n=79), incluyendo 51 episodios por Streptococcus spp. También se produjeron 15 episodios de infección por gérmenes gramnegativos entéricos y no entéricos, y 21 infecciones polimicrobianas mientras que, en 13 casos, los estudios bacteriológicos fueron negativos. Diecisiete pacientes (12,2%) experimentaron al menos una infección mono- o polimicrobiana con aislamiento de microorganismos entéricos, para un total de 25 episodios (incidencia acumulada de un episodio cada 133,4 pacientes/meses). Al final del seguimiento, 9 pacientes habían fallecido, y 3 habían sido transferidos a hemodiálisis debido a peritonitis grave o recurrente.
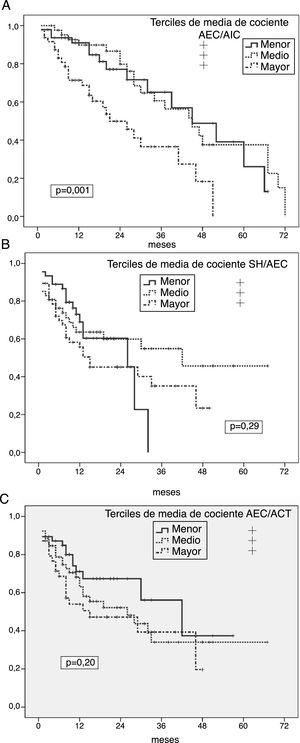
Predictores univariantes de infección peritonealRiesgo general de peritonitisLos análisis de Kaplan-Meier mostraron un riesgo incrementado de peritonitis en los terciles más altos de cociente AIC/AEC (p=0,001) (fig. 1A), y significativamente más bajo en el tercil menor de IMG (p=0,024), mientras que SH absoluta, SH/AEC (fig. 1B), AEC/ACT (fig. 1C) o IMM no mostraron correlación con esta variable resultado. Sin embargo, los pacientes que presentaron al menos un episodio de peritonitis mostraron mayores grados de SH absoluta (1,46±1,64 versus 0,92±1,87l; p=0,059), cociente AEC/AIC (0,98±0,13 versus 0,90±0,13; p=0,002) y cociente AEC/ACT (0,49±0,03 versus 0,47±0,03, p=0,004) (p=0,088 para SH/AEC) al inicio de DP que los que no presentaron esta complicación.
A) Probabilidad de infección peritoneal (cualquier etiología) en relación a la media de estimaciones del cociente AEC/AIC durante el primer año en DP. B) Probabilidad de infección peritoneal (cualquier etiología) en relación a la media de estimaciones del cociente SH/AEC durante el primer año en DP. C) Probabilidad de infección peritoneal (cualquier etiología) en relación a la media de estimaciones del cociente AEC/ACT durante el primer año en DP.
En relación a otras variables, el riesgo global de peritonitis fue mayor en diabéticos (p=0,001) y pacientes con filtrado glomerular más bajo al inicio de DP (p=0,042), con tendencias no significativas en los casos de pacientes con trastornos depresivos (p=0,072) (todas las demás variables en tabla 1 no significativas NS).
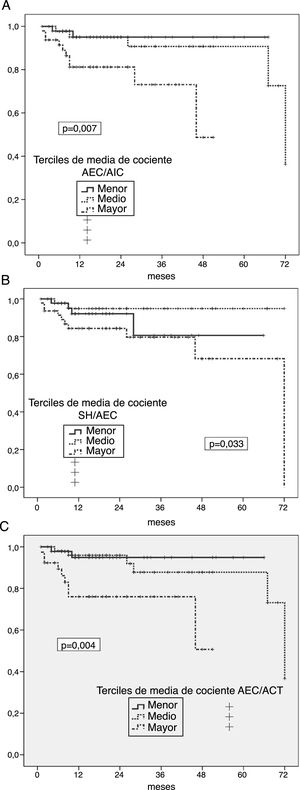
Riesgo de peritonitis por gérmenes entéricosLos análisis univariantes mostraron un riesgo significativamente aumentado de peritonitis entérica en pacientes en el tercil mayor de cocientes medios AEC/AIC (p=0,007) (fig. 2A), SH/AEC (fig. 2B) y AEC/ACT (fig. 2C). En el caso de la SH absoluta, solo se observó una tendencia en el mismo sentido (p=0,096). Por el contrario, el tercil mayor de IMM asoció una tendencia a menor riesgo de esta complicación (p=0,092) (IMG NS). Los pacientes que padecieron algún episodio de peritonitis entérica presentaban mayores grados de SH absoluta (1,92±1,83 versus 1,03±1,73l; p=0,059), cociente AEC/AIC (1,02±0,17 versus 0,92±0,13; p=0,012), cociente SH/AEC (0,12±0,11 versus 0,05±0,09; p=0,016), y cociente AEC/ACT (0,51±0,04 versus 0,46±0,04; p=0,010) al inicio de DP que los que no presentaron esta complicación.
A) Probabilidad de infección peritoneal entérica en relación a la media de estimaciones del cociente AEC/AIC durante el primer año en DP. B) Probabilidad de infección peritoneal entérica en relación a la media de estimaciones del cociente SH/AEC durante el primer año en DP. C) Probabilidad de infección peritoneal entérica en relación a la media de estimaciones del cociente AEC/ACT durante el primer año en DP.
Niveles elevados de proteína C reactiva (p=0,056) y reducidos de albúmina plasmática (p=0,11) al inicio de DP fueron las únicas variables que mostraron tendencia (no significativa) a asociación univariante con el riesgo de peritonitis entérica, durante el seguimiento.
Análisis multivarianteLos resultados del análisis multivariante se presentan en la tabla 3. Aparte de una tendencia NS a un menor riesgo en pacientes con niveles más bajos de IMG, ningún parámetro de composición corporal mostró asociación con la probabilidad de padecer una infección peritoneal (cualquier etiología). Por el contrario, nuestros análisis desvelaron una correlación consistente entre la presencia persistente de la SV (estimada a partir de los cocientes AIC/AEC, SH/AEC y AEC/ACT) y el riesgo subsiguiente de padecer al menos un episodio de peritonitis por gérmenes entéricos. Cabe destacar que, en el caso del cociente SH/AEC, la razón de riesgo entre terciles mayor y menor no alcanzaba la significación estadística (tabla 3), pero si lo hacía la comparación entre terciles mayor y medio (RR: 3,67; IC 95%: 1,02/13,51; p=0,044).
Riesgo de infección peritoneal en relación a los análisis de composición corporal. Estudio multivariante
| Peritonitis (todas) | Peritonitis (entéricas) | |||||
|---|---|---|---|---|---|---|
| RR | IC 95% | Valor de p | RR | IC 95% | Valor de p | |
| SH media | ||||||
| Tercil medio | 0,80 | 0,41/1,56 | 0,51 | 0,84 | 0,87/4,22 | 0,84 |
| Tercil mayor | 1,11 | 0,60/2,06 | 0,73 | 2,17 | 0,75/7,55 | 0,25 |
| Media de AEC/AIC | ||||||
| Tercil medio | 1,30 | 0,64/2,64 | 0,47 | 1,00 | 0,36/5,14 | 0,98 |
| Tercil mayor | 1,52 | 0,76/3,03 | 0,23 | 3,48 | 1,03/14,59 | 0,046 |
| Media de SH/AEC | ||||||
| Tercil medio | 0,98 | 0,50/1,92 | 0,95 | 0,69 | 0,29/2,45 | 0,28 |
| Tercil mayor | 1,49 | 0,80/2,80 | 0,21 | 2,31 | 0,98/6,56 | 0,061 |
| Media de AEC/ACT | ||||||
| Tercil medio | 1,45 | 0,78/2,75 | 0,25 | 1,50 | 0,67/8,23 | 0,33 |
| Tercil mayor | 1,80 | 0,93/3,49 | 0,086 | 6,33 | 1,37/19,37 | 0,011 |
| Media de IMG | ||||||
| Tercil medio | 2,05 | 1,00/4,21 | 0,049 | 0,61 | 0,17/2,15 | 0,44 |
| Tercil mayor | 1,88 | 0,98/3,56 | 0,061 | 0,67 | 0,19/2,35 | 0,53 |
| Media de IMM | ||||||
| Tercil medio | 0,89 | 0,48/1,65 | 0,72 | 1,52 | 0,55/4,78 | 0,38 |
| Tercil mayor | 0,88 | 0,47/1,67 | 0,70 | 0,88 | 0,29/1,76 | 0,75 |
ACT: agua corporal total; AEC: agua extracelular; AIC: agua intracelular; IC: intervalo de confianza; IMG: índice de masa grasa; IMM: índice de masa magra; RR: riesgo relativo; SH: sobrehidratación.
Tercil inferior referencia.
Las cifras expresan coeficientes ajustados. Principales variables de control: filtrado glomerular, diabetes (riesgo de peritonitis de cualquier etiología), albumina plasmática y proteína C reactiva (riesgo de peritonitis, global o entérica).
Tanto las infecciones peritoneales como la SV tienen un efecto negativo conocido sobre la evolución de los pacientes en DP. Tradicionalmente, se ha considerado que estas complicaciones comprometían la supervivencia de pacientes y técnica de DP por mecanismos diferenciados, pero más recientemente, se ha sugerido que la SV persistente puede ser un factor de riesgo modificable de peritonitis en DP. Así, en un análisis post hoc de un estudio transversal, orientado a investigar la prevalencia y los factores de riesgo para SH en 307 pacientes en DP en China, Guo et al.5 observaron que los pacientes con mayores niveles de cociente AEC/ACT presentaban peores resultados en cuanto a supervivencia de pacientes y técnica, y riesgos aparentemente incrementados de peritonitis y eventos cardiovasculares. Por otra parte, Santhakumaran et al.25 presentaron los resultados de un estudio retrospectivo de pacientes con, al menos, 2 análisis de composición corporal, y compararon las tasas de infección peritoneal de pacientes categorizados según la mediana del cociente SH/AEC, usado como estimador de SH. El análisis univariante mostró una clara tendencia a mayor riesgo de peritonitis por gérmenes entéricos en los pacientes sobrehidratados, aunque esta asociación no se mantuvo tras ajustar los coeficientes para los niveles de albúmina plasmática y filtrado glomerular.
El aislamiento de microorganismos de origen entérico durante una infección peritoneal en DP suele asociarse con presentaciones clínicas agresivas y mal pronóstico general, incluyendo tasas sustanciales de mortalidad y fallo de la técnica18,26,27. A pesar de los continuados esfuerzos en las últimas décadas, la incidencia global de estas infecciones no ha mejorado significativamente. Un mejor conocimiento de su patogenia podría ser de gran ayuda, con este propósito, pero la información disponible es limitada y, a menudo, controvertida. La presencia de brechas preexistentes (p. ej., diverticulosis) o incidentes (p. ej., isquemia intestinal o colecistitis aguda) en la continuidad de las barreras antimicrobianas abdominales representa una fuente evidente para este tipo de infecciones. Otros muchos factores han sido relacionados con un mayor riesgo de peritonitis entérica en DP, incluyendo diabetes, comorbilidad general, malnutrición, inflamación, estreñimiento, diarrea, abuso de laxantes, hipokaliemia persistente, antibioterapias de amplio espectro o tratamientos con inhibidores de la secreción ácida gástrica28. Por otra parte, y de manera comparable a otras formas de peritonitis, la propia técnica de DP puede contribuir al riesgo de infecciones entéricas. Por ejemplo, las soluciones hipertónicas, particularmente si son ricas en productos de degradación de la glucosa, pueden generar inflamación local y afectar a los mecanismos de defensa peritoneal29. Además, la presencia in situ del catéter peritoneal y la propia mecánica de la diálisis (incluyendo la renovación recurrente del líquido peritoneal) pueden contribuir a una respuesta inmune defectuosa, en estos pacientes26.
En nuestro conocimiento, este es el primer estudio prospectivo que demuestra una asociación entre la SH persistente y el riesgo de infección peritoneal por gérmenes entéricos. Sin embargo, la explicación para esta asociación no es totalmente clara. Se ha sugerido que el edema persistente de la pared intestinal puede favorecer la transmigración microbiana y de endotoxinas bacterianas, en algunos casos dando lugar a infecciones sistémicas, en diferentes contextos clínicos. Los pacientes con insuficiencia cardíaca congestiva presentan trastornos de la microcirculación intestinal, que parecen contribuir al estado inflamatorio observado en estos casos23. La analogía potencial con los pacientes en DP con SH persistente resulta muy atractiva. Estudios previos han mostrado una asociación entre la SH persistente y marcadores inflamatorios, en estos pacientes30, y el presente estudio mostró una tendencia a asociación entre los niveles basales de proteína C reactiva y el riesgo subsiguiente de peritonitis entérica. Sin embargo, se trata de hipótesis claramente especulativas, porque la asociación entre SV, edema de pared intestinal y riesgo de infección local o sistémica parece poco consistente. Además, y desde un punto de vista opuesto, no hay evidencia de que los pacientes tratados con ultrafiltración peritoneal por insuficiencia cardíaca refractaria, o los pacientes en DP que sufren fases de anasarca presenten un riesgo particular de infección por gérmenes entéricos. Por último, hay que considerar explicaciones alternativas. Por ejemplo, la SH puede ser un mero marcador de sujetos con mayor riesgo intrínseco de peritonitis en DP (ancianos, diabéticos, malnutridos, hipoalbuminémicos o con enfermedad cardiovascular) aunque, en este caso, sería de esperar un riesgo globalmente incrementado de infección peritoneal, no restringido específicamente a infecciones por microorganismos intestinales.
Este estudio presenta limitaciones significativas, incluyendo su diseño unicéntrico y una muestra de tamaño limitado, lo que puede haber afectado a la consistencia de algunos resultados. Por ejemplo, los cocientes AEC/AIC y AEC/ACT, pero no la SH absoluta, mostraron asociación con la variable resultado principal, mientras que el cociente SH/AEC mostró una clara tendencia que, sin embargo, no resultó plenamente consistente. Nuestro modelo multivariante consideró las principales variables de confusión con asociación reconocida con el riesgo de peritonitis en DP, pero el conocimiento limitado de los factores patogénicos para peritonitis entérica (incluyendo la presencia oculta de enfermedad abdominal) añaden incertidumbre a la fiabilidad de los resultados.
En resumen, la sobrecarga de volumen persistente asocia un riesgo significativo de infección peritoneal por microorganismos de origen entérico en pacientes tratados con DP. Por el contrario, el riesgo global de infección peritoneal no parece estar incrementado, en este contexto. La prevención y manejo precoz y eficaz de la sobrecarga de volumen debería formar parte de cualquier estrategia orientada a reducir la incidencia de peritonitis entérica, en estos pacientes.
FinanciaciónEste estudio recibió apoyo financiero y metodológico del Grupo de Investigación en Enfermedades Endocrinas y Metabólicas del Instituto de Investigación Biomédica de la Facultad de Ciencias de la Salud, Universidad de A Coruña (INIBIC), Proyecto PI16/00884, Instituto de Salud Carlos III.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.